Method Article
Nöral Hücre Transplantasyonunun İnsan Serebral Organoid Modeli
Bu Makalede
Özet
Burada, etiketli nöral hücrelerin insan serebral organoidlerine nakli ve izlenmesi için bir protokol açıklıyoruz.
Özet
Hücre nakli yaklaşımlarının ilerlemesi, nakledilen hücrenin fonksiyonel potansiyelinin doğru bir şekilde değerlendirilmesine izin veren model sistemleri gerektirir. Merkezi sinir sistemi için, ksenotransplantasyon son teknoloji ürünü olmaya devam etse de, bu tür modeller teknik olarak zorlu, verim açısından sınırlı ve pahalıdır. Dahası, mevcut çevresel sinyaller insan hücreleriyle mükemmel bir şekilde çapraz reaksiyona girmez. Bu makale, insan nöral hücrelerinin insan serebral organoidlerine nakli ve izlenmesi için ucuz, erişilebilir ve yüksek verimli uyumlu bir model sunmaktadır. Bu organoidler, ticari kitler kullanılarak insan kaynaklı pluripotent kök hücrelerden kolayca üretilebilir ve beynin anahtar hücre tiplerini içerir.
Bu nakil protokolünü ilk olarak EGFP etiketli insan iPSC'den türetilmiş nöral progenitör hücrelerin (NPC'ler) bu organoidlere enjeksiyonu ile gösterdik. Daha sonra, canlı hücre floresan mikroskobu ile organoiddeki bu hücrelerin büyümesini izlemek için hususları tartışacağız ve nakledilen EGFP etiketli NPC'lerin 4 aylık bir süre boyunca bir organoidde izlenmesini göstereceğiz. Son olarak, nakledilen hücrelerin kesit alınması, siklik immünofloresan boyama ve lokal bağlamlarında görüntülenmesi için bir protokol sunuyoruz. Burada sunulan organoid transplantasyon modeli, nakledilen insan hücrelerinin ucuz ve gerçekleştirmesi kolay bir protokolle doğrudan bir insan mikro ortamında uzun süreli (en az 4 ay) izlenmesine izin verir. Bu nedenle, hem nöral hücre tedavileri (nakiller) hem de muhtemelen merkezi sinir sistemi (CNS) tümörlerini mikroçevresel olarak daha doğru bir şekilde modellemek için yararlı bir modeli temsil eder.
Giriş
İnsan beyni, nöral ve glial soyların çoklu hücre tiplerinden oluşan karmaşık bir organdır. Bunlar birlikte, bilişe yol açan karmaşık bir ağ oluşturur. Travmatik beyin hasarı (TBI)1,2, nörodejeneratif bozukluklar 3,4,5,6,7 ve inme8 dahil olmak üzere çok çeşitli nörolojik bozuklukların tedavisi için hücrelerin bu sisteme transplantasyonuna büyük ilgi vardır. Bununla birlikte, bu tür stratejilerin geliştirilmesindeki önemli bir sınırlama, beklenen transplantasyon sonuçlarını belirlemek için mevcut preklinik modellerin göreceli yetersizliğidir. Şu anda en çok kullanılan modeller, hücre potansiyelini belirlemek için in vitro kültür yöntemleri ve farelere ksenotransplantasyondur. Hücre kültürü yöntemleri, farklılaşmayı ve kendini yenileme potansiyelini9 değerlendirebilirken, bunlar, hücrelerin bir nakil bağlamında karşılaşacağı mikro ortamı taklit etmeyen optimal büyüme koşulları altında gerçekleştirilir. Ayrıca, hücrelerin büyüme şekli davranışlarını etkileyebilir10.
Fare beyinleri, mikroçevrenin tüm hücrelerini içerir ve bu nedenle, transplantasyon için son derece güçlü model sistemlerdir11. Bununla birlikte, fare ve insan korteksi12,13 arasında önemli farklılıklar vardır ve tüm büyüme faktörleri türler arasında çapraz reaksiyona girmez. Primat modelleri, insan sistemini daha iyi taklit eden ve aynı zamanda önemli klinik öncesi sonuçlar veren daha yakın bir alternatiftir14. Bununla birlikte, bu daha yakın akrabalar bile, hücresel yapılarında önemli farklılıklar gösterirler15. Bu model sistemlerin her ikisi de nakil sırasında hücre davranışı hakkında değerli bilgiler sağlarken ve nihai bir tedavinin cerrahi unsurlarını içerirken, kusurlu kalırlar. Aynı zamanda maliyetli ve teknik olarak zorlayıcıdırlar (yani, hayvanlar üzerinde beyin ameliyatı yapılması gerekir), bu nedenle olası verimi sınırlarlar. Ayrıca, insan beyin hücrelerinin hayvanlara nakledilmesiyle ilgili çok sayıda etik sorun vardır16. Beyin dilimi kültürleri, bir beynin kesilmesine ve birden fazla tedavi için kullanılmasına izin verir, böylece hayvan nakillerinin bazı sınırlamalarını ortadan kaldırır; Bununla birlikte, bunların sınırlı ömürleri (haftalar) vardır, hala hayvan kaynaklıdır ve (ince bir dilim olarak) hücrelerin enjeksiyonunu taklit etmek için yeterli hacim/yüzey bütünlüğüne sahip değildir17. Bu nedenle, kesinlikle hücre kültürü/potansiyel modeller ile in vivo transplantasyon arasında önemli bir boşluk vardır.
Serebral organoidler, beyinde bulunan ana nöral hücre tiplerini içeren bir in vitro modeldir ve insan kaynaklı pluripotent kök hücrelerden (iPSC'ler) yüksek sayıda üretilebilir18,19. Bu tür organoidler, nakil ortamında ilgilenilen bir test hücresinin fonksiyonel kapasitesinin değerlendirilmesine izin verebilecek hücresel bir bağlam sağlar. Gerçekten de, yakın zamanda yapılan bir çalışma, insan serebral organoidlerine nakledilen nöral progenitör hücrelerin (NPC'ler) hayatta kaldığını, çoğaldığını ve obez bir diyabetik fareninbeynine nakledilen NPC'lere benzer şekilde farklılaştığını göstermiştir20. Serebral organoidler bu nedenle insan beyninin hücre tiplerini yakalayan, zulüm içermeyen, uzun ömürlü (>6 ay), uygun maliyetli bir sistemi temsil eder. Bu nedenle, nöral hücrelerin rejeneratif kapasitesinin erken aşama testi için ideal bir nakil alıcısını temsil edebilirler.
Bu makale, etiketli insan NPC'lerinin insan serebral organoidlerine transplantasyonu ve ardından izlenmesi için bir protokol sunmaktadır (Şekil 1). Bu, GFP etiketli NPC'lerin olgun (2-4 aylık) serebral organoidlere enjekte edilmesiyle başlar18. Nakledilen hücreler daha sonra 4 aylık bir süre boyunca canlı hücre floresan mikroskobu ile takip edilir. Bu süre zarfında, hem enjeksiyon bölgesindeki hücrelerin kalıcılığını hem de organoidin distal bölgelerine göçünü gösteriyoruz. Bitiş noktasında, önceki çalışmalara dayanarak ek boyama ve görüntüleme turlarına izin vermek için mevcut AlexaFluor bazlı boyaların söndürülmesi için bir protokol de dahil olmak üzere, bu organoidlerden türetilen histolojik kesitlerin antijen alımını, boyanmasını ve görüntülenmesini gösteriyoruz21. Bu nedenle bu protokol, bir nakil ortamında hücrelerin farklılaşma kapasitesinin, greft dayanıklılığının, yerinde hücre genişlemesinin ve nakil bölgesinden hücre göçünün ölçülmesinde faydalı olabilir. Bunun hem rejeneratif tıp/hücre tedavisi uygulamaları hem de tümör hücrelerini ilgili bölgeye özgü organoidlere aşılayarak tümör modellemesi için faydalı olacağını tahmin ediyoruz.
Protokol
NOT: Bu protokolde kullanılan tüm malzemeler, reaktifler ve ekipmanlarla ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. Lentiviral transdüksiyon ile hücrelerin florofor etiketlenmesi
- Buz üzerinde tercih edilen çözündürülmüş bazal membran matrisinin bir alikotunu çözün.
- Alikot çözülürken, tüm dış kuyucuklarla birlikte 24 oyuklu bir plakadaki kuyular arasındaki boşlukları doldurmak için steril su ekleyin.
NOT: Bu, ortada kullanım için sekiz kuyu açık bırakır ve hücrelerin yüksek nemde kalmasını sağlar, böylece buharlaşma kaynaklı değişkenliği en aza indirir. - Çözündürülmüş bazal membran matrisini buz gibi soğuk DMEM/F12 ortamında 1:100 oranında seyreltin (burada kullanılan lot ile 0.089 mg/mL'lik bir nihai konsantrasyon elde edildi).
- Gerçekleştirilecek enfeksiyon başına hazırlanan 24 oyuklu plakanın orta (açık) kuyucuklarından birine 300 μL seyreltilmiş çözündürülmüş bazal membran matrisi ekleyin. Kuyu tabanının tamamını eşit şekilde kapladığınızdan emin olun ve gerekirse eşit bir kaplama sağlamak için daha fazlasını ekleyin.
- Bir katmanın kuyu tabanı boyunca katılaşmasına izin vermek için plakayı 37 ° C'de 30 dakika inkübe edin. Bu inkübasyonun sonunda, sıvının hala kuyu tabanını tamamen kapladığını ve merkezde buharlaşmadığını doğrulayın. Buharlaşma, nemin çok düşük olduğunun bir işaretidir; Bu durumda, kaplamayı tekrarlayın.
NOT: Plakalar bir gece önce kaplanabilir ve belirgin bir yan etki olmaksızın seyreltilmiş çözünmüş bazal membran matrisinde bırakılabilir; Bununla birlikte, buharlaşma riski büyük ölçüde artar, bu nedenle kullanımdan önce dikkatlice incelenmeleri gerekir. - Ortamı, bir kuyu plakasında büyüyen birleşik iPSC'den türetilmiş NPC'lerin bir kuyusundan çıkarın.
NOT: Bu makale için, pasaj 3 ve pasaj 10 arasında üreticinin talimatlarına göre ticari bir kit kullanılarak üretilen iPSC'den türetilmiş nöral progenitörler kullanılmıştır. - Kuyunun kenarına yavaşça 1 mL PBS ekleyin ve eşit yıkamayı sağlamak için plakayı sallayın.
- PBS'yi çıkarın ve 300 μL proteolitik-kollajenolitik enzim karışımı ile değiştirin, kuyu tabanını tamamen kapladığınızdan emin olmak için plakayı tekrar sallayın. 37 °C'de 5 dakika inkübe edin. Işık mikroskobu ile hücrelerin plaka yüzeyinden ayrıldığını doğrulayın.
- Bir P1.000 pipet ile 700 μL DMEM/F12 ekleyin ve bu karışımı plakanın tabanının tüm yüzeylerine püskürterek hücreleri ayırın. Hücre agregalarının tek hücreli bir süspansiyona ayrıldığından emin olmak için yukarı ve aşağı pipetleyin. Hücreleri alın ve konik 15 mL'lik bir tüpte 9 mL DMEM / F12 ortamına ekleyin.
- 300 × g'da 5 dakika santrifüjleyin.
- Bu süre zarfında, kaplanacak oyuk başına 500 μL için 10 μM Y-27632 ile takviye edilmiş yeterli ortam ve ayrıca yeniden süspansiyon için 1 mL hazırlayın.
NOT: Y-27632, NPC'lerin tek hücreler olarak geçtikten sonra yüksek hayatta kalmasını sağlamak için gereklidir. - Süpernatanı çıkarın ve hücreleri 1 mL Y-27632 takviyeli ortamda yeniden süspanse edin, hücre agregalarını parçalamak için birkaç kez hafifçe yukarı ve aşağı pipetleyin.
- Birkaç mikrolitre hücre çıkarın ve tripan mavisi ile seyreltin (1:5 ila 1:10).
- Bir hemositometredeki canlı (tripan mavisi-negatif) hücreleri sayın. Sayımların doğru olduğundan emin olmak için hemositometrenin çeyreği başına en az 50 canlı hücre elde etmek için tripan mavisi seyreltmesini ayarlayın. Her kuyucukta 100.000 hücrenin bulunması için gereken hücre süspansiyonu hacmini hesaplayın.
- Hücreleri pipetleyerek hafifçe yukarı ve aşağı karıştırın ve hesaplanan hacmi alın (oyuk başına 100.000 hücre için). Bunu, Y-27632 takviyeli ortama (adım 1.11'den itibaren) ekleyin, böylece nihai hacim kaplanacak oyuk başına 500 μL olur.
- Seyreltilmiş çözündürülmüş bazal membran matrisini önceden kaplanmış oyuklardan çıkarın (30 dakika veya daha uzun inkübasyonun tamamlandığı varsayılarak).
- Hücreleri pipetleyerek nazikçe karıştırın ve her bir oyuğa 500 μL hücre süspansiyonu ekleyin.
- Hücreleri eşit olarak dağıtmak için, bir hücre kültürü inkübatörüne yerleştirmeden hemen önce plakayı yumuşak doğrusal taramalarla (ileri-geri, dur, ileri-geri) büyük bir "+" işareti hareketiyle hareket ettirin.
- Gece boyunca (16-24 saat) 37 °C ve% 5 CO2'de inkübe edin.
- Ortamı çıkarın ve titre edilmiş lentivirüsü ekleyin. Tek entegrasyon olayları gerekiyorsa, hücre başına 0.3 enfeksiyöz birimlik (ideal olarak ilgili hücreler üzerinde titre edilir) çok sayıda enfeksiyon hedefleyin ve ortamda 500 μL'ye kadar (Y-27632 olmadan) doldurun.
NOT: İlgilenilen lentivirüs, daha önce yapıldığı gibi önceden titre edilmiş olarak satın alınabilir veya şirket içinde üretilebilir22. Burada, EGFP'yi eksprese eden NPC'leri oluşturmak ve seçmek için puromisin direncine sahip kurum içi üretilen bir GFP lentivirüsü kullanıldı. Lentivirüs ilgilenilen hücreler üzerinde titre edilmemişse ve kopya sayısı kritikse, birkaç kuyucuğa birkaç hacim eklenmesi ve ~% 30 EGFP + hücreleri 48-72 saat olan kuyunun daha sonra kullanılması önerilir. Kopya sayısı kritik değilse, insersiyonel mutajenezin bazı klonlarda anormal davranışa neden olabileceği uyarısı ile fazla virüs eklenebilir. DİKKAT: Lentiviral vektörler seviye 2-3 biyolojik tehlikedir (içeriklerine bağlı olarak). Lentivirüs, yüzeylerin ve plastik eşyaların ve sıvı atıkların dekontaminasyonu için yerel biyogüvenlik düzenlemelerine uyun. - Hücreleri inkübatöre geri koyun ve 37 ° C ve% 5 CO2'de 24 saat inkübe edin.
- Hücreleri inkübatörden çıkarın ve süpernatanı çıkarın.
DİKKAT: Hücrelerden gelen süpernatan bu noktada hala lentiviral partiküller içerdiğinden, kullanımı ve bertarafı için yerel biyogüvenlik düzenlemelerine uymaya devam edin. - Kuyu duvarına hafifçe PBS ekleyerek hücreleri 2 x 500 μL PBS ile durulayın; Ardından, kalan lentivirüsü yıkamak için kuyu köşesinden çıkarın.
DİKKAT: Hücrelerden gelen süpernatan bu noktada hala lentiviral partiküller içerdiğinden, kullanımı ve bertarafı için yerel biyogüvenlik düzenlemelerine uymaya devam edin. - 500 μL taze ortama (Y-27632 olmadan) geçin ve gece boyunca 37 °C ve% 5 CO2'de büyümeye devam edin.
- EGFP'yi eksprese eden hücrelerin oranını doğrulamak için canlı hücre floresan mikroskobu kullanın ve devam edeceğiniz kuyuyu seçin.
- Tercih edilen lentiviral vektör bir seçim kaseti (puromisin direnci gibi antibiyotik direnç geni) içeriyorsa, seçici ajanı (burada, 1 μg / mL puromisin) hassas ancak dirençli olmayan hücreleri öldüren önceden doğrulanmış bir dozda ortama ekleyin. Aksi takdirde, ilk bölünme sırasında EGFP + hücrelerini izole etmek için floresanla aktive edilen hücre sıralamasını kullanın.
- Şu andan itibaren, hücreleri izdiham için günlük izleme ile koruyun ve günlük olarak tam ortam değişiklikleri gerçekleştirin.
- Birleşmeye ulaşıldığında, bir veya daha fazla oyuklu 6 oyuklu kaplanmış plakadan (1 mL seyreltilmiş çözünmüş bazal membran matrisi ile; bkz. adım 1.3-1.5) hazırlayın ve hücreleri adım 1.6-1.15'te açıklandığı gibi hasat edin.
NOT: Herhangi bir seçim ajanı dahil edilmemişse, bu aşamada hücreleri akış sitometrisine göre sıralayın. Stresi en aza indirmek için hücrelerin yeterince geniş bir nozul ve düşük basınçla sıralandığından ve ayrıca ayırma işleminin her adımında 10 μM Y-27632'nin dahil edildiğinden emin olun. - Hücreleri 200.000 hücre/cm2'lik bir nihai yoğunluğa kadar kaplayın.
- Günlük izlemeyi sürdürün ve ortam değişikliklerini günlük olarak tamamlayın.
NOT: Hücreler tekrar birleştiğinde, artık kullanıma hazırdırlar. Alternatif olarak, bir stok artık aşağıdaki gibi ileride kullanılmak üzere dondurulabilir. - Hücreleri 1.6-1.15 adımlarında açıklandığı gibi bölün, hasat edin ve sayın.
- İlgili bilgilerle bir dizi kriyoviyal önceden etiketleyin (örneğin, geçiş, EGFP%, çizgi).
- Orta +% 10 DMSO'da 400.000 hücre / mL'de yeniden süspanse edin.
NOT: DMSO, dondurulmadığında hücreler için toksiktir, bu nedenle DMSO varlığında oda sıcaklığında geçirilen süreyi en aza indirin. - Kriyoviyal başına 1.33. adımdan 1 mL (400.000 hücre) karışım ekleyin ve bir hücre dondurma kabına koyun.
- Kabı gece boyunca −80 °C'lik bir dondurucuya aktarın.
- Ertesi gün, uzun süreli depolama için hücreleri sıvı nitrojene aktarın.
2. Beyin organoidine etiketli hücre enjeksiyonu
NOT: Bu kağıt için, serebral organoidler, üreticinin talimatlarına göre ticari bir kit kullanılarak üretilmiştir. Bu, ilgilenilen serebral organoid ile değiştirilebilir. Protokolün bu bölümünde kullanılan malzemeler, çözündürülmüş bazal membran matrisinin 4 °C'nin üzerinde jelleşmesini önlemek için önceden soğutulmalıdır.
- Çözünmüş bazal membran matrisi ile temas edecek insülin şırınga(lar)ını, uçlarını ve tüplerini soğumaları için −20 °C'ye yerleştirin.
- Gerçekleştirilecek enjeksiyon sayısına bağlı olarak (~2 μL/enjeksiyon) uygun boyutta çözündürülmüş bazal membran matrisinin uygun boyutta bir alikotunu buz üzerinde çözdürün. Bu işlem yaklaşık 30 dakika sürer.
- Alikot çözülürken, 1.6-1.15 adımlarında açıklandığı gibi hücreleri bölün, hasat edin ve sayın.
- Enjeksiyon başına gereken hacimleri hesaplayın. Birden fazla enjeksiyon yapıyorsanız, toplam hücre hacmini 1.5 mL'lik bir tüpe yerleştirin ve 1 mL'ye kadar DMEM / F12 ekleyin.
NOT: Kayıpları/pipetleme hatalarını hesaba katmak için birkaç ekstra enjeksiyona izin veren bir birim kullanılmalıdır. - Sonraki adımlar hazırlanırken hücreleri buza yerleştirin.
- Çözüldükten sonra, çözündürülmüş bazal membran matrisini buz gibi soğuk DMEM/F12'de 3 mg/mL'lik nihai konsantrasyona seyreltin.
- Tek hücreli süspansiyonu buzdan alın ve 300 ° C'de 5 dakika boyunca 4 × g'da döndürün.
NOT: Soğutmalı bir santrifüj mevcut değilse, oda sıcaklığında döndürme genellikle tolere edilir gibi görünmektedir. - Hücre peletini bozmadan ortamı nazikçe tamamen çıkarın. Gerçekleştirilecek enjeksiyon başına 2 μL'lik bir nihai hacim elde etmek için seyreltilmiş çözündürülmüş bazal membran matrisinde (3 mg/mL) nazikçe pipetleme yaparak hücre peletini yeniden süspanse edin ve kullanıma kadar hemen tekrar buz üzerine koyun.
NOT: Kabarcık oluşumunu ve jelleşmeyi önlemek için hücrelerin yeniden süspansiyonunun yavaş ve önceden soğutulmuş uçlarla yapılması gerekir. - Önceden soğutulmuş şırınga(lar)ı −20 °C dondurucudan bir buz kovasına aktarın. Kullanana kadar orada tutun.
- Beyin organoidlerinin bulunduğu plakayı inkübatörden çıkarın. Enjekte edilecek organoidi 35 mm'lik bir tabağa aktarmak için geniş delikli bir uç kullanın. Stabilize etmek ve enjeksiyonu kolaylaştırmak için organoide zarar vermeden mümkün olan tüm ortamı çıkarın.
NOT: Organoidin tahrip olmasını önlemek için geniş çaplı uçların kullanılması önemlidir. Mevcut değilse, normal bir P1,000 ucunun ucunu steril makasla kesin. - Enjeksiyonu yönlendirmeye ve kolaylaştırmaya yardımcı olması için organoidi içeren 35 mm'lik çanağı diseksiyon mikroskobu altına yerleştirin.
NOT: Steril bir alanda diseksiyon mikroskobu mevcut değilse, enjeksiyonu biraz azaltılmış kontrolle de olsa onsuz yapmak mümkündür. Diğer bir alternatif, büyütme halkası veya gözlük kullanılmasıdır. - Organoid(ler) enjekte edilmeye hazır olduğunda, soğutulmuş bir P20 pipet ucuyla hücreleri nazikçe yeniden süspanse edin ve 2 μL'yi (enjekte edilecek istenen sayıda hücreyi içeren) önceden soğutulmuş steril bir cam slayt üzerine hareket ettirin.
NOT: Çoklu enjeksiyonlar için, cam slayt boyunca ek 2 μL hacimler eklenebilir. Buz üzerinde tutun ve buharlaşmamaya dikkat edin. - Buzdan önceden soğutulmuş bir insülin şırıngası alın ve tüm hücrelerin/ortamın alınmasına izin vermek için iğnenin eğimi aşağı bakacak şekilde 2 μL hücre süspansiyonunu yavaşça yukarı çekin.
NOT: Herhangi bir havada çekmekten kaçınmak için çok yavaş gittiğinizden emin olun. - Organoid içeren tabağın kapağını açın ve mikroskobu üzerine odaklayın. Çanağı bir elinizle tutun. İğnenin eğimini yukarı yerleştirin ve diğer elinizle hücreleri yavaşça organoid yüzeye enjekte edin.
NOT: Dokuya zarar vermemek için yavaş enjekte etmek önemlidir. - Enjeksiyondan sonra, kapağı tekrar tabağa yerleştirin ve enjekte edilen organoidin 1-2 dakika bekletilmesine izin verin.
NOT: Bu, seyreltilmiş çözünmüş bazal membran matrisinin jelleşmesini ve hücreleri yerinde tutmasını sağlar. Ortam çok erken eklenirse, yüzeyde oturan hücreleri yıkayabilir. - Yavaşça 500 μL organoid ortam ekleyin ve organoidi geniş delikli bir uçla 24 oyuklu bir plakanın kuyusuna aktarın. Organoidi gece boyunca 37 °C ve% 5 CO2'de inkübe edin. Her iki günde bir tam orta değişiklikler gerçekleştirin.
NOT: Görüntüleme ayarlamaları için kullanılacak bir negatif kontrol organoidinin (sahte enjekte edilmiş) dahil edilmesi önemlidir. Bunu yapmak için, hücresiz 2 μL'lik bir nihai hacim elde etmek için seyreltilmiş çözünmüş bazal membran matrisi (3 mg / mL) ile daha önce tarif edildiği gibi bir organoid enjekte edin.
3. Canlı hücre floresan görüntüleme ile greft takibi
NOT: İlgilenilen floroforu uyarabilen ve floresansını tespit etmek için gereken filtre setine sahip bir floresan mikroskobu kullanın. Daha önce de belirtildiği gibi, burada kullanılan NPC'ler, 488 nm'lik bir uyarma zirvesi ve ~510 nm'lik bir emisyon zirvesi ile EGFP+ idi.
- Negatif kontrol organoidi (enjekte edilmemiş veya sahte enjeksiyonlu) yükleyin ve aydınlatma yoğunluğunu ve maruz kalma süresini otofloresan minimum olacak şekilde ayarlayın. Burada kullanılan cihaz için aydınlatma yoğunluğu 1 ile 2 arasında ve pozlama süresi 80 ms ile 100 ms arasında ayarlanmıştır.
NOT: Birçok uyarma dalga boyu (özellikle daha düşük dalga boyları) hücreler için toksik olabileceğinden, yoğunluğun düşük tutulması ve organoidin zarar görmesini önlemek için çok uzun süre bakmaktan kaçınılması önerilir. - Pozitif kontrol organoidini yükleyin ve etiketli hücrelerin açıkça görülebilmesini sağlamak için gerekirse maruz kalma süresini artırın. Enjeksiyon bölgesini (EGFP+ bölgesi) bulmak için organoidi geniş delikli bir pipet ucuyla yeniden konumlandırın.
- Ortamı negatif kontrol organoidinden tamamen çıkarın. Negatif kontrol organoidini yükleyin ve seçilen ayarlarla görüntüleyin (burada kullanılan cihaz için aydınlatma yoğunluğu 1 ile 2 arasında ve pozlama süresi 80 ms ile 100 ms arasında ayarlanmıştır). Görüntüleme tamamlandığında, organoidin kurumasını önlemek için hemen taze ortam ekleyin.
NOT: Orta düzeyde kaldırma, aksi takdirde yüzen ve sürekli hareket eden organoidlerin yüksekliğini ve yönünü sabitleyerek yüksek kaliteli görüntülemeyi engellediği için iyi bir görüntü elde etmek için kritik öneme sahiptir. - Test organoidlerinin her biri ile ortam çıkarma / görüntülemeyi tekrarlayın.
- Organoidleri normal inkübasyon/ortam değişikliklerine döndürün (adım 2.16'da olduğu gibi) ve görüntülemeyi istenen aralıklarla tekrarlayın. Burada, organoidler, enjekte edilen EGFP + NPC'lerin hayatta kalmasını, çoğalmasını, farklılaşmasını ve göçünü takip etmek ve test etmek için enjeksiyondan sonraki 1. hafta, 9. hafta ve 16. haftalarda görüntülendi.
4. Histoloji ve immünofloresan
- Bitiş noktasında, organoidi, organoidin kimliği ve diğer gerekli tanımlayıcılarla etiketlenmiş bir histoloji kasetine aktarın.
- Kaseti% 10 formalin ile doldurun ve kapatın. 24 saat oda sıcaklığında tutun.
- Organoid ile kapalı kaseti bir doku işlemine aktarın ve aşağıdaki protokolü ayarlayın: etanol %70 10 dakika, etanol %80 20 dakika, etanol %95 30 dakika, etanol %100 30 dakika, etanol %100 40 dakika, etanol %100 50 dakika, toluen 30 dakika, toluen 40 dakika, toluen 50 dakika, parafin 59 °C'de 25 dakika, parafin 59 °C'de 35 dakika, parafin 59 °C'de 40 dakika, parafin 59 °C'de 50 dakika.
NOT: Yukarıdaki adımlar, aksi belirtilmedikçe oda sıcaklığında vakum altında yapılır. Bu protokol, suyu% 100'e kadar alkol gradyanları ile değiştirir. Toluen ile ara adım, her ikisi de içinde çözünür olduğu için alkol ve parafin arasında bir geçiştir. DİKKAT: Toluen ve parafin, son derece yanıcı sıvılar olabileceğinden ve solunduğunda veya cilt veya gözlerle temas ettiğinde hasara neden olabileceğinden tehlikeli maddeler olarak kabul edilir. Bunları sıkıca kapalı olarak güvenli bir yerde sakladığınızdan emin olun. Bunları tutarken uygun kişisel koruyucu ekipman giyin. Atıkları yerel kimyasal tehlike yönetmeliklerine göre atın. - Organoid ile kapalı kaseti gömme istasyonundaki bir parafin banyosuna aktarın.
- Kaseti banyodan alın, açın ve organoidi çelik tabanlı bir kalıba aktarın. Kalıbı parafin dağıtıcısının altına yerleştirin ve tamamen parafin ile örtün.
- Boş kaseti çelik taban kalıbının üstüne yerleştirin. Burada, kasetin üstüne daha fazla parafin ekleyin.
- Çelik taban kalıbını kaset üstte olacak şekilde buza aktarın ve 5 dakika soğumaya bırakın. Çelik kalıbı çıkarın ve kaseti bir parafin bloğuna gömülü organoid ile saklayın.
- Bölümleri kesmek için kaseti bir mikrotoma aktarın. Bölümleri istediğiniz gibi kesin.
NOT: Burada organoid boyunca 15 μm kalınlığında kesitler yapılmıştır. - Her bölümü 45 °C'ye ayarlanmış bir su banyosunun yüzeyine bırakın ve bir cam mikroskop lamı üzerinde alın.
- Slaytları bir inkübatörde gece boyunca 42 °C'de kurumaya bırakın.
NOT: Slaytlar artık boyama zamanına kadar oda sıcaklığında saklanabilir. - Slaytı 2 dakika boyunca toluen ile doldurulmuş bir Coplin slayt boyama kavanozuna yerleştirin. Bu adımı bir kez daha tekrarlayın.
DİKKAT: Toluen, son derece yanıcı bir sıvı olabileceğinden ve solunduğunda veya cilt veya gözlerle temas ettiğinde hasara neden olabileceğinden tehlikeli bir madde olarak kabul edilir. Güvenli bir yerde sıkıca kapalı olarak sakladığınızdan emin olun. Kullanırken uygun kişisel koruyucu ekipman giyin. Atıkları yerel kimyasal tehlike yönetmeliklerine göre atın. - 2 dakika boyunca %100 EtOH ile doldurulmuş bir cam Coplin slayt boyama kavanozuna aktarın. Bu adımı bir kez daha tekrarlayın.
- 2 dakika boyunca damıtılmış suyla dolu bir cam Coplin slayt boyama kavanozuna aktarın. Bu adımı bir kez daha tekrarlayın.
- Antijen alımı için sitrat tamponu hazırlayın (10 mM sitrik asit, %0.05 Tween 20, pH 6.0).
NOT: Sitrat tamponu oda sıcaklığında 3 aya kadar veya daha uzun süre saklamak için 4 °C'de saklanabilir. - 95 °C ile 100 °C arasında bir su banyosu ayarlayın.
DİKKAT: Bu su banyosu dikkatli olunmazsa yanıklara neden olabilir. Banyo veya bileşenleri ile doğrudan temastan kaçınmak için gerekli tüm önlemleri alın. - Su banyosunda, içindeki slaytlara sığabilecek plastik bir kap yüzdürün. Erimeyi önlemek için plastiğin banyonun dibine temas etmediğinden emin olun (alttan ısıtma banyosu olduğu varsayılarak). Sitrat tamponunu plastik kabın içine dökün ve 95-100 °C'ye ulaşmasına izin verin.
- Tampon istenen sıcaklığa ulaştığında, slaytları tamponun içine yerleştirin ve kabı bir kapakla gevşek bir şekilde kapatın. Kabın içindeki slaytları 30-40 dakika su banyosunda bırakın.
- Plastik kabı su banyosundan çıkarın ve oda sıcaklığında 20 dakika daha soğumaya bırakın.
- Slaytları PBS ile 3 x 2 dakika yıkayın. PBS'yi numuneye dokunmadan veya aşırı kurutmadan bir kağıt mendille çıkarın.
- Geçirgenlik tamponunu (90 mL PBS +% 0.1 Tween-20) hazırlayın ve bir cam slayt boyama kavanozunu bununla doldurun. Slaytları geçirgenleştirme tamponuna daldırın ve 10 dakika inkübe edin.
- Slaytları PBS ile 3 x 2 dakika yıkayın.
- Her numuneyi (~25 μL) kaplayacak kadar boyama karışımı hazırlayın.
NOT: Burada kullanılan antikorlar ve son konsantrasyonlar için Tablo 1'e bakınız. - Her organoid dilimi kaplamak için 25 μL boyama karışımı ekleyin. Oda sıcaklığında 1 saat veya gece boyunca karanlıkta 4 °C'de inkübe edin.
NOT: Boyama karışımının buharlaşmasını önlemek için numunelerin yüksek nemde kaldığından emin olun. Slaytları nemli tutacak bir kap yoksa, köşesinde ıslak mendiller bulunan bir kutunun içine koyun. - Slaytları PBS ile 3 x 2 dakika yıkayın.
- Tuzu çıkarmak için bir cam slayt boyama kavanozunun içinde damıtılmış suyla bir kez durulayın.
- Numunelerin her birine 10 μL sıvı tutucu + 4',6-diamidino-2-fenilindol (DAPI) ekleyin.
NOT: İkinci bir boyama turu yapılmazsa slaytlar kapatılabilir. Burada, lamel çıkarma dokuya zarar verebileceğinden, söndürme/yeniden boyama için erişime izin vermek için slaytlar kapatılmamıştır. - Seçilen floresan mikroskobu kullanarak slaytları görüntüleyin.
NOT: Yoğunlukların ve maruz kalma sürelerinin doğru ayarlanmasına izin vermek için her antikor için pozitif ve negatif kontrollere sahip olduğunuzdan emin olun (burada kullanılan cihaz için aydınlatma yoğunluğu 5 ile 6 arasında ve maruz kalma süresi 2.000 ms ile 3.000 ms arasında ayarlanmıştır), ancak bu antikora bağlı olarak değişebilir. Ek olarak, mikroskobun kullanılan her kanal için yeterli dedektöre sahip olduğundan emin olun. Numuneler kapatılmadığından, görüntülenirken yüzleri yukarı bakacak şekilde yerleştirilmeleri gerektiğini unutmayın. - Görüntülemeden sonra, taze 2x söndürme tamponu hazırlayın (PBS'de% 9 H2O2 + 50 mM NaOH).
NOT: Su verme solüsyonu kullanılmadan hemen önce taze olarak hazırlanmalıdır. Reaksiyon, zamanla azalacak olanH2O2'ninaktivitesine duyarlıdır. DİKKAT:H2O2tahriş edicidir ve NaOH yakıcıdır. Bunlar uygun güvenlik ekipmanı ile tedavi edilmeli ve cilt temasından kaçınılmalıdır. Yerel kimyasal güvenlik politikalarına uygun olarak atıldıklarından emin olun. - Cam Coplin slayt boyama kavanozunu yarıya kadar 2x söndürme tamponu (45 mL) ile doldurun, 45 mL PBS ekleyin ve slaytları içine koyun. Gece boyunca 4 °C'de inkübe edin.
- Floresan mikroskobu ile floroforların etkili bir şekilde söndürüldüğünü kontrol edin.
- Boyama ve görüntülemeyi yukarıdaki gibi tekrarlayın.
NOT: Su verme ve yeniden boyama, gerektiğinde ek turlar için tekrarlanabilir, ancak her ek turda hasar riski artar.
5. Görüntü kaydı
- FIJI'yi açın.
- 1. ve 2. turdaki DAPI görüntülerini içeren bir klasör oluşturun. Gerekirse hangisinin hangisi olduğunu netleştirmek için adları değiştirin.
- Görüntü kaydının çıktısı için boş bir klasör oluşturun.
- Eklentiler'e tıklayın | Kayıt | Sanal yığın dilimlerini kaydedin.
- Kaynak dizini altında, her turdan DAPI görüntülerini içeren klasörü seçin.
- Çıkış dizini altında, kayıt çıktısı için oluşturulan klasörü seçin.
- Kaydı düzeltmek için Özellik ayıklama modelini Rigid olarak ve Kayıt modeli açılır menüsünü Rigid - translate+rotate olarak ayarlayın, yalnızca görüntünün deforme olmak yerine hizalama için taşınmasına ve döndürülmesine izin verin.
NOT: Deformasyon bekleniyorsa, özellik çıkarma modeli ve kayıt modeli istenildiği gibi Afin veya diğer modellere ayarlanabilir, ancak bu istenmeyen dönüşümlere neden olabilir. Bazen turlar arasında bir dilim hasar görebilir ve bu da başarılı kaydı engelleyebilir. - Dönüştürme parametrelerini kaydetmek ve diğer kanallara uygulanmalarına izin vermek için Dönüştürmeleri kaydet kutusunu işaretleyin.
- Tamam'a tıklayın.
- Dönüştürme dosyasının kaydedileceği konumu seçin (varsayılan olarak giriş dizinidir) ve Aç'a tıklayın.
- Dönüşümler için başvuru görevi görecek DAPI görüntüsünü seçin. Diğer turların her birinden gelen DAPI görüntüsü buna göre hizalanacaktır.
NOT: Tamamlandığında, kayıtlı görüntüler bir yığın olarak (ve çıktı klasöründe) görünecektir. - Görüntü kaydının başarılı olduğunu doğrulamak için görüntüler arasında ileri geri geçiş yapmak için alttaki kaydırma çubuğunu kullanın (çekirdekler, en azından çakışan alanlar için her iki görüntüde de aynı yerdedir).
- Giriş görüntülerinin her turu için bir .xml dosyasının oluşturulduğunu doğrulayın.
NOT: Bunlar, o turdaki dosyalar için gereken çeviri parametrelerini içerir. - Kaydedilecek tüm görüntüleri içeren bir klasör oluşturun (her turun her kanalı). Dosyaların sırasını not edin.
- Dönüştürme parametreleri için bir klasör oluşturun ve kaydedilecek kanal başına her tur için .xml dosyasının bir kopyasını oluşturun. Kaydedilecek görüntüler ile dönüştürme parametresi kopyaları arasındaki dosya sırasının (ada göre) aynı olup olmadığını bir kez daha denetleyin, çünkü bir sonraki adım her görüntüyü dönüştürme parametresi dosyalarının sırasına göre dönüştürecektir.
- Eklentiler'e tıklayın | Dönüştür | Sanal yığın dilimlerini dönüştürün.
- Kaynak dizin altında, kaydedilecek görüntüleri içeren klasörü seçin.
- Çıkış dizini altında, kayıt çıktısı için oluşturulan klasörü seçin.
- Dönüşümler dizini altında, dönüştürülecek görüntü dosyası başına bir kopya olacak şekilde .xml dosyalarını içeren klasörü seçin. Yine, sıranın dosyalarla eşleştiğinden emin olun (yani, her tur 1 kanalı için 1. tur .xml bir kopyası, her 2. tur kanalı için 2. tur .xml bir kopyası, vb.).
- Tamam'a tıklayın.
NOT: Tamamlandığında, o turdan kaydedilen görüntüler bir yığın olarak (ve çıktı klasöründe) görünecektir. - Kanallar arasında ileri geri geçiş yapmak için alttaki kaydırma çubuğunu kullanın. Tüm kanalların aynı şekilde dönüştürüldüğünü doğrulayın. Aksi takdirde, bunun nedeni büyük olasılıkla dönüşümler dizinindeki yanlış bir .xml dosyasıdır; Bu durumda, dosyayı düzeltin ve tekrarlayın.
NOT: Görüntülenen parlaklık aralığı bir kanala dayalı olacaktır, ancak bu gerçek kaydedilen görüntüleri etkilemez, yalnızca ekranı etkiler. - Kayıtlı görüntülerin hepsinin turlar arasında başarılı bir şekilde hizalandığını ve bindirmeler/aşağı akış analizi için hazır olduğunu gözlemleyin.
NOT: Büyük gruplar için kayıt gerçekleştirmenin daha verimli programlı yolları vardır. Burada sunulan yöntem, programlama gerektirmeyen kolay bir yöntemdir.
Sonuçlar
Serebral organoid kimliğinin doğrulanması olarak, olgun (2 aylık) bir serebral organoidin histolojik kesitleri PAX6 (dorsal NPC'lerinbir belirteci 23) ve SATB2 (olgun, postmitotik, üst tabaka nöronlarının bir belirteci24) için boyandı. Beklendiği gibi, PAX6+ hücreleri organoidin iç kısmında ve SATB2+ hücreleri üst katmanlarda mevcuttu (Şekil 2). Bu sonuçlar, kullanılan serebral organoidlerin, farklılaşma kitinde belirtildiği gibi gerçekten dorsal ön beyin olduğunu desteklemektedir. Serebral organoid nakil sisteminin doza bağımlılığını belirlemek için, 2 aylık serebral organoidlere artan sayıda EGFP + iPSC türevi NPC enjekte edildi. 10.000 hücre ve üzerinde tutarlı EGFP + hücre yaması tespiti ile GFP floresansının giriş hücresi sayısına açık bir doz bağımlılığı mevcuttu (Şekil 3). Nakledilen NPC'lerin kalıcılığı ve göçü, nakledilen organoidlerin zaman içinde takip edilmesiyle değerlendirildi. Bunun için 50.000 iPSC'den türetilmiş EGFP+ NPC, aynı iPSC hattından üretilen 2-3 aylık serebral organoidlere nakledildi. Enjekte edilen organoidler ve kontroller, önümüzdeki 3-4 ay boyunca belirtilen zaman noktalarında EGFP pozitifliği açısından görüntülendi. Bu nakil serisinde, enjekte edilen bölgenin 4 aylık takip süresi boyunca kalıcılığını gözlemledik (Şekil 4A). Ek EGFP + hücre yamaları, transplantasyondan 9 gün sonra ortaya çıktı ve çalışma bitiş noktasına kadar (organoide bağlı olarak 3-4 ay) devam etti, bu da hücrelerin göçünü ve yeni bölgelerine entegrasyonunu gösterdi (Şekil 4A). Daha yüksek bir büyütmede, organoide uzun çıkıntılarla net nöral morfoloji gözlemlenebildi (Şekil 4B), enjekte edilen hücrelerin entegrasyonunu doğruladı.
Enjeksiyondan sonra enjekte edilen hücrelerin farklılaşma durumunu belirlemek için, 4 ay boyunca izlenen organoid ve kontrolü sabitlendi, parafine gömüldü, 15 μm kalınlığında dilimler halinde kesildi ve cam slaytlara monte edildi. Dilimler daha sonra ya tek bir floresan boyama turunda (EGFP, TUJ1, NESTIN) ya da ek belirteçler (MAP2, GFAP) eklemek için iki ardışık boyama döngüsünde işlendi ve boyandı. İlk tek turlu boyama, NPC durumunu koruyan hücrelerin bir karışımı (NESTIN+TUJ1−) ve nöral bir kadere doğru farklılaşmış hücrelerin (NESTIN−TUJ1+) bir karışımı da dahil olmak üzere enjeksiyon bölgesinde EGFP+ hücrelerinin varlığını doğruladı (Şekil 5). Hem kontrol hem de enjekte edilen organoidler için, TUJ1+ olgunlaşmamış-olgun nöronların çoğunluğu ile çok az NESTIN+ NPC gözlenmiştir (hepsi enjeksiyon bölgesinde EGFP+ nakledilen NPC'ler olmasa da çoğu) (Şekil 5). İki yuvarlak boyama daha fazla ayrıntı verdi ve organoidin dış bölgesinin çoğunda olgun nöronları (NESTIN−TUJ1+MAP2+GFAP−) ortaya çıkardı ve ortaya doğru olgunlaşmamış (NESTIN−TUJ1+MAP2−GFAP−) nöron alanları ortaya çıkardı (Şekil 6A,B). Astrositler (NESTIN−TUJ1−MAP2−GFAP+) hem enjekte edilen hem de kontrol organoidlerinde mevcuttu ve dış kenarların etrafına serpiştirildi (Şekil 6A,B). Enjekte edilen organoidde iki yuvarlak boyamanın gerçekleştirildiği dilim, olgun nöronların fenotipini benimsemiş olan enjeksiyon bölgesinden uzakta küçük bir EGFP + hücresi uydu kolonisi gösterdi (Şekil 6B, C). Bunlardan bazıları astrositlere yakın görünüyordu; bununla birlikte, GFAP boyamasıyla tam örtüşen EGFP + hücreleri yoktu, bu da astrositlerin kendilerini üretmekten ziyade bitişik olduklarını düşündürüyordu (Şekil 6B, C).
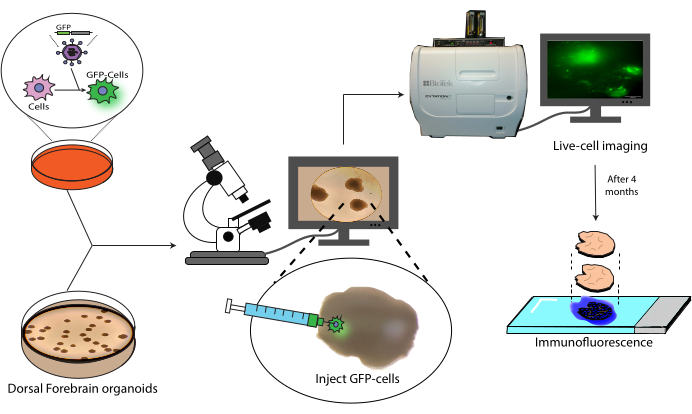
Şekil 1: Etiketli hücrelerin serebral organoidlere transplantasyon modeli. Lentiviral transdüksiyon ile etiketli hücrelerin oluşturulmasına, bunların serebral organoidlere transplantasyonuna ve canlı hücre görüntüleme ve immünofloresan ile izlenmesine şematik genel bakış. Kısaltma: GFP = yeşil floresan proteini. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
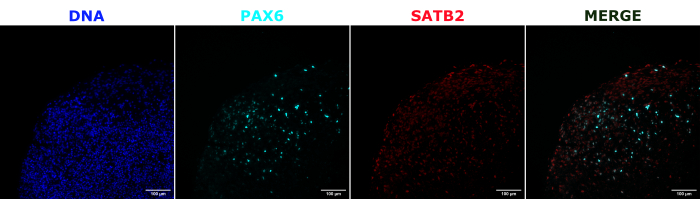
Şekil 2: Erken ve geç organoidlerin mimarisini gösteren histolojik kesitlerin immünofloresansı. 2 aylık bir serebral organoid sabitlendi, parafine gömüldü, dilimlendi ve PAX6, SATB2 ve DAPI ile boyandı. Otofloresandan yanlış pozitif bir sinyali önlemek için pozlama ve entegrasyon süresini ayarlamak için boyanmamış bir bölüm kullanıldı. PAX6+ hücreleri organoidin iç kısmında, SATB2+ hücreleri ise üst katmanlarda mevcuttu. Z-yığını görüntüleri, 15 μm'lik doku kesitinin tamamından her 4.2 μm'de bir çekildi. Optik bölümler, varsayılan seçeneklerle Gen5 yazılımındaki odak istifleme seçeneği kullanılarak birleştirildi. Ölçek çubukları = 100 μm. Kısaltmalar: PAX6 = eşleştirilmiş kutu 6 proteini; SATB2 = özel AT-zengin dizi bağlayıcı protein 2; DAPI = 4',6-diamidino-2-fenilindol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
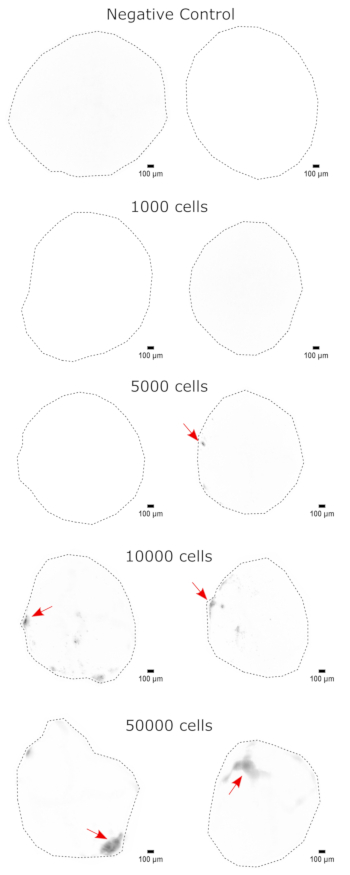
Şekil 3: NPC'lerin serebral organoidlere doza bağlı aşılanması. Organoidler 0 (negatif kontrol), 1.000, 5.000, 10.000 veya 50.000 GFP + iPSC türevi NPC ile nakledildi. Transplantasyondan 1 hafta sonra, organoidler bir GFP filtre küpü ile bir Cytation 5 üzerinde görüntülendi. Negatif kontrol, otofloresansı en aza indirmek için maruziyet ve entegrasyon süresini ayarlamak için kullanıldı. Daha koyu renkler, negatif kontrole göre daha fazla EGFP floresansını gösterir. Ölçek çubukları = 100 μm. Bunlar tüm organoidlerin 4x görüntüleridir. Görüntülemeden sonra, organoidler arasındaki değişken arka plan yoğunluğunu düzeltmek için görüntülemeden önce piksel yarıçapı 50 olan yuvarlanan top arka plan çıkarma işlemi gerçekleştirildi. En yüksek aşılama bölgeleri olarak tanımlanan enjeksiyon bölgeleri, aşılamanın mevcut olduğu kırmızı bir okla gösterilir. Kısaltmalar: NPC'ler = nöral progenitör hücreler; GFP = yeşil floresan proteini; EGFP = geliştirilmiş GFP; iPSC = indüklenmiş pluripotent kök hücre. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
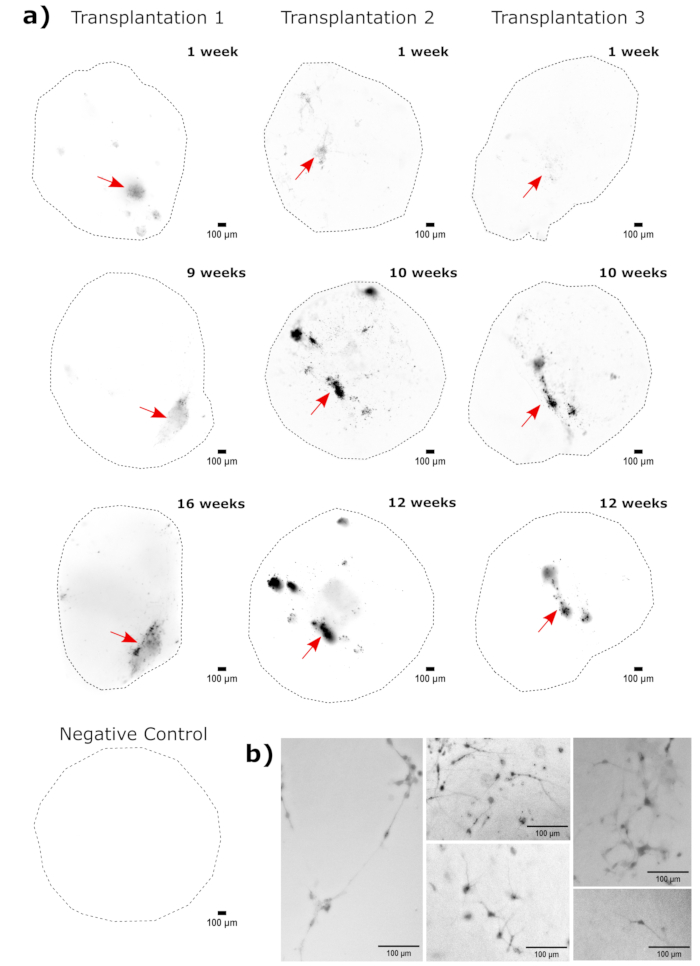
Şekil 4: Floresan canlı hücre görüntüleme ile nakledilen hücre büyümesinin, göçünün ve kalıcılığının izlenmesi. (A) Kontrol ve nakledilen (50.000 GFP + iPSC türevi NPC) organoidleri, iki bağımsız nakil setinden 2-4 ay boyunca floresan canlı hücre görüntüleme ile takip edildi. Her bir zaman noktasında otofloresansı en aza indirmek için maruziyet ve entegrasyon süresini ayarlamak için negatif kontrol organoidleri kullanıldı. EGFP görüntüleri, nakil sonrası belirtilen zamanlarda Cytation 5 üzerinde bir GFP filtre küpü kullanılarak yakalandı. Daha koyu renkler, o zaman noktası için negatif kontrole göre daha fazla EGFP floresansını gösterir. Organoidler boyunca değişken arka plan yoğunluğunu düzeltmek için görüntülemeden önce piksel yarıçapı 50 olan yuvarlanan top arka plan çıkarma işlemi gerçekleştirildi. Organoidler, her zaman noktasında yaklaşık olarak aynı yönde yerleştirildi ve görüntüler, ekranın tutarlılığı ve nakledilen hücre büyümesini açıkça göstermek için döndürüldü. En erken zaman noktasında en yüksek aşılama bölgeleri olarak tanımlanan enjeksiyon bölgeleri kırmızı bir okla gösterilir. Şeklin altında örnek bir negatif kontrol organoidi gösterilmektedir. (B) Transplantasyondan sonraki 1. ve 15. haftalarda aşılanmış organoidlerden örnek 20x görüntüler gösterilmiştir. Nörit görünürlüğünü sağlamak için FIJI kullanılarak görüntülenmeden önce yerel kontrast artırıldı. Ölçek çubukları = 100 μm. Kısaltmalar: NPC'ler = nöral progenitör hücreler; GFP = yeşil floresan proteini; EGFP = geliştirilmiş GFP; iPSC = indüklenmiş pluripotent kök hücre. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
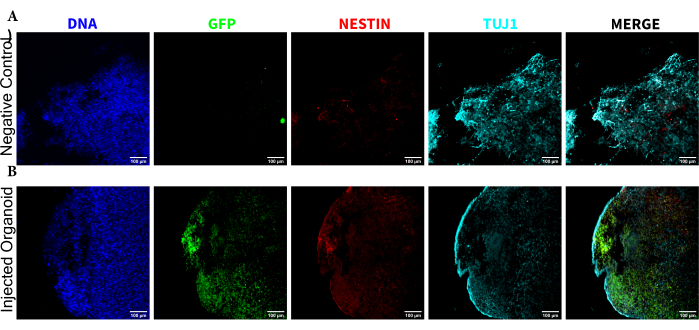
Şekil 5: Transplante edilen NPC'lerin enjeksiyon bölgesinde migrasyon ve nöral farklılaşma ile birlikte kalıcılığını ortaya koyan histolojik kesitlerin immünofloresansı. (A) enjekte edilmemiş ve (B) nakledilmiş organoidlerden alınan tek kanallı floresan görüntüleri. Sağdaki üst üste binen resim, ilgilenilen üç kanalı (NESTIN, TUJ1 ve EGFP) gösterir, ancak DAPI'yi içermez. Ekran minimumları, sadece negatif hücrelerden gelen sinyali hariç tutacak şekilde ayarlandı (enjekte edilmemiş kontrolden EGFP için ve bilinen işaretleyici kombinasyonlarına dayalı diğer kanallar için belirlenir). Ekran maksimumları, herhangi bir hücrede bu antikor için gözlemlenen en yüksek sinyale dayanıyordu. Doğrudan karşılaştırmaya izin vermek için enjekte edilmeyen ve nakledilen organoidler arasında görüntüleme aralıkları sabit tutuldu. Ölçek çubukları = 100 μm. Kısaltmalar: NPC'ler = nöral progenitör hücreler; DAPI = 4',6-diamidino-2-fenilindol; TUJ1 = beta-III tübülin; EGFP = geliştirilmiş yeşil floresan proteini. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
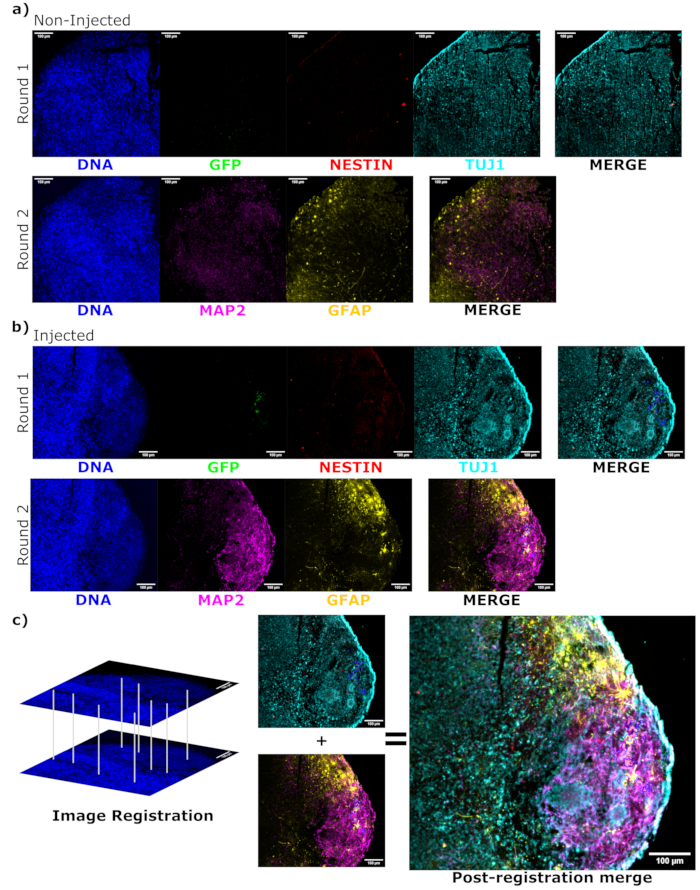
Şekil 6: Histolojik kesitlerin siklik immünofloresan kullanılarak aşılanmış hücre farklılaşma durumunun ve lokalizasyonunun değerlendirilmesi. Enjekte edilmemiş, (A) yaş uyumlu ve (B) nakledilen organoidlerden alınan tek kanallı floresan görüntüleri, belirtildiği gibi birinci ve ikinci boyama turu için gösterilir. Ekran minimumları, sadece negatif hücrelerden gelen sinyali hariç tutacak şekilde ayarlandı (enjekte edilmemiş kontrolden EGFP için ve bilinen işaretleyici kombinasyonlarına dayalı diğer kanallar için belirlenir). Ekran maksimumları, herhangi bir hücrede bu antikor için gözlemlenen en yüksek sinyale dayanıyordu. Görüntüleme aralıkları (ve tabii ki görüntüleme parametreleri), doğrudan karşılaştırmaya izin vermek için kontrol ve enjekte edilen organoidler arasında sabit tutuldu. Ölçek çubukları = 100 μm. Sağdaki her organoid için her boyama turu için üst üste bindirilmiş bir görüntü (DAPI hariç) gösterilir. (B) Görüntü kaydının gerçekleştirildiği enjekte edilen organoid için, tüm görüntüler her iki boyama turunda gözlemlenen bölgeye kırpılır. (B,C) Enjekte edilen organoid için, EGFP + hücre bölgeleri mavi renkle belirtilmiştir. Görüntü kaydı sırasında özellikleri eşleştirmek için DAPI'nin nasıl kullanıldığına ilişkin bir diyagram (C) içinde gösterilir ve ardından kayıtlı görüntünün genel bir birleşimi gösterilir. Kısaltmalar: DAPI = 4',6-diamidino-2-fenilindol; TUJ1 = beta-III tübülin; EGFP = geliştirilmiş yeşil floresan proteini; MAP2 = mikrotübül ile ilişkili protein 2; GFAP = glial fibriler asidik protein. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Klon | Florofor | Konsantrasyon | |
| Anti-NESTIN | 10C2 Serisi | AlexaFluor 594 | 1'ü 2,000 arada |
| Anti-TUBB3 | TUJ1 | AlexaFluor 647 | 1'ü 2,000 arada |
| GFP Karşıtı | FM264G | AlexaFluor 488 | 1'ü 200 arada |
| Anti-GFAP | SMI 25 | AlexaFluor 594 | 1'ü 500 arada |
| Anti-MAP2 | SMI 52 | AlexaFluor 488 | 1'ü 1,000 arada |
| Anti-PAX6 | O18-1330 Serisi | AlexaFluor 647 | 100'ü 1 arada |
| SATB2 Önleme | EPNCIR130A | AlexaFluor 594 | 1'ü 500 arada |
Tablo 1: Boyama için antikor konsantrasyonları. Kısaltmalar: TUBB3 = beta-tubulin III; GFP = yeşil floresan proteini; GFAP = glial fibriler asidik protein; MAP2 = mikrotübül ile ilişkili protein 2; PAX6 = eşleştirilmiş kutu 6 proteini; SATB2 = özel AT açısından zengin dizi bağlayıcı protein 2.
Tartışmalar
CNS yaralanmalarının / nörodejeneratif bozuklukların tedavisi için hücre terapötik yaklaşımlarına olan önemli ilgi göz önüne alındığında 1,2,3,4,5,6,7,8, bir nakil ortamında hücre fonksiyon modelleri önem kazanmaktadır. Bu makale, etiketli insan NPC'lerinin insan serebral organoidlerine nakli için bir yöntemin yanı sıra canlı hücre takibi ve histoloji ve immünofloresan boyama ile son nokta değerlendirmesi sunmaktadır. Daha da önemlisi, nakledilen hücrelerin organoid ortamda göç, farklılaşma ve uzun süreli (4 ay) kalıcılık yeteneğine sahip olduğunu gösterdik. Bu tür uzun süreli kalıcılık, beyin dilimi kültürlerinin sürdürülebilirliği üzerinde belirgin bir artıştır17. Bu nedenle, bu sistem, hayatta kalma, çoğalma ve farklılaşma gibi potansiyel bir terapötik ortamda değerlendirilmesi gereken davranışların çoğunu incelemek için uygundur. Gerçekten de, yakın zamanda yapılan bir ortogonal çalışma, nakledilen NPC'lerin, NSG fare beyinlerinenakledilen NPC'lere kıyasla serebral organoidlerde benzer şekilde davrandığını göstermiştir 20, böylece organoidlerin bir nakil alıcısı olarak faydasını doğrulamıştır. Bu bir in vitro sistem olduğundan, sitokinlerin veya ilgilenilen ilaçların eklenmesi de kolaydır. Bu, iltihaplanma ve immünosupresanlar gibi belirli ortamların nakledilen hücreler üzerindeki etkilerini daha iyi anlamak ve terapötik bir ortamda karşılaşabileceklerini daha fazla taklit etmek için kullanılabilir. Gösterdiğimiz döngüsel immünofloresan protokolü (önceki araştırmalaradayanarak 21), bu yaklaşımın gücünü daha da genişleterek, çok çeşitli soy ve potansiyel olarak hastalığa özgü belirteçlerin aynı anda tek bir bölümde değerlendirilmesine izin verir ve böylece nakledilen hücrelerin ve doku üzerindeki etkilerinin doğru bir şekilde izlenmesine izin verir. Tabii ki, analizin hedeflerine bağlı olarak bunun yerine diğer uç nokta değerlendirme yöntemleri kullanılabilir. Örneğin, hücre morfolojisi birincil ilgi alanıysa 3D rekonstrüksiyon ile doku temizleme kullanılabilir veya belirli hücre tiplerinin nicelleştirilmesi nihai hedef ise akış sitometrisi ile ayrışma kullanılabilir. Bu yöntemin, CNS tümörleri gibi diğer hücre tiplerine kolayca genişletilebilir olmasını ve potansiyel olarak mikro-çevre ile ilgili bir bağlamda çalışmalarına izin vermesini bekliyoruz. Benzer şekilde, alıcı olarak kullanılan organoidler, hastalık modeli organoidleri 25,26,27 ile değiştirilebilirve potansiyel olarak bu koşullar için transplantasyon yaklaşımlarının modellenmesine izin verir.
Tüm modellerde olduğu gibi, burada sunulanın da kendi sınırlamaları vardır. Birincisi, iPSC'den türetilen organoidler gelişimsel olarak olgunlaşmamıştır19 ve bu nedenle, birçok nörodejeneratif hastalığın ortaya çıktığı yaşlanan beyne kıyasla önemli farklılıklara sahiptir. Serebral organoidler de gelişimdetekdüze değildir 19, bu nedenle aynı fizyolojik nişe tutarlı enjeksiyonu engeller. Ayrıca, ilgili beyin bölgelerinin hücre tipleriniiçerirken 18,19, in vivo ortamda da önemli olan endotelyal, mikroglial ve bağışıklık bileşenlerinden yoksundurlar14. Bu, konakçının hücre nakline nasıl tepki vereceğinin incelenmesini sınırlar. Vasküler28 ve mikroglial29 hücrelerin eklenmesinin yanı sıra organoid tutarlılığını ve bölgeselleşmeyi18 arttırmak, böylece organoid transplantasyon sisteminin modelleme gücünü geliştirmek için teknikler şu anda çevrimiçi hale geliyor. Bununla birlikte, burada sunulanların ötesinde daha fazla test ve optimizasyon gerektireceklerdir. Bu protokol ucuz olmasına ve özel ekipman gerektirmemesine rağmen, örneğin enjeksiyon derinliği gibi bir dizi önemli teknik husus vardır. Bunun nedeni, hem organoidlerin perfüze edilmemesi hem de bu nedenle, çok büyürlersegenellikle nekrotik bir merkeze sahip olmalarıdır 19 ve bu ışık, canlı hücre takibi için organoid çekirdekten geçemez. Bu nedenle, çok derine enjekte edilen hücreler ve içeri göç eden koloniler gözden kaçabilir. Bu, daha iyi doku penetransına30 sahip daha uzun dalga boylu floroforların kullanılmasıyla iyileştirilebilse de, organoid boyutuna ve tespit aparatına bağlı olarak, bu muhtemelen dikkate alınacaktır. Son olarak, beyin organoidleri gelişme durumunda olduğundan, ortam, enjekte edildiği organoidin gelişim aşamasına bağlı olarak muhtemelen farklılık göstereceğinden, transplantasyon zamanlaması bir diğer önemli husustur. Bu, enjeksiyon sırasında tutarlı bir organoid yaşı sağlanarak bir dereceye kadar kontrol edilebilse de, şüphesiz dikkate alınması gereken bir faktördür.
Bu protokol ucuzdur, basittir, hayvan içermez ve özel ekipman gerektirmez, bu nedenle transplantasyon modellemesini daha geniş bir laboratuvar yelpazesi için erişilebilir hale getirir. Hem nöral hücre terapötiklerinde hem de organoid model sistemlerde hızlı ilerleme hızıyla, burada sunulan organoid transplantasyon protokolünün bir dizi hastalık ve terapötik yaklaşım için yararlı bir model olacağını tahmin ediyoruz.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma için fonlar, Marcelle ve Jean Coutu vakfından ve Fonds de recherche du Québec - Santé'den (FRQS #295647) IRIC Hayırsever fonları aracılığıyla sağlandı. D.J.H.F.K., FRQS'den Chercheurs-boursiers Junior 1 bursu (#283502) şeklinde maaş desteğine sahiptir. M.I.I.R., İmmünoloji ve Kanser Araştırmaları Enstitüsü'nden IRIC Doktora Ödülü, Montreal Üniversitesi'nden Bourse de passage accélère de la maitrise au doctorat ve Bourse de Mérite aux cycles supérieurs tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Accutase | StemCell Technologies | 7920 | proteolytic-collagenolytic enzyme mix |
| Alexa Fluor 488 anti-GFP Antibody | BioLegend | 338008 | |
| Alexa Fluor 488 anti-MAP2 (clone SMI 52) | BioLegend | 801804 | |
| Alexa Fluor 594 anti-GFAP Antibody (clone SMI 25) | BioLegend | 837510 | |
| Alexa Fluor 594 anti-Nestin (clone 10C2) | BioLegend | 656804 | |
| Alexa Fluor 647 anti-Tubulin β 3 (TUBB3) (clone TUJ1) | BioLegend | 801209 | |
| Citric Acid Monohydrate | Fisher Chemical | A104-500 | |
| Cytation 5 Cell Imaging Multimode Reader | Biotek | - | |
| Denaturated Ethyl Alcohol (Anhydrous) | ChapTec | - | |
| DMEM F12/Glutamax | Thermo | 10565018 | |
| Dymethil Sulfoxide (DMSO), Sterile | BioShop | DMS666.100 | |
| FIJI 1.53c | - | - | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501128-4L | |
| Gen5 | - | - | |
| HistoCore Arcadia H | Leica Biosystems | - | |
| Matrigel Growth Factor Reduced (GFR) | Corning | 356231 | Phenol Red-free, LDEV-free |
| MX35 microtome blade | Epredia | 3053835 | |
| NaOH | Sigma | 655104 | |
| PBS (-Ca -Mg) | Sigma | D8537 | |
| Puromycin Dihydrochloride | Thermo | A1113803 | |
| ROCK inhibitor Y-27632 | Abcam | ab120129 | |
| Simport Scientific Stainless-Steel Base Molds | Fisher Scientific | 22-038-209 | |
| Simport Scientific UNISETTE Biopsy Processing/Embedding Cassette | Fisher Scientific | 36-101-9255 | |
| STEMdiff Forebrain Neuron Differentiation Kit | StemCell Technologies | 8600 | |
| STEMdiff Neural Progenitor Medium | StemCell Technologies | 5833 | |
| STEMdiff SMADi Neural Induction Kit | StemCell Technologies | 8581 | |
| Thermo Scientific Shandon Finesse ME Microtome | Thermo Scientific | - | |
| Tissue Prep | Fisher Scientific | T555 | |
| Tissue-Tek VIP 6 AI Tissue Processor | Sakura Finetek | - | |
| Toluene (histological) | ChapTec | - | |
| Trypan blue; 0.4% (wt/vol) | Thermo | 15250061 | |
| Tween 20 | BioShop | TWN510.100 |
Referanslar
- Spurlock, M. S., et al. Amelioration of penetrating ballistic-like brain injury induced cognitive deficits after neuronal differentiation of transplanted human neural stem cells. Journal of Neurotrauma. 34 (11), 1981 (2017).
- Zhou, Y., Shao, A., Xu, W., Wu, H., Deng, Y. Advance of stem cell treatment for traumatic brain injury. Frontiers in Cellular Neuroscience. 13, 301 (2019).
- Hayashi, Y., Lin, H. -. T., Lee, C. -. C., Tsai, K. -. J. Effects of neural stem cell transplantation in Alzheimer's disease models. Journal of Biomedical Science. 27 (1), 29 (2020).
- Kefalopoulou, Z., et al. Long-term clinical outcome of fetal cell transplantation for Parkinson disease: Two case reports. JAMA Neurology. 71 (1), 83-87 (2014).
- Li, W., et al. Extensive graft-derived dopaminergic innervation is maintained 24 years after transplantation in the degenerating parkinsonian brain. Proceedings of the National Academy of Sciences of the United States of America. 113 (23), 6544-6549 (2016).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Takahashi, J. iPS cell-based therapy for Parkinson's disease: A Kyoto trial. Regenerative Therapy. 13, 18-22 (2020).
- Krause, M., Phan, T. G., Ma, H., Sobey, C. G., Lim, R. Cell-based therapies for stroke: Are we there yet. Frontiers in Neurology. 10, 656 (2019).
- Coles-Takabe, B. L. K., et al. Don't look: Growing clonal versus nonclonal neural stem cell colonies. Stem Cells. 26 (11), 2938-2944 (2008).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Jakel, R. J., Schneider, B. L., Svendsen, C. N. Using human neural stem cells to model neurological disease. Nature Reviews Genetics. 5 (2), 136-144 (2004).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Li, J., et al. Conservation and divergence of vulnerability and responses to stressors between human and mouse astrocytes. Nature Communications. 12 (1), 3958 (2021).
- Morizane, A., et al. MHC matching improves engraftment of iPSC-derived neurons in non-human primates. Nature Communications. 8 (1), 385 (2017).
- Khrameeva, E., et al. Single-cell-resolution transcriptome map of human, chimpanzee, bonobo, and macaque brains. Genome Research. 30 (5), 776-789 (2020).
- Powell, K. Hybrid brains: The ethics of transplanting human neurons into animals. Nature. 608 (7921), 22-25 (2022).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- García-Delgado, A. B., et al. Brain organoids to evaluate cellular therapies. Animals. 12 (22), (2022).
- Lin, J. -. R., Fallahi-Sichani, M., Sorger, P. K. Highly multiplexed imaging of single cells using a high-throughput cyclic immunofluorescence method. Nature Communications. 6 (1), 8390 (2015).
- Knapp, D. J. H. F., et al. Single-cell analysis identifies a CD33+ subset of human cord blood cells with high regenerative potential. Nature Cell Biology. 20 (6), 710-720 (2018).
- Georgala, P. A., Carr, C. B., Price, D. J. The role of Pax6 in forebrain development. Developmental Neurobiology. 71 (8), 690-709 (2011).
- Britanova, O., et al. Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex. Neuron. 57 (3), 378-392 (2008).
- Kim, H., et al. Modeling G2019S-LRRK2 sporadic Parkinson's disease in 3D midbrain organoids. Stem Cell Reports. 12 (3), 518-531 (2019).
- Smits, L. M., et al. Modeling Parkinson's disease in midbrain-like organoids. NPJ Parkinson's Disease. 5, 5 (2019).
- Jin, M., et al. Type-I-interferon signaling drives microglial dysfunction and senescence in human iPSC models of Down syndrome and Alzheimer's disease. Cell Stem Cell. 29 (7), 1135.e8-1153.e8 (2022).
- Sun, X. -. Y., et al. Generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, e76707 (2022).
- Popova, G., et al. Human microglia states are conserved across experimental models and regulate neural stem cell responses in chimeric organoids. Cell Stem Cell. 28 (12), 2153.e6-2166.e6 (2021).
- Wang, S., Li, B., Zhang, F. Molecular fluorophores for deep-tissue bioimaging. ACS Central Science. 6 (8), 1302-1316 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır