Method Article
Ein menschliches zerebrales Organoidmodell der neuronalen Zelltransplantation
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Protokoll für die Transplantation und Verfolgung markierter Nervenzellen in menschliche Hirnorganoide.
Zusammenfassung
Die Weiterentwicklung von Zelltransplantationsansätzen erfordert Modellsysteme, die eine genaue Beurteilung der funktionellen Potenz transplantierter Zellen ermöglichen. Für das zentrale Nervensystem ist die Xenotransplantation zwar nach wie vor auf dem neuesten Stand der Technik, aber technisch anspruchsvoll, im Durchsatz begrenzt und teuer. Darüber hinaus reagieren die vorhandenen Umweltsignale nicht perfekt mit menschlichen Zellen. In diesem Artikel wird ein kostengünstiges, zugängliches und hochdurchsatzkompatibles Modell für die Transplantation und Verfolgung menschlicher Nervenzellen in menschliche Hirnorganoide vorgestellt. Diese Organoide können mit kommerziellen Kits leicht aus humanen induzierten pluripotenten Stammzellen erzeugt werden und enthalten die wichtigsten Zelltypen des Großhirns.
Wir demonstrieren dieses Transplantationsprotokoll zunächst mit der Injektion von EGFP-markierten humanen iPSC-abgeleiteten neuralen Vorläuferzellen (NPCs) in diese Organoide. Als nächstes diskutieren wir Überlegungen zur Verfolgung des Wachstums dieser Zellen im Organoid durch Lebendzell-Fluoreszenzmikroskopie und demonstrieren die Verfolgung von transplantierten EGFP-markierten NPCs in einem Organoid über einen Zeitraum von 4 Monaten. Schließlich stellen wir ein Protokoll für das Schneiden, die zyklische Immunfluoreszenzfärbung und die Bildgebung der transplantierten Zellen in ihrem lokalen Kontext vor. Das hier vorgestellte Organoid-Transplantationsmodell ermöglicht die langfristige (mindestens 4 Monate) Verfolgung transplantierter menschlicher Zellen direkt in einer menschlichen Mikroumgebung mit einem kostengünstigen und einfach durchzuführenden Protokoll. Es stellt daher ein nützliches Modell sowohl für neuronale Zelltherapien (Transplantationen) als auch wahrscheinlich für die mikroumweltgenauere Modellierung von Tumoren des Zentralnervensystems (ZNS) dar.
Einleitung
Das menschliche Gehirn ist ein komplexes Organ, das aus mehreren Zelltypen der neuronalen und glialen Linien besteht. Zusammen bilden diese ein ausgeklügeltes Netzwerk, das Kognition entstehen lässt. Es besteht ein großes Interesse an der Transplantation von Zellen in dieses System zur Behandlung einer Vielzahl von neurologischen Erkrankungen, einschließlich traumatischer Hirnverletzungen (TBI)1,2, neurodegenerativer Erkrankungen 3,4,5,6,7 und Schlaganfall8. Eine große Einschränkung bei der Weiterentwicklung solcher Strategien ist jedoch der relative Mangel an verfügbaren präklinischen Modellen, um die erwarteten Transplantationsergebnisse zu bestimmen. Die derzeit am häufigsten verwendeten Modelle sind In-vitro-Kulturmethoden zur Bestimmung des Zellpotenzials und die Xenotransplantation in Mäuse. Während Zellkulturmethoden das Differenzierungs- und Selbsterneuerungspotenzial beurteilen können9, werden diese unter optimalen Wachstumsbedingungen durchgeführt, die nicht die Mikroumgebung nachahmen, der die Zellen in einem Transplantationskontext begegnen würden. Darüber hinaus kann die Art und Weise, wie die Zellen gezüchtet werden, ihr Verhalten beeinflussen10.
Mäusegehirne enthalten alle Zellen der Mikroumgebung und sind daher äußerst leistungsfähige Modellsysteme für die Transplantation11. Es gibt jedoch wichtige Unterschiede zwischen dem Kortex der Maus und dem Menschen 12,13, und nicht alle Wachstumsfaktoren reagieren zwischen den Arten. Primatenmodelle sind eine engere Alternative, die das menschliche System besser nachahmen und auch wichtige präklinische Ergebnisse geliefert haben14. Selbst diese näher verwandten Verwandten behalten jedoch wichtige Unterschiede in ihrer zellulären Zusammensetzungbei 15. Obwohl diese beiden Modellsysteme wertvolle Einblicke in das Zellverhalten während der Transplantation liefern und die chirurgischen Elemente einer eventuellen Therapie einbeziehen, bleiben sie unvollkommen. Sie sind auch kostspielig und technisch anspruchsvoll (d. h. man muss Gehirnoperationen an den Tieren durchführen), wodurch der mögliche Durchsatz begrenzt wird. Darüber hinaus gibt es eine Fülle von ethischen Fragen, die mit der Transplantation menschlicher Gehirnzellen in Tiere verbunden sind16. Gehirnschnittkulturen ermöglichen es, ein Gehirn zu schneiden und für mehrere Behandlungen zu verwenden, wodurch einige der Einschränkungen von Tiertransplantationen beseitigt werden. Diese haben jedoch eine begrenzte Lebensdauer (Wochen), sind immer noch tierischen Ursprungs und haben (da es sich um eine dünne Scheibe handelt) keine ausreichende Volumen-/Oberflächenintegrität, um die Injektion von Zellennachzuahmen 17. Es bleibt also eine wichtige Lücke zwischen reinen Zellkultur-/Potenzialmodellen und In-vivo-Transplantation.
Zerebrale Organoide sind ein In-vitro-Modell, das die wichtigsten im Gehirn vorkommenden neuralen Zelltypen enthält und in großer Zahl aus humanen induzierten pluripotenten Stammzellen (iPSCs) erzeugt werden kann18,19. Solche Organoide bieten somit einen zellulären Kontext, der die Beurteilung der Funktionsfähigkeit einer Testzelle von Interesse in der Transplantationsumgebung ermöglichen könnte. In der Tat zeigte eine kürzlich durchgeführte Studie, dass neurale Vorläuferzellen (NPCs), die in menschliche zerebrale Organoide transplantiert wurden, überleben, sich vermehren und sich ähnlich differenzieren wie NPCs, die in das Gehirn einer starkkombinierten immundefizienten g amma(NSG) Maus transplantiert wurden20. Zerebrale Organoide stellen somit ein tierversuchsfreies, langlebiges (>6 Monate), kostengünstiges System dar, das die Zelltypen des menschlichen Gehirns erfasst. Als solche könnten sie ein idealer Transplantatempfänger für die frühe Prüfung der Regenerationsfähigkeit von Nervenzellen darstellen.
In diesem Artikel wird ein Protokoll für die Transplantation und anschließende Verfolgung von markierten menschlichen NPCs in menschliche zerebrale Organoide vorgestellt (Abbildung 1). Dies beginnt mit der Injektion von GFP-markierten NPCs in reife (2-4 Monate alte) zerebrale Organoide18. Die transplantierten Zellen werden dann über einen Zeitraum von 4 Monaten von einer Fluoreszenzmikroskopie lebender Zellen verfolgt. Während dieser Zeit zeigen wir sowohl die Persistenz von Zellen an der Injektionsstelle, als auch die Migration in distale Regionen des Organoids. Am Endpunkt demonstrieren wir die Antigengewinnung, Färbung und Bildgebung von histologischen Schnitten, die von diesen Organoiden abgeleitet wurden, einschließlich eines Protokolls für das Quenching bestehender Farbstoffe auf AlexaFluor-Basis, um zusätzliche Färbe- und Bildgebungsrunden zu ermöglichen, basierend auf früheren Arbeiten21. Dieses Protokoll könnte daher bei der Messung der Differenzierungskapazität von Zellen in einer Transplantationsumgebung, der Haltbarkeit des Transplantats, der Zellexpansion in situ und der Zellmigration von der Transplantationsstelle nützlich sein. Wir gehen davon aus, dass dies sowohl für Anwendungen in der regenerativen Medizin/Zelltherapie als auch für die Tumormodellierung durch Transplantation von Tumorzellen in relevante regionsspezifische Organoide nützlich sein wird.
Protokoll
HINWEIS: In der Materialtabelle finden Sie Details zu allen Materialien, Reagenzien und Geräten, die in diesem Protokoll verwendet werden.
1. Fluorophor-Markierung von Zellen durch lentivirale Transduktion
- Tauen Sie ein Aliquot der gelösten Basalmembranmatrix Ihrer Wahl auf Eis auf.
- Während das Aliquot auftaut, fügen Sie steriles Wasser hinzu, um die Lücken zwischen den Vertiefungen in einer 24-Well-Platte zusammen mit allen äußeren Vertiefungen zu füllen.
HINWEIS: Dadurch bleiben acht Vertiefungen in der Mitte offen und stellen sicher, dass die Zellen in hoher Luftfeuchtigkeit bleiben, wodurch die verdunstungsbedingte Variabilität minimiert wird. - Verdünnen Sie die lösliche Basalmembranmatrix 1:100 in eiskaltem DMEM/F12-Medium (mit der hier verwendeten Charge wurde eine Endkonzentration von 0,089 mg/ml erreicht).
- Geben Sie 300 μl der verdünnten solubilisierten Basalmembranmatrix in eine der mittleren (offenen) Vertiefungen der vorbereiteten 24-Well-Platte pro durchzuführender Infektion. Achten Sie darauf, den gesamten Boden der Vertiefung gleichmäßig zu bedecken, und fügen Sie bei Bedarf mehr hinzu, um eine gleichmäßige Beschichtung zu gewährleisten.
- Die Platte wird 30 Minuten lang bei 37 °C inkubiert, damit sich eine Schicht entlang des Bohrlochbodens verfestigen kann. Vergewissern Sie sich am Ende dieser Inkubation, dass die Flüssigkeit den Bohrlochboden noch vollständig bedeckt und in der Mitte nicht verdunstet ist. Verdunstung ist ein Zeichen dafür, dass die Luftfeuchtigkeit zu niedrig ist; Wiederholen Sie in diesem Fall die Beschichtung.
HINWEIS: Die Platten können am Vorabend beschichtet und in verdünnter solubilisierter Basalmembranmatrix ohne offensichtliche negative Auswirkungen belassen werden; Das Verdunstungsrisiko ist jedoch stark erhöht, daher müssen sie vor dem Gebrauch sorgfältig überprüft werden. - Entfernen Sie das Medium aus einem Well mit konfluenten iPSC-abgeleiteten NPCs, die in einer Well-Platte wachsen.
HINWEIS: Für diese Arbeit wurden iPSC-abgeleitete neuronale Vorläuferzellen verwendet, die mit einem kommerziellen Kit gemäß den Anweisungen des Herstellers zwischen Passage 3 und Passage 10 hergestellt wurden. - Geben Sie vorsichtig 1 ml PBS an die Seite der Vertiefung und schaukeln Sie die Platte, um ein gleichmäßiges Waschen zu gewährleisten.
- Entfernen Sie das PBS und ersetzen Sie es durch 300 μl der proteolytisch-kollagennolytischen Enzymmischung, wobei Sie die Platte erneut schaukeln, um sicherzustellen, dass der Well-Boden vollständig bedeckt ist. 5 min bei 37 °C inkubieren. Stellen Sie lichtmikroskopisch sicher, dass sich die Zellen von der Plattenoberfläche lösen.
- Fügen Sie mit einer P1.000-Pipette 700 μl DMEM/F12 hinzu und lösen Sie die Zellen, indem Sie diese Mischung über alle Oberflächen des Plattenbodens sprühen. Pipettieren Sie auf und ab, um sicherzustellen, dass die Zellaggregate in eine gleichmäßige Einzelzellsuspension aufgebrochen werden. Nehmen Sie die Zellen auf und geben Sie 9 ml DMEM/F12-Medium in ein konisches 15-ml-Röhrchen.
- Bei 300 × g 5 Min. zentrifugieren.
- Bereiten Sie während dieser Zeit genügend Medium vor, das mit 10 μM Y-27632 für 500 μl pro zu plattierendem Well ergänzt wird, plus 1 ml für die Resuspension.
HINWEIS: Y-27632 ist notwendig, um ein hohes Überleben der NPCs nach der Passage als einzelne Zellen zu gewährleisten. - Entfernen Sie den Überstand und resuspendieren Sie die Zellen in 1 ml Y-27632-supplementiertem Medium, indem Sie mehrmals vorsichtig auf und ab pipettieren, um die Zellaggregate aufzubrechen.
- Nehmen Sie ein paar Mikroliter Zellen heraus und verdünnen Sie sie (1:5 bis 1:10) in Trypanblau.
- Zählen Sie die lebensfähigen (trypanblau-negativen) Zellen auf einem Hämozytometer. Passen Sie die Trypanblau-Verdünnung an, um mindestens 50 lebensfähige Zellen pro Quadranten des Hämozytometers zu erhalten, um sicherzustellen, dass die Zählungen genau sind. Berechnen Sie das Volumen der Zellsuspension, das für 100.000 Zellen benötigt wird, die in jedem Well vorhanden sind.
- Mischen Sie die Zellen durch Pipettieren vorsichtig auf und ab und nehmen Sie das berechnete Volumen auf (für 100.000 Zellen pro Well). Fügen Sie dies dem Y-27632-supplementierten Medium (aus Schritt 1.11) hinzu, so dass das endgültige Volumen 500 μl pro zu plattierendem Well beträgt.
- Entfernen Sie die verdünnte solubilisierte Basalmembranmatrix aus den zuvor beschichteten Vertiefungen (vorausgesetzt, die Inkubation von 30 Minuten oder länger ist abgeschlossen).
- Mischen Sie die Zellen vorsichtig durch Pipettieren und geben Sie 500 μl der Zellsuspension in jede Vertiefung.
- Um die Zellen gleichmäßig zu verteilen, bewegen Sie die Platte unmittelbar vor dem Einsetzen in einen Zellkulturinkubator in einer großen "+"-Zeichenbewegung mit sanften linearen Strichen (vorwärts-rückwärts, stopp, rückwärts-rückwärts).
- Über Nacht (16-24 h) bei 37 °C und 5 % CO2 inkubieren.
- Entfernen Sie das Medium und fügen Sie das titrierte Lentivirus hinzu. Wenn einzelne Integrationsereignisse erforderlich sind, streben Sie eine Multiplizität der Infektion von 0,3 infektiösen Einheiten pro Zelle an (idealerweise titriert auf den interessierenden Zellen) und füllen Sie bis zu 500 μl in Medium (ohne Y-27632) auf.
HINWEIS: Das interessierende Lentivirus kann wie bisher vortitriert oder im eigenen Haus hergestellt werden22. Hier wurde ein selbst hergestelltes GFP-Lentivirus mit Puromycin-Resistenz verwendet, um die EGFP exprimierenden NPCs zu erzeugen und auszuwählen. Wenn das Lentivirus nicht auf den interessierenden Zellen titriert wurde und die Kopienzahl kritisch ist, wird empfohlen, mehrere Volumina in ein paar Wells zu geben und das Well mit ~30% EGFP+ -Zellen 48-72 h später zu verwenden. Wenn die Kopienzahl nicht kritisch ist, kann überschüssiges Virus hinzugefügt werden, mit der Einschränkung, dass die Insertionsmutagenese bei einigen Klonen zu anomalem Verhalten führen kann. ACHTUNG: Lentivirale Vektoren sind eine biologische Gefahr der Stufe 2-3 (abhängig von ihrem Inhalt). Befolgen Sie die örtlichen Biosicherheitsvorschriften für den Umgang mit dem Lentivirus, die Dekontamination von Oberflächen und Kunststoffen sowie flüssigen Abfällen. - Die Zellen werden wieder in den Inkubator gestellt und 24 Stunden lang bei 37 °C und 5 % CO2 inkubiert.
- Entfernen Sie die Zellen aus dem Inkubator und entfernen Sie den Überstand.
ACHTUNG: Da der Überstand aus den Zellen zu diesem Zeitpunkt noch lentivirale Partikel enthält, befolgen Sie weiterhin die örtlichen Biosicherheitsvorschriften für die Handhabung und Entsorgung. - Spülen Sie die Zellen mit 2 x 500 μl PBS, indem Sie PBS vorsichtig an die Wand der Vertiefung geben; Nehmen Sie dann aus der Brunnenecke, um alle verbleibenden Lentiviren abzuwaschen.
ACHTUNG: Da der Überstand aus den Zellen zu diesem Zeitpunkt noch lentivirale Partikel enthält, befolgen Sie weiterhin die örtlichen Biosicherheitsvorschriften für die Handhabung und Entsorgung. - Wechseln Sie zu 500 μl frischem Medium (ohne Y-27632) und wachsen Sie über Nacht bei 37 °C und 5 % CO2 weiter.
- Verwenden Sie die Fluoreszenzmikroskopie für lebende Zellen, um den Anteil der Zellen zu überprüfen, die EGFP exprimieren, und wählen Sie die Vertiefung aus, mit der fortgefahren werden soll.
- Wenn der lentivirale Vektor der Wahl eine Selektionskassette enthält (Antibiotikaresistenzgen wie Puromycinresistenz), geben Sie das Selektionsmittel (hier 1 μg/ml Puromycin) in einer zuvor validierten Dosis in das Medium, die empfindliche, aber nicht resistente Zellen abtötet. Andernfalls verwenden Sie die fluoreszenzaktivierte Zellsortierung, um die EGFP+ -Zellen zum Zeitpunkt der ersten Teilung zu isolieren.
- Pflegen Sie die Zellen von nun an mit täglicher Überwachung auf Konfluenz und führen Sie täglich vollständige Mediumwechsel durch.
- Wenn die Konfluenz erreicht ist, bereiten Sie eine oder mehrere Vertiefungen einer frischen 6-Well-beschichteten Platte vor (mit 1 ml verdünnter solubilisierter Basalmembranmatrix; siehe Schritte 1.3-1.5) und ernten Sie die Zellen wie in den Schritten 1.6-1.15 beschrieben.
HINWEIS: Wenn kein Selektionsmittel enthalten ist, sortieren Sie die Zellen in diesem Stadium nach Durchflusszytometrie. Stellen Sie sicher, dass die Zellen mit einer ausreichend breiten Düse und niedrigem Druck sortiert werden, um den Stress zu minimieren, sowie dass bei jedem Schritt des Sortierprozesses 10 μM Y-27632 enthalten ist. - Plattieren Sie die Zellen auf eine Enddichte von 200.000 Zellen/cm2.
- Behalten Sie die tägliche Überwachung bei und führen Sie täglich den Medienwechsel durch.
HINWEIS: Wenn die Zellen wieder Konfluenz erreichen, sind sie jetzt einsatzbereit. Alternativ kann ein Bestand nun wie folgt für die zukünftige Verwendung eingefroren werden. - Teilen, ernten und zählen Sie die Zellen wie in den Schritten 1.6-1.15 beschrieben.
- Beschriften Sie einen Satz Kryoröhrchen mit den relevanten Informationen (z. B. Durchgang, EGFP%, Linie).
- Resuspendieren Sie bei 400.000 Zellen/ml in Medium + 10 % DMSO.
HINWEIS: DMSO ist giftig für Zellen, wenn es nicht gefroren ist, minimieren Sie also die Zeit, die Sie bei Raumtemperatur in Gegenwart von DMSO verbringen. - 1 ml (400.000 Zellen) der Mischung aus Schritt 1.33 pro Kryoröhrchen zugeben und in einen Zellgefrierbehälter geben.
- Stellen Sie den Behälter über Nacht in einen -80 °C-Gefrierschrank.
- Am nächsten Tag werden die Zellen zur Langzeitlagerung in flüssigen Stickstoff überführt.
2. Markierte Zellinjektion in das Gehirnorganoid
HINWEIS: Für dieses Papier wurden zerebrale Organoide mit einem handelsüblichen Kit gemäß den Anweisungen des Herstellers hergestellt. Dies kann durch das interessierende zerebrale Organoid ersetzt werden. Die in diesem Teil des Protokolls verwendeten Materialien müssen vorgekühlt werden, um ein Gelieren der löslichen Basalmembranmatrix bei über 4 °C zu vermeiden.
- Legen Sie die Insulinspritze(n), Spitzen und Röhrchen, die mit der löslichen Basalmembranmatrix in Kontakt kommen, auf −20 °C, um sie abkühlen zu lassen.
- Tauen Sie ein Aliquot geeigneter Größe der gelösten Basalmembranmatrix auf Eis auf, abhängig von der Anzahl der durchzuführenden Injektionen (~2 μl/Injektion). Dies dauert ca. 30 Minuten.
- Während das Aliquot auftaut, teilen, ernten und zählen Sie die Zellen wie in den Schritten 1.6-1.15 beschrieben.
- Berechnen Sie die pro Injektion benötigten Volumina. Wenn Sie mehrere Injektionen durchführen, geben Sie das Gesamtvolumen der Zellen in ein 1,5-ml-Röhrchen und fügen Sie bis zu 1 ml DMEM/F12 hinzu.
HINWEIS: Ein Volumen, das einige zusätzliche Injektionen zulässt, sollte verwendet werden, um Verluste/Pipettierfehler zu berücksichtigen. - Legen Sie die Zellen in Eis, während die nächsten Schritte vorbereitet werden.
- Nach dem Auftauen verdünnen Sie die lösliche Basalmembranmatrix auf eine Endkonzentration von 3 mg/ml in eiskaltem DMEM/F12.
- Nehmen Sie die einzellige Suspension aus dem Eis und schleudern Sie sie bei 300 × g für 5 min bei 4 °C herunter.
HINWEIS: Wenn keine gekühlte Zentrifuge verfügbar ist, scheint das Schleudern bei Raumtemperatur im Allgemeinen toleriert zu werden. - Entfernen Sie das Medium vorsichtig vollständig, ohne das Zellpellet zu stören. Resuspendieren Sie das Zellpellet durch vorsichtiges Pipettieren in der verdünnten solubilisierten Basalmembranmatrix (3 mg/ml), um ein endgültiges Volumen von 2 μl pro durchzuführender Injektion zu erhalten, und legen Sie es sofort bis zur Verwendung wieder auf Eis.
HINWEIS: Die Resuspension der Zellen muss langsam und mit vorgekühlten Spitzen durchgeführt werden, um Blasenbildung und Gelierung zu vermeiden. - Übertragen Sie die vorgekühlte(n) Spritze(n) aus dem -20 °C-Gefrierschrank in einen Eiskübel. Bewahren Sie sie dort auf, bis sie verwendet werden.
- Nehmen Sie die Platte mit den Gehirnorganoiden aus dem Inkubator. Verwenden Sie eine Spitze mit breiter Öffnung, um das zu injizierende Organoid in eine 35-mm-Schale zu übertragen. Entfernen Sie das gesamte Medium, ohne das Organoid zu beschädigen, um es zu stabilisieren und die Injektion zu erleichtern.
HINWEIS: Es ist wichtig, Spitzen mit breiter Bohrung zu verwenden, um eine Zerstörung des Organoids zu vermeiden. Wenn sie nicht verfügbar sind, schneiden Sie das Ende einer normalen P1.000-Spitze mit einer sterilen Schere ab. - Legen Sie die 35-mm-Schale mit dem Organoid unter ein Präpariermikroskop, um die Injektion zu führen und zu erleichtern.
HINWEIS: Wenn in einem sterilen Bereich kein Präpariermikroskop zur Verfügung steht, ist es möglich, die Injektion ohne eines durchzuführen, wenn auch mit etwas eingeschränkter Kontrolle. Eine weitere Alternative ist die Verwendung einer Vergrößerungsschlaufe oder Brille. - Sobald das/die Organoid(e) zur Injektion bereit sind, resuspendieren Sie die Zellen vorsichtig mit einer gekühlten P20-Pipettenspitze und bewegen Sie 2 μl (mit der gewünschten Anzahl von zu injizierenden Zellen) auf einen vorgekühlten sterilen Glasobjektträger.
HINWEIS: Für Mehrfachinjektionen können zusätzliche 2 μl-Volumina über den Objektträger hinzugefügt werden. Bewahren Sie es auf Eis auf und achten Sie darauf, dass es nicht verdunstet. - Nehmen Sie eine vorgekühlte Insulinspritze aus dem Eis und ziehen Sie die 2 μl Zellsuspension langsam mit der Abschrägung der Nadel nach unten auf, damit alle Zellen/das Medium aufgenommen werden können.
Anmerkungen: Achten Sie darauf, extrem langsam zu fahren, um kein Lufteinsaugen zu vermeiden. - Öffnen Sie den Deckel der Schale, die das Organoid enthält, und richten Sie das Mikroskop darauf. Halten Sie die Schüssel mit einer Hand. Legen Sie die Fase der Nadel nach oben und injizieren Sie die Zellen mit der anderen Hand langsam in die Organoidoberfläche.
HINWEIS: Es ist wichtig, langsam zu injizieren, um eine Schädigung des Gewebes zu vermeiden. - Setzen Sie nach der Injektion den Deckel wieder in die Schale und lassen Sie das injizierte Organoid 1-2 Minuten einwirken.
HINWEIS: Dadurch kann die verdünnte solubilisierte Basalmembranmatrix gelieren und die Zellen an Ort und Stelle halten. Wird das Medium zu früh zugegeben, kann es die an der Oberfläche sitzenden Zellen wegspülen. - Fügen Sie vorsichtig 500 μl des Organoidmediums hinzu und übertragen Sie das Organoid mit einer breiten Spitze in eine Vertiefung einer 24-Well-Platte. Das Organoid wird über Nacht bei 37 °C und 5 % CO2 inkubiert. Führen Sie jeden zweiten Tag einen kompletten Mediumwechsel durch.
HINWEIS: Es ist wichtig, ein Negativkontrollorganoid (Scheininjektion) beizufügen, das für bildgebende Anpassungen verwendet wird. Zu diesem Zweck wird ein Organoid wie zuvor beschrieben mit verdünnter solubilisierter Basalmembranmatrix (3 mg/ml) injiziert, um ein Endvolumen von 2 μl ohne Zellen zu erhalten.
3. Transplantatverfolgung durch Fluoreszenzbildgebung lebender Zellen
HINWEIS: Verwenden Sie ein Fluoreszenzmikroskop, das das interessierende Fluorophor anregen kann und über den erforderlichen Filtersatz verfügt, um seine Fluoreszenz zu erkennen. Wie bereits erwähnt, waren die hier verwendeten NPCs EGFP+, mit einem Anregungspeak von 488 nm und einem Emissionspeak von ~510 nm.
- Laden Sie ein Negativkontrollorganoid (nicht injiziert oder simuliert injiziert) und stellen Sie die Beleuchtungsintensität und Belichtungszeit so ein, dass die Autofluoreszenz minimal ist. Für das hier verwendete Instrument wurde die Beleuchtungsstärke zwischen 1 und 2 und die Belichtungszeit zwischen 80 ms und 100 ms eingestellt.
HINWEIS: Da viele Anregungswellenlängen (insbesondere niedrigere Wellenlängen) für Zellen toxisch sein können, wird empfohlen, die Intensität niedrig zu halten und nicht zu lange zu suchen, um Schäden am Organoid zu vermeiden. - Laden Sie das Positivkontrollorganoid und erhöhen Sie gegebenenfalls die Expositionszeit, um sicherzustellen, dass markierte Zellen deutlich sichtbar sind. Positionieren Sie das Organoid mit einer Pipettenspitze mit breitem Durchgang neu, um die Injektionsstelle (EGFP+- Bereich) zu finden.
- Entfernen Sie das Medium vollständig aus dem Negativkontrollorganoid. Laden Sie das Negativkontroll-Organoid und bilden Sie es mit den gewählten Einstellungen ab (für das hier verwendete Instrument wurde die Beleuchtungsstärke zwischen 1 und 2 und die Belichtungszeit zwischen 80 ms und 100 ms eingestellt). Wenn die Bildgebung abgeschlossen ist, fügen Sie sofort frisches Medium hinzu, um ein Austrocknen des Organoids zu verhindern.
HINWEIS: Die Entfernung des Mediums ist entscheidend für ein gutes Bild, da sie die Höhe und Ausrichtung der Organoide fixiert, die ansonsten schweben und sich ständig bewegen, was eine qualitativ hochwertige Bildgebung ausschließt. - Wiederholen Sie die Mediumentfernung/Bildgebung mit jedem der Testorganoide.
- Setzen Sie die Organoide wieder auf normale Inkubations-/Medienwechsel (wie in Schritt 2.16) zurück und wiederholen Sie die Bildgebung in den gewünschten Intervallen. Hier wurden die Organoide in Woche 1, Woche 9 und Woche 16 nach der Injektion abgebildet, um das Überleben, die Proliferation, die Differenzierung und die Migration der injizierten EGFP+ -NPCs zu verfolgen und zu testen.
4. Histologie und Immunfluoreszenz
- Übertragen Sie das Organoid am Endpunkt auf eine Histologiekassette, die mit der ID des Organoids und anderen erforderlichen Identifikatoren beschriftet ist.
- Füllen Sie die Kassette mit 10% Formalin und schließen Sie sie. Bewahren Sie es 24 Stunden bei Raumtemperatur auf.
- Die geschlossene Kassette mit dem Organoid wird in einen Gewebeprozess überführt und das folgende Protokoll eingestellt: Ethanol 70 % 10 min, Ethanol 80 % 20 min, Ethanol 95 % 30 min, Ethanol 100 % 30 min, Ethanol 100 % 40 min, Ethanol 100 % 50 min, Toluol 30 min, Toluol 40 min, Toluol 50 min, Paraffin 25 min bei 59 °C, Paraffin 35 min bei 59 °C, Paraffin 40 min bei 59 °C, Paraffin 50 min bei 59 °C.
Anmerkungen: Die obigen Schritte werden unter Vakuum bei Raumtemperatur durchgeführt, sofern nicht anders angegeben. Dieses Protokoll ersetzt das Wasser durch Alkoholgradienten von bis zu 100%. Der Zwischenschritt bei Toluol ist ein Übergang zwischen Alkohol und Paraffin, da beide darin löslich sind. ACHTUNG: Toluol und Paraffin gelten als Gefahrstoffe, da sie leicht entzündliche Flüssigkeiten sein können und durch Einatmen oder Kontakt mit Haut oder Augen Schäden verursachen können. Achten Sie darauf, sie fest verschlossen an einem sicheren Ort aufzubewahren. Tragen Sie beim Umgang mit ihnen geeignete persönliche Schutzausrüstung. Entsorgen Sie Abfälle gemäß den örtlichen Vorschriften zur Chemikalienbelastung. - Die geschlossene Kassette mit dem Organoid in ein Paraffinbad in der Einbettstation überführen.
- Nehmen Sie die Kassette aus dem Bad, öffnen Sie sie und geben Sie das Organoid in eine Stahlgrundform. Stellen Sie die Form unter den Paraffinspender und bedecken Sie sie vollständig mit Paraffin.
- Legen Sie die leere Kassette auf die Oberseite der Stahlgrundform. Geben Sie hier mehr Paraffin auf die Kassette.
- Die Stahlgrundform mit der Kassette oben in Eis legen und 5 Minuten abkühlen lassen. Entfernen Sie die Stahlform und bewahren Sie die Kassette mit dem Organoid in einem Paraffinblock auf.
- Übertragen Sie die Kassette in ein Mikrotom, um Abschnitte zu schneiden. Abschnitte nach Belieben zuschneiden.
HINWEIS: Hier wurden Abschnitte mit einer Dicke von 15 μm durch das Organoid hergestellt. - Lassen Sie jeden Abschnitt auf die Oberfläche eines 45 °C eingestellten Wasserbades fallen und nehmen Sie ihn auf einem Glasobjektträger auf.
- Lassen Sie die Objektträger über Nacht in einem Inkubator bei 42 °C trocknen.
HINWEIS: Die Objektträger können nun bis zum Zeitpunkt der Färbung bei Raumtemperatur gelagert werden. - Legen Sie den Objektträger für 2 Minuten in ein mit Toluol gefülltes Coplin-Objektträgerfärbeglas. Wiederholen Sie diesen Schritt noch einmal.
ACHTUNG: Toluol gilt als Gefahrgut, da es eine leicht entzündliche Flüssigkeit sein kann und durch Einatmen oder Kontakt mit Haut oder Augen Schäden verursachen kann. Achten Sie darauf, es fest verschlossen an einem sicheren Ort aufzubewahren. Tragen Sie beim Umgang damit eine geeignete persönliche Schutzausrüstung. Entsorgen Sie Abfälle gemäß den örtlichen Vorschriften zur Chemikalienbelastung. - In ein mit EtOH 100% gefülltes Glas-Objektträger-Färbegefäß für 2 Minuten umfüllen. Wiederholen Sie diesen Schritt noch einmal.
- In ein mit destilliertem Wasser gefülltes Coplin-Objektträger-Färbeglas für 2 Minuten geben. Wiederholen Sie diesen Schritt noch einmal.
- Für die Antigengewinnung Citratpuffer (10 mM Zitronensäure, 0,05 % Tween 20, pH 6,0) vorbereiten.
HINWEIS: Citratpuffer kann bis zu 3 Monate bei Raumtemperatur oder bei 4 °C für eine längere Lagerung gelagert werden. - Stellen Sie ein Wasserbad zwischen 95 °C und 100 °C ein.
ACHTUNG: Dieses Wasserbad kann Verbrennungen verursachen, wenn man nicht aufpasst. Treffen Sie alle notwendigen Vorsichtsmaßnahmen, um den direkten Kontakt mit dem Bad oder seinen Komponenten zu vermeiden. - Im Wasserbad schwimmt ein Plastikbehälter, in den die Objektträger passen. Stellen Sie sicher, dass der Kunststoff den Boden des Bades nicht berührt (vorausgesetzt, es handelt sich um ein Bodenheizbad), um ein Schmelzen zu vermeiden. Gießen Sie den Citratpuffer in den Plastikbehälter und lassen Sie ihn 95-100 °C erreichen.
- Sobald der Puffer die gewünschte Temperatur erreicht hat, legen Sie die Objektträger in den Puffer und decken Sie den Behälter locker mit einem Deckel ab. Lassen Sie die Objektträger im Behälter 30-40 Minuten im Wasserbad.
- Nehmen Sie den Plastikbehälter aus dem Wasserbad und lassen Sie ihn weitere 20 Minuten bei Raumtemperatur abkühlen.
- Waschen Sie die Objektträger 3 x 2 Minuten lang mit PBS. Entfernen Sie das PBS mit einem Papiertuch, ohne die Probe zu berühren oder zu übertrocknen.
- Bereiten Sie den Permeabilisierungspuffer (90 ml PBS + 0,1 % Tween-20) vor und füllen Sie ein Glasobjektträger-Färbeglas damit. Tauchen Sie die Objektträger in den Permeabilisierungspuffer und inkubieren Sie sie 10 Minuten lang.
- Waschen Sie die Objektträger 3 x 2 Minuten lang mit PBS.
- Bereiten Sie genügend Färbemischung vor, um jede Probe abzudecken (~25 μl).
HINWEIS: Siehe Tabelle 1 für die hier verwendeten Antikörper und die Endkonzentrationen. - Fügen Sie 25 μl Färbemischung hinzu, um jede Organoidscheibe zu bedecken. 1 h bei Raumtemperatur oder über Nacht bei 4 °C im Dunkeln inkubieren.
HINWEIS: Stellen Sie sicher, dass die Proben bei hoher Luftfeuchtigkeit bleiben, um das Verdunsten der Färbemischung zu verhindern. Wenn kein Behälter zum Feuchthalten der Objektträger verfügbar ist, legen Sie sie in eine Schachtel mit einigen feuchten Taschentüchern an der Ecke. - Waschen Sie die Objektträger 3 x 2 Minuten lang mit PBS.
- Spülen Sie einmal mit destilliertem Wasser in einem Glasobjektträger-Färbeglas ab, um das Salz zu entfernen.
- Zu jeder Probe werden 10 μl flüssiges Eindeckmittel + 4',6-Diamidino-2-phenylindol (DAPI) gegeben.
HINWEIS: Die Objektträger können versiegelt werden, wenn keine zweite Färberunde durchgeführt wird. Hier wurden die Objektträger nicht abgedeckt, um den Zugang zum Abschrecken/Wiederfärben zu ermöglichen, da das Entfernen des Deckglases das Gewebe beschädigen kann. - Bilden Sie die Objektträger mit dem ausgewählten Fluoreszenzmikroskop ab.
HINWEIS: Stellen Sie sicher, dass für jeden Antikörper Positiv- und Negativkontrollen vorhanden sind, um die richtige Einstellung der Intensitäten und Expositionszeiten zu ermöglichen (für das hier verwendete Instrument wurde die Beleuchtungsintensität zwischen 5 und 6 und die Belichtungszeit zwischen 2.000 ms und 3.000 ms eingestellt), obwohl dies je nach Antikörper variieren kann. Stellen Sie außerdem sicher, dass das Mikroskop über geeignete Detektoren für jeden verwendeten Kanal verfügt. Beachten Sie, dass die Proben, da sie nicht abgedeckt sind, während der Bildgebung mit der Vorderseite nach oben gelegt werden müssen. - Bereiten Sie nach der Bildgebung frischen 2x Quenching-Puffer vor (9% H2O2 + 50 mM NaOH in PBS).
HINWEIS: Die Abschrecklösung muss unmittelbar vor der Verwendung frisch zubereitet werden. Die Reaktion reagiert empfindlich auf die Aktivität des H2O2, die mit der Zeit abnimmt. ACHTUNG: H2O2 ist reizend und NaOH ätzend. Diese sollten mit geeigneter Sicherheitsausrüstung behandelt und Hautkontakt vermieden werden. Stellen Sie sicher, dass sie in Übereinstimmung mit den lokalen Richtlinien zur Chemikaliensicherheit entsorgt werden. - Füllen Sie das Coplin-Objektträger-Färbeglas zur Hälfte mit 2x Quenching-Puffer (45 ml), fügen Sie 45 mL PBS hinzu und legen Sie die Objektträger hinein. Über Nacht bei 4 °C inkubieren.
- Überprüfen Sie durch Fluoreszenzmikroskopie, ob die Fluorophore effektiv abgeschreckt wurden.
- Wiederholen Sie die Färbung und Bildgebung wie oben.
HINWEIS: Das Abschrecken und Nachfärben kann bei Bedarf für weitere Runden wiederholt werden, obwohl das Risiko einer Beschädigung mit jeder weiteren Runde steigt.
5. Bildregistrierung
- Öffnen Sie FIJI.
- Erstellen Sie einen Ordner mit den DAPI-Bildern aus Runde 1 und Runde 2. Ändern Sie bei Bedarf die Namen, um zu verdeutlichen, was was ist.
- Erstellen Sie einen leeren Ordner für die Ausgabe der Bildregistrierung.
- Klicken Sie auf Plugins | Anmeldung | Registrieren Sie Virtual Stack Slices.
- Wählen Sie unter Quellverzeichnis den Ordner aus, der die DAPI-Images aus jeder Runde enthält.
- Wählen Sie unter Ausgabeverzeichnis den Ordner aus, der für die Registrierungsausgabe erstellt wurde.
- Legen Sie das Feature-Extraktionsmodell auf Starr und das Dropdown-Menü Registrierungsmodell auf Starr - Verschieben+Drehen fest, um die Registrierung zu korrigieren, sodass das Bild nur zur Ausrichtung verschoben und gedreht werden kann, anstatt verformt zu werden.
HINWEIS: Sollte eine Verformung erwartet werden, können das Feature-Extraktionsmodell und das Registrierungsmodell wie gewünscht an Affine oder andere Modelle angepasst werden, obwohl dies zu unerwünschten Transformationen führen kann. Gelegentlich kann ein Slice zwischen den Runden beschädigt werden, was eine erfolgreiche Registrierung verhindern kann. - Aktivieren Sie das Kontrollkästchen Transformationen speichern , um die Transformationsparameter zu speichern, damit sie auf die anderen Kanäle angewendet werden können.
- Klicken Sie auf OK.
- Wählen Sie den Speicherort für die Transformationsdatei aus (standardmäßig das Eingabeverzeichnis) und klicken Sie auf Öffnen.
- Wählen Sie das DAPI-Image aus, das als Referenz für die Transformationen dienen soll. Das DAPI-Bild aus jeder der anderen Runden wird an diesem ausgerichtet.
HINWEIS: Wenn der Vorgang abgeschlossen ist, werden die registrierten Bilder als Stapel (und im Ausgabeordner) angezeigt. - Verwenden Sie den Schieberegler unten, um zwischen den Bildern hin und her zu blättern, um zu überprüfen, ob die Bildregistrierung erfolgreich war (die Kerne befinden sich in beiden Bildern an der gleichen Stelle, zumindest für die überlappenden Bereiche).
- Stellen Sie sicher, dass für jede Runde der Eingabebilder eine .xml Datei erstellt wurde.
HINWEIS: Diese enthalten die Übersetzungsparameter, die für die Dateien aus dieser Runde benötigt werden. - Erstellen Sie einen Ordner mit allen zu registrierenden Bildern (jeder Kanal jeder Runde). Beachten Sie die Reihenfolge der Dateien.
- Erstellen Sie einen Ordner für die Transformationsparameter und erstellen Sie eine Kopie der .xml Datei für jede Runde pro zu registrierenden Kanal. Überprüfen Sie, ob die Dateireihenfolge (nach Name) zwischen den zu registrierenden Bildern und den Kopien der Transformationsparameter identisch ist, da im nächsten Schritt jedes Bild in der Reihenfolge der Transformationsparameterdateien durchlaufen und transformiert wird.
- Klicken Sie auf Plugins | Transformieren | Transformieren Sie virtuelle Stack-Slices.
- Wählen Sie unter Quellverzeichnis den Ordner aus, der die zu registrierenden Bilder enthält.
- Wählen Sie unter Ausgabeverzeichnis den Ordner aus, der für die Registrierungsausgabe erstellt wurde.
- Wählen Sie unter Transformationsverzeichnis den Ordner aus, der die .xml Dateien mit einer Kopie pro zu transformierender Bilddatei enthält. Stellen Sie auch hier sicher, dass die Reihenfolge mit den Dateien übereinstimmt (d. h. eine Kopie der Runde 1 .xml für jeden Kanal der Runde 1, eine Kopie der Runde 2 .xml für jeden Kanal der Runde 2 usw.).
- Klicken Sie auf OK.
HINWEIS: Wenn Sie fertig sind, werden die registrierten Bilder aus dieser Runde als Stapel (und im Ausgabeordner) angezeigt. - Verwenden Sie den Schieberegler an der Unterseite, um zwischen den Kanälen hin und her zu wechseln. Stellen Sie sicher, dass alle Kanäle auf die gleiche Weise transformiert wurden. Wenn nicht, liegt dies wahrscheinlich an einer falschen .xml Datei im Verzeichnis transforms. Reparieren Sie in diesem Fall die Datei und wiederholen Sie den Vorgang.
HINWEIS: Der angezeigte Helligkeitsbereich basiert auf einem Kanal, dies wirkt sich jedoch nicht auf die tatsächlich gespeicherten Bilder aus, sondern nur auf die Anzeige. - Beachten Sie, dass die registrierten Bilder alle erfolgreich über Runden hinweg ausgerichtet und für Überlagerungen/nachgelagerte Analysen bereit sind.
HINWEIS: Es gibt effizientere programmgesteuerte Möglichkeiten, um die Registrierung für große Batches durchzuführen. Die hier vorgestellte Methode ist einfach und erfordert keine Programmierung.
Ergebnisse
Zur Validierung der zerebralen Organoididentität wurden histologische Schnitte eines reifen (2 Monate alten) zerebralen Organoids auf PAX6 (ein Marker für dorsale NPCs23) und SATB2 (ein Marker für reife, postmitotische Neuronen der oberen Schicht24) gefärbt. Wie erwartet waren PAX6+ -Zellen im Inneren des Organoids und SATB2+ -Zellen in den oberen Schichten vorhanden (Abbildung 2). Diese Ergebnisse unterstützen die Tatsache, dass es sich bei den verwendeten zerebralen Organoiden tatsächlich um das dorsale Vorderhirn handelte, wie im Differenzierungskit angegeben. Um die Dosisabhängigkeit des zerebralen Organoid-Transplantationssystems zu ermitteln, wurden 2 Monate alte zerebrale Organoide mit einer zunehmenden Anzahl von EGFP+ iPSC-abgeleiteten NPCs injiziert. Es war eine klare Dosisabhängigkeit der GFP-Fluoreszenz von der Anzahl der Eingangszellen vorhanden, mit konsistenter EGFP+ -Zellpatch-Detektion bei 10.000 Zellen und mehr (Abbildung 3). Die Persistenz und Migration der transplantierten NPCs wurde als nächstes bewertet, indem die transplantierten Organoide im Laufe der Zeit verfolgt wurden. Dazu wurden 50.000 iPSC-abgeleitete EGFP+ -NPCs in 2-3 Monate alte zerebrale Organoide transplantiert, die aus derselben iPSC-Linie erzeugt wurden. Die injizierten Organoide und Kontrollen wurden zu bestimmten Zeitpunkten in den nächsten 3-4 Monaten auf EGFP-Positivität untersucht. In dieser Transplantationsserie beobachteten wir die Persistenz der injizierten Stelle während des gesamten 4-monatigen Tracking-Zeitraums (Abbildung 4A). Zusätzliche EGFP+ -Zellpflaster erschienen 9 Tage nach der Transplantation und blieben bis zum Endpunkt der Studie (3-4 Monate je nach Organoid) bestehen, was auf die Migration der Zellen und die Integration an ihren neuen Stellen hinweist (Abbildung 4A). Bei einer höheren Vergrößerung war eine klare neuronale Morphologie mit langen Projektionen in das Organoid zu beobachten (Abbildung 4B), was die Integration der injizierten Zellen bestätigte.
Um den Differenzierungsstatus der injizierten Zellen spät nach der Injektion zu bestimmen, wurden das 4 Monate lang verfolgte Organoid und seine Kontrolle fixiert, paraffineingebettet, in 15 μm dicke Scheiben geschnitten und auf Objektträger montiert. Die Schichten wurden dann entweder in einer einzigen Runde der Fluoreszenzfärbung (EGFP, TUJ1, NESTIN) oder für zwei aufeinanderfolgende Färbezyklen verarbeitet und gefärbt, um zusätzliche Marker hinzuzufügen (MAP2, GFAP). Die anfängliche Einrundenfärbung bestätigte das Vorhandensein von EGFP+-Zellen an der Injektionsstelle, einschließlich einer Mischung aus Zellen mit NPC-Status (NESTIN+TUJ1−) und solchen, die sich in Richtung eines neuronalen Schicksals (NESTIN−TUJ1+) differenziert hatten (Abbildung 5). Sowohl für die Kontroll- als auch für die injizierten Organoide wurden nur sehr wenige NESTIN+-NPCs beobachtet (die meisten, wenn auch nicht alle waren EGFP+-transplantierte NPCs an der Injektionsstelle), wobei die Mehrheit der unreif-reifen TUJ1+-Neuronen bestand (Abbildung 5). Die Zwei-Runden-Färbung ergab mehr Details und enthüllte reife Neuronen (NESTIN−TUJ1+MAP2+GFAP−) um den größten Teil der äußeren Region des Organoids, mit Bereichen unreifer (NESTIN−TUJ1+MAP2−GFAP−) Neuronen in der Mitte (Abbildung 6A,B). Astrozyten (NESTIN−TUJ1−MAP2−GFAP+) waren sowohl in den injizierten als auch in den Kontrollorganoiden vorhanden und waren an den äußeren Rändern eingestreut (Abbildung 6A,B). Der Schnitt, für den die Zwei-Runden-Färbung im injizierten Organoid durchgeführt wurde, zeigte eine kleine Satellitenkolonie von EGFP+-Zellen weit von der Injektionsstelle entfernt, die den Phänotyp reifer Neuronen angenommen hatte (Abbildung 6B, C). Einige von ihnen schienen sich in unmittelbarer Nähe von Astrozyten zu befinden; es gab jedoch keine EGFP+-Zellen mit vollständiger Überlappung zur GFAP-Färbung, was darauf hindeutet, dass sie benachbart waren, anstatt die Astrozyten selbst zu erzeugen (Abbildung 6B, C).
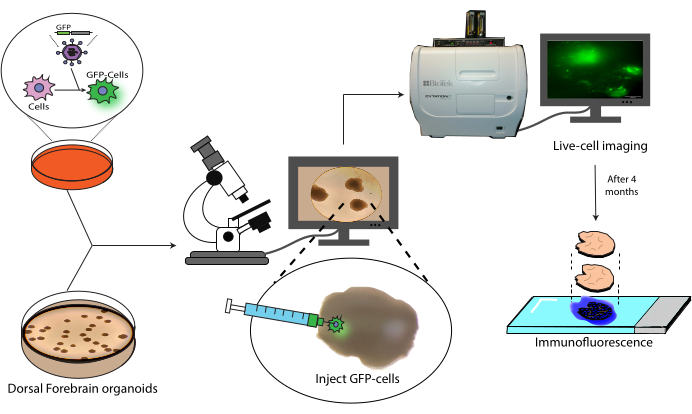
Abbildung 1: Transplantationsmodell von markierten Zellen in zerebrale Organoide. Schematische Übersicht über die Erzeugung markierter Zellen durch lentivirale Transduktion, ihre Transplantation in zerebrale Organoide und die Verfolgung durch Lebendzellbildgebung und Immunfluoreszenz. Abkürzung: GFP = grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
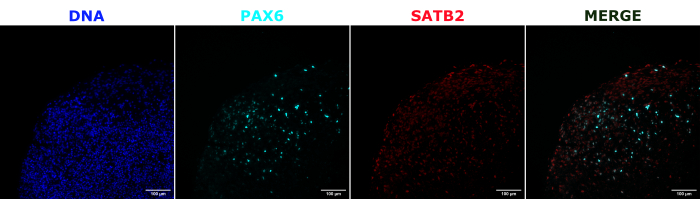
Abbildung 2: Immunfluoreszenz histologischer Schnitte, die die Architektur früher und später Organoide zeigen. Ein 2 Monate altes zerebrales Organoid wurde fixiert, paraffineingebettet, geschnitten und mit PAX6, SATB2 und DAPI gefärbt. Ein ungefärbter Schnitt wurde verwendet, um die Belichtungs- und Integrationszeit einzustellen, um ein falsch-positives Signal durch Autofluoreszenz zu vermeiden. PAX6+-Zellen waren im Inneren des Organoids vorhanden, während SATB2+-Zellen in den oberen Schichten vorhanden waren. Z-Stapel-Bilder wurden alle 4,2 μm über den gesamten 15-μm-Gewebeschnitt aufgenommen. Optische Abschnitte wurden mit der Focus-Stacking-Option in der Gen5-Software mit Standardoptionen kombiniert. Maßstabsleisten = 100 μm. Abkürzungen: PAX6 = gepaartes Box-6-Protein; SATB2 = spezielles AT-reiches sequenzbindendes Protein 2; DAPI = 4',6-Diamidino-2-phenylindol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
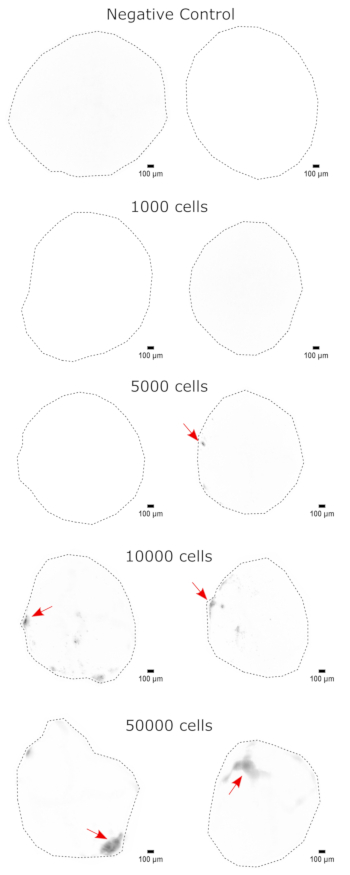
Abbildung 3: Dosisabhängige Transplantation von NPCs in zerebrale Organoide. Die Organoide wurden mit 0 (Negativkontrolle), 1.000, 5.000, 10.000 oder 50.000 GFP+ iPSC-abgeleiteten NPCs transplantiert. 1 Woche nach der Transplantation wurden die Organoide auf einer Cytation 5 mit einem GFP-Filterwürfel abgebildet. Die Negativkontrolle wurde verwendet, um die Belichtungs- und Integrationszeit einzustellen, um die Autofluoreszenz zu minimieren. Dunklere Farben weisen auf eine höhere EGFP-Fluoreszenz im Vergleich zur Negativkontrolle hin. Maßstabsleisten = 100 μm. Dies sind 4x-Bilder der gesamten Organoide. Nach der Bildgebung wurde vor der Anzeige eine Rolling-Ball-Hintergrundsubtraktion mit einem Pixelradius von 50 durchgeführt, um die variable Hintergrundintensität über die Organoide hinweg zu korrigieren. Injektionsstellen, die als Regionen mit der höchsten Transplantation identifiziert wurden, sind mit einem roten Pfeil gekennzeichnet, wo eine Transplantation vorhanden war. Abkürzungen: NPCs = neuronale Vorläuferzellen; GFP = grün fluoreszierendes Protein; EGFP = erweitertes GFP; iPSC = induzierte pluripotente Stammzelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
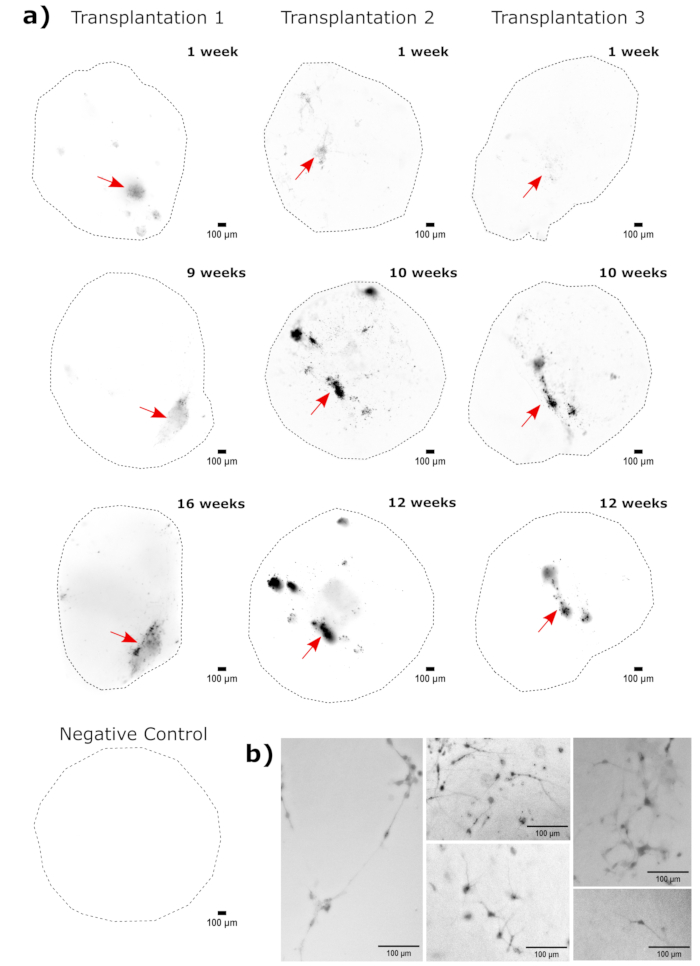
Abbildung 4: Verfolgung des Wachstums, der Migration und der Persistenz transplantierter Zellen mit Fluoreszenz-Lebendzell-Bildgebung. (A) Kontroll- und transplantierte (50.000 GFP+ iPSC-abgeleitete NPCs) Organoide wurden über einen Zeitraum von 2-4 Monaten von zwei unabhängigen Transplantationssets mit Fluoreszenz-Lebendzell-Bildgebung verfolgt. Negativkontrollorganoide wurden verwendet, um die Belichtungs- und Integrationszeit einzustellen, um die Autofluoreszenz zu jedem Zeitpunkt zu minimieren. EGFP-Bilder wurden mit einem GFP-Filterwürfel auf der Cytation 5 zu angegebenen Zeitpunkten nach der Transplantation aufgenommen. Dunklere Farben zeigen eine höhere EGFP-Fluoreszenz im Vergleich zur Negativkontrolle für diesen Zeitpunkt an. Vor der Anzeige wurde eine Rolling-Ball-Hintergrundsubtraktion mit einem Pixelradius von 50 durchgeführt, um die variable Hintergrundintensität über die Organoide hinweg zu korrigieren. Die Organoide wurden zu jedem Zeitpunkt in ungefähr der gleichen Ausrichtung platziert, und die Bilder wurden gedreht, um die Konsistenz der Anzeige zu gewährleisten und das transplantierte Zellwachstum deutlich zu zeigen. Die Injektionsstellen, die zum frühesten Zeitpunkt als Regionen mit der höchsten Transplantation identifiziert wurden, sind mit einem roten Pfeil gekennzeichnet. Ein Beispiel für ein Organoid mit negativer Kontrolle ist unten in der Abbildung dargestellt. (B) Beispiel: 20x-Bilder von transplantierten Organoiden in Woche 1 und Woche 15 nach der Transplantation. Der lokale Kontrast wurde vor der Anzeige mit FIJI verbessert, um die Sichtbarkeit der Neuriten zu gewährleisten. Maßstabsleisten = 100 μm. Abkürzungen: NPCs = neuronale Vorläuferzellen; GFP = grün fluoreszierendes Protein; EGFP = erweitertes GFP; iPSC = induzierte pluripotente Stammzelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
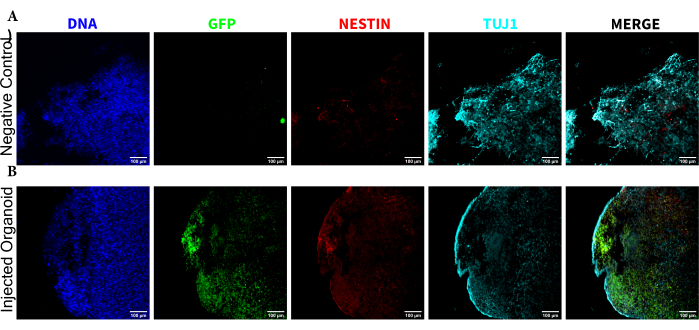
Abbildung 5: Immunfluoreszenz der histologischen Schnitte, die die Persistenz der transplantierten NPCs an der Injektionsstelle zusammen mit Migration und neuronaler Differenzierung zeigt. Einkanal-Fluoreszenzbilder von (A) nicht injizierten und (B) transplantierten Organoiden. Das überlagerte Bild rechts zeigt die drei interessierenden Kanäle (NESTIN, TUJ1 und EGFP), enthält jedoch nicht DAPI. Die Anzeigeminimums wurden so eingestellt, dass nur das Signal von den negativen Zellen ausgeschlossen wird (bestimmt für EGFP aus der nicht injizierten Steuerung und für andere Kanäle basierend auf bekannten Markerkombinationen). Die Anzeigemaxima basierten auf dem höchsten Signal, das für diesen Antikörper in einer Zelle beobachtet wurde. Die Anzeigebereiche wurden zwischen den nicht injizierten und transplantierten Organoiden konstant gehalten, um einen direkten Vergleich zu ermöglichen. Maßstabsleisten = 100 μm. Abkürzungen: NPCs = neuronale Vorläuferzellen; DAPI = 4',6-Diamidino-2-phenylindol; TUJ1 = Beta-III-Tubulin; EGFP = verstärktes grün fluoreszierendes Protein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
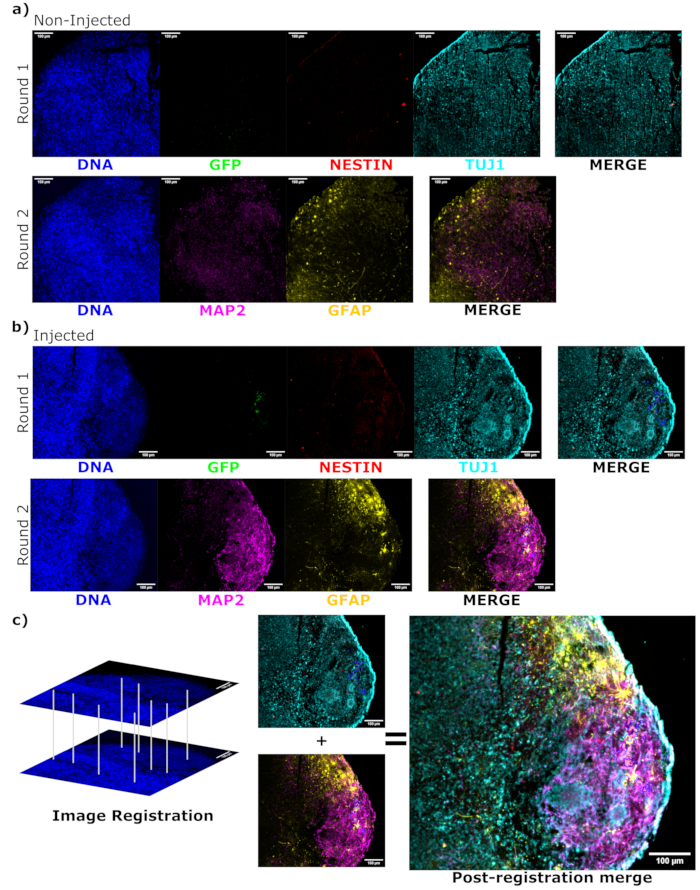
Abbildung 6: Beurteilung des Differenzierungszustands und der Lokalisation der transplantierten Zellen mittels zyklischer Immunfluoreszenz der histologischen Schnitte. Einkanal-Fluoreszenzbilder von den nicht injizierten, (A) altersangepassten und (B) transplantierten Organoiden werden für die erste und zweite Färberunde wie angegeben gezeigt. Die Anzeigeminimums wurden so eingestellt, dass nur das Signal von den negativen Zellen ausgeschlossen wird (bestimmt für EGFP aus der nicht injizierten Steuerung und für andere Kanäle basierend auf bekannten Markerkombinationen). Die Anzeigemaxima basierten auf dem höchsten Signal, das für diesen Antikörper in einer Zelle beobachtet wurde. Die Anzeigebereiche (und natürlich die Bildgebungsparameter) wurden zwischen dem Kontroll- und dem injizierten Organoid konstant gehalten, um einen direkten Vergleich zu ermöglichen. Maßstabsleisten = 100 μm. Ein überlagertes Bild (ohne DAPI) wird für jede Färberunde für jedes Organoid auf der rechten Seite angezeigt. (B) Für das injizierte Organoid, bei dem die Bildregistrierung durchgeführt wurde, werden alle Bilder auf den in beiden Färberunden beobachteten Bereich zugeschnitten. (B,C) Für das injizierte Organoid sind die EGFP+-Zellregionen blau umrandet. Ein Diagramm zur Verwendung von DAPI zum Abgleich der Features während der Bildregistrierung ist in (C) dargestellt, gefolgt von einer Gesamtzusammenführung des registrierten Bildes. Abkürzungen: DAPI = 4',6-Diamidino-2-phenylindole; TUJ1 = Beta-III-Tubulin; EGFP = verstärktes grün fluoreszierendes Protein; MAP2 = Mikrotubuli-assoziiertes Protein 2; GFAP = saures Gliafibrillenprotein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Klonen | Fluorophor | Konzentration | |
| Anti-NESTIN | 10C2 | AlexaFluor 594 | 1 zu 2.000 |
| Anti-TUBB3 | TUJ1 | AlexaFluor 647 | 1 zu 2.000 |
| Anti-GFP | FM264G | AlexaFluor 488 | 1 zu 200 |
| Anti-GFAP | SMI 25 | AlexaFluor 594 | 1 zu 500 |
| Anti-MAP2 | SMI 52 | AlexaFluor 488 | 1 zu 1.000 |
| Anti-PAX6 | Nr. O18-1330 | AlexaFluor 647 | 1 zu 100 |
| Anti-SATB2 | EPNCIR130A | AlexaFluor 594 | 1 zu 500 |
Tabelle 1: Antikörperkonzentrationen für die Färbung. Abkürzungen: TUBB3 = Beta-Tubulin III; GFP = grün fluoreszierendes Protein; GFAP = saures Gliafaserprotein; MAP2 = Mikrotubuli-assoziiertes Protein 2; PAX6 = gepaartes Box-6-Protein; SATB2 = spezielles AT-reiches sequenzbindendes Protein 2.
Diskussion
Angesichts des großen Interesses an zelltherapeutischen Ansätzen zur Behandlung von ZNS-Verletzungen/neurodegenerativen Erkrankungen 1,2,3,4,5,6,7,8 gewinnen Modelle der Zellfunktion in einem Transplantationssetting an Bedeutung. In dieser Arbeit wird eine Methode zur Transplantation von markierten, menschlichen NPCs in menschliche zerebrale Organoide vorgestellt, zusammen mit ihrer Lebendzellverfolgung und Endpunktbewertung durch Histologie und Immunfluoreszenzfärbung. Wichtig ist, dass wir zeigten, dass die transplantierten Zellen in der Lage waren, zu migrieren, zu differenzieren und langfristig (4 Monate) in der Organoid-Umgebung zu persistieren. Eine solche langfristige Persistenz ist ein deutlicher Anstieg gegenüber der Wartbarkeit von Hirnschnittkulturen17. Dieses System ist daher geeignet, um viele der Verhaltensweisen zu untersuchen, die man in einem potenziellen therapeutischen Umfeld beurteilen müsste, wie z. B. Überleben, Proliferation und Differenzierung. Tatsächlich hat eine orthogonale Studie kürzlich gezeigt, dass sich transplantierte NPCs in zerebralen Organoiden ähnlich verhalten wie NPCs, die in NSG-Mausgehirne transplantiert wurden20, was den Nutzen von Organoiden als Transplantatempfänger bestätigt. Da es sich um ein In-vitro-System handelt, ist es auch einfach, Zytokine oder Medikamente von Interesse hinzuzufügen. Dies könnte verwendet werden, um die Auswirkungen bestimmter Umgebungen wie Entzündungen und Immunsuppressiva auf die transplantierten Zellen besser zu verstehen, um weiter nachzuahmen, was ihnen in einem therapeutischen Umfeld begegnen könnte. Das zyklische Immunfluoreszenzprotokoll, das wir demonstriert haben (basierend auf früheren Forschungen21), erweitert die Leistungsfähigkeit dieses Ansatzes weiter, indem es die gleichzeitige Bewertung einer breiten Palette von linien- und potenziell krankheitsspezifischen Markern in einem einzigen Abschnitt ermöglicht und somit eine genaue Verfolgung der transplantierten Zellen und ihrer Auswirkungen auf das Gewebe ermöglicht. Natürlich können stattdessen andere Endpunktbewertungsmethoden verwendet werden, abhängig von den Zielen der Analyse. Zum Beispiel könnte die Gewebereinigung mit 3D-Rekonstruktion verwendet werden, wenn die Zellmorphologie von primärem Interesse ist, oder die Dissoziation gefolgt von Durchflusszytometrie, wenn die Quantifizierung bestimmter Zelltypen das Endziel ist. Wir erwarten, dass diese Methode leicht auf andere Zelltypen wie ZNS-Tumoren erweiterbar ist und möglicherweise deren Untersuchung in einem mikroumweltrelevanten Kontext ermöglicht. In ähnlicher Weise könnten die als Empfänger verwendeten Organoide gegen Krankheitsmodell-Organoide ausgetauscht werden 25,26,27, was möglicherweise die Modellierung von Transplantationsansätzen für diese Erkrankungen ermöglicht.
Wie bei allen Modellen hat auch das hier vorgestellte seine eigenen Einschränkungen. Zum einen sind iPSC-abgeleitete Organoide entwicklungsunreif19 und weisen daher wichtige Unterschiede zum alternden Gehirn auf, in dem sich viele neurodegenerative Erkrankungen manifestieren. Zerebrale Organoide sind auch in der Entwicklung uneinheitlich19, was eine konsistente Injektion in genau dieselbe physiologische Nische ausschließt. Darüber hinaus enthalten sie zwar die Zelltypen der relevanten Hirnregionen18,19, ihnen fehlen jedoch die Endothel-, Mikroglia- und Immunkomponenten, die auch im In-vivo-Setting wichtig sind14. Dies schränkt die Untersuchung ein, wie der Wirt auf die Zelltransplantation reagieren wird. Derzeit werden Techniken zur Hinzufügung von vaskulären28- undMikroglia-29-Zellen sowie zur Erhöhung der Organoidkonsistenz und Regionalisierung18 in Betrieb genommen, wodurch die Modellierungsleistung des Organoid-Transplantationssystems verbessert wird. Sie würden jedoch weitere Tests und Optimierungen erfordern, die über das hier Dargestellte hinausgehen. Obwohl dieses Protokoll kostengünstig ist und keine spezielle Ausrüstung erfordert, gibt es eine Reihe wichtiger technischer Überlegungen, z. B. die Injektionstiefe. Dies liegt sowohl daran, dass Organoide nicht durchblutet sind und daher oft ein nekrotisches Zentrum haben, wenn sie zu groß werden19 und dass Licht nicht durch den Organoidkern für die Verfolgung lebender Zellen eindringen kann. So können die Zellen, die zu tief injiziert wurden, und Kolonien, die ins Innere gewandert sind, übersehen werden. Dies kann zwar durch die Verwendung von Fluorophoren mit längerer Wellenlänge und besserer Gewebepenetranz30 verbessert werden, aber je nach Organoidgröße und Nachweisgerät wird dies wahrscheinlich eine Überlegung bleiben. Da sich Gehirnorganoide in einem Entwicklungsstadium befinden, ist der Transplantationszeitpunkt eine weitere wichtige Überlegung, da die Umgebung wahrscheinlich je nach Entwicklungsstadium des Organoids, in das es injiziert wird, unterschiedlich ist. Dies kann zwar bis zu einem gewissen Grad kontrolliert werden, indem ein konsistentes Organoid-Alter zum Zeitpunkt der Injektion sichergestellt wird, ist aber zweifellos ein Faktor, der berücksichtigt werden muss.
Dieses Protokoll ist kostengünstig, einfach, tierversuchsfrei und erfordert keine spezielle Ausrüstung, wodurch die Transplantationsmodellierung für eine größere Anzahl von Labors zugänglich wird. Angesichts des rasanten Fortschritts sowohl bei neuralen Zelltherapeutika als auch bei Organoid-Modellsystemen gehen wir davon aus, dass das hier vorgestellte Organoid-Transplantationsprotokoll ein nützliches Modell für eine Reihe von Krankheiten und therapeutischen Ansätzen sein wird.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Mittel für diese Arbeit wurden durch die philanthropischen IRIC-Fonds der Stiftung Marcelle und Jean Coutu und des Fonds de recherche du Québec - Santé (FRQS #295647) bereitgestellt. D.J.H.F.K. erhält Gehaltsunterstützung von FRQS in Form eines Chercheurs-boursiers Junior 1-Stipendiums (#283502). M.I.I.R. wurde durch einen IRIC-Doktorandenpreis des Instituts für Immunologie und Krebsforschung, eine Bourse de passage accélère de la maîtrise au doctorat der Universität Montreal und eine Bourse de Mérite aux cycles supérieurs unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Accutase | StemCell Technologies | 7920 | proteolytic-collagenolytic enzyme mix |
| Alexa Fluor 488 anti-GFP Antibody | BioLegend | 338008 | |
| Alexa Fluor 488 anti-MAP2 (clone SMI 52) | BioLegend | 801804 | |
| Alexa Fluor 594 anti-GFAP Antibody (clone SMI 25) | BioLegend | 837510 | |
| Alexa Fluor 594 anti-Nestin (clone 10C2) | BioLegend | 656804 | |
| Alexa Fluor 647 anti-Tubulin β 3 (TUBB3) (clone TUJ1) | BioLegend | 801209 | |
| Citric Acid Monohydrate | Fisher Chemical | A104-500 | |
| Cytation 5 Cell Imaging Multimode Reader | Biotek | - | |
| Denaturated Ethyl Alcohol (Anhydrous) | ChapTec | - | |
| DMEM F12/Glutamax | Thermo | 10565018 | |
| Dymethil Sulfoxide (DMSO), Sterile | BioShop | DMS666.100 | |
| FIJI 1.53c | - | - | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501128-4L | |
| Gen5 | - | - | |
| HistoCore Arcadia H | Leica Biosystems | - | |
| Matrigel Growth Factor Reduced (GFR) | Corning | 356231 | Phenol Red-free, LDEV-free |
| MX35 microtome blade | Epredia | 3053835 | |
| NaOH | Sigma | 655104 | |
| PBS (-Ca -Mg) | Sigma | D8537 | |
| Puromycin Dihydrochloride | Thermo | A1113803 | |
| ROCK inhibitor Y-27632 | Abcam | ab120129 | |
| Simport Scientific Stainless-Steel Base Molds | Fisher Scientific | 22-038-209 | |
| Simport Scientific UNISETTE Biopsy Processing/Embedding Cassette | Fisher Scientific | 36-101-9255 | |
| STEMdiff Forebrain Neuron Differentiation Kit | StemCell Technologies | 8600 | |
| STEMdiff Neural Progenitor Medium | StemCell Technologies | 5833 | |
| STEMdiff SMADi Neural Induction Kit | StemCell Technologies | 8581 | |
| Thermo Scientific Shandon Finesse ME Microtome | Thermo Scientific | - | |
| Tissue Prep | Fisher Scientific | T555 | |
| Tissue-Tek VIP 6 AI Tissue Processor | Sakura Finetek | - | |
| Toluene (histological) | ChapTec | - | |
| Trypan blue; 0.4% (wt/vol) | Thermo | 15250061 | |
| Tween 20 | BioShop | TWN510.100 |
Referenzen
- Spurlock, M. S., et al. Amelioration of penetrating ballistic-like brain injury induced cognitive deficits after neuronal differentiation of transplanted human neural stem cells. Journal of Neurotrauma. 34 (11), 1981 (2017).
- Zhou, Y., Shao, A., Xu, W., Wu, H., Deng, Y. Advance of stem cell treatment for traumatic brain injury. Frontiers in Cellular Neuroscience. 13, 301 (2019).
- Hayashi, Y., Lin, H. -. T., Lee, C. -. C., Tsai, K. -. J. Effects of neural stem cell transplantation in Alzheimer's disease models. Journal of Biomedical Science. 27 (1), 29 (2020).
- Kefalopoulou, Z., et al. Long-term clinical outcome of fetal cell transplantation for Parkinson disease: Two case reports. JAMA Neurology. 71 (1), 83-87 (2014).
- Li, W., et al. Extensive graft-derived dopaminergic innervation is maintained 24 years after transplantation in the degenerating parkinsonian brain. Proceedings of the National Academy of Sciences of the United States of America. 113 (23), 6544-6549 (2016).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Takahashi, J. iPS cell-based therapy for Parkinson's disease: A Kyoto trial. Regenerative Therapy. 13, 18-22 (2020).
- Krause, M., Phan, T. G., Ma, H., Sobey, C. G., Lim, R. Cell-based therapies for stroke: Are we there yet. Frontiers in Neurology. 10, 656 (2019).
- Coles-Takabe, B. L. K., et al. Don't look: Growing clonal versus nonclonal neural stem cell colonies. Stem Cells. 26 (11), 2938-2944 (2008).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Jakel, R. J., Schneider, B. L., Svendsen, C. N. Using human neural stem cells to model neurological disease. Nature Reviews Genetics. 5 (2), 136-144 (2004).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Li, J., et al. Conservation and divergence of vulnerability and responses to stressors between human and mouse astrocytes. Nature Communications. 12 (1), 3958 (2021).
- Morizane, A., et al. MHC matching improves engraftment of iPSC-derived neurons in non-human primates. Nature Communications. 8 (1), 385 (2017).
- Khrameeva, E., et al. Single-cell-resolution transcriptome map of human, chimpanzee, bonobo, and macaque brains. Genome Research. 30 (5), 776-789 (2020).
- Powell, K. Hybrid brains: The ethics of transplanting human neurons into animals. Nature. 608 (7921), 22-25 (2022).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- García-Delgado, A. B., et al. Brain organoids to evaluate cellular therapies. Animals. 12 (22), (2022).
- Lin, J. -. R., Fallahi-Sichani, M., Sorger, P. K. Highly multiplexed imaging of single cells using a high-throughput cyclic immunofluorescence method. Nature Communications. 6 (1), 8390 (2015).
- Knapp, D. J. H. F., et al. Single-cell analysis identifies a CD33+ subset of human cord blood cells with high regenerative potential. Nature Cell Biology. 20 (6), 710-720 (2018).
- Georgala, P. A., Carr, C. B., Price, D. J. The role of Pax6 in forebrain development. Developmental Neurobiology. 71 (8), 690-709 (2011).
- Britanova, O., et al. Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex. Neuron. 57 (3), 378-392 (2008).
- Kim, H., et al. Modeling G2019S-LRRK2 sporadic Parkinson's disease in 3D midbrain organoids. Stem Cell Reports. 12 (3), 518-531 (2019).
- Smits, L. M., et al. Modeling Parkinson's disease in midbrain-like organoids. NPJ Parkinson's Disease. 5, 5 (2019).
- Jin, M., et al. Type-I-interferon signaling drives microglial dysfunction and senescence in human iPSC models of Down syndrome and Alzheimer's disease. Cell Stem Cell. 29 (7), 1135.e8-1153.e8 (2022).
- Sun, X. -. Y., et al. Generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, e76707 (2022).
- Popova, G., et al. Human microglia states are conserved across experimental models and regulate neural stem cell responses in chimeric organoids. Cell Stem Cell. 28 (12), 2153.e6-2166.e6 (2021).
- Wang, S., Li, B., Zhang, F. Molecular fluorophores for deep-tissue bioimaging. ACS Central Science. 6 (8), 1302-1316 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten