Method Article
神经细胞移植的人脑类器官模型
摘要
在这里,我们描述了一种将标记的神经细胞移植和跟踪到人类大脑类器官中的方案。
摘要
细胞移植方法的进步需要能够准确评估移植细胞功能效力的模型系统。对于中枢神经系统,尽管异种移植仍然是最先进的,但这种模型在技术上具有挑战性,吞吐量有限且价格昂贵。此外,存在的环境信号不能与人体细胞完全交叉反应。本文提出了一种廉价、可访问且高通量兼容的模型,用于将人类神经细胞移植和跟踪到人类大脑类器官中。这些类器官可以很容易地使用商业试剂盒从人类诱导的多能干细胞中产生,并包含大脑的关键细胞类型。
我们首先通过将 EGFP 标记的人 iPSC 衍生的神经祖细胞 (NPC) 注射到这些类器官中来证明这种移植方案。接下来,我们将讨论通过活细胞荧光显微镜跟踪类器官中这些细胞生长的考虑因素,并演示在4个月内跟踪类器官中移植的EGFP标记的NPC。最后,我们提出了一种切片、循环免疫荧光染色和移植细胞在当地成像的方案。这里介绍的类器官移植模型允许直接在人类微环境中以廉价且易于执行的方案对移植的人类细胞进行长期(至少 4 个月)跟踪。因此,它代表了一种有用的模型,既可用于神经细胞疗法(移植),也可用于以更精确的微环境方式模拟中枢神经系统(CNS)肿瘤。
引言
人脑是一个复杂的器官,由神经和神经胶质谱系的多种细胞类型组成。这些共同构成了一个复杂的网络,产生了认知。将细胞移植到该系统中作为治疗多种神经系统疾病的药物引起了人们的极大兴趣,包括创伤性脑损伤 (TBI)1,2、神经退行性疾病3、4、5、6、7 和中风8.然而,推进此类策略的一个主要限制是相对缺乏可用的临床前模型来确定预期的移植结果。目前最常用的模型是体外培养方法,用于确定细胞潜力和异种移植到小鼠体内。虽然细胞培养方法可以评估分化和自我更新潜力9,但这些方法是在最佳生长条件下进行的,这些条件不模拟细胞在移植环境中遇到的微环境。此外,细胞的生长方式会影响它们的行为10.
小鼠大脑包含微环境的所有细胞,因此是极其强大的移植模型系统11。然而,小鼠和人类皮层之间存在重要差异12,13,并且并非所有生长因子在物种之间发生交叉反应。灵长类动物模型是一种更接近的替代方案,可以更好地模仿人体系统,并且还产生了重要的临床前结果14。然而,即使是这些关系更密切的亲戚,它们的细胞组成也保留了重要的差异15。虽然这两种模型系统都为移植过程中的细胞行为提供了有价值的见解,并结合了最终治疗的手术元素,但它们仍然不完美。它们成本高昂且技术上具有挑战性(即,必须对动物进行脑部手术),从而限制了可能的吞吐量。此外,将人类脑细胞移植到动物体内还有很多伦理问题16.脑切片培养允许切割一个大脑并用于多种治疗,从而消除了动物移植的一些局限性;然而,它们的寿命有限(数周),仍然是动物来源的,并且(作为薄片)没有足够的体积/表面完整性来模拟细胞的注射17。因此,严格的细胞培养/电位模型与体内移植之间仍然存在重要差距。
大脑类器官是一种体外模型,包含大脑中存在的主要神经细胞类型,可以从人类诱导的多能干细胞 (iPSC) 中大量产生18,19。因此,这种类器官提供了细胞背景,可以评估移植环境中感兴趣的测试细胞的功能能力。事实上,最近的一项研究表明,移植到人类大脑类器官中的神经祖细胞 (NPC) 的存活、增殖和分化与移植到肥胖糖尿病患者大脑中的NPC 相似 20。因此,大脑类器官代表了一种零残忍、长寿命(>6个月)、具有成本效益的系统,可以捕获人脑的细胞类型。因此,它们可以代表神经细胞再生能力早期测试的理想移植受体。
本文介绍了一种将标记的人类鼻咽癌移植和随后跟踪到人类大脑类器官中的方案(图1)。这首先将GFP标记的NPC注射到成熟(2-4个月大)的大脑类器官中18。然后对移植的细胞进行为期4个月的活细胞荧光显微镜检查。在这段时间里,我们既显示了细胞在注射部位的持久性,也显示了向类器官远端区域的迁移。在终点,我们展示了来自这些类器官的组织学切片的抗原检索、染色和成像,包括基于先前工作21 的现有基于 AlexaFluor 的染料的淬灭方案,以允许额外的染色和成像轮次。因此,该方案可用于测量移植环境中细胞的分化能力,移植物耐久性,原 位细胞扩增以及从移植部位迁移的细胞。我们预计,这将对再生医学/细胞治疗应用以及通过将肿瘤细胞移植到相关区域特异性类器官中的肿瘤建模有用。
研究方案
注意:有关本协议中使用的所有材料、试剂和设备的详细信息 ,请参阅材料表 。
1. 慢病毒转导细胞荧光团标记
- 在冰上解冻所选溶溶基底膜基质的等分试样。
- 当等分试样解冻时,加入无菌水以填充 24 孔板中孔之间的间隙以及所有外孔。
注意:这在中间留下了八个孔供使用,并确保细胞保持在高湿度下,从而最大限度地减少蒸发引起的变异性。 - 在冰冷的 DMEM/F12 培养基中以 1:100 稀释溶解的基底膜基质(使用此处使用的批次获得终浓度为 0.089 mg/mL)。
- 将 300 μL 稀释的溶解基底膜基质加入制备的 24 孔板的中间(开放)孔之一,每次感染进行。确保均匀地覆盖整个井底,并在需要时添加更多,以确保均匀的涂层。
- 将板在37°C下孵育30分钟,以使一层沿井底凝固。在孵育结束时验证液体是否仍完全覆盖井底并且未在中心蒸发。蒸发是湿度过低的标志;如果发生这种情况,请重复涂层。
注意:板可以在前一天晚上涂覆并留在稀释的溶解基底膜基质中,而不会产生明显的不良影响;但是,蒸发的风险大大增加,因此在使用前必须仔细检查。 - 从孔板中生长的汇合iPSC衍生NPC的一个孔中除去培养基。
注意:对于本文,使用了在第 3 代和第 10 代之间按照制造商的说明使用商业试剂盒生产的 iPSC 衍生的神经祖细胞。 - 在孔的侧面轻轻加入 1 mL PBS,然后摇晃板以确保均匀洗涤。
- 去除PBS,并用300μL蛋白水解 - 胶原溶解酶混合物代替,再次摇动板以确保完全覆盖孔底。在37°C孵育5分钟。 通过光学显微镜验证细胞是否从板表面分离。
- 用 P1,000 移液管加入 700 μL DMEM/F12,然后通过将该混合物喷洒在板底部的所有表面上来分离细胞。上下移液,以确保细胞聚集体分解成均匀的单细胞悬浮液。取入细胞,加入锥形 15 mL 管中的 9 mL DMEM/F12 培养基中。
- 以300× g 离心5分钟。
- 在此期间,制备足够的补充有 10 μM Y-27632 的培养基,每孔 500 μL 进行铺板,加上 1 mL 重悬。
注意:Y-27632 对于确保 NPC 作为单细胞传代后的高存活率是必要的。 - 除去上清液,将细胞重悬于 1 mL 补充 Y-27632 的培养基中,轻轻上下移液数次以分解细胞聚集体。
- 取出几微升细胞,用台盼蓝稀释(1:5至1:10)。
- 在血细胞计数器上计数活细胞(台盼蓝阴性)。调整台盼蓝稀释度,使血细胞计数器的每个象限至少获得 50 个活细胞,以确保计数准确。计算每个孔中存在 100,000 个细胞所需的细胞悬液体积。
- 通过移液轻轻上下混合细胞,并占计算体积(每孔 100,000 个细胞)。将其添加到补充 Y-27632 的培养基中(从步骤 1.11 开始),使得最终体积为每孔 500 μL 进行板平。
- 从先前包被的孔中除去稀释的溶解基底膜基质(假设孵育完成30分钟或更长时间)。
- 通过移液轻轻混合细胞,并向每个孔中加入 500 μL 细胞悬液。
- 为了均匀分布细胞,在放入细胞培养箱之前,以大的"+"号运动移动板,轻柔的线性扫描(向前-向后,停止,向后)。
- 在37°C和5%CO2下孵育过夜(16-24小时)。
- 取出培养基,加入滴定的慢病毒。如果需要单次整合事件,则以每个细胞 0.3 个感染单位的多重感染为目标(理想情况下在目标细胞上滴定),并在培养基(不含 Y-27632)中加注至 500 μL。
注意:感兴趣的慢病毒可以预先滴定或内部生产,如前所述22.在这里,使用内部生产的具有嘌呤霉素耐药性的GFP慢病毒来生成和选择表达EGFP的NPC。如果尚未在目标细胞上滴定慢病毒并且拷贝数至关重要,则建议将几个体积添加到几个孔中,并在以后使用具有~30%EGFP + 细胞48-72小时的孔。如果拷贝数不重要,可以添加过量的病毒,但需要注意的是,插入诱变可能会导致某些克隆出现异常行为。注意:慢病毒载体是 2-3 级生物危害(取决于其内容)。遵守当地生物安全法规,处理慢病毒、表面和塑料器皿的去污以及液体废物。 - 将细胞返回培养箱,并在37°C和5%CO2下孵育24小时。
- 从培养箱中取出细胞,并取出上清液。
注意:由于细胞中的上清液此时仍含有慢病毒颗粒,因此请继续遵守当地的生物安全法规进行处理和处置。 - 用 2 x 500 μL PBS 冲洗细胞,将 PBS 轻轻加入孔壁;然后,从井角取出以冲洗掉任何残留的慢病毒。
注意:由于细胞中的上清液此时仍含有慢病毒颗粒,因此请继续遵守当地的生物安全法规进行处理和处置。 - 改为500μL新鲜培养基(不含Y-27632),并在37°C和5%CO2 下继续生长过夜。
- 使用活细胞荧光显微镜验证表达EGFP的细胞比例,并选择要处理的孔。
- 如果选择的慢病毒载体包含选择盒(抗生素耐药基因,如嘌呤霉素耐药性),则将选择剂(此处为1μg/mL嘌呤霉素)以先前验证的剂量添加到培养基中,以杀死敏感但不耐药的细胞。否则,使用荧光激活细胞分选在第一次分裂时分离 EGFP+ 细胞。
- 从现在开始,每天监测细胞的汇合度,并每天进行完整的培养基更换。
- 当达到汇合度时,准备一个或多个新鲜的 6 孔包被板(用 1 mL 稀释的溶解基底膜基质;参见步骤 1.3-1.5),并按照步骤 1.6-1.15 中的描述收获细胞。
注意:如果不包含选择剂,请在此阶段通过流式细胞术对细胞进行分选。确保使用足够宽的喷嘴和低压对细胞进行分选,以尽量减少压力,并且在分选过程的每个步骤中都包含 10 μM Y-27632。 - 将细胞铺板至最终密度为 200,000 个细胞/cm2。
- 保持每日监测,每天完成介质更换。
注意:当细胞再次汇合时,它们现在可以使用了。或者,现在可以按如下方式冻结库存以备将来使用。 - 按照步骤1.6-1.15中的说明对细胞进行分裂、收获和计数。
- 用相关信息(例如,传代、EGFP%、品系)预先标记一组冷冻管。
- 在培养基 + 10% DMSO 中以 400,000 个细胞/mL 重悬。
注意:DMSO在未冷冻时对细胞有毒,因此在DMSO存在的情况下,尽量减少在室温下花费的时间。 - 每次冷冻管加入 1 mL(400,000 个细胞)步骤 1.33 的混合物,并放入细胞冷冻容器中。
- 将容器转移到-80°C冰箱过夜。
- 第二天,将细胞转移到液氮中进行长期储存。
2.将标记的细胞注射到大脑类器官中
注意:对于本文,大脑类器官是按照制造商的说明使用商业试剂盒生产的。这可以用感兴趣的大脑类器官代替。协议的这一部分中使用的材料必须预冷,以避免溶解的基底膜基质在4°C以上凝胶化。
- 将胰岛素注射器,尖端和管子将与溶解的基底膜基质接触,置于-20°C,使其冷却。
- 根据将要执行的进样次数(~2μL/进样),在冰上解冻合适大小的溶解基底膜基质等分试样。这大约需要 30 分钟。
- 当等分试样解冻时,按照步骤 1.6-1.15 中所述对细胞进行分裂、收获和计数。
- 计算每次注射所需的体积。如果进行多次注射,将细胞总体积放入 1.5 mL 试管中,并加入最多 1 mL 的 DMEM/F12。
注意:应使用允许额外进样的体积来考虑损失/移液错误。 - 在准备下一步时将细胞放入冰中。
- 解冻后,在冰冷的DMEM / F12中将溶解的基底膜基质稀释至终浓度为3mg / mL。
- 从冰中取出单细胞悬浮液,并在4°C下以300× g 旋转5分钟。
注意:如果没有冷冻离心机,通常似乎可以忍受在室温下旋转。 - 轻轻完全除去培养基,不要干扰细胞沉淀。通过在稀释的溶解基底膜基质(3mg / mL)中轻轻移液将细胞沉淀重悬,以获得每次注射的最终体积为2μL,并立即将其放回冰上直至使用。
注意:细胞的重悬需要缓慢进行,并使用预冷的尖端,以避免形成气泡和胶凝。 - 将预冷的注射器从-20°C冰箱转移到冰桶中。将它们留在那里直到使用。
- 从培养箱中取出装有脑类器官的板。使用宽口径尖端将要注射的类器官转移到 35 毫米培养皿中。在不损坏类器官的情况下去除所有可能的培养基,以稳定它并促进注射。
注意: 使用宽口径尖端以避免破坏类器官很重要。如果没有,请用无菌剪刀剪掉常规 P1,000 尖端的末端。 - 将含有类器官的 35 mm 培养皿置于解剖显微镜下,以帮助引导和促进注射。
注意:如果无菌区域没有解剖显微镜,则可以在没有解剖显微镜的情况下进行注射,尽管控制有所减少。另一种选择是使用放大镜或眼镜。 - 准备好注射类器官后,用冷却的 P20 移液器吸头轻轻重悬细胞,并将 2 μL(包含要注射的所需数量的细胞)移动到预冷的无菌载玻片上。
注意:对于多次进样,可以在载玻片上添加额外的 2 μL 体积。把它放在冰上,注意避免蒸发。 - 从冰中取出预冷的胰岛素注射器,缓慢抽取 2 μL 细胞悬液,针头斜面朝下,以吸收所有细胞/培养基。
注意: 确保走得非常慢,以避免吸入任何空气。 - 打开含有类器官的培养皿的盖子,并将显微镜聚焦在其上。用一只手握住盘子。将针头的斜面向上放置,然后用另一只手将细胞缓慢注射到类器官表面。
注意:缓慢注射以避免损坏组织很重要。 - 注射后,将盖子放回培养皿中,让注射的类器官静置1-2分钟。
注意:这允许稀释的溶解基底膜基质凝胶化,将细胞固定到位。如果过早添加培养基,它会冲走位于表面的细胞。 - 轻轻加入 500 μL 类器官培养基,然后用宽口径尖端将类器官转移到 24 孔板的孔中。将类器官在37°C和5%CO2 下孵育过夜。每隔一天进行一次完整的培养基更换。
注意:重要的是要包括一个阴性对照类器官(模拟注射),它将用于成像调整。为此,如前所述,用稀释的溶解基底膜基质(3mg / mL)注射类器官,以获得最终体积为2μL的无细胞。
3. 活细胞荧光成像移植物追踪
注意:使用可以激发目标荧光团的荧光显微镜,并具有检测其荧光所需的滤光片组。如前所述,这里使用的NPC是EGFP+,激发峰为488 nm,发射峰为~510 nm。
- 加载阴性对照类器官(非注射或模拟注射),并设置照明强度和曝光时间,使自发荧光最小。对于此处使用的仪器,照明强度设置在 1 到 2 之间,曝光时间设置在 80 毫秒到 100 毫秒之间。
注意:由于许多激发波长(尤其是较低波长)可能对细胞有毒,因此建议保持低强度并避免寻找太久以防止对类器官的损害。 - 加载阳性对照类器官,并在必要时增加暴露时间,以确保标记的细胞清晰可见。用宽口径移液器吸头重新定位类器官以找到注射部位(EGFP + 区域)。
- 从阴性对照类器官中完全取出培养基。加载阴性对照类器官,并使用所选设置对其进行成像(对于此处使用的仪器,照明强度设置在 1 到 2 之间,曝光时间设置在 80 毫秒到 100 毫秒之间)。成像完成后,立即添加新鲜培养基以防止类器官变干。
注意:介质去除对于获得良好的图像至关重要,因为它可以固定类器官的高度和方向,否则类器官会漂浮并不断移动,从而无法进行高质量的成像。 - 对每个测试类器官重复培养基去除/成像。
- 将类器官返回正常孵育/培养基变化(如步骤2.16),并以所需的间隔重复成像。在这里,在注射后第 1 周、第 9 周和第 16 周对类器官进行成像,以跟踪和测试注射的 EGFP+ NPC 的存活、增殖、分化和迁移。
4. 组织学和免疫荧光
- 在终点,将类器官转移到标有类器官 ID 和其他必要标识符的组织学盒中。
- 用10%福尔马林填充盒式磁带,然后关闭。将其在室温下保存24小时。
- 将带有类器官的封闭盒转移到组织过程中,并设置以下方案:乙醇70%10分钟,乙醇80%20分钟,乙醇95%30分钟,乙醇100%30分钟,乙醇100%40分钟,乙醇100%50分钟,甲苯30分钟,甲苯40分钟,甲苯50分钟,石蜡在59°C下25分钟,石蜡在59°C下35分钟, 石蜡在59°C下40分钟,石蜡在59°C下50分钟。
注意: 除非另有说明,否则上述步骤是在室温下真空下完成的。该协议用高达100%的酒精梯度代替水。甲苯的中间步骤是醇和石蜡之间的过渡,因为两者都可溶于其中。 注意:甲苯和石蜡被认为是有害物质,因为它们可能是高度易燃的液体,吸入或接触皮肤或眼睛会造成损害。确保将它们紧闭存放在安全的空间中。处理它们时应穿戴适当的个人防护装备。根据当地化学危害法规处理废物。 - 将带有类器官的封闭盒转移到嵌入站的石蜡浴中。
- 从浴缸中取出盒式磁带,打开它,然后将类器官转移到钢制底座模具中。将模具放在石蜡分配器下方,并用石蜡完全覆盖。
- 将空盒放在钢制底座模具的顶部。在这里,在盒式磁带顶部添加更多石蜡。
- 将顶部装有盒的钢制底座模具转移到冰中,冷却5分钟。取下钢模具,并将盒式器嵌入石蜡块中。
- 将盒式切片机转移到切片机中以切割切片。根据需要切割部分。
注意:在这里,在整个类器官中制作了15μm厚度的切片。 - 将每个部分放在45°C的水浴表面上,然后在玻璃显微镜载玻片上拾取。
- 让载玻片在42°C的培养箱中干燥过夜。
注意:载玻片现在可以在室温下储存,直到染色。 - 将载玻片置于装满甲苯的Coplin载玻片染色罐中2分钟。再次重复此步骤。
注意: 甲苯被认为是一种有害物质,因为它可能是一种高度易燃的液体,并且可能因吸入或接触皮肤或眼睛而造成损害。确保将其紧闭存放在安全的空间中。处理时应穿戴适当的个人防护装备。根据当地化学危害法规处理废物。 - 转移到装有EtOH 100%的玻璃Coplin载玻片染色罐中2分钟。再次重复此步骤。
- 转移到装满蒸馏水的玻璃Coplin载玻片染色罐中2分钟。再次重复此步骤。
- 对于抗原修复,准备柠檬酸盐缓冲液(10 mM柠檬酸,0.05%吐温20,pH 6.0)。
注意:柠檬酸盐缓冲液可以在室温下储存长达3个月,或在4°C下储存更长时间。 - 在95°C和100°C之间设置水浴。
注意: 如果不小心,这种水浴可能会导致灼伤。采取一切必要的预防措施,避免直接接触浴槽或其组件。 - 在水浴中,漂浮一个可以容纳载玻片的塑料容器。确保塑料不接触浴槽底部(假设是底部加热浴),以避免熔化。将柠檬酸盐缓冲液倒入塑料容器内,使其达到95-100°C。
- 缓冲液达到所需温度后,将载玻片放入缓冲液内,并用盖子松散地盖住容器。将载玻片留在水浴中的容器内30-40分钟。
- 从水浴中取出塑料容器,在室温下冷却20分钟以上。
- 用PBS清洗载玻片3×2分钟。用纸巾取出PBS,不要接触样品或过度干燥。
- 准备透化缓冲液(90 mL PBS + 0.1% Tween-20),并用它填充载玻片染色罐。将载玻片浸入透化缓冲液中,孵育10分钟。
- 用PBS清洗载玻片3×2分钟。
- 准备足够的染色混合物以覆盖每个样品(~25μL)。
注:此处使用的抗体和最终浓度见 表1 。 - 加入 25 μL 染色混合物以覆盖每个类器官切片。在室温下孵育1小时或在4°C下在黑暗中孵育过夜。
注意:确保样品保持在高湿度下,以防止染色混合物蒸发。如果没有保持载玻片湿润的容器,请将它们放入一个盒子中,并在角落放一些湿纸巾。 - 用PBS清洗载玻片3×2分钟。
- 在载玻片染色罐内用蒸馏水冲洗一次以除去盐分。
- 向每个样品中加入 10 μL 液体封片剂 + 4',6-二脒基-2-苯基吲哚 (DAPI)。
注意:如果不进行第二轮染色,则可以密封载玻片。在这里,载玻片没有被覆盖以允许进入淬火/重新染色,因为盖玻片去除会损坏组织。 - 使用选定的荧光显微镜对载玻片进行成像。
注意:确保每种抗体都有阳性和阴性对照,以便正确设置强度和暴露时间(对于此处使用的仪器,照明强度设置在 5 到 6 之间,暴露时间设置在 2,000 毫秒和 3,000 毫秒之间),尽管这可能因抗体而异。此外,确保显微镜为所使用的每个通道配备足够的检测器。请注意,由于样品没有被覆盖,因此在成像时需要将它们面朝上放置。 - 成像后,制备新鲜的2x淬灭缓冲液(9%H2O2 + 50mM NaOH的PBS)。
注意:淬火溶液在使用前必须立即新鲜制备。该反应对 H2O2 的活性敏感,该活性会随着时间的推移而降低。注意:H2O2 是刺激物,NaOH 是腐蚀性的。这些应使用适当的安全设备进行治疗,并应避免皮肤接触。确保按照当地化学品安全政策进行处置。 - 用 2x 淬灭缓冲液 (45 mL) 填充玻璃 Coplin 载玻片染色罐的一半,加入 45 mL PBS,然后将载玻片放入其中。在4°C孵育过夜。
- 通过荧光显微镜检查荧光团是否被有效淬灭。
- 如上所述重复染色和成像。
注意:淬火和重新染色可以根据需要重复进行额外的轮次,但每增加一轮,损坏的风险就会增加。
5. 图像配准
- 打开斐济。
- 使用第 1 轮和第 2 轮的 DAPI 图像创建一个文件夹。如果需要,更改名称以阐明哪个是哪个。
- 为图像注册的输出创建一个空文件夹。
- 点击 插件 |注册 |注册虚拟堆栈切片。
- 在 "源目录"下,选择包含每个轮次的 DAPI 图像的文件夹。
- 在 "输出目录"下,选择为注册输出创建的文件夹。
- 将 特征提取模型 设置为 刚 性,将 配准模型 下拉菜单设置为 刚性 - 平移+旋转 以固定配准,仅允许移动和旋转图像以进行对齐而不是变形。
注意:如果预期会发生变形,则可以根据需要将 特征提取模型 和 配准模型 调整为 仿射 或其他模型,尽管这可能会导致不需要的变换。有时,切片可能会在两轮之间损坏,这可能会阻止成功注册。 - 选中保存 变换 框以保存变换参数,允许将其应用于其他通道。
- 单击 "确定"。
- 选择 保存转换文件的位置 (默认为输入目录),然后单击 "打开"。
- 选择要用作转换引用的 DAPI 图像。其他每一轮的 DAPI 图像将与此图像对齐。
注意:完成后,注册的图像将显示为堆栈(并在输出文件夹中)。 - 使用底部的滑动条在图像之间来回翻转,以验证图像配准是否成功(细胞核在两个图像中的同一位置,至少对于重叠区域而言)。
- 验证是否已为每一轮输入图像创建.xml文件。
注意:这些参数包含该轮文件所需的转换参数。 - 创建一个包含所有要注册的图像的文件夹(每轮的每个通道)。记下文件的顺序。
- 为转换参数创建一个文件夹,并为每个要注册的通道的每个轮次制作一个 .xml 文件的副本。仔细检查要注册的图像和转换参数复制之间的文件顺序(按名称)是否相同,因为下一步将按照转换参数文件的顺序进行转换和转换每个图像。
- 点击 插件 |转型 |转换虚拟堆栈切片。
- 在 "源目录"下,选择包含要注册的映像的文件夹。
- 在 "输出目录"下,选择为注册输出创建的文件夹。
- 在 "转换目录"下,选择包含.xml文件的文件夹,每个要转换的图像文件都有一个副本。同样,确保顺序与文件匹配(即,每个第 1 轮通道的第 1 轮.xml副本,每个第 2 轮通道的第 2 轮.xml副本,以此类推)。
- 单击 "确定"。
注意:完成后,该回合的注册图像将显示为堆栈(并在输出文件夹中)。 - 使用底部的滑动条在通道之间来回翻转。验证所有通道是否都以相同的方式转换。如果不是,这可能是由于 transforms 目录中的 .xml 文件错误;在这种情况下,请修复文件并重复。
注意: 显示的亮度范围将基于一个通道,但这不会影响实际保存的图像,只会影响显示。 - 观察注册图像是否都已成功跨轮对齐,并准备好进行叠加/下游分析。
注意:有更有效的编程方法来完成大批量的注册。这里介绍的方法只是一个简单的方法,不需要编程。
结果
作为对大脑类器官身份的验证,对成熟(2 个月大)大脑类器官的组织学切片进行 PAX6(背侧 NPC23 的标志物)和 SATB2(成熟、有丝分裂后上层神经元的标志物 24)染色。正如预期的那样,PAX6+ 细胞存在于类器官的内部,SATB2+ 细胞存在于上层(图2)。这些结果支持所使用的大脑类器官确实是分化试剂盒中指定的背侧前脑。为了确定脑类器官移植系统的剂量依赖性,2 个月大的脑类器官注射了越来越多的 EGFP+ iPSC 衍生的 NPC。GFP荧光对输入细胞数存在明显的剂量依赖性,在10,000个及以上的细胞上检测到一致的EGFP+ 细胞贴片(图3)。接下来通过随时间跟踪移植的类器官来评估移植 NPC 的持久性和迁移性。为此,将 50,000 个 iPSC 衍生的 EGFP+ NPC 移植到由同一 iPSC 系生成的 2-3 个月大的大脑类器官中。在接下来的 3-4 个月内,在指定的时间点对注射的类器官和对照组进行 EGFP 阳性成像。在这个移植系列中,我们观察到注射部位在整个4个月的跟踪期内持续存在(图4A)。移植后 9 天出现额外的 EGFP+ 细胞斑块,并持续到研究终点(3-4 个月,取决于类器官),表明细胞的迁移和整合在其新位点(图 4A)。在更高的放大倍率下,可以观察到清晰的神经形态,长投影到类器官中(图4B),证实了注射细胞的整合。
为了确定注射后晚期注射细胞的分化状态,将 4 个月的跟踪类器官及其对照固定、石蜡包埋、切割成 15 μm 厚的切片并安装在载玻片上。然后对切片进行单轮荧光染色(EGFP、TUJ1、NESTIN)或连续两个染色循环以添加其他标记物(MAP2、GFAP)进行处理和染色。最初的单轮染色证实了注射部位存在EGFP+细胞,包括保留鼻咽癌状态的细胞(NESTIN+TUJ1-)和向神经命运分化的细胞(NESTIN-TUJ1+)的混合物(图5)。对于对照组和注射类器官,观察到很少的 NESTIN+ NPC(大多数,但并非所有是注射部位的 EGFP+ 移植 NPC),大多数 TUJ1+ 未成熟-成熟神经元(图 5)。两轮染色提供了更多细节,揭示了类器官大部分外部区域周围的成熟神经元(NESTIN-TUJ1+MAP2+GFAP-),中间有未成熟(NESTIN-TUJ1+MAP2-GFAP-)神经元区域(图6A,B)。星形胶质细胞(NESTIN-TUJ1-MAP2-GFAP+)存在于注射和对照类器官中,并散布在外边缘周围(图6A,B)。在注射的类器官中进行两轮染色的切片显示,远离注射部位的EGFP +细胞的小型卫星集落,该细胞采用了成熟神经元的表型(图6B,C)。其中一些似乎与星形胶质细胞非常接近;然而,没有与GFAP染色完全重叠的EGFP +细胞,表明它们是相邻的,而不是产生星形胶质细胞本身(图6B,C)。
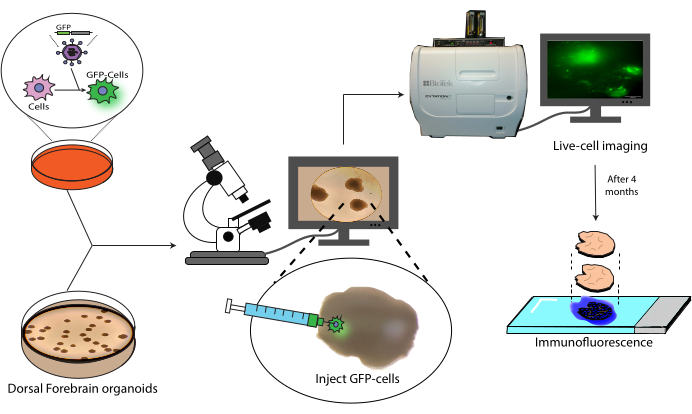
图1:标记细胞移植到大脑类器官中的模型。 通过慢病毒转导产生标记细胞的示意图概述,将其移植到大脑类器官中,以及通过活细胞成像和免疫荧光进行跟踪。缩写:GFP=绿色荧光蛋白。 请点击这里查看此图的较大版本.
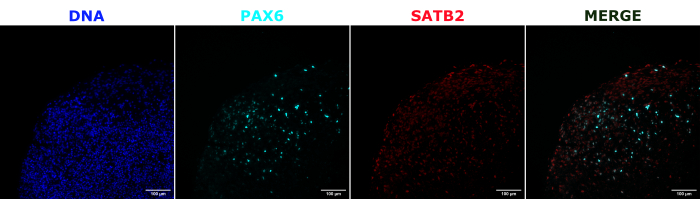
图 2:显示早期和晚期类器官结构的组织学切片的免疫荧光。 将 2 个月大的大脑类器官固定、石蜡包埋、切片并用 PAX6、SATB2 和 DAPI 染色。使用未染色的切片来设置曝光和积分时间,以避免自发荧光产生的假阳性信号。PAX6+细胞存在于类器官内部,而SATB2+细胞存在于上层。在整个 15 μm 组织切片中每 4.2 μm 拍摄一次 Z 堆栈图像。使用 Gen5 软件中的焦点堆叠选项和默认选项组合光学部分。比例尺 = 100 μm。缩写:PAX6 = 配对盒 6 蛋白;SATB2 = 特殊的富含 AT 的序列结合蛋白 2;DAPI = 4',6-二脒基-2-苯基吲哚。 请点击这里查看此图的较大版本.
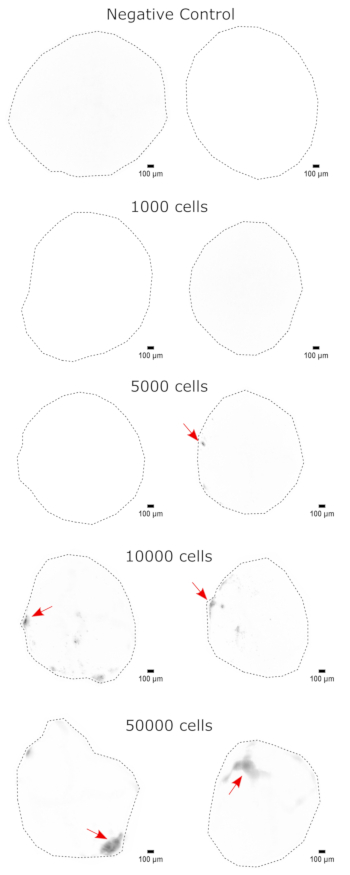
图3:鼻咽癌的剂量依赖性植入大脑类器官。 类器官移植了 0(阴性对照)、1,000、5,000、10,000 或 50,000 个 GFP+ iPSC 衍生的 NPC。移植后 1 周,使用 GFP 滤波器立方体在 Cytation 5 上对类器官进行成像。阴性对照用于设置暴露和积分时间,以尽量减少自发荧光。颜色越深表示相对于阴性对照的EGFP荧光越多。比例尺 = 100 μm。这些是整个类器官的 4 倍图像。成像后,在显示前执行像素半径为 50 的滚球背景减法,以校正类器官的可变背景强度。被确定为最高植入区域的注射部位用红色箭头表示,其中存在植入。缩写:NPCs = 神经祖细胞;GFP = 绿色荧光蛋白;EGFP = 增强型 GFP;iPSC = 诱导多能干细胞。 请点击这里查看此图的较大版本.
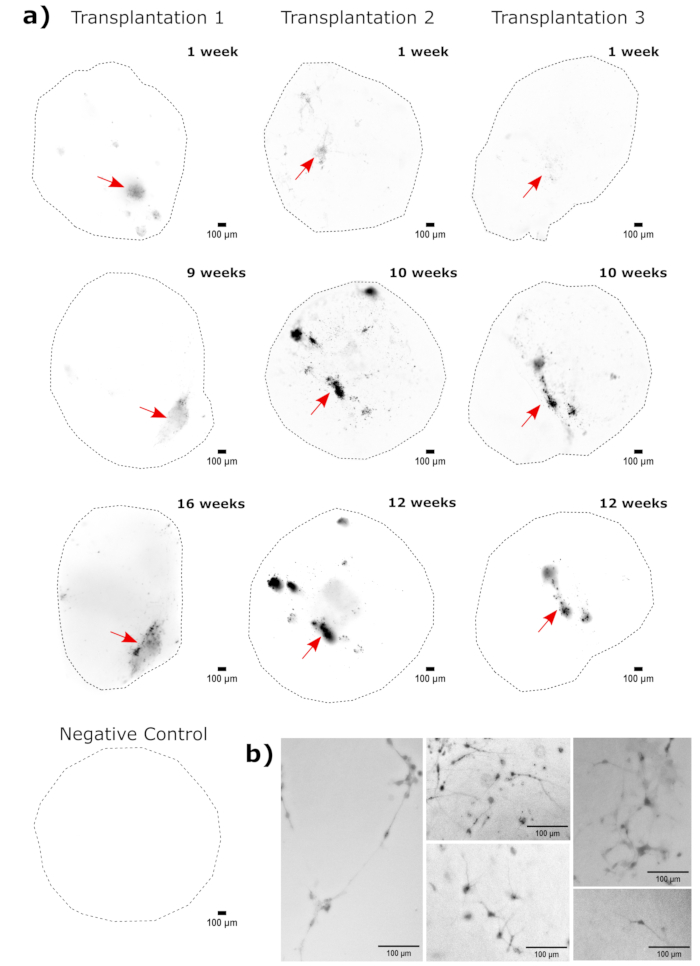
图 4:使用荧光活细胞成像跟踪移植细胞的生长、迁移和持久性。 (A) 对照和移植(50,000 个 GFP+ iPSC 衍生的 NPC)类器官进行 2-4 个月的荧光活细胞成像,来自两个独立的移植组。阴性对照类器官用于设置暴露和整合时间,以最大限度地减少每个时间点的自发荧光。在移植后的指定时间使用 Cytation 5 上的 GFP 滤光片立方体捕获 EGFP 图像。较深的颜色表示相对于该时间点的阴性对照,EGFP荧光更多。在显示之前,以像素半径为50的滚球背景减法进行校正整个类器官的可变背景强度。类器官在每个时间点以大致相同的方向放置,并且旋转图像以保持显示的一致性并清楚地显示移植的细胞生长。在最早的时间点被确定为最高植入区域的注射部位用红色箭头表示。阴性对照类器官的例子如图底部所示。(B) 移植后第 1 周和第 15 周的移植类器官的示例 20x 图像。在显示之前,使用FIJI增强了局部对比度,以确保神经突的可见性。比例尺 = 100 μm。缩写:NPCs = 神经祖细胞;GFP = 绿色荧光蛋白;EGFP = 增强型 GFP;iPSC = 诱导多能干细胞。 请点击这里查看此图的较大版本.
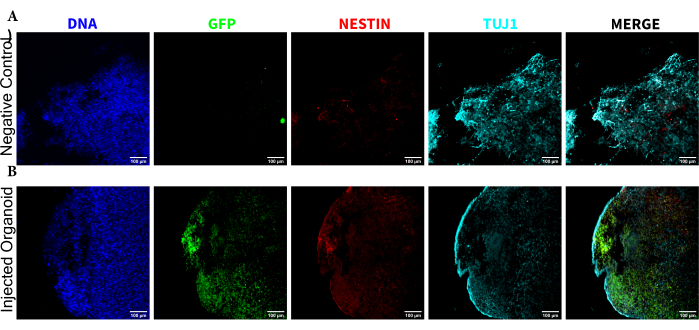
图 5:组织学切片的免疫荧光揭示了移植的 NPC 在注射部位的持续存在以及迁移和神经分化。 来自 (A) 未注射和 (B) 移植类器官的单通道荧光图像。右侧叠加的图像显示了三个感兴趣的通道(NESTIN、TUJ1 和 EGFP),但不包括 DAPI。显示最小值被设置为仅排除来自负单元的信号(针对来自非注入对照的 EGFP 和其他基于已知标记组合的通道确定)。显示最大值基于在任何细胞中观察到的该抗体的最高信号。未注射和移植类器官之间的显示范围保持不变,以便直接比较。比例尺 = 100 μm。缩写:NPCs = 神经祖细胞;DAPI = 4',6-二脒基-2-苯基吲哚;TUJ1 = β-III 微管蛋白;EGFP = 增强型绿色荧光蛋白。 请点击这里查看此图的较大版本.
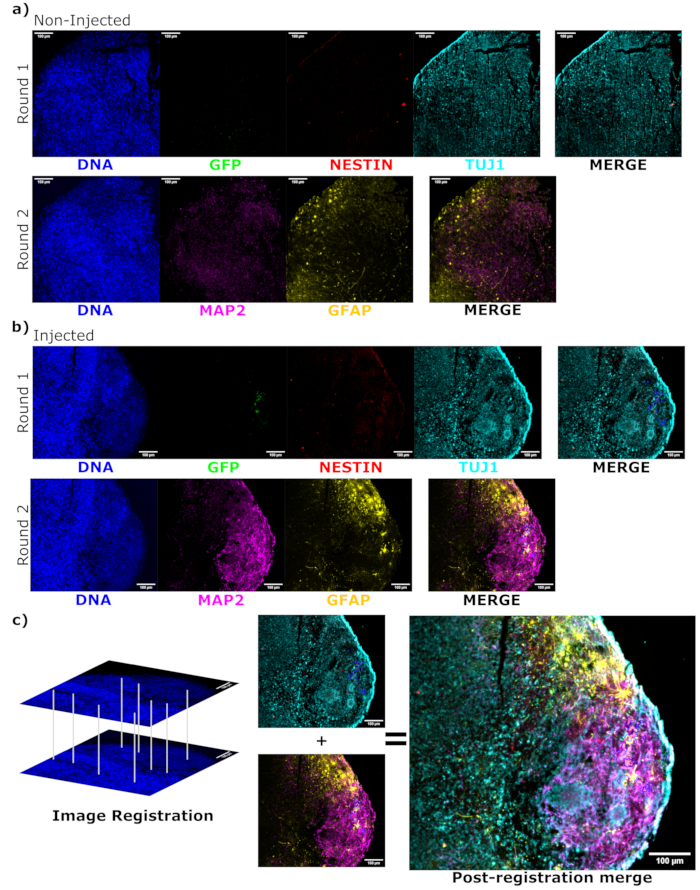
图 6:使用组织学切片的循环免疫荧光评估移植细胞分化状态和定位。 如图所示,显示来自未注射、(A) 年龄匹配和 (B) 移植类器官的单通道荧光图像,用于第一轮和第二轮染色。显示最小值被设置为仅排除来自负单元的信号(针对来自非注入对照的 EGFP 和其他基于已知标记组合的通道确定)。显示最大值基于在任何细胞中观察到的该抗体的最高信号。对照组和注射类器官之间的显示范围(当然还有成像参数)保持不变,以便直接比较。比例尺 = 100 μm。右侧显示了每个类器官的每个染色轮的叠加图像(不包括 DAPI)。(B)对于进行图像配准的注射类器官,所有图像都被裁剪到在两轮染色中观察到的区域。(乙、丙)对于注射的类器官,EGFP+ 细胞区域以蓝色勾勒。(C)显示了在图像配准期间如何使用DAPI匹配特征的图表,然后是注册图像的整体合并。缩写:DAPI = 4',6-二脒基-2-苯基吲哚;TUJ1 = β-III 微管蛋白;EGFP = 增强型绿色荧光蛋白;MAP2 = 微管相关蛋白 2;GFAP = 胶质纤维酸性蛋白。 请点击这里查看此图的较大版本.
| 克隆 | 荧光基团 | 浓度 | |
| 抗NESTIN | 10C2 | AlexaFluor 594 (英语) | 2,000 分之一 |
| 抗TUBB3 | TUJ1型 | AlexaFluor 647荧光 | 2,000 分之一 |
| 抗GFP | FM264G系列 | AlexaFluor 488 (英语) | 1/200 |
| 抗GFAP | SMI 25型 | AlexaFluor 594 (英语) | 1/500 |
| 抗MAP2 | SMI 52型 | AlexaFluor 488 (英语) | 千分之一 |
| 抗PAX6 | O18-1330型 | AlexaFluor 647荧光 | 1/100 |
| 抗SATB2 | EPNCIR130A | AlexaFluor 594 (英语) | 1/500 |
表 1:用于染色的抗体浓度。 缩写:TUBB3 = β-微管蛋白III;GFP = 绿色荧光蛋白;GFAP = 胶质纤维酸性蛋白;MAP2 = 微管相关蛋白 2;PAX6 = 配对盒 6 蛋白;SATB2 = 特殊的富含 AT 的序列结合蛋白 2。
讨论
鉴于对治疗中枢神经系统损伤/神经退行性疾病的细胞治疗方法的浓厚兴趣 1,2,3,4,5,6,7,8,移植环境中的细胞功能模型越来越重要。本文介绍了一种将标记的人类鼻咽癌移植到人类大脑类器官中的方法,以及通过组织学和免疫荧光染色对它们的活细胞跟踪和终点评估。重要的是,我们发现移植的细胞能够在类器官环境中迁移、分化和长期(4 个月)持久性。这种长期持久性比脑切片培养物的可维持性显着增加17。因此,该系统适用于检查在潜在治疗环境中需要评估的许多行为,例如存活、增殖和分化。事实上,最近的一项正交研究表明,移植的 NPC 在大脑类器官中的行为与移植到 NSG 小鼠大脑中的 NPC 相似20,从而证实了类器官作为移植受体的效用。由于这是一个体外系统,因此添加细胞因子或感兴趣的药物也很简单。这可以用来更好地了解特定环境(如炎症和免疫抑制剂)对移植细胞的影响,以进一步模拟它们在治疗环境中可能遇到的情况。我们展示的环状免疫荧光方案(基于先前的研究21)进一步扩展了这种方法的功能,允许在单个切片中同时评估各种谱系和潜在的疾病特异性标志物,从而允许准确跟踪移植细胞及其对组织的影响。当然,根据分析目标,可以使用其他终点评估方法。例如,如果主要对细胞形态感兴趣,则可以使用具有 3D 重建的组织清除,或者如果特定细胞类型的定量是最终目标,则可以使用解离后流式细胞术。我们预计这种方法可以很容易地扩展到其他细胞类型,如中枢神经系统肿瘤,有可能允许它们在微环境相关的背景下进行研究。类似地,用作受体的类器官可以交换为疾病模型类器官25,26,27,从而可能允许对这些条件的移植方法进行建模。
与所有模型一样,这里介绍的模型也有其自身的局限性。首先,iPSC衍生的类器官在发育上是不成熟的19,因此与衰老的大脑相比具有重要差异,其中许多神经退行性疾病都表现出来。大脑类器官在发育中也是不均匀的19,因此排除了一致地注射到相同的确切生理生态位。此外,虽然它们包含相关大脑区域的细胞类型18,19,但它们缺乏内皮、小胶质细胞和免疫成分,这些成分在体内环境中也很重要14。这限制了宿主对细胞移植的反应研究。目前,添加血管28 和小胶质细胞29 细胞以及增加类器官一致性和区域化18 的技术正在上线,从而提高类器官移植系统的建模能力。但是,除了此处介绍的内容之外,它们还需要进一步的测试和优化。虽然该协议价格低廉且不需要专门的设备,但仍有许多重要的技术考虑因素 - 例如注射深度。这既是由于类器官没有被灌注,因此,如果它们长得太大,通常有一个坏死中心19,并且光不能穿透类器官核心进行活细胞追踪。因此,注射太深的细胞和迁移到内部的菌落可能会被遗漏。虽然这可以通过使用具有更好组织外显率的更长波长的荧光团来改善30,但取决于类器官的大小和检测设备,这可能仍然是一个考虑因素。最后,由于大脑类器官处于发育状态,移植时间是另一个关键考虑因素,因为环境可能会根据注射它的类器官的发育阶段而有所不同。虽然这在一定程度上可以通过确保注射时一致的类器官年龄来控制,但毫无疑问,这是一个需要考虑的因素。
该协议价格低廉、简单、无动物成分,并且不需要专门的设备,从而使移植建模可供更广泛的实验室使用。随着神经细胞疗法和类器官模型系统的快速发展,我们预计这里介绍的类器官移植方案将成为一系列疾病和治疗方法的有用模型。
披露声明
作者没有什么可透露的。
致谢
这项工作的资金由Marcelle和Jean Coutu基金会以及魁北克-桑特研究基金会(FRQS #295647)的IRIC慈善基金提供。D.J.H.F.K. 以 Chercheurs-boursiers Junior 1 奖学金 (#283502) 的形式获得 FRQS 的工资支持。M.I.I.R. 得到了免疫学和癌症研究所的 IRIC 博士奖、蒙特利尔大学的 Bourse de passage accélère de la maitrise au doctorat 和 Bourse de Mérite aux cycles supérieurs 的支持。
材料
| Name | Company | Catalog Number | Comments |
| Accutase | StemCell Technologies | 7920 | proteolytic-collagenolytic enzyme mix |
| Alexa Fluor 488 anti-GFP Antibody | BioLegend | 338008 | |
| Alexa Fluor 488 anti-MAP2 (clone SMI 52) | BioLegend | 801804 | |
| Alexa Fluor 594 anti-GFAP Antibody (clone SMI 25) | BioLegend | 837510 | |
| Alexa Fluor 594 anti-Nestin (clone 10C2) | BioLegend | 656804 | |
| Alexa Fluor 647 anti-Tubulin β 3 (TUBB3) (clone TUJ1) | BioLegend | 801209 | |
| Citric Acid Monohydrate | Fisher Chemical | A104-500 | |
| Cytation 5 Cell Imaging Multimode Reader | Biotek | - | |
| Denaturated Ethyl Alcohol (Anhydrous) | ChapTec | - | |
| DMEM F12/Glutamax | Thermo | 10565018 | |
| Dymethil Sulfoxide (DMSO), Sterile | BioShop | DMS666.100 | |
| FIJI 1.53c | - | - | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501128-4L | |
| Gen5 | - | - | |
| HistoCore Arcadia H | Leica Biosystems | - | |
| Matrigel Growth Factor Reduced (GFR) | Corning | 356231 | Phenol Red-free, LDEV-free |
| MX35 microtome blade | Epredia | 3053835 | |
| NaOH | Sigma | 655104 | |
| PBS (-Ca -Mg) | Sigma | D8537 | |
| Puromycin Dihydrochloride | Thermo | A1113803 | |
| ROCK inhibitor Y-27632 | Abcam | ab120129 | |
| Simport Scientific Stainless-Steel Base Molds | Fisher Scientific | 22-038-209 | |
| Simport Scientific UNISETTE Biopsy Processing/Embedding Cassette | Fisher Scientific | 36-101-9255 | |
| STEMdiff Forebrain Neuron Differentiation Kit | StemCell Technologies | 8600 | |
| STEMdiff Neural Progenitor Medium | StemCell Technologies | 5833 | |
| STEMdiff SMADi Neural Induction Kit | StemCell Technologies | 8581 | |
| Thermo Scientific Shandon Finesse ME Microtome | Thermo Scientific | - | |
| Tissue Prep | Fisher Scientific | T555 | |
| Tissue-Tek VIP 6 AI Tissue Processor | Sakura Finetek | - | |
| Toluene (histological) | ChapTec | - | |
| Trypan blue; 0.4% (wt/vol) | Thermo | 15250061 | |
| Tween 20 | BioShop | TWN510.100 |
参考文献
- Spurlock, M. S., et al. Amelioration of penetrating ballistic-like brain injury induced cognitive deficits after neuronal differentiation of transplanted human neural stem cells. Journal of Neurotrauma. 34 (11), 1981 (2017).
- Zhou, Y., Shao, A., Xu, W., Wu, H., Deng, Y. Advance of stem cell treatment for traumatic brain injury. Frontiers in Cellular Neuroscience. 13, 301 (2019).
- Hayashi, Y., Lin, H. -. T., Lee, C. -. C., Tsai, K. -. J. Effects of neural stem cell transplantation in Alzheimer's disease models. Journal of Biomedical Science. 27 (1), 29 (2020).
- Kefalopoulou, Z., et al. Long-term clinical outcome of fetal cell transplantation for Parkinson disease: Two case reports. JAMA Neurology. 71 (1), 83-87 (2014).
- Li, W., et al. Extensive graft-derived dopaminergic innervation is maintained 24 years after transplantation in the degenerating parkinsonian brain. Proceedings of the National Academy of Sciences of the United States of America. 113 (23), 6544-6549 (2016).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Takahashi, J. iPS cell-based therapy for Parkinson's disease: A Kyoto trial. Regenerative Therapy. 13, 18-22 (2020).
- Krause, M., Phan, T. G., Ma, H., Sobey, C. G., Lim, R. Cell-based therapies for stroke: Are we there yet. Frontiers in Neurology. 10, 656 (2019).
- Coles-Takabe, B. L. K., et al. Don't look: Growing clonal versus nonclonal neural stem cell colonies. Stem Cells. 26 (11), 2938-2944 (2008).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Jakel, R. J., Schneider, B. L., Svendsen, C. N. Using human neural stem cells to model neurological disease. Nature Reviews Genetics. 5 (2), 136-144 (2004).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Li, J., et al. Conservation and divergence of vulnerability and responses to stressors between human and mouse astrocytes. Nature Communications. 12 (1), 3958 (2021).
- Morizane, A., et al. MHC matching improves engraftment of iPSC-derived neurons in non-human primates. Nature Communications. 8 (1), 385 (2017).
- Khrameeva, E., et al. Single-cell-resolution transcriptome map of human, chimpanzee, bonobo, and macaque brains. Genome Research. 30 (5), 776-789 (2020).
- Powell, K. Hybrid brains: The ethics of transplanting human neurons into animals. Nature. 608 (7921), 22-25 (2022).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- García-Delgado, A. B., et al. Brain organoids to evaluate cellular therapies. Animals. 12 (22), (2022).
- Lin, J. -. R., Fallahi-Sichani, M., Sorger, P. K. Highly multiplexed imaging of single cells using a high-throughput cyclic immunofluorescence method. Nature Communications. 6 (1), 8390 (2015).
- Knapp, D. J. H. F., et al. Single-cell analysis identifies a CD33+ subset of human cord blood cells with high regenerative potential. Nature Cell Biology. 20 (6), 710-720 (2018).
- Georgala, P. A., Carr, C. B., Price, D. J. The role of Pax6 in forebrain development. Developmental Neurobiology. 71 (8), 690-709 (2011).
- Britanova, O., et al. Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex. Neuron. 57 (3), 378-392 (2008).
- Kim, H., et al. Modeling G2019S-LRRK2 sporadic Parkinson's disease in 3D midbrain organoids. Stem Cell Reports. 12 (3), 518-531 (2019).
- Smits, L. M., et al. Modeling Parkinson's disease in midbrain-like organoids. NPJ Parkinson's Disease. 5, 5 (2019).
- Jin, M., et al. Type-I-interferon signaling drives microglial dysfunction and senescence in human iPSC models of Down syndrome and Alzheimer's disease. Cell Stem Cell. 29 (7), 1135.e8-1153.e8 (2022).
- Sun, X. -. Y., et al. Generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, e76707 (2022).
- Popova, G., et al. Human microglia states are conserved across experimental models and regulate neural stem cell responses in chimeric organoids. Cell Stem Cell. 28 (12), 2153.e6-2166.e6 (2021).
- Wang, S., Li, B., Zhang, F. Molecular fluorophores for deep-tissue bioimaging. ACS Central Science. 6 (8), 1302-1316 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。