Method Article
Церебральная органоидная модель трансплантации нервных клеток человека
В этой статье
Резюме
В этой статье мы опишем протокол трансплантации и отслеживания меченых нервных клеток в церебральные органоиды человека.
Аннотация
Развитие подходов к трансплантации клеток требует модельных систем, позволяющих точно оценить функциональную активность трансплантированных клеток. Для центральной нервной системы, несмотря на то, что ксенотрансплантация остается современной, такие модели технически сложны, ограничены в пропускной способности и дороги. Более того, присутствующие сигналы окружающей среды не идеально вступают в перекрестную реакцию с клетками человека. В данной работе представлена недорогая, доступная и высокопроизводительная модель трансплантации и отслеживания нервных клеток человека в органоиды головного мозга человека. Эти органоиды могут быть легко получены из индуцированных плюрипотентных стволовых клеток человека с помощью коммерческих наборов и содержат ключевые типы клеток головного мозга.
Сначала мы продемонстрируем этот протокол трансплантации с помощью инъекции меченых EGFP человеческих ИПСК-клеток-предшественников (NPC) в эти органоиды. Далее мы обсудим соображения по отслеживанию роста этих клеток в органоиде с помощью флуоресцентной микроскопии живых клеток и продемонстрируем отслеживание трансплантированных EGFP-меченных NPC в органоиде в течение 4-месячного периода. Наконец, мы представляем протокол секционирования, циклического иммунофлуоресцентного окрашивания и визуализации трансплантированных клеток в их локальном контексте. Представленная здесь модель трансплантации органоидов позволяет в течение длительного времени (не менее 4 месяцев) отслеживать трансплантированные человеческие клетки непосредственно в микросреде человека с помощью недорогого и простого в исполнении протокола. Таким образом, она представляет собой полезную модель как для терапии нервными клетками (трансплантации), так и, вероятно, для моделирования опухолей центральной нервной системы (ЦНС) более точным микроэкологическим способом.
Введение
Человеческий мозг представляет собой сложный орган, состоящий из нескольких типов клеток нервной и глиальной линий. Вместе они образуют сложную сеть, которая порождает познание. Существует значительный интерес к трансплантации клеток в эту систему в качестве лечения широкого спектра неврологических расстройств, включая черепно-мозговую травму (ЧМТ)1,2, нейродегенеративные расстройства 3,4,5,6,7 и инсульт8. Однако одним из основных препятствий в продвижении таких стратегий является относительная нехватка доступных доклинических моделей для определения ожидаемых результатов трансплантации. В настоящее время наиболее часто используемыми моделями являются методы культивирования in vitro для определения клеточного потенциала и ксенотрансплантации мышам. Несмотря нато, что методы культивирования клеток позволяют оценить потенциал дифференцировки и самообновления, они проводятся в оптимальных условиях роста, которые не имитируют микроокружение, с которым клетки столкнулись бы в контексте трансплантации. Более того, способ, которым клетки выращиваются, может влиять на их поведение10.
Мозг мыши содержит все клетки микроокружения и, таким образом, является чрезвычайно мощной модельной системой длятрансплантации. Однако существуют важные различия между корой головного мозга мыши и человека12,13, и не все факторы роста перекрестно реагируют между видами. Модели приматов являются более близкой альтернативой, которая лучше имитирует человеческую систему, а также дает важные доклиническиерезультаты. Однако даже эти более близкородственные родственники сохраняют важные различия в клеточномсоставе. Несмотря на то, что обе эти модельные системы дают ценную информацию о поведении клеток во время трансплантации и включают в себя хирургические элементы возможной терапии, они остаются несовершенными. Кроме того, они являются дорогостоящими и технически сложными (т.е. необходимо проводить операции на головном мозге животных), что ограничивает возможную пропускную способность. Кроме того, существует множество этических проблем, связанных с трансплантацией клеток человеческого мозгаживотным16. Культивирование срезов мозга позволяет разрезать один мозг и использовать его для нескольких видов лечения, тем самым устраняя некоторые ограничения трансплантации животных; Тем не менее, они имеют ограниченную продолжительность жизни (недели), по-прежнему животного происхождения и (будучи тонким ломтиком) не обладают достаточным объемом/целостностью поверхности, чтобы имитировать введение клеток17. Таким образом, остается значительный разрыв между чисто клеточными культурами/потенциальными моделями и трансплантацией in vivo.
Церебральные органоиды представляют собой модель in vitro, содержащую основные типы нервных клеток, присутствующих в головном мозге, и могут быть получены в больших количествах из индуцированных плюрипотентных стволовых клеток человека (ИПСК)18,19. Таким образом, такие органоиды обеспечивают клеточный контекст, который может позволить оценить функциональную способность тест-клетки, представляющей интерес в условиях трансплантации. Действительно, недавнее исследование показало, что нейронные клетки-предшественники (NPC), трансплантированные в церебральные органоиды человека, выживают, размножаются и дифференцируются аналогично NPC, трансплантированным в мозг мыши с комбинированным иммунодефицитом (NSG)20 с ожирением. Церебральные органоиды, таким образом, представляют собой долгоживущую (>6 месяцев), экономически эффективную систему, которая захватывает типы клеток человеческого мозга. Таким образом, они могут представлять собой идеального реципиента трансплантата для тестирования регенеративной способности нервных клеток на ранней стадии.
В данной работе представлен протокол трансплантации и последующего отслеживания меченых НПК человека в органоиды головного мозга человека (рис. 1). Это начинается с инъекции меченых GFP NPC в зрелые (2-4 месяца) церебральные органоиды18. Затем трансплантированные клетки проходят флуоресцентную микроскопию живых клеток в течение 4 месяцев. В течение этого времени мы показываем как персистенцию клеток в месте инъекции, так и миграцию в дистальные области органоида. В конечной точке мы демонстрируем извлечение, окрашивание и визуализацию антигенов гистологических срезов, полученных из этих органоидов, включая протокол гашения существующих красителей на основе AlexaFluor, чтобы обеспечить дополнительные раунды окрашивания и визуализации, основанные на предыдущей работе21. Таким образом, этот протокол может быть полезен для измерения способности клеток к дифференцировке в условиях трансплантации, долговечности трансплантата, клеточной экспансии in situ и миграции клеток из места трансплантации. Мы ожидаем, что это будет полезно как для применения в регенеративной медицине и клеточной терапии, так и для моделирования опухолей путем имплантации опухолевых клеток в соответствующие регионоспецифичные органоиды.
протокол
ПРИМЕЧАНИЕ: См. Таблицу материалов для получения подробной информации, относящейся ко всем материалам, реагентам и оборудованию, используемым в этом протоколе.
1. Флуорофорное мечение клеток лентивирусной трансдукцией
- Разморозьте аликвоту солюбилизированной матрицы базальной мембраны на льду.
- Пока аликвота оттаивает, добавьте стерильную воду, чтобы заполнить промежутки между лунками в 24-луночной пластине вместе со всеми внешними лунками.
ПРИМЕЧАНИЕ: Это оставляет восемь лунок открытыми посередине для использования и гарантирует, что ячейки останутся в высокой влажности, тем самым сводя к минимуму изменчивость, вызванную испарением. - Растворимую матрицу базальной мембраны разбавить 1:100 в ледяной среде DMEM/F12 (конечная концентрация 0,089 мг/мл была получена при использовании данного лота).
- Добавьте 300 мкл разбавленной солюбилизированной мембранной матрицы основания в одну из средних (открытых) лунок подготовленной 24-луночной планшета для каждой выполняемой инфекции. Обязательно равномерно покройте все дно колодца и при необходимости добавьте еще, чтобы обеспечить равномерное покрытие.
- Инкубируйте планшет в течение 30 минут при температуре 37 °C, чтобы слой затвердел вдоль дна лунки. В конце инкубации убедитесь, что жидкость все еще полностью покрывает дно лунки и не испарилась в центре. Испарение – признак того, что влажность слишком низкая; Если это произошло, повторите нанесение покрытия.
ПРИМЕЧАНИЕ: Пластины могут быть покрыты накануне вечером и оставлены в разбавленной растворимой мембранной матрице базальной мембраны без явных побочных эффектов; Однако риск испарения сильно увеличивается, поэтому перед применением их необходимо тщательно осмотреть. - Удалите среду из одной лунки сливающихся NPC, полученных из iPSC, растущих в луночной пластине.
ПРИМЕЧАНИЕ: Для этой статьи использовались нейронные предшественники, полученные из ИПСК, полученные с использованием коммерческого набора в соответствии с инструкциями производителя между пассажем 3 и пассажем 10. - Аккуратно добавьте 1 мл PBS на край колодца и покачайте пластину, чтобы обеспечить равномерное мытье.
- Снимите PBS и замените 300 мкл смеси протеолитических и коллагенолитических ферментов, снова покачав пластину, чтобы убедиться, что она полностью покрыла дно лунки. Выдерживать 5 мин при температуре 37 °C. Убедитесь, что клетки отделяются от поверхности пластины с помощью световой микроскопии.
- С помощью пипетки P1 000 добавьте 700 мкл DMEM/F12 и отделите клетки, распылив эту смесь на все поверхности нижней части планшета. Пипетки вверх и вниз, чтобы убедиться, что клеточные агрегаты разбиты на однородную одноклеточную суспензию. Возьмите клетки и добавьте к 9 мл среды DMEM/F12 в конической пробирке объемом 15 мл.
- Центрифуга при 300 × г в течение 5 мин.
- В течение этого времени подготовьте достаточное количество среды, добавленной 10 мкМ Y-27632, для 500 мкл на лунку для покрытия, плюс 1 мл для ресуспензии.
ПРИМЕЧАНИЕ: Y-27632 необходим для обеспечения высокой выживаемости NPC после прохождения в виде одиночных клеток. - Удалите надосадочную жидкость и повторно суспендируйте клетки в 1 мл среды с добавлением Y-27632, осторожно пипетируя вверх и вниз несколько раз, чтобы разрушить клеточные агрегаты.
- Выньте несколько микролитров клеток и разведите их (от 1:5 до 1:10) в трипановом синем.
- Подсчитайте жизнеспособные (трипановые синие-отрицательные) клетки на гемоцитометре. Отрегулируйте разбавление трипанового синего так, чтобы получить не менее 50 жизнеспособных клеток в квадранте гемоцитометра, чтобы обеспечить точность подсчета. Рассчитайте объем клеточной суспензии, необходимый для того, чтобы в каждой лунке присутствовало 100 000 клеток.
- Осторожно перемешайте ячейки вверх и вниз с помощью пипетирования и возьмите рассчитанный объем (для 100 000 клеток на лунку). Добавьте его в среду с добавлением Y-27632 (начиная с шага 1.11) так, чтобы окончательный объем составлял 500 мкл на лунку для покрытия.
- Удалите разбавленную растворимизированную мембранную матрицу базального основания из лунок с предыдущим покрытием (при условии, что инкубация длилась 30 минут или дольше).
- Аккуратно перемешайте клетки с помощью пипетки и добавьте 500 мкл клеточной суспензии в каждую лунку.
- Чтобы равномерно распределить клетки, перемещайте планшет большими движениями со знаком «+» мягкими линейными движениями (вперед-назад, стоп, назад-вперед) непосредственно перед помещением в инкубатор клеточных культур.
- Инкубируют в течение ночи (16-24 ч) при температуре 37 °C и 5%CO2.
- Удалите среду и добавьте титрованный лентивирус. Если требуются единичные события интеграции, стремитесь к кратности инфекции 0,3 инфекционных единиц на клетку (в идеале титровать на интересующих клетках) и дополнять до 500 мкл в среде (без Y-27632).
ПРИМЕЧАНИЕ: Интересующий лентивирус может быть приобретен предварительно титрованным или произведен на месте, как это делалось ранее22. Здесь для генерации и отбора NPC, экспрессирующих EGFP, был использован лентивирус GFP собственного производства с резистентностью к пуромицину. Если лентивирус не был титрован на интересующих клетках и число копий является критическим, рекомендуется добавить несколько объемов в пару лунок, а лунку с ~30% клеток EGFP+ через 48-72 ч использовать позже. Если число копий не является критическим, может быть добавлен лишний вирус с оговоркой, что инсерционный мутагенез может привести к аномальному поведению у некоторых клонов. ВНИМАНИЕ: Лентивирусные переносчики представляют собой биологическую опасность 2-3 уровня (в зависимости от их содержания). Соблюдайте местные правила биобезопасности при обращении с лентивирусом, обеззараживании поверхностей и пластиковой посуды, а также жидких отходов. - Верните клетки в инкубатор и инкубируйте их в течение 24 ч при 37 °C и 5% CO2.
- Извлеките клетки из инкубатора, и удалите надосадочную жидкость.
ВНИМАНИЕ: Поскольку надосадочная жидкость из клеток все еще содержит лентивирусные частицы, продолжайте соблюдать местные правила биобезопасности при обращении с ней и утилизации. - Промойте ячейки 2 x 500 мкл PBS, осторожно добавив PBS к стенке лунки; Затем выньте из угла колодца, чтобы смыть оставшийся лентивирус.
ВНИМАНИЕ: Поскольку надосадочная жидкость из клеток все еще содержит лентивирусные частицы, продолжайте соблюдать местные правила биобезопасности при обращении с ней и утилизации. - Перейдите на 500 мкл свежей среды (без Y-27632) и продолжайте расти при 37 °C и 5%CO2 в течение ночи.
- Используйте флуоресцентную микроскопию живых клеток, чтобы проверить долю клеток, экспрессирующих EGFP, и выбрать лунку, с которой нужно работать.
- Если лентивирусный вектор выбора содержит селекционную кассету (ген устойчивости к антибиотикам, такой как резистентность к пуромицину), добавьте селекционный агент (в данном случае 1 мкг/мл пуромицина) в среду в предварительно валидированной дозе, которая убивает чувствительные, но не резистентные клетки. В противном случае используйте флуоресцентно-активированную сортировку клеток, чтобы изолировать клетки EGFP+ во время первого расщепления.
- С этого момента поддерживайте ячейки с ежедневным мониторингом слияния и ежедневно выполняйте полную смену среды.
- Когда слияние будет достигнуто, подготовьте одну или несколько лунок из свежей 6-луночной пластины с покрытием (с 1 мл разбавленной солюбилизированной мембранной матрицы; см. шаги 1.3-1.5) и соберите клетки, как описано в шагах 1.6-1.15.
ПРИМЕЧАНИЕ: Если селекционный агент не включен, отсортируйте клетки методом проточной цитометрии на этом этапе. Убедитесь, что ячейки сортируются с достаточно широким соплом и низким давлением, чтобы свести к минимуму напряжение, а также что 10 мкМ Y-27632 включен на каждом этапе процесса сортировки. - Пластины ячеек довести до конечной плотности 200 000 клеток/см2.
- Поддерживайте ежедневный мониторинг и выполняйте ежедневную смену среды.
ПРИМЕЧАНИЕ: Когда ячейки снова достигают слияния, они готовы к использованию. Кроме того, запас теперь можно заморозить для использования в будущем следующим образом. - Разделите, соберите и подсчитайте клетки, как описано в шагах 1.6–1.15.
- Предварительно пометьте набор криовиалов соответствующей информацией (например, пассаж, EGFP%, линия).
- Ресуспенд при концентрации 400 000 клеток/мл в среде + 10% ДМСО.
ПРИМЕЧАНИЕ: ДМСО токсичен для клеток, если он не заморожен, поэтому сведите к минимуму время, проведенное при комнатной температуре в присутствии ДМСО. - Добавьте 1 мл (400 000 клеток) смеси с этапа 1,33 на криовиальную камеру и поместите в контейнер для замораживания клеток.
- Переложите контейнер в морозильную камеру с температурой −80 °C на ночь.
- На следующий день пересадите клетки в жидкий азот для длительного хранения.
2. Меченая инъекция клеток в органоид головного мозга
ПРИМЕЧАНИЕ: Для этой статьи церебральные органоиды были получены с использованием коммерческого набора в соответствии с инструкциями производителя. Его можно заменить интересующим его церебральным органоидом. Материалы, используемые в этой части протокола, должны быть предварительно охлаждены, чтобы избежать гелеобразования растворимой матрицы базальной мембраны при температуре выше 4 °C.
- Поместите инсулиновые шприцы, наконечники и трубки, которые будут контактировать с солюбилизированной матрицей базальной мембраны, при температуре −20 °C, чтобы дать им остыть.
- Разморозьте на льду аликвоту солюбилизированной матрицы базальной мембраны подходящего размера в зависимости от количества инъекций, которые будут выполнены (~2 мкл/инъекция). Это займет около 30 минут.
- Пока аликвота оттаивает, разделите, соберите и подсчитайте клетки, как описано в шагах 1.6-1.15.
- Рассчитайте объемы, необходимые для одной инъекции. Если вы делаете несколько инъекций, поместите общий объем клеток в пробирку объемом 1,5 мл и добавьте до 1 мл DMEM/F12.
ПРИМЕЧАНИЕ: Объем, который позволяет сделать несколько дополнительных инъекций, должен быть использован для учета потерь/ошибок пипетирования. - Поместите клетки в лед, пока готовятся следующие шаги.
- После размораживания растворимую матрицу базальной мембраны разбавляют до конечной концентрации 3 мг/мл в ледяном DMEM/F12.
- Возьмите одноячеистую суспензию изо льда и отжмите ее при 300 × г в течение 5 мин при 4 °C.
ПРИМЕЧАНИЕ: Если охлаждаемая центрифуга недоступна, отжим при комнатной температуре, как правило, допускается. - Осторожно удалите среду полностью, не повредив гранулы ячеек. Ресуспендируйте клеточную гранулу путем осторожного пипетирования в разбавленном растворимом матриксе базальной мембраны (3 мг/мл) для получения окончательного объема 2 мкл на одну выполняемую инъекцию, и немедленно поместите ее обратно на лед до использования.
ПРИМЕЧАНИЕ: Ресуспендирование клеток необходимо выполнять медленно и с предварительно охлажденными наконечниками, чтобы избежать образования пузырьков и гелеобразования. - Переложите предварительно охлажденный шприц (шприцы) из морозильной камеры с температурой −20 °C в ведерко со льдом. Храните их там до использования.
- Извлеките пластину с органоидами мозга из инкубатора. Используйте широкоствольный наконечник, чтобы перенести органоид для инъекции в чашку диаметром 35 мм. Удалить всю среду можно, не повреждая органоид, чтобы стабилизировать его и облегчить инъекцию.
ПРИМЕЧАНИЕ: Важно использовать широкоствольные наконечники, чтобы избежать разрушения органоида. Если их нет, отрежьте конец обычного наконечника P1,000 стерильными ножницами. - Поместите 35-миллиметровую чашку, содержащую органоид, под препарирующий микроскоп, чтобы помочь направить и облегчить инъекцию.
ПРИМЕЧАНИЕ: Если препарирующий микроскоп недоступен в стерильной зоне, можно выполнить инъекцию без него, хотя и с несколько ослабленным контролем. Другой альтернативой является использование лупы или стекол. - После того, как органоид(ы) будут готовы к введению, осторожно ресуспендируйте клетки с помощью охлажденного наконечника пипетки P20 и переместите 2 мкл (содержащих желаемое количество клеток для введения) на предварительно охлажденный стерильный стеклянный предметный стеклянный предмет.
ПРИМЕЧАНИЕ: Для многократных инъекций можно добавить дополнительные объемы 2 мкл на предметное стекло. Держите его на льду и следите за тем, чтобы избежать испарения. - Возьмите со льда предварительно охлажденный инсулиновый шприц и медленно наберите 2 мкл клеточной суспензии скосом иглы вниз, чтобы все клетки/среда могли впитаться.
ПРИМЕЧАНИЕ: Двигайтесь очень медленно, чтобы не втягивать воздух. - Откройте крышку чашки, содержащей органоид, и сфокусируйте на ней микроскоп. Держите блюдо одной рукой. Поместите скос иглы вверх, а другой рукой медленно вводите клетки в поверхность органоида.
ПРИМЕЧАНИЕ: Важно вводить медленно, чтобы не повредить ткани. - После инъекции поместите крышку обратно в чашку и оставьте введенный органоид на 1-2 минуты.
ПРИМЕЧАНИЕ: Это позволяет разбавленному солюбилизированному матрице базальной мембраны гелеобразуя, удерживая клетки на месте. Если средство добавить слишком рано, оно может смыть клетки, находящиеся на поверхности. - Осторожно добавьте 500 мкл органоидной среды и перенесите органоид с широкоствольным наконечником в лунку 24-луночного планшета. Инкубируйте органоид при температуре 37 °C и 5%CO2 в течение ночи. Выполняйте полную смену среды через день.
ПРИМЕЧАНИЕ: Важно включить органоид отрицательного контроля (имитация инъекции), который будет использоваться для корректировки визуализации. Для этого вводят органоид, как описано выше, с разбавленным солюбилизированным матрицей базальной мембраны (3 мг/мл) до получения конечного объема 2 мкл без клеток.
3. Отслеживание трансплантата с помощью флуоресцентной визуализации живых клеток
ПРИМЕЧАНИЕ: Используйте флуоресцентный микроскоп, который может возбуждать интересующий флуорофор и имеет набор фильтров, необходимых для обнаружения его флуоресценции. Как упоминалось ранее, NPC, используемые здесь, были EGFP+, с пиком возбуждения 488 нм и пиком излучения ~510 нм.
- Загрузите органоид с отрицательным контролем (неинжектированный или фиктивный инжектированный) и установите интенсивность освещения и время экспозиции таким образом, чтобы автофлуоресценция была минимальной. Для используемого здесь прибора интенсивность освещения была установлена в диапазоне от 1 до 2, а время экспозиции — от 80 мс до 100 мс.
ПРИМЕЧАНИЕ: Поскольку многие длины волн возбуждения (особенно более низкие длины волн) могут быть токсичными для клеток, рекомендуется поддерживать низкую интенсивность и избегать слишком долгого поиска, чтобы предотвратить повреждение органоида. - Загрузите органоид положительного контроля и при необходимости увеличьте время экспозиции, чтобы меченые клетки были хорошо видны. Переместите органоид с помощью наконечника пипетки с широким отверстием, чтобы найти место инъекции (область EGFP+ ).
- Полностью удалите среду из органоида отрицательного контроля. Загрузите органоид отрицательного управления и изобразите его с выбранными настройками (для используемого здесь прибора интенсивность освещения была установлена в диапазоне от 1 до 2, а время экспозиции — от 80 мс до 100 мс). Когда визуализация будет завершена, немедленно добавьте свежую среду, чтобы предотвратить высыхание органоида.
ПРИМЕЧАНИЕ: Удаление среды имеет решающее значение для получения хорошего изображения, поскольку оно фиксирует высоту и ориентацию органоидов, которые в противном случае плавают и постоянно движутся, что исключает получение высококачественной визуализации. - Повторите удаление среды/визуализацию с каждым из исследуемых органоидов.
- Верните органоиды к нормальной инкубации/смене среды (как на шаге 2.16) и повторите визуализацию через желаемые промежутки времени. Здесь органоиды были визуализированы на 1-й, 9-й и 16-й неделях после инъекции, чтобы проследить и проверить выживаемость, пролиферацию, дифференцировку и миграцию введенных NPC EGFP+ .
4. Гистология и иммунофлюоресценция
- В конечной точке перенесите органоид в гистологическую кассету, помеченную идентификатором органоида и другими необходимыми идентификаторами.
- Наполните кассету 10%-ным формалином и закройте ее. Выдержать при комнатной температуре 24 часа.
- Перенесите закрытую кассету с органоидом в тканевой отросток и установите следующий протокол: этанол 70% 10 мин, этанол 80% 20 мин, этанол 95% 30 мин, этанол 100% 30 мин, этанол 100% 40 мин, этанол 100% 50 мин, толуол 30 мин, толуол 40 мин, толуол 50 мин, парафин 25 мин при 59 °C, парафин 35 мин при 59 °C, парафин 40 мин при 59 °С, парафин 50 мин при 59 °С.
ПРИМЕЧАНИЕ: Вышеуказанные шаги выполняются в вакууме при комнатной температуре, если не указано иное. Этот протокол заменяет воду градиентами спирта до 100%. Промежуточной стадией с толуолом является переход между спиртом и парафином, так как оба растворимы в нем. ВНИМАНИЕ: Толуол и парафин считаются опасными материалами, поскольку они могут быть легковоспламеняющимися жидкостями и могут вызвать повреждение при вдыхании или контакте с кожей или глазами. Храните их плотно закрытыми в надежном месте. При обращении с ними надевайте надлежащие средства индивидуальной защиты. Утилизируйте отходы в соответствии с местными правилами химической опасности. - Закрытую кассету с органоидом переложить в парафиновую ванну на закладную станцию.
- Возьмите кассету из ванны, откройте ее и перенесите органоид в стальную базовую форму. Поставьте форму под дозатор парафина, и полностью покройте ее парафином.
- Поместите пустую кассету на верхнюю часть формы со стальным основанием. Здесь добавьте еще парафина поверх кассеты.
- Переложите форму со стальным основанием с кассетой сверху на лед и дайте ей остыть в течение 5 минут. Снимите стальную форму, а кассету с органоидом вложите в парафиновый блок.
- Перенесите кассету в микротом, чтобы вырезать срезы. Отрежьте секции по желанию.
ПРИМЕЧАНИЕ: Здесь были сделаны срезы толщиной 15 мкм по всему органоиду. - Опустите каждую секцию на поверхность водяной бани, установленной при температуре 45 °C, и возьмите ее на предметное стекло микроскопа.
- Дайте предметным стеклам высохнуть в инкубаторе при температуре 42 °C в течение ночи.
ПРИМЕЧАНИЕ: Теперь предметные стекла можно хранить при комнатной температуре до момента окрашивания. - Поместите предметное стекло в банку для окрашивания предметных стекол Coplin, наполненную толуолом, на 2 минуты. Повторите этот шаг еще раз.
ВНИМАНИЕ: Толуол считается опасным материалом, так как он может быть легковоспламеняющейся жидкостью и может вызвать повреждение при вдыхании или контакте с кожей или глазами. Храните его плотно закрытым в надежном месте. При обращении с ним надевайте надлежащие средства индивидуальной защиты. Утилизируйте отходы в соответствии с местными правилами химической опасности. - Переложите в стеклянную банку для окрашивания Coplin, наполненную EtOH на 100%, на 2 минуты. Повторите этот шаг еще раз.
- Переложите в стеклянную банку для окрашивания Coplin, наполненную дистиллированной водой, на 2 минуты. Повторите этот шаг еще раз.
- Для получения антигена приготовьте цитратный буфер (10 мМ лимонной кислоты, 0,05% Tween 20, pH 6,0).
ПРИМЕЧАНИЕ: Цитратный буфер можно хранить при комнатной температуре до 3 месяцев или при 4 °C для более длительного хранения. - Установите водяную баню при температуре от 95 °C до 100 °C.
ВНИМАНИЕ: Эта водяная баня может вызвать ожоги, если не соблюдать осторожность. Примите все необходимые меры предосторожности, чтобы избежать прямого контакта с ванной или ее компонентами. - На водяной бане всплывите пластиковый контейнер, в который могут поместиться горки. Убедитесь, что пластик не касается дна ванны (при условии, что это ванна с подогревом дна), чтобы избежать расплавления. Залейте цитратный буфер внутрь пластикового контейнера и дайте ему нагреться до 95-100 °C.
- Как только буфер достигнет желаемой температуры, поместите предметные стекла внутрь буфера и неплотно накройте контейнер крышкой. Оставьте горки внутри контейнера на водяной бане на 30-40 минут.
- Снимите пластиковый контейнер с водяной бани и дайте ему остыть при комнатной температуре еще 20 минут.
- Промойте предметные стекла в течение 3 x 2 мин с помощью PBS. Удалите PBS бумажной салфеткой, не прикасаясь к образцу и не пересушивая его.
- Приготовьте буфер для пермеабилизации (90 мл PBS + 0,1% Tween-20) и наполните им банку для окрашивания предметных стекол. Погрузите предметные стекла в буфер проницаемости и инкубируйте в течение 10 минут.
- Промойте предметные стекла в течение 3 x 2 мин с помощью PBS.
- Приготовьте достаточное количество смеси для окрашивания, чтобы покрыть каждый образец (~25 мкл).
ПРИМЕЧАНИЕ: Антитела и конечные концентрации, используемые здесь, см. в таблице 1 . - Добавьте 25 мкл красящей смеси, чтобы покрыть каждый срез органоида. Инкубируют при комнатной температуре в течение 1 ч или в течение ночи при 4 °C в темноте.
ПРИМЕЧАНИЕ: Убедитесь, что образцы остаются при высокой влажности, чтобы предотвратить испарение красящей смеси. Если контейнер для поддержания горки во влажном состоянии недоступен, поместите их в коробку с влажными салфетками в углу. - Промойте предметные стекла в течение 3 x 2 мин с помощью PBS.
- Промойте один раз дистиллированной водой внутри стеклянной банки для окрашивания предметных стекол, чтобы удалить соль.
- Добавьте 10 мкл жидкого монтанта + 4',6-диамидино-2-фенилиндол (DAPI) в каждый из образцов.
ПРИМЕЧАНИЕ: Предметные стекла могут быть запечатаны, если не будет выполнен второй раунд окрашивания. В данном случае предметные стекла не были закрыты, чтобы обеспечить доступ для закалки/повторного окрашивания, так как удаление покровного стекла может повредить ткань. - Визуализируйте предметные стекла с помощью выбранного флуоресцентного микроскопа.
ПРИМЕЧАНИЕ: Убедитесь, что у каждого антитела есть положительный и отрицательный контроль, чтобы обеспечить надлежащую настройку интенсивности и времени экспозиции (для используемого здесь прибора интенсивность освещения была установлена в диапазоне от 5 до 6, а время экспозиции от 2000 мс до 3000 мс), хотя это может варьироваться в зависимости от антитела. Кроме того, убедитесь, что микроскоп оснащен соответствующими детекторами для каждого используемого канала. Имейте в виду, что, поскольку образцы не покрыты, их необходимо размещать лицевой стороной вверх во время визуализации. - После визуализации приготовьте свежий 2-кратный закалочный буфер (9%H2O2 + 50 мМ NaOH в PBS).
ПРИМЕЧАНИЕ: Закалочный раствор должен быть приготовлен свежим непосредственно перед его использованием. Реакция чувствительна к активностиН2О2, которая со временем будет снижаться. ВНИМАНИЕ:H2O2 является раздражителем, а NaOH едким. Их следует лечить с помощью соответствующего защитного оборудования и избегать контакта с кожей. Убедитесь, что они утилизируются в соответствии с местными правилами химической безопасности. - Наполните стеклянную банку для окрашивания предметных стекол Coplin наполовину буфером для закалки (45 мл), добавьте 45 мл PBS и поместите предметные стекла внутрь. Инкубировать в течение ночи при температуре 4 °C.
- С помощью флуоресцентной микроскопии проверяют, что флуорофоры были эффективно погашены.
- Повторите окрашивание и визуализацию, как описано выше.
ПРИМЕЧАНИЕ: Закалка и повторное окрашивание могут быть повторены для дополнительных раундов по мере необходимости, хотя риск повреждения увеличивается с каждым дополнительным раундом.
5. Регистрация изображения
- Откройте ФИДЖИ.
- Создайте папку с изображениями DAPI из раунда 1 и раунда 2. При необходимости измените имена, чтобы уточнить, что есть что.
- Сделайте пустую папку для вывода изображения регистрации.
- Нажмите на Плагины | Регистрация | Зарегистрируйте виртуальные срезы стека.
- В разделе Source directory (Исходный каталог) выберите папку, содержащую DAPI-образы из каждого раунда.
- В разделе Output directory (Каталог вывода) выберите папку, предназначенную для вывода регистрации.
- Установите для параметра Модель извлечения элементов (Feature extraction model ) значение Жесткая (Rig ), а для ниспадающего меню Модель регистрации (Registration model) – Rigid - translate+rotate (Жесткий) - переместить+повернуть , чтобы исправить регистрацию, позволив перемещать и поворачивать изображение только для выравнивания, а не для деформации.
ПРИМЕЧАНИЕ: Если ожидается деформация, модель извлечения признаков и модель регистрации могут быть скорректированы на Affine или другие модели по желанию, хотя это может привести к нежелательным преобразованиям. Иногда между раундами может быть поврежден срез, что может помешать успешной регистрации. - Установите флажок Сохранить преобразования , чтобы сохранить параметры трансформации и применить их к другим каналам.
- Нажмите кнопку ОК.
- Выберите место для сохранения файла преобразования (по умолчанию входной каталог) и нажмите кнопку Открыть.
- Выберите изображение DAPI, которое будет служить эталоном для преобразований. Изображение DAPI из каждого из других раундов будет выровнено по этому раунду.
ПРИМЕЧАНИЕ: После завершения зарегистрированные изображения появятся в виде стопки (и в выходной папке). - Используйте ползунок в нижней части изображения, чтобы переключаться между изображениями, чтобы убедиться, что регистрация изображения прошла успешно (ядра находятся в одном и том же месте на обоих изображениях, по крайней мере, для перекрывающихся областей).
- Убедитесь, что для каждого раунда входных изображений создан .xml файл.
ПРИМЕЧАНИЕ: Они содержат параметры перевода, необходимые для файлов из этого раунда. - Создайте папку, содержащую все изображения, которые нужно зарегистрировать (каждый канал каждого раунда). Обратите внимание на порядок файлов.
- Создайте папку для параметров трансформации и сделайте одну копию .xml файла для каждого раунда для каждого регистрируемого канала. Убедитесь, что порядок файлов (по имени) одинаков между регистрируемыми изображениями и копиями параметров преобразования, так как на следующем шаге каждое изображение будет преобразовано в порядке файлов параметров преобразования.
- Нажмите на Плагины | Трансформация | Преобразование срезов виртуального стека.
- В разделе Source directory (Исходный каталог) выберите папку, содержащую образы для регистрации.
- В разделе Output directory (Каталог вывода) выберите папку, предназначенную для вывода регистрации.
- В разделе Transforms directory выберите папку, содержащую .xml файлов с одной копией для каждого файла изображения, который необходимо преобразовать. Опять же, убедитесь, что порядок соответствует файлам (т.е. одна копия .xml раунда 1 для каждого канала раунда 1, одна копия .xml раунда 2 для каждого канала раунда 2 и т. д.).
- Нажмите кнопку ОК.
ПРИМЕЧАНИЕ: После завершения зарегистрированные изображения из этого раунда появятся в виде стопки (и в выходной папке). - Используйте ползунок в нижней части экрана, чтобы переключаться между каналами. Убедитесь, что все каналы были преобразованы одинаково. Если нет, то, скорее всего, это связано с неправильным файлом .xml в каталоге transforms; В этом случае исправьте файл и повторите.
ПРИМЕЧАНИЕ: Отображаемый диапазон яркости будет основан на одном канале, но это не повлияет на фактические сохраненные изображения, а только на дисплей. - Обратите внимание, что все зарегистрированные изображения успешно выровнены по раундам и готовы к наложению/последующему анализу.
ПРИМЕЧАНИЕ: Существуют более эффективные программные способы регистрации для больших пакетов. Представленный здесь метод является простым, не требующим программирования.
Результаты
Для подтверждения идентичности церебральных органоидов гистологические срезы зрелого (2-месячного) церебрального органоида были окрашены на PAX6 (маркер дорсальных NPC23) и SATB2 (маркер зрелых постмитотических нейронов верхнего слоя24). Как и ожидалось, клетки PAX6+ присутствовали внутри органоида, а клетки SATB2+ присутствовали в верхних слоях (рис. 2). Эти результаты подтверждают, что использованные церебральные органоиды действительно были дорсальными передним мозгом, как указано в наборе для дифференцировки. Для установления дозозависимости системы церебральной органоидной трансплантации церебральным органоидам 2-месячным органоидам вводили все большее количество EGFP+ ИПСК, полученных из ИПСК. Была выявлена четкая дозозависимая зависимость флуоресценции GFP от количества входных клеток с последовательным обнаружением клеточного пятна EGFP+ на 10 000 клеток и выше (рис. 3). Постоянство и миграция трансплантированных NPC были оценены путем наблюдения за трансплантированными органоидами с течением времени. Для этого 50 000 EGFP+ NPC, полученных из iPSC, были пересажены в 2-3-месячные церебральные органоиды, полученные из той же линии iPSC. Введенные органоиды и контрольная группа были визуализированы на предмет положительного результата EGFP в указанные моменты времени в течение следующих 3-4 месяцев. В этой серии трансплантаций мы наблюдали персистенцию места инъекции в течение 4-месячного периода отслеживания (рис. 4A). Дополнительные клеточные участки EGFP+ появились через 9 дней после трансплантации и сохранялись до конечной точки исследования (3-4 месяца в зависимости от органоида), что указывает на миграцию клеток и интеграцию в их новых участках (рис. 4А). При большем увеличении наблюдалась четкая морфология нейронов с длинными проекциями в органоид (рис. 4B), что подтверждает интеграцию введенных клеток.
Для определения статуса дифференцировки введенных клеток на поздних стадиях после инъекции отслеживаемый органоид в течение 4 месяцев и его контроль фиксировали, внедряли парафином, нарезали на ломтики толщиной 15 мкм и устанавливали на предметные стекла. Затем срезы обрабатывали и окрашивали либо в одном цикле флуоресцентного окрашивания (EGFP, TUJ1, NESTIN), либо в течение двух последовательных циклов окрашивания для добавления дополнительных маркеров (MAP2, GFAP). Первоначальное окрашивание подтвердило наличие клеток EGFP+ в месте инъекции, включая смесь клеток, сохраняющих статус NPC (NESTIN+TUJ1−), и клеток, дифференцировавшихся в сторону нейронной судьбы (NESTIN−TUJ1+) (рис. 5). Как для контрольных, так и для инъецированных органоидов наблюдалось очень мало НПК NESTIN+ (большинство, хотя и не все, были EGFP+ трансплантированными NPC в месте инъекции), с большинством незрело-зрелых нейронов TUJ1+ (рис. 5). Двухраундовое окрашивание дало более детальное изображение, выявив зрелые нейроны (NESTIN−TUJ1+MAP2+GFAP−) вокруг большей части внешней области органоида, с участками незрелых (NESTIN−TUJ1+MAP2−GFAP−) нейронов ближе к середине (рис. 6A,B). Астроциты (NESTIN−TUJ1−MAP2−GFAP+) присутствовали как в инъецированных, так и в контрольных органоидах и были вкраплены по внешним краям (рис. 6A,B). Срез, для которого было выполнено двухраундовое окрашивание во введенном органоиде, показал небольшую колонию клеток-сателлитов EGFP+ вдали от места инъекции, которые приняли фенотип зрелых нейронов (рис. 6B, C). Некоторые из них, по-видимому, находились в непосредственной близости от астроцитов; однако не было обнаружено клеток EGFP+ с полным перекрытием окрашивания GFAP, что позволяет предположить, что они были рядом, а не генерировали сами астроциты (рис. 6B, C).
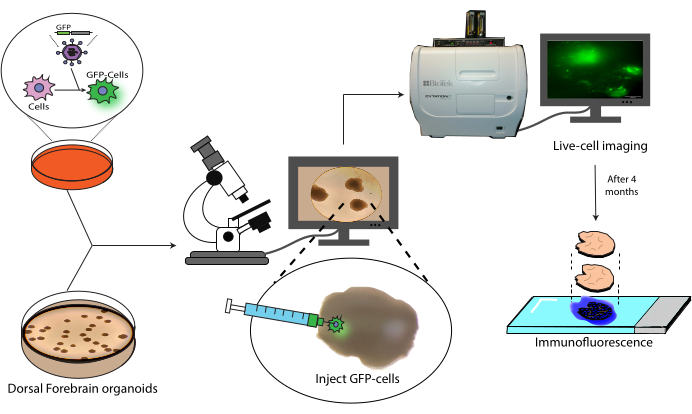
Рисунок 1: Модель трансплантации меченых клеток в церебральные органоиды. Схематический обзор генерации меченых клеток с помощью лентивирусной трансдукции, их трансплантации в церебральные органоиды и отслеживания с помощью визуализации живых клеток и иммунофлуоресценции. Аббревиатура: GFP = зеленый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
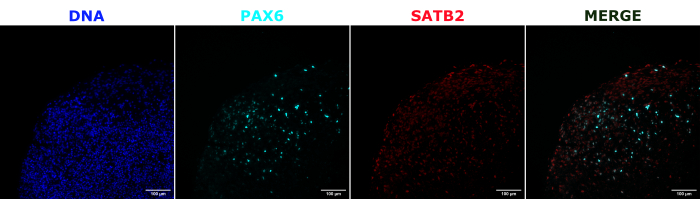
Рисунок 2: Иммунофлуоресценция гистологических срезов, показывающая архитектуру ранних и поздних органоидов. Церебральный органоид 2-месячного возраста был зафиксирован, введен парафином, разрезан и окрашен PAX6, SATB2 и DAPI. Неокрашенный участок был использован для установки времени экспозиции и интегрирования, чтобы избежать ложноположительного сигнала от автофлуоресценции. Клетки PAX6+ присутствовали внутри органоида, в то время как клетки SATB2+ присутствовали в верхних слоях. Изображения Z-стека делались каждые 4,2 мкм по всему 15-мкм срезу ткани. Оптические секции были объединены с помощью опции фокус-стекинга в программном обеспечении Gen5 с опциями по умолчанию. Масштабные линейки = 100 мкм. Сокращения: PAX6 = парный белок box 6; SATB2 = специальный АТ-богатый белок, связывающий последовательности 2; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
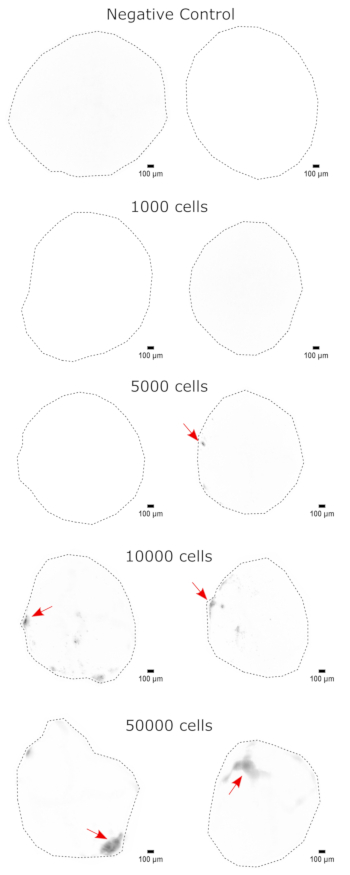
Рисунок 3: Дозозависимое приживление НПК в церебральные органоиды. Органоиды трансплантировали с 0 (отрицательный контроль), 1 000, 5 000, 10 000 или 50 000 GFP+ NPC, полученных из iPSC. Через 1 неделю после трансплантации органоиды визуализировали на Cytation 5 с фильтрующим кубом GFP. Отрицательный контроль использовался для установки времени экспозиции и интегрирования для минимизации автофлуоресценции. Более темные цвета указывают на большую флуоресценцию EGFP по сравнению с отрицательным контролем. Масштабные линейки = 100 мкм. Это 4-кратные изображения целых органоидов. После визуализации перед отображением выполнялось вычитание фона с радиусом 50 пикселей для коррекции переменной интенсивности фона на органоидах. Места инъекций, определенные как области наибольшего приживления, обозначаются красной стрелкой, где приживление присутствовало. Аббревиатуры: NPC = нейронные клетки-предшественники; GFP = зеленый флуоресцентный белок; EGFP = расширенный GFP; ИПСК = индуцированная плюрипотентная стволовая клетка. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
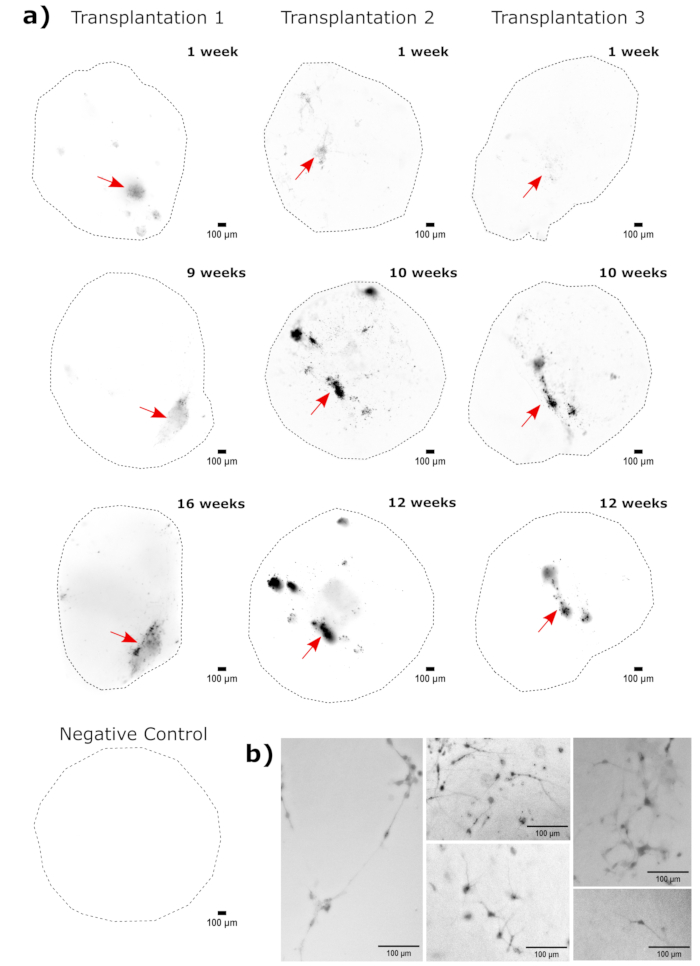
Рисунок 4: Отслеживание роста, миграции и персистенции трансплантированных клеток с помощью флуоресцентной визуализации живых клеток. (А) Контрольные и трансплантированные (50 000 НПСК, полученных из ИПСК GFP+ ) органоиды проводили флуоресцентную визуализацию живых клеток в течение 2-4 месяцев из двух независимых наборов трансплантатов. Органоиды с отрицательным контролем использовались для установки времени экспозиции и интегрирования, чтобы свести к минимуму автофлуоресценцию в каждый момент времени. Изображения EGFP были получены с помощью фильтрующего куба GFP на Cytation 5 в указанное время после трансплантации. Более темные цвета указывают на большую флуоресценцию EGFP по сравнению с отрицательным контролем для этого момента времени. Перед отображением было выполнено вычитание фона с радиусом 50 пикселей для коррекции переменной интенсивности фона на органоидах. Органоиды были размещены примерно в одной и той же ориентации в каждый момент времени, а изображения были повернуты для единообразия дисплея и четкого отображения роста трансплантированных клеток. Места инъекций, определенные как области наибольшего приживления в самый ранний момент времени, обозначены красной стрелкой. Пример органоида отрицательного контроля показан в нижней части рисунка. (B) Пример 20-кратного изображения показаны с привитых органоидов на 1-й и 15-й неделях после трансплантации. Локальный контраст был усилен перед отображением с использованием FIJI для обеспечения видимости нейритов. Масштабные линейки = 100 мкм. Аббревиатуры: NPC = нейронные клетки-предшественники; GFP = зеленый флуоресцентный белок; EGFP = расширенный GFP; ИПСК = индуцированная плюрипотентная стволовая клетка. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
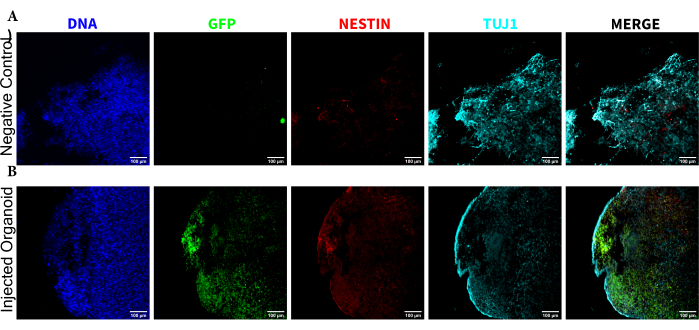
Рисунок 5: Иммунофлуоресценция гистологических срезов, выявляющая персистенцию трансплантированных НПК в месте инъекции наряду с миграцией и дифференцировкой нейронов. Одноканальные флуоресцентные изображения (А) неинъекционных и (Б) трансплантированных органоидов. На наложенном изображении справа показаны три интересующих канала (NESTIN, TUJ1 и EGFP), но DAPI не включен. Минимумы дисплея были установлены таким образом, чтобы просто исключить сигнал из отрицательных ячеек (определяемых для EGFP из неинжектированного контроля и для других каналов на основе известных комбинаций маркеров). Максимумы показа были основаны на самом высоком сигнале, наблюдаемом для этого антитела в любой клетке. Диапазоны отображения между неинъецированными и трансплантированными органоидами оставались постоянными, чтобы обеспечить прямое сравнение. Масштабные линейки = 100 мкм. Аббревиатуры: NPC = нейронные клетки-предшественники; DAPI = 4',6-диамидино-2-фенилиндол; TUJ1 = бета-III тубулин; EGFP = усиленный зеленый флуоресцентный белок. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
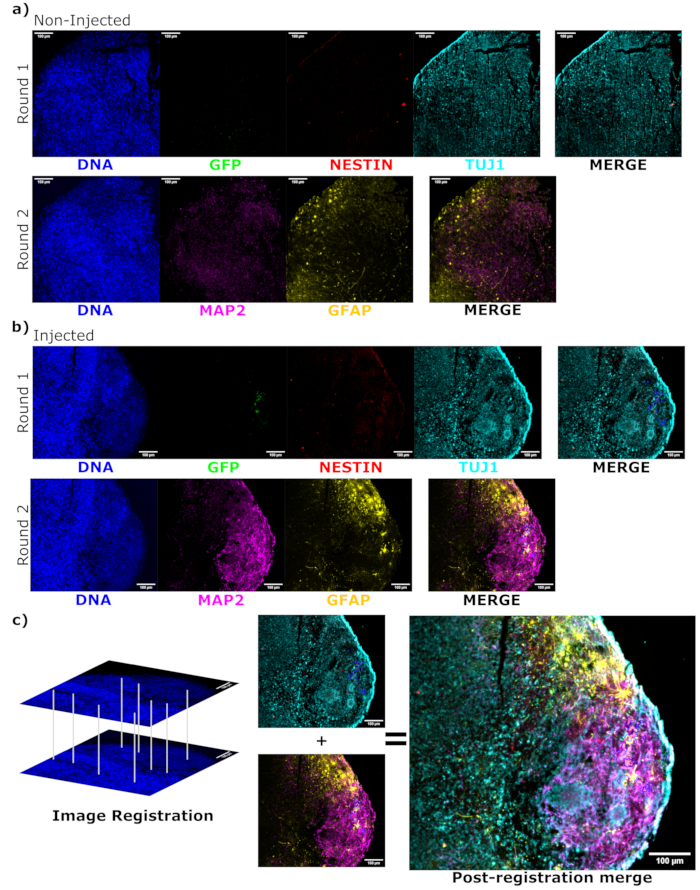
Рисунок 6: Оценка состояния и локализации дифференцировки привитых клеток с помощью циклической иммунофлуоресценции гистологических срезов. Одноканальные флуоресцентные изображения неинъецированных, (А) соответствующих по возрасту и (Б) трансплантированных органоидов показаны для первого и второго раунда окрашивания, как показано. Минимумы дисплея были установлены таким образом, чтобы просто исключить сигнал из отрицательных ячеек (определяемых для EGFP из неинжектированного контроля и для других каналов на основе известных комбинаций маркеров). Максимумы показа были основаны на самом высоком сигнале, наблюдаемом для этого антитела в любой клетке. Диапазоны отображения (и, конечно же, параметры визуализации) поддерживались постоянными между контрольной группой и введенными органоидами, чтобы обеспечить прямое сравнение. Масштабные линейки = 100 мкм. Наложенное изображение (за исключением DAPI) показано для каждого раунда окрашивания для каждого органоида справа. (B) Для инъецированного органоида, в котором была выполнена регистрация изображения, все изображения обрезаются до области, наблюдаемой в обоих раундах окрашивания. (В,В) Для введенного органоида участки клеток EGFP+ обведены синим цветом. На рисунке (C) показана диаграмма того, как DAPI используется для сопоставления объектов во время регистрации изображения, за которой следует общее слияние зарегистрированного образа. Сокращения: DAPI = 4',6-диамидино-2-фенилиндол; TUJ1 = бета-III тубулин; EGFP = усиленный зеленый флуоресцентный белок; MAP2 = белок, ассоциированный с микротрубочками 2; GFAP = глиальный фибриллярный кислый белок. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Клон | Флуорофор | Концентрация | |
| Анти-НЕСТИН | 10С2 | АлексаФлуор 594 | 1 из 2 000 |
| Анти-ТУББ3 | ТУДЖ1 | АлексаФлуор 647 | 1 из 2 000 |
| Анти-GFP | ФМ264Г | АлексаФлуор 488 | 1 из 200 |
| Анти-GFAP | СМИ 25 | АлексаФлуор 594 | 1 из 500 |
| Анти-MAP2 | СМИ 52 | АлексаФлуор 488 | 1 из 1 000 |
| Анти-PAX6 | О18-1330 | АлексаФлуор 647 | 1 из 100 |
| Защита от SATB2 | EPNCIR130A | АлексаФлуор 594 | 1 из 500 |
Таблица 1: Концентрации антител для окрашивания. Сокращения: TUBB3 = бета-тубулин III; GFP = зеленый флуоресцентный белок; GFAP = глиальный фибриллярный кислый белок; MAP2 = белок, ассоциированный с микротрубочками 2; PAX6 = парный белок box 6; SATB2 = специальный AT-богатый последовательность белок 2.
Обсуждение
Учитывая значительный интерес к клеточным терапевтическим подходам для лечения повреждений ЦНС/нейродегенеративных расстройств 1,2,3,4,5,6,7,8, модели функционирования клеток в условиях трансплантации приобретают все большее значение. В данной работе представлен метод трансплантации меченых человеческих NPC в церебральные органоиды человека, а также отслеживание их живых клеток и оценка конечной точки с помощью гистологии и иммунофлуоресцентного окрашивания. Важно отметить, что мы показали, что трансплантированные клетки способны к миграции, дифференцировке и длительной (4 месяца) персистенции в органоидной среде. Такая долговременная персистентность заметно превышает поддерживаемость культур срезов мозга17. Таким образом, эта система подходит для изучения многих моделей поведения, которые необходимо было бы оценить в потенциальной терапевтической обстановке, таких как выживаемость, пролиферация и дифференциация. Действительно, ортогональное исследование недавно продемонстрировало, что трансплантированные NPC ведут себя одинаково в церебральных органоидах по сравнению с NPC, трансплантированными в мозг мышей NSG20, тем самым подтверждая полезность органоидов в качестве реципиента трансплантата. Поскольку это система in vitro, в нее также легко добавлять интересующие вас цитокины или препараты. Это может быть использовано для лучшего понимания воздействия специфических сред, таких как воспаление и иммунодепрессанты, на трансплантированные клетки, чтобы в дальнейшем имитировать то, с чем они могут столкнуться в терапевтических условиях. Протокол циклической иммунофлюоресценции, который мы продемонстрировали (на основе предыдущего исследования21), еще больше расширяет возможности этого подхода, позволяя одновременно оценивать широкий спектр линейных и, возможно, специфических маркеров заболевания в одном срезе и, таким образом, позволяя точно отслеживать трансплантированные клетки и их влияние на ткани. Конечно, вместо этого можно использовать другие методы оценки конечных точек в зависимости от целей анализа. Например, очищение тканей с помощью 3D-реконструкции может быть использовано, если морфология клеток представляет первостепенный интерес, или диссоциация с последующей проточной цитометрией, если конечной целью является количественная оценка конкретных типов клеток. Мы ожидаем, что этот метод будет легко распространяться на другие типы клеток, такие как опухоли ЦНС, что потенциально позволит изучать их в микроэкологическом контексте. Аналогичным образом, органоиды, используемые в качестве реципиентов, могут быть заменены на органоиды модели болезни 25,26,27, что потенциально позволяет моделировать подходы к трансплантации для этих состояний.
Как и у всех моделей, у представленной здесь тоже есть свои ограничения. Во-первых, органоиды, полученные из ИПСК, являютсянезрелыми и, таким образом, имеют важные отличия по сравнению со стареющим мозгом, в котором проявляются многие нейродегенеративные заболевания. Церебральные органоиды также неоднородны в своем развитии19, что исключает последовательное введение в одну и ту же физиологическую нишу. Более того, несмотря на то, что они содержат типы клеток соответствующих областей мозга18,19, в них отсутствуют эндотелиальные, микроглиальные и иммунные компоненты, которые также важны в условиях in vivo 14. Это ограничивает изучение того, как хозяин будет реагировать на трансплантацию клеток. В настоящее время появляются методы добавления сосудистых28 и микроглиальных29 клеток, а также для повышения органоидной консистенции и регионализации18, тем самым улучшая моделирующую способность системы органоидной трансплантации. Тем не менее, они потребуют дальнейшего тестирования и оптимизации, помимо того, что представлено здесь. Несмотря на то, что этот протокол является недорогим и не требует специального оборудования, остается ряд важных технических соображений, таких как глубина впрыска, например. Это связано как с тем, что органоиды не перфузируются и, таким образом, часто имеют некротический центр, если они становятсяслишком большими, так и с тем, что свет не может проникнуть через органоидное ядро для отслеживания живых клеток. Таким образом, клетки, которые были введены слишком глубоко, и колонии, которые мигрировали внутрь, могут быть пропущены. Хотя это может быть улучшено за счет использования более длинноволновых флуорофоров с лучшей проникающей способностью тканей30, в зависимости от размера органоида и аппарата обнаружения, это, вероятно, останется рассмотрением. Наконец, поскольку органоиды головного мозга находятся в стадии развития, время трансплантации является еще одним ключевым фактором, поскольку окружающая среда, вероятно, будет отличаться в зависимости от стадии развития органоида, в который он вводится. Хотя это можно в некоторой степени контролировать, обеспечивая постоянный органоидный возраст во время инъекции, это, без сомнения, фактор, который необходимо учитывать.
Этот протокол недорогой, простой, не требует использования на животных и не требует специализированного оборудования, что делает моделирование трансплантации доступным для более широкого круга лабораторий. Учитывая быстрые темпы развития как в области терапии нервных клеток, так и в системах моделей органоидов, мы ожидаем, что протокол трансплантации органоидов, представленный здесь, станет полезной моделью для целого ряда заболеваний и терапевтических подходов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Средства на эту работу были предоставлены через благотворительные фонды IRIC из фонда Марселя и Жана Куту и из Fonds de recherche du Québec - Santé (FRQS #295647). D.J.H.F.K. получает зарплатную поддержку от FRQS в виде стипендии Chercheurs-boursiers Junior 1 (#283502). M.I.I.R. был поддержан докторской премией IRIC от Института исследований в области иммунологии и рака, Bourse de passage accélère de la maitrise au doctorat от Монреальского университета и Bourse de Mérite aux cycles supérieurs.
Материалы
| Name | Company | Catalog Number | Comments |
| Accutase | StemCell Technologies | 7920 | proteolytic-collagenolytic enzyme mix |
| Alexa Fluor 488 anti-GFP Antibody | BioLegend | 338008 | |
| Alexa Fluor 488 anti-MAP2 (clone SMI 52) | BioLegend | 801804 | |
| Alexa Fluor 594 anti-GFAP Antibody (clone SMI 25) | BioLegend | 837510 | |
| Alexa Fluor 594 anti-Nestin (clone 10C2) | BioLegend | 656804 | |
| Alexa Fluor 647 anti-Tubulin β 3 (TUBB3) (clone TUJ1) | BioLegend | 801209 | |
| Citric Acid Monohydrate | Fisher Chemical | A104-500 | |
| Cytation 5 Cell Imaging Multimode Reader | Biotek | - | |
| Denaturated Ethyl Alcohol (Anhydrous) | ChapTec | - | |
| DMEM F12/Glutamax | Thermo | 10565018 | |
| Dymethil Sulfoxide (DMSO), Sterile | BioShop | DMS666.100 | |
| FIJI 1.53c | - | - | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501128-4L | |
| Gen5 | - | - | |
| HistoCore Arcadia H | Leica Biosystems | - | |
| Matrigel Growth Factor Reduced (GFR) | Corning | 356231 | Phenol Red-free, LDEV-free |
| MX35 microtome blade | Epredia | 3053835 | |
| NaOH | Sigma | 655104 | |
| PBS (-Ca -Mg) | Sigma | D8537 | |
| Puromycin Dihydrochloride | Thermo | A1113803 | |
| ROCK inhibitor Y-27632 | Abcam | ab120129 | |
| Simport Scientific Stainless-Steel Base Molds | Fisher Scientific | 22-038-209 | |
| Simport Scientific UNISETTE Biopsy Processing/Embedding Cassette | Fisher Scientific | 36-101-9255 | |
| STEMdiff Forebrain Neuron Differentiation Kit | StemCell Technologies | 8600 | |
| STEMdiff Neural Progenitor Medium | StemCell Technologies | 5833 | |
| STEMdiff SMADi Neural Induction Kit | StemCell Technologies | 8581 | |
| Thermo Scientific Shandon Finesse ME Microtome | Thermo Scientific | - | |
| Tissue Prep | Fisher Scientific | T555 | |
| Tissue-Tek VIP 6 AI Tissue Processor | Sakura Finetek | - | |
| Toluene (histological) | ChapTec | - | |
| Trypan blue; 0.4% (wt/vol) | Thermo | 15250061 | |
| Tween 20 | BioShop | TWN510.100 |
Ссылки
- Spurlock, M. S., et al. Amelioration of penetrating ballistic-like brain injury induced cognitive deficits after neuronal differentiation of transplanted human neural stem cells. Journal of Neurotrauma. 34 (11), 1981 (2017).
- Zhou, Y., Shao, A., Xu, W., Wu, H., Deng, Y. Advance of stem cell treatment for traumatic brain injury. Frontiers in Cellular Neuroscience. 13, 301 (2019).
- Hayashi, Y., Lin, H. -. T., Lee, C. -. C., Tsai, K. -. J. Effects of neural stem cell transplantation in Alzheimer's disease models. Journal of Biomedical Science. 27 (1), 29 (2020).
- Kefalopoulou, Z., et al. Long-term clinical outcome of fetal cell transplantation for Parkinson disease: Two case reports. JAMA Neurology. 71 (1), 83-87 (2014).
- Li, W., et al. Extensive graft-derived dopaminergic innervation is maintained 24 years after transplantation in the degenerating parkinsonian brain. Proceedings of the National Academy of Sciences of the United States of America. 113 (23), 6544-6549 (2016).
- Parmar, M., Grealish, S., Henchcliffe, C. The future of stem cell therapies for Parkinson disease. Nature Reviews Neuroscience. 21 (2), 103-115 (2020).
- Takahashi, J. iPS cell-based therapy for Parkinson's disease: A Kyoto trial. Regenerative Therapy. 13, 18-22 (2020).
- Krause, M., Phan, T. G., Ma, H., Sobey, C. G., Lim, R. Cell-based therapies for stroke: Are we there yet. Frontiers in Neurology. 10, 656 (2019).
- Coles-Takabe, B. L. K., et al. Don't look: Growing clonal versus nonclonal neural stem cell colonies. Stem Cells. 26 (11), 2938-2944 (2008).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266-277 (2017).
- Jakel, R. J., Schneider, B. L., Svendsen, C. N. Using human neural stem cells to model neurological disease. Nature Reviews Genetics. 5 (2), 136-144 (2004).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Li, J., et al. Conservation and divergence of vulnerability and responses to stressors between human and mouse astrocytes. Nature Communications. 12 (1), 3958 (2021).
- Morizane, A., et al. MHC matching improves engraftment of iPSC-derived neurons in non-human primates. Nature Communications. 8 (1), 385 (2017).
- Khrameeva, E., et al. Single-cell-resolution transcriptome map of human, chimpanzee, bonobo, and macaque brains. Genome Research. 30 (5), 776-789 (2020).
- Powell, K. Hybrid brains: The ethics of transplanting human neurons into animals. Nature. 608 (7921), 22-25 (2022).
- Humpel, C. Organotypic brain slice cultures: A review. Neuroscience. 305, 86-98 (2015).
- Birey, F., et al. Assembly of functionally integrated human forebrain spheroids. Nature. 545 (7652), 54-59 (2017).
- Lancaster, M. A., et al. Cerebral organoids model human brain development and microcephaly. Nature. 501 (7467), 373-379 (2013).
- García-Delgado, A. B., et al. Brain organoids to evaluate cellular therapies. Animals. 12 (22), (2022).
- Lin, J. -. R., Fallahi-Sichani, M., Sorger, P. K. Highly multiplexed imaging of single cells using a high-throughput cyclic immunofluorescence method. Nature Communications. 6 (1), 8390 (2015).
- Knapp, D. J. H. F., et al. Single-cell analysis identifies a CD33+ subset of human cord blood cells with high regenerative potential. Nature Cell Biology. 20 (6), 710-720 (2018).
- Georgala, P. A., Carr, C. B., Price, D. J. The role of Pax6 in forebrain development. Developmental Neurobiology. 71 (8), 690-709 (2011).
- Britanova, O., et al. Satb2 is a postmitotic determinant for upper-layer neuron specification in the neocortex. Neuron. 57 (3), 378-392 (2008).
- Kim, H., et al. Modeling G2019S-LRRK2 sporadic Parkinson's disease in 3D midbrain organoids. Stem Cell Reports. 12 (3), 518-531 (2019).
- Smits, L. M., et al. Modeling Parkinson's disease in midbrain-like organoids. NPJ Parkinson's Disease. 5, 5 (2019).
- Jin, M., et al. Type-I-interferon signaling drives microglial dysfunction and senescence in human iPSC models of Down syndrome and Alzheimer's disease. Cell Stem Cell. 29 (7), 1135.e8-1153.e8 (2022).
- Sun, X. -. Y., et al. Generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, e76707 (2022).
- Popova, G., et al. Human microglia states are conserved across experimental models and regulate neural stem cell responses in chimeric organoids. Cell Stem Cell. 28 (12), 2153.e6-2166.e6 (2021).
- Wang, S., Li, B., Zhang, F. Molecular fluorophores for deep-tissue bioimaging. ACS Central Science. 6 (8), 1302-1316 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены