A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم مستويات الالتهام الذاتي في نموذجين مختلفين لخلايا البنكرياس باستخدام التألق المناعي LC3
In This Article
Summary
الهدف من هذا البروتوكول هو تحديد مستويات الالتهام الذاتي في سرطان البنكرياس وخلايا أسينار البنكرياس من خلال التألق المناعي LC3 والقياس الكمي لنقطة LC3.
Abstract
الالتهام الذاتي هو عملية تقويضية متخصصة تؤدي إلى تحلل المكونات السيتوبلازمية بشكل انتقائي ، بما في ذلك البروتينات والعضيات التالفة. يسمح الالتهام الذاتي للخلايا بالاستجابة الفسيولوجية لمحفزات الإجهاد ، وبالتالي الحفاظ على التوازن الخلوي. قد تعدل الخلايا السرطانية مستويات الالتهام الذاتي للتكيف مع الظروف المعاكسة مثل نقص الأكسجة أو نقص المغذيات أو التلف الناجم عن العلاج الكيميائي. يعد سرطان البنكرياس الغدي القنوي أحد أكثر أنواع السرطان فتكا. تتمتع خلايا سرطان البنكرياس بنشاط التهام الذاتي العالي بسبب التنظيم النسخي والتنشيط بعد الترجمة لبروتينات الالتهام الذاتي.
هنا ، تم استخدام خط خلايا PANC-1 كنموذج لخلايا سرطان البنكرياس البشرية ، وتم استخدام خط خلايا البنكرياس acinar AR42J كنموذج فسيولوجي لخلايا الثدييات شديدة التمايز. استخدمت هذه الدراسة التألق المناعي لسلسلة ضوء البروتين المرتبطة بالأنابيب الدقيقة 3 (LC3) كمؤشر لحالة تنشيط الالتهام الذاتي. LC3 هو بروتين الالتهام الذاتي الذي يظهر ، في الظروف القاعدية ، نمطا منتشرا للتوزيع في السيتوبلازم (المعروف باسم LC3-I في هذه الحالة). يؤدي تحريض الالتهام الذاتي إلى اقتران LC3 بالفوسفاتيديل إيثانولامين على سطح البلعمة الذاتية المشكلة حديثا لتشكيل LC3-II ، وهو بروتين مرتبط بالغشاء يساعد في تكوين وتوسيع البلعمة الذاتية. لتحديد عدد هياكل الالتهام الذاتي الموسومة ، تم استخدام برنامج FIJI مفتوح المصدر بمساعدة أداة "3D Objects Counter".
يسمح لنا قياس مستويات الالتهام الذاتي في كل من الظروف الفسيولوجية والخلايا السرطانية بدراسة تعديل الالتهام الذاتي في ظل ظروف متنوعة مثل نقص الأكسجة أو العلاج الكيميائي أو ضربة قاضية لبعض البروتينات.
Introduction
الالتهام الذاتي الكبير (يشار إليه عادة باسم الالتهام الذاتي) هو عملية تقويضية متخصصة تؤدي إلى تحلل المكونات السيتوبلازمية بشكل انتقائي ، بما في ذلك البروتينات والعضيات التالفة 1,2. يسمح الالتهام الذاتي للخلايا بالاستجابة الفسيولوجية لمحفزات الإجهاد ، وبالتالي الحفاظ على التوازن الخلوي3. أثناء الالتهام الذاتي ، يتم تشكيل حويصلة غشاء مزدوج: البلعمة الذاتية. يحتوي البلعمة الذاتية على جزيئات الشحن ويدفعها إلى الليزوزوم للتحلل 1,4.
تم تزيين البلعمة الذاتية بواسطة سلسلة ضوء البروتين المرتبطة بالبروتين الذاتي 3 (LC3) 5. عندما لا يتم تحفيز الالتهام الذاتي ، ينتشر LC3 في السيتوبلازم والنواة في شكل LC3-I. من ناحية أخرى ، عندما يتم تحفيز الالتهام الذاتي ، يتم اقتران LC3 مع فوسفاتيديل إيثانولامين في غشاء هياكل الالتهام الذاتي6. يعرف هذا التشكيل الجديد LC3 باسم LC3-II1. يتسبب تحول التشكل LC3 في حدوث تغييرات في توطينه الخلوي وهجرة دوديسيل كبريتات الصوديوم بولي أكريلاميد جل الكهربائي (SDS-PAGE) ، والتي يمكن اكتشافها بواسطة تقنيات مثل التألق المناعي واللطخة الغربية 5,7. بهذه الطريقة ، يعد اقتران LC3 حدثا رئيسيا في عملية الالتهام الذاتي التي يمكن استخدامها لقياس نشاط الالتهام الذاتي.
الخلية العنيبية البنكرياسية هي خلية شديدة التمايز ، في ظل ظروف صحية ، لديها معدل منخفض من الالتهام الذاتي. ومع ذلك ، في ظروف فسيولوجية مختلفة أو تحت التحفيز الدوائي ، يمكنهم تنشيط الالتهام الذاتي. لذلك ، فإن تحديد مستويات الالتهام الذاتي في خط الخلية هذا مفيد لدراسة الآثار المباشرة أو غير المباشرة المحتملة للعوامل الدوائية أو البيولوجية المختلفة على الالتهام الذاتي 8,9.
يعد سرطان البنكرياس الغدي القنوي أحد أكثر أنواع السرطان فتكا ، نظرا لتشخيصه المتأخر ومقاومته العالية للعلاج الكيميائي10. تتمتع خلايا سرطان البنكرياس بنشاط الالتهام الذاتي العالي بسبب التنظيم النسخي والتنشيط اللاحق للبروتينات المرتبطة بالالتهام الذاتي11. قد تقوم خلايا سرطان البنكرياس بتعديل مستويات الالتهام الذاتي استجابة للظروف غير المواتية مثل نقص الأكسجة أو الحرمان من المغذيات أو التلف الناجم عن العلاج الكيميائي11. وبالتالي ، فإن تحليل مستويات الالتهام الذاتي في خلايا سرطان البنكرياس يمكن أن يساعد في فهم كيفية تكيفها مع البيئات المختلفة وتقييم فعالية علاجات تعديل الالتهام الذاتي.
تظهر هذه الدراسة طريقة لأداء التألق المناعي LC3 في نموذجين خلويين متميزين للبنكرياس. النموذج الأول ، خلايا PANC-1 ، بمثابة نموذج لسرطان الغدة القنوية البنكرياس. تم علاج هذه الخلايا باستخدام gemcitabine ، وهو عامل علاج كيميائي ثبت سابقا أنه يحفز الالتهام الذاتي ، وتحديدا في خلايا سرطان البنكرياس التي تحمل جين فيروس ساركوما الفئران كيرستن (KRAS) 12,13. النموذج الثاني ، خلايا AR42J ، كان بمثابة نموذج فسيولوجي أكثر لخلايا البنكرياس الخارجية الإفراز. تم تمييز هذه الخلايا مع ديكساميثازون لتصبح أكثر تشابها مع خلايا البنكرياس الأسينار14. في هذه الخلايا ، تم تحفيز الالتهام الذاتي دوائيا من خلال استخدام PP242 ، وهو مثبط قوي ل mTOR15. في هذه الدراسة ، نوضح قابلية تطبيق البروتوكول الموصوف بنموذجين مختلفين للبنكرياس وقدرته على التمييز بين حالات الالتهام الذاتي المنخفض والعالي.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. إعداد الخلية
- انقع أغطية مستديرة مقاس 12 مم في الإيثانول المطلق ، وضعها عموديا في آبار صفيحة 24 بئرا.
- قم بإزالة الغطاء ، وتعريض اللوحة متعددة الآبار للأشعة فوق البنفسجية لمدة 15 دقيقة.
- ضع أغطية الغطاء أفقيا ، واغسلها باستخدام وسيط النسر المعدل من Dulbecco (DMEM).
- بذر عدد مرور منخفض من خلايا البنكرياس. يجب تعديل الكمية للحصول على التقاء 50٪ -75٪ في يوم التثبيت16.
ملاحظة: يوصى بزرع 2.5 × 10 4 PANC-1 أو 4 × 104 AR42J لكل بئر لتثبيت الخلايا بعد 3 أيام. - استزراع الخلايا في DMEM التي تحتوي على 10٪ مصل بقري جنيني ، 100 وحدة / مل بنسلين ، و 100 ميكروغرام / مل ستربتومايسين في حاضنة عند 37 درجة مئوية تحت جو مرطب مع 5٪ ثاني أكسيد الكربون (CO2).
ملاحظة: بالنسبة لخلايا PANC-1 ، يوصى باحتضان الخلايا لمدة يومين بين بذر الخلية والخطوات التالية. بعد هذا الوقت ، يمكن نقل الخلايا أو معالجتها أو تثبيتها. يجسد هذا البروتوكول العلاج بالجيمسيتابين في خلايا PANC-1 غير المنقولة والتمايز وعلاج PP242 لخلايا AR42J غير المنقولة.
2. علاج الخلايا
- علاج جيمسيتابين لخلايا PANC-1
- تحضير محلول 1 ميكروغرام / ميكرولتر جيمسيتابين في DMEM بعد يومين من البذر. عالج كل بئر ب 2.6 ميكرولتر من محلول جيمسيتابين 1 ميكروغرام / ميكرولتر لتحقيق تخفيف نهائي قدره 20 ميكرومتر.
- احتضان الخلايا لمدة 24 ساعة في الحاضنة.
- تمايز AR42J وعلاج PP242
- تحضير محلول 4 ميكروغرام / مل ديكساميثازون في DMEM.
- عالج كل بئر ب 4.9 ميكرولتر من محلول ديكساميثازون 4 ميكروغرام / مل للحصول على تخفيف نهائي قدره 100 نانومتر.
- احتضان الخلايا لمدة 48 ساعة في الحاضنة.
- قم بإزالة الوسط ، وعالج كل بئر ب 0.5 ميكرولتر من 1 mM PP242 للحصول على تخفيف نهائي قدره 1 ميكرومتر.
- احتضان الخلايا لمدة 2 ساعة في الحاضنة.
3. تثبيت ونفاذية الخلايا
- قم بإعداد صفيحة من 24 بئرا مع ميثانول بارد وصفيحة ذات 6 آبار مع محلول ملحي مخزن بالفوسفات البارد (PBS ؛ 137 mM NaCl ، 2.7 mM KCl ، 8 mM Na 2HPO 4 ، 2 mM KH2PO4). الحفاظ عليها على الجليد.
- خذ كل غطاء بملاقط ، واغسله مرتين في برنامج تلفزيوني ، واحتضانه لمدة 6 دقائق في الميثانول.
4. حجب الخلايا
- اغسل كل غطاء مرتين في برنامج تلفزيوني ، واحتضنه لمدة 1 ساعة في مصل بقري جنيني بنسبة 10٪ في PBS (محلول مانع).
ملاحظة: في هذه الخطوة، قد يتم إيقاف البروتوكول مؤقتا. يمكن تخزين قسائم الغطاء طوال الليل في الثلاجة في محلول الحجب ، ويمكن متابعة البروتوكول في اليوم التالي.
5. احتضان أغطية الغطاء بالجسم المضاد الأساسي
- قم بإعداد محلول 1: 1000 من مضاد LC3 في محلول الحجب ، واحتفظ به على الجليد.
- ضع قطعة من فيلم ختم المختبر على الغطاء متعدد الآبار.
- ضع قطرة واحدة (25 ميكرولتر) لكل غطاء من محلول مضاد LC3 فوق طبقة مانعة للتسرب.
- خذ كل غطاء بملاقط ، وضعه فوق قطرة الجسم المضاد الأولية ، مع الحرص على أن يكون جانب الخلية ملامسا للمحلول.
- قم بإعداد غرفة رطبة عن طريق وضع قطعة رطبة من الورق في صندوق بلاستيكي مسطح القاع.
- ضع الطبق متعدد الآبار في غرفة الرطوبة ، وقم بتغطيته بورق ، واحتضانه طوال الليل في الثلاجة.
6. احتضان أغطية الغطاء بالجسم المضاد الثانوي
- قم بإزالة اللوحة متعددة الآبار من غرفة الرطوبة ، وضع أغطية الغطاء مرة أخرى في اللوحة متعددة الآبار.
- أداء ثلاث غسلات مع برنامج تلفزيوني.
- قم بإعداد محلول مضاد للأرانب يحمل علامة الفلورسنت مع تخفيف 1: 800 في محلول الحجب ، والحفاظ عليه على الجليد المحمي من الضوء.
- ضع قطعة فيلم مانعة للتسرب فوق الغطاء متعدد الآبار.
- ضع قطرة (25 ميكرولتر) لكل غطاء من محلول مضاد للأرانب فوق فيلم الختم.
- خذ كل غطاء بملاقط ، وضعه فوق قطرة الجسم المضاد الأولية ، مع الحرص على أن يكون جانب الخلية ملامسا للمحلول.
- احتضان لوحة متعددة الآبار في غرفة الرطوبة لمدة 2 ساعة في درجة حرارة الغرفة (RT) محمية من الضوء.
7. تلطيخ الخلايا ب 4 ′ ، 6-دياميدينو -2-فينيليندول (DAPI)
- قم بإزالة اللوحة متعددة الآبار من غرفة الرطوبة ، وضع أغطية الغطاء مرة أخرى في اللوحة متعددة الآبار.
- أداء ثلاث غسلات مع برنامج تلفزيوني.
- قم بإعداد محلول 300 نانومتر من DAPI في PBS (محمي من الضوء).
- احتضن كل غطاء بمحلول DAPI لمدة 10 دقائق.
- أداء ثلاث غسلات مع برنامج تلفزيوني. حافظ على اللوحة متعددة الآبار محمية من الضوء.
8. المونتاج
- تحضير اثنين من الكئوس بالماء وقطعة من الورق.
- ضع قطرة واحدة (10 ميكرولتر) لكل غطاء من محلول كحول البولي فينيل ثنائي (ثلاثي ميثيل الألومنيوم) -1،4-ديازابيسيكلو [2.2.2] أوكتان (PVA-DABCO) على شريحة.
ملاحظة: يتم تحضير PVA-DABCO من خلال الجمع بين 0.25 M DABCO و 10٪ W / V PVA و 20٪ من الجلسرين و 50٪ Tris HCl (1.5 M ، درجة الحموضة 8.8) في ماء عالي النقاء. - خذ كل غطاء بملاقط ، واغسله في كل دورق ماء ، وجففه في الورق ، وضعه فوق قطرة PVA-DABCO (مع ملامسة الخلايا للمحلول).
- اتركه يجف طوال الليل ، محميا من الضوء.
9. عرض المجهر متحد البؤر والتقاط الصور
- تصور أغطية الأغطية في مجهر متحد البؤر مقلوب باستخدام هدف يبلغ حوالي 63 ×17.
- التقط صورا تمثيلية للخلايا المصنفة.
10. تحديد نقاط LC3
- اسحب وأفلت كل ملف صورة يحتوي على القنوات الملتقطة ، مثل ".czi" ، في شاشة ImageJ (FIJI) لفتحه. انقر فوق "موافق " في مربع الحوار ، وأغلق نافذة وحدة التحكم .
- من علامة التبويب صورة ، حدد اللون > تقسيم القنوات.
- أغلق الصور المقابلة للقنوات بخلاف صورة LC3.
- من علامة التبويب صورة ، حدد ضبط توازن اللون >
- حرك شريط التمرير الحد الأقصى إلى اليسار حتى يتم تشبع الصورة لتصور ملامح الخلية.
- ارسم الحد الخارجي للخلية باستخدام أداة التحديد اليدوي .
- انقر فوق الزر "إعادة تعيين " لإعادة ضبط اللون.
- من علامة التبويب تحرير ، حدد قص لقص العنصر المحدد.
- أغلق الصورة دون حفظها.
- من علامة التبويب تحرير ، حدد لصق.
- في القائمة تحليل ، اختر الأداة 3D Objects Counter.
- اضبط العتبة. في المثال المقدم في هذه الدراسة ، تم تعيين العتبة عند 2,000.
- اضبط مرشح الحجم. في هذه الدراسة ، تم تعيينه بين 50 و 500.
- تأكد من وضع علامة على المربعين كائنات وملخص.
- انقر فوق موافق. سيتم وصف عدد النقاط على أنها كائنات تم اكتشافها في الملخص.
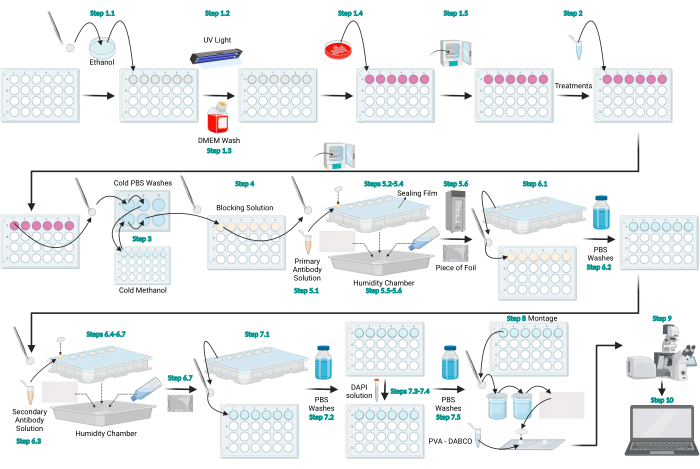
الشكل 1: رسم تخطيطي لبروتوكول التألق المناعي LC3. رسم تخطيطي يمثل البروتوكول العام المقدم للتألق المناعي LC3. تم إنشاء الشكل باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
النتائج
يقوم هذا البروتوكول بإجراء التألق المناعي ل LC3 في خطوط خلايا البنكرياس لتحديد مستويات الالتهام الذاتي في ظروف مختلفة. كانت نتيجة هذه التجربة هي مراقبة الصور الخلوية من القنوات الحمراء والزرقاء ، المقابلة ل LC3 و DAPI. تشير صور LC3 إلى التوزيع الخلوي لهذا البروتين ، بينما يوضح DAPI التوطين النووي....
Access restricted. Please log in or start a trial to view this content.
Discussion
تسمح الطريقة الموضحة في هذا البروتوكول بتصور توزيع LC3 الداخلي في الخلية وتحديد مستويات الالتهام الذاتي في ظل ظروف مختلفة. طريقة أخرى مماثلة تستخدم لتحليل توزيع LC3 وتحديد تنشيط الالتهام الذاتي تتضمن نقل LC3 المسمى بالتألق (مثل RFP-LC3) 19. يتميز نقل RFP-LC3 بمزايا عدم الحاجة إلى التثبيت ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ولم يعلن عن أي تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل بمنح من جامعة بوينس آيرس (UBACyT 2018-2020 20020170100082BA) ، والمجلس الوطني للبحث العلمي والتكنولوجيا (CONICET) (PIP 2021-2023 GI− 11220200101549CO ؛ و PUE 22920170100033) والوكالة الوطنية للترويج العلمي والتكنولوجي (PICT 2019-01664).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 10x Phosphate-Buffered Saline (PBS) | Corning | 46-013-CM | |
| 12 mm round coverslips | HDA | CBR_OBJ_6467 | |
| 24 Well- Cell Culture Plate | Sorfa | 220300 | |
| Absolute ethanol | Biopack | 2207.10.00 | |
| Alexa Fluor 594 Donkey anti-rabbit IgG (H+L) | Invitrogen | R37119 | |
| Confocal Laser Scanning Microscope | Zeiss | LSM 800 | |
| Dexamethasone | Sigma Aldrich | D4902 | |
| DMEN | Sartorius | 01-052-1A | |
| Fetal Bovine Serum | NATOCOR | Lintc-634 | |
| Gemcitabina | Eli Lilly | VL7502 | |
| LC3B (D11) XP Rabbit mAb | Cell Signaling Technology | 3868S | |
| Methanol | Anedra | 6197 | |
| Parafilm "M" (Laboratory Sealing Film) | Bemis/Curwood | PM-996 | |
| Pen-Strep Solution | Sartorius | 03-031-1B | |
| PP242 | Santa Cruz Biotechnology | SC-301606 | |
| Trypsin EDTA | Gibco | 11570626 |
References
- Grasso, D., Renna, F. J., Vaccaro, M. I. Initial steps in mammalian autophagosome biogenesis. Frontiers in Cell and Developmental Biology. 6, 146(2018).
- Galluzzi, L., et al. Molecular definitions of autophagy and related processes. EMBO Journal. 36 (13), 1811-1836 (2017).
- Kitada, M., Koya, D. Autophagy in metabolic disease and ageing. Nature Reviews Endocrinology. 17 (11), 647-661 (2021).
- Ktistakis, N. T., Tooze, S. A. Digesting the expanding mechanisms of autophagy. Trends in Cell Biology. 26 (8), 624-635 (2016).
- Tanida, I., Ueno, T., Kominami, E. LC3 and autophagy. Methods in Molecular Biology. 445, 77-88 (2008).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. EMBO Journal. 19 (21), 5720-5728 (2000).
- Mizushima, N., Yoshimori, T. How to interpret LC3 immunoblotting. Autophagy. 3 (6), 542-545 (2007).
- Vanasco, V., et al. Mitochondrial dynamics and VMP1-related selective mitophagy in experimental acute pancreatitis. Frontiers in Cell and Developmental Biology. 9, 640094(2021).
- Williams, J. A. Regulatory mechanisms in pancreas and salivary acini. Annual Review of Physiology. 46, 361-375 (1984).
- Mizrahi, J. D., Surana, R., Valle, J. W., Shroff, R. T. Pancreatic cancer. Lancet. 395 (10242), 2008-2020 (2020).
- Li, J., et al. Regulation and function of autophagy in pancreatic cancer. Autophagy. 17 (11), 3275-3296 (2021).
- Ropolo, A., et al. A novel E2F1-EP300-VMP1 pathway mediates gemcitabine-induced autophagy in pancreatic cancer cells carrying oncogenic KRAS. Frontiers in Endocrinology. 11, 411(2020).
- Pardo, R., et al. Gemcitabine induces the VMP1-mediated autophagy pathway to promote apoptotic death in human pancreatic cancer cells. Pancreatology. 10 (1), 19-26 (2010).
- Logsdon, C. D., Moessner, J., Williams, J. A., Goldfine, I. D. Glucocorticoids increase amylase mRNA levels, secretory organelles, and secretion in pancreatic acinar AR42J cells. Journal of Cell Biology. 100 (4), 1200-1208 (1985).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (4th edition). Autophagy. 17 (1), 1(2021).
- Segeritz, C. -P., Vallier, L. Chapter 9 - Cell culture: Growing cells as model systems in vitro. Basic Science Methods for Clinical Researchers. Jalali, M., Saldanha, F. Y. L., Jalali, M. , Academic Press. Cambridge, MA. 151-172 (2017).
- Elliott, A. D. Confocal microscopy: Principles and modern practices. Current Protocols in Cytometry. 92 (1), 68(2020).
- Grasso, D., et al. a novel selective autophagy pathway mediated by VMP1-USP9x-p62, prevents pancreatic cell death. Journal of Biological Chemistry. 286 (10), 8308-8324 (2011).
- Ropolo, A., et al. The pancreatitis-induced vacuole membrane protein 1 triggers autophagy in mammalian cells. Journal of Biological Chemistry. 282 (51), 37124-37133 (2007).
- Karanasios, E., Stapleton, E., Walker, S. A., Manifava, M., Ktistakis, N. T. Live cell imaging of early autophagy events: Omegasomes and beyond. Journal of Visualized Experiments. (77), e50484(2013).
- Kuma, A., Matsui, M., Mizushima, N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: caution in the interpretation of LC3 localization. Autophagy. 3 (4), 323-328 (2007).
- Zhang, Z., Singh, R., Aschner, M. Methods for the detection of autophagy in mammalian cells. Current Protocols in Toxicology. 69, 1-26 (2016).
- Yoshii, S. R., Mizushima, N. Monitoring and measuring autophagy. International Journal of Molecular Sciences. 18 (9), 1865(2017).
- Betriu, N., Andreeva, A., Semino, C. E. Erlotinib promotes ligand-induced EGFR degradation in 3D but not 2D cultures of pancreatic ductal adenocarcinoma cells. Cancers. 13 (18), 4504(2021).
- Wang, W., Dong, L., Zhao, B., Lu, J., Zhao, Y. E-cadherin is downregulated by microenvironmental changes in pancreatic cancer and induces EMT. Oncology Reports. 40 (3), 1641-1649 (2018).
- Kim, S. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305(2020).
- Meng, Y., et al. Cytoplasmic EpCAM over-expression is associated with favorable clinical outcomes in pancreatic cancer patients with Hepatitis B virus negative infection. International Journal of Clinical and Experimental Medicine. 8 (12), 22204-22216 (2015).
- Brock, R., Hamelers, I. H., Jovin, T. M. Comparison of fixation protocols for adherent cultured cells applied to a GFP fusion protein of the epidermal growth factor receptor. Cytometry. 35 (4), 353-362 (1999).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved