Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка уровней аутофагии в двух разных моделях клеток поджелудочной железы с использованием иммунофлуоресценции LC3
В этой статье
Резюме
Целью этого протокола является определение аутофагических уровней в раке поджелудочной железы и ацинарных клетках поджелудочной железы с помощью иммунофлуоресценции LC3 и количественного определения точек LC3.
Аннотация
Аутофагия представляет собой специализированный катаболический процесс, который избирательно разрушает цитоплазматические компоненты, включая белки и поврежденные органеллы. Аутофагия позволяет клеткам физиологически реагировать на стрессовые стимулы и, таким образом, поддерживать клеточный гомеостаз. Раковые клетки могут модулировать свои уровни аутофагии, чтобы адаптироваться к неблагоприятным условиям, таким как гипоксия, дефицит питательных веществ или повреждение, вызванное химиотерапией. Протоковая аденокарцинома поджелудочной железы является одним из самых смертоносных видов рака. Раковые клетки поджелудочной железы обладают высокой аутофагической активностью из-за транскрипционной апрегуляции и посттрансляционной активации белков аутофагии.
Здесь клеточная линия PANC-1 использовалась в качестве модели раковых клеток поджелудочной железы человека, а линия ацинарных клеток поджелудочной железы AR42J использовалась в качестве физиологической модели высокодифференцированных клеток млекопитающих. В этом исследовании в качестве индикатора состояния активации аутофагии использовали иммунофлуоресценцию связанного с микротрубочками белка легкой цепи 3 (LC3). LC3 представляет собой белок аутофагии, который в базальных условиях демонстрирует диффузный паттерн распределения в цитоплазме (известный как LC3-I в этом состоянии). Индукция аутофагии запускает конъюгацию LC3 с фосфатидилэтаноламином на поверхности новообразованных аутофагосом с образованием LC3-II, связанного с мембраной белка, который помогает в образовании и расширении аутофагосом. Для количественной оценки количества меченых автофагических структур было использовано программное обеспечение с открытым исходным кодом FIJI с помощью инструмента «3D Objects Counter».
Измерение аутофагических уровней как в физиологических условиях, так и в раковых клетках позволяет нам изучать модуляцию аутофагии при различных условиях, таких как гипоксия, химиотерапия или нокдаун определенных белков.
Введение
Макроаутофагия (обычно называемая аутофагией) представляет собой специализированный катаболический процесс, который избирательно разрушает цитоплазматические компоненты, включая белки и поврежденные органеллы 1,2. Аутофагия позволяет клеткам физиологически реагировать на стрессовые стимулы и, таким образом, поддерживать клеточный гомеостаз3. Во время аутофагии образуется пузырь с двойной мембраной: аутофагосома. Аутофагосома содержит молекулы груза и направляет их в лизосому для деградации 1,4.
Аутофагосомы украшены легкой цепью белка 3 (LC3)5, ассоциированной с аутофагическим белком, связанным с микротрубочками. Когда аутофагия не индуцирована, LC3 диффундирует в цитоплазме и ядре в конформации LC3-I. С другой стороны, когда индуцируется аутофагия, LC3 конъюгируется с фосфатидилэтаноламином в мембране аутофагических структур6. Эта новая конформация LC3 известна как LC3-II1. Конформационный сдвиг LC3 вызывает изменения в его клеточной локализации и миграции электрофореза в додецилсульфате натрия-полиакриламидном геле (SDS-PAGE), которые могут быть обнаружены такими методами, как иммунофлуоресценция и вестерн-блоттинг 5,7. Таким образом, конъюгация LC3 является ключевым событием в аутофагическом процессе, которое может быть использовано для измерения аутофагической активности.
Ацинарная клетка поджелудочной железы является высокодифференцированной клеткой, которая в здоровых условиях имеет низкий уровень аутофагии. Однако в различных физиологических условиях или при фармакологической стимуляции они могут активировать аутофагию. Следовательно, определение аутофагических уровней в этой клеточной линии полезно для изучения потенциальных прямых или косвенных эффектов различных фармакологических или биологических агентов на аутофагию 8,9.
Протоковая аденокарцинома поджелудочной железы является одним из самых смертоносных видов рака, учитывая его позднюю диагностику и высокую устойчивость к химиотерапии10. Раковые клетки поджелудочной железы обладают высокой аутофагической активностью из-за транскрипционной апрегуляции и посттрансляционной активации белков, связанных с аутофагией11. Раковые клетки поджелудочной железы могут корректировать свои уровни аутофагии в ответ на неблагоприятные условия, такие как гипоксия, лишение питательных веществ или повреждение, вызванное химиотерапией11. Следовательно, анализ уровней аутофагии в раковых клетках поджелудочной железы может помочь понять, как они адаптируются к различным средам, и оценить эффективность лечения, модулирующего аутофагию.
В этом исследовании показан метод проведения иммунофлуоресценции LC3 на двух различных клеточных моделях поджелудочной железы. Первая модель, клетки PANC-1, послужили моделью для аденокарциномы протоков поджелудочной железы. Эти клетки обрабатывали гемцитабином, химиотерапевтическим агентом, который, как было показано ранее, индуцирует аутофагию, особенно в раковых клетках поджелудочной железы, несущих онкогенный ген вируса саркомы крысы Кирстен (KRAS)12,13. Вторая модель, клетки AR42J, служила более физиологической моделью экзокринных клеток поджелудочной железы. Эти клетки дифференцировались с дексаметазоном, чтобы стать более похожими на ацинарные клетки поджелудочной железы14. В этих клетках аутофагия была фармакологически индуцирована с помощью PP242, который является мощным ингибитором mTOR15. В этом исследовании мы демонстрируем применимость протокола, описанного с двумя разными моделями поджелудочной железы, и его способность различать состояния низкой и высокой аутофагии.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Подготовка клеток
- Смочите 12-миллиметровые круглые покровные стекла в абсолютном этаноле и поместите их вертикально в лунки 24-луночной пластины.
- Снимите крышку и подвергните многолуночную пластину ультрафиолетовому излучению в течение 15 минут.
- Расположите покровные стекла горизонтально и промойте их с помощью модифицированной среды Dulbecco Eagle Medium (DMEM).
- Семена имеют низкое проходное количество клеток поджелудочной железы. Сумма должна быть скорректирована для получения 50%-75% слияния в день фиксации16.
ПРИМЕЧАНИЕ: Рекомендуется застелить 2,5 × 10 4 PANC-1 или 4 × 104 AR42J клеток на лунку, чтобы закрепить клетки через 3 дня. - Культивируют клетки в DMEM, содержащем 10% эмбриональной бычьей сыворотки, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина, в инкубаторе при 37 °C в увлажненной атмосфере с 5% углекислого газа (CO2).
ПРИМЕЧАНИЕ: Для клеток PANC-1 рекомендуется инкубировать клетки в течение 2 дней между посевом клеток и следующими шагами. По истечении этого времени клетки могут быть трансфицированы, обработаны или зафиксированы. Этот протокол иллюстрирует лечение гемцитабином в нетрансфицированных клетках PANC-1, а также дифференцировку и обработку PP242 для нетрансфицированных клеток AR42J.
2. Обработка клеток
- Лечение гемцитабином клеток PANC-1
- Приготовьте раствор 1 мкг/мкл гемцитабина в ДМЭМ через 2 дня после посева. Обработайте каждую лунку 2,6 мкл раствора гемцитабина 1 мкг/мкл для достижения окончательного разбавления 20 мкМ.
- Инкубируют клетки в течение 24 ч в инкубаторе.
- Дифференциация AR42J и лечение PP242
- Приготовьте раствор дексаметазона 4 мкг/мл в ДМЭМ.
- Обработайте каждую лунку 4,9 мкл раствора дексаметазона 4 мкг/мл, чтобы получить окончательное разведение 100 нМ.
- Инкубируют клетки в течение 48 ч в инкубаторе.
- Удалите среду и обработайте каждую лунку 0,5 мкл 1 мМ PP242 для получения окончательного разбавления 1 мкМ.
- Инкубируют клетки в течение 2 ч в инкубаторе.
3. Фиксация и проникновение клеток
- Подготовьте 24-луночный планшет с холодным метанолом и 6-луночный планшет с холодным фосфатно-буферным физиологическим раствором (PBS; 137 мМ NaCl, 2,7 мМ KCl, 8 мМ Na 2 HPO 4, 2 мМ KH2PO4). Держите их на льду.
- Возьмите каждое покровное стекло пинцетом, дважды промойте его в PBS и инкубируйте в течение 6 минут в метаноле.
4. Блокировка ячеек
- Дважды промойте каждое покровное стекло в PBS и инкубируйте в течение 1 ч в 10% фетальной бычьей сыворотке в PBS (блокирующий раствор).
ПРИМЕЧАНИЕ: На этом этапе протокол может быть приостановлен. Покровные стекла можно хранить в течение ночи в холодильнике в блокирующем растворе, а протокол можно продолжить на следующий день.
5. Инкубация покровных стекол с первичным антителом
- Приготовьте раствор анти-LC3 в соотношении 1:1,000 в блокирующем растворе и держите его на льду.
- Поместите кусок лабораторной герметизирующей пленки на многолуночную крышку.
- Нанесите одну каплю (25 мкл) на покровное стекло раствора анти-LC3 поверх герметизирующей пленки.
- Возьмите каждый покровный лист пинцетом и поместите его на первичную каплю антител, следя за тем, чтобы сторона клетки соприкасалась с раствором.
- Подготовьте влажную камеру, поместив влажный лист бумаги в пластиковую коробку с плоским дном.
- Поместите многолуночную тарелку в камеру влажности, накройте фольгой и выдержите ночь в холодильнике.
6. Инкубация покровных стекол с вторичным антителом
- Извлеките многолуночную пластину из камеры влажности и поместите покровные стекла обратно в многолуночную пластину.
- Выполните три стирки с помощью PBS.
- Приготовьте раствор флуоресцентно меченного антикролика с разведением 1:800 в блокирующем растворе, и выдержите его на льду в защищенном от света месте.
- Поместите кусок герметизирующей пленки на многолуночную крышку.
- Нанесите каплю (25 мкл) на покровное стекло раствора против кроликов на герметизирующую пленку.
- Возьмите каждый покровный лист пинцетом и поместите его на первичную каплю антител, следя за тем, чтобы сторона клетки соприкасалась с раствором.
- Инкубируют многолуночную пластину во влажной камере в течение 2 ч при комнатной температуре (ОТ) в защищенном от света месте.
7. Окрашивание клеток 4',6-диамидино-2-фенилиндолом (DAPI)
- Извлеките многолуночную пластину из камеры влажности и поместите покровные стекла обратно в многолуночную пластину.
- Выполните три стирки с помощью PBS.
- Приготовьте 300 нМ раствор DAPI в PBS (защищенный от света).
- Инкубируйте каждое покровное стекло раствором DAPI в течение 10 минут.
- Выполните три стирки с помощью PBS. Следите за тем, чтобы многолунковая пластина была защищена от света.
8. Монтаж
- Подготовьте два стакана с водой и листом бумаги.
- Поместите одну каплю (10 мкл) на покровное стекло раствора поливинилового спирта-бис(триметилалюминия)-1,4-диазабицикло[2.2.2]октанового аддукта (PVA-DABCO) на предметное стекло.
ПРИМЕЧАНИЕ: PVA-DABCO получают путем объединения 0,25 М DABCO, 10% W/V PVA, 20% глицерина и 50% Tris HCl (1,5 М, pH 8,8) в сверхчистой воде. - Возьмите каждое покровное стекло пинцетом, вымойте его в каждом стакане для воды, высушите в бумаге и поместите его на каплю PVA-DABCO (с ячейками, контактирующими с раствором).
- Дайте ему высохнуть в течение ночи, защищая от света.
9. Просмотр конфокальной микроскопии и захват изображения
- Визуализируйте покровные стекла в инвертированном конфокальном микроскопе, используя объектив размером около 63x17.
- Захват репрезентативных изображений помеченных ячеек.
10. Количественная оценка точек LC3
- Перетащите каждый файл изображения, содержащий захваченные каналы, например «.czi», на экран ImageJ (FIJI), чтобы открыть. Нажмите « ОК» в диалоговом окне и закройте окно консоли .
- На вкладке «Изображение» выберите «Цвет» > «Разделить каналы».
- Закройте изображения, соответствующие каналам, отличным от изображения LC3.
- На вкладке « Изображение » выберите « Настроить > цветовой баланс»
- Перемещайте ползунок «Максимум » влево, пока изображение не станет насыщенным, чтобы визуализировать контуры ячеек.
- Нарисуйте контур ячейки с помощью инструмента « Выделение от руки ».
- Нажмите кнопку « Сброс », чтобы сбросить настройку цвета.
- На вкладке « Правка » выберите « Вырезать », чтобы вырезать выбранный элемент.
- Закройте изображение, не сохраняя его.
- На вкладке " Правка " выберите " Вставить".
- В меню « Анализ» выберите инструмент «Счетчик 3D-объектов».
- Установите пороговое значение. В примере, приведенном в этом исследовании, пороговое значение установлено на уровне 2 000.
- Установите фильтр размера. В этом исследовании он установлен между 50 и 500.
- Убедитесь, что флажки «Объекты » и « Сводка » отмечены.
- Нажмите на кнопку ОК. Количество точек будет описано как объекты, обнаруженные в сводке.
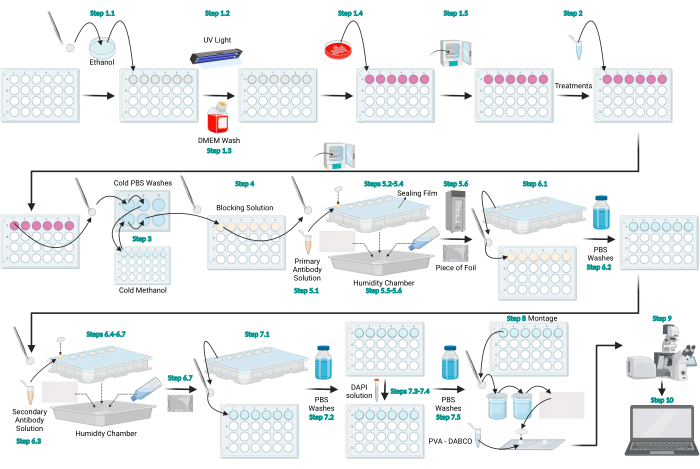
Рисунок 1: Принципиальная схема протокола иммунофлуоресценции LC3. Принципиальная схема, представляющая общий протокол, предусмотренный для иммунофлуоресценции LC3. Рисунок создан с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
Этот протокол выполняет иммунофлуоресценцию LC3 в клеточных линиях поджелудочной железы для определения уровней аутофагии в различных условиях. Результатом этого эксперимента стало получение клеточных изображений из красного и синего каналов, соответствующих LC3 и DAPI. Изображения LC3 п?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Способ, описанный в этом протоколе, позволяет визуализировать эндогенное распределение LC3 в клетке и количественно определять аутофагические уровни в различных условиях. Другой аналогичный метод, используемый для анализа распределения LC3 и определения активации аутофагии, включает м...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
О конфликте интересов не было заявлено.
Благодарности
Эта работа была поддержана грантами Университета Буэнос-Айреса (UBACyT 2018-2020 20020170100082BA), Национального совета по научным исследованиям и технологиям (CONICET) (PIP 2021-2023 GI− 11220200101549CO; и PUE 22920170100033) и Национального агентства по развитию науки и технологий (PICT 2019-01664).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 10x Phosphate-Buffered Saline (PBS) | Corning | 46-013-CM | |
| 12 mm round coverslips | HDA | CBR_OBJ_6467 | |
| 24 Well- Cell Culture Plate | Sorfa | 220300 | |
| Absolute ethanol | Biopack | 2207.10.00 | |
| Alexa Fluor 594 Donkey anti-rabbit IgG (H+L) | Invitrogen | R37119 | |
| Confocal Laser Scanning Microscope | Zeiss | LSM 800 | |
| Dexamethasone | Sigma Aldrich | D4902 | |
| DMEN | Sartorius | 01-052-1A | |
| Fetal Bovine Serum | NATOCOR | Lintc-634 | |
| Gemcitabina | Eli Lilly | VL7502 | |
| LC3B (D11) XP Rabbit mAb | Cell Signaling Technology | 3868S | |
| Methanol | Anedra | 6197 | |
| Parafilm "M" (Laboratory Sealing Film) | Bemis/Curwood | PM-996 | |
| Pen-Strep Solution | Sartorius | 03-031-1B | |
| PP242 | Santa Cruz Biotechnology | SC-301606 | |
| Trypsin EDTA | Gibco | 11570626 |
Ссылки
- Grasso, D., Renna, F. J., Vaccaro, M. I. Initial steps in mammalian autophagosome biogenesis. Frontiers in Cell and Developmental Biology. 6, 146(2018).
- Galluzzi, L., et al. Molecular definitions of autophagy and related processes. EMBO Journal. 36 (13), 1811-1836 (2017).
- Kitada, M., Koya, D. Autophagy in metabolic disease and ageing. Nature Reviews Endocrinology. 17 (11), 647-661 (2021).
- Ktistakis, N. T., Tooze, S. A. Digesting the expanding mechanisms of autophagy. Trends in Cell Biology. 26 (8), 624-635 (2016).
- Tanida, I., Ueno, T., Kominami, E. LC3 and autophagy. Methods in Molecular Biology. 445, 77-88 (2008).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. EMBO Journal. 19 (21), 5720-5728 (2000).
- Mizushima, N., Yoshimori, T. How to interpret LC3 immunoblotting. Autophagy. 3 (6), 542-545 (2007).
- Vanasco, V., et al. Mitochondrial dynamics and VMP1-related selective mitophagy in experimental acute pancreatitis. Frontiers in Cell and Developmental Biology. 9, 640094(2021).
- Williams, J. A. Regulatory mechanisms in pancreas and salivary acini. Annual Review of Physiology. 46, 361-375 (1984).
- Mizrahi, J. D., Surana, R., Valle, J. W., Shroff, R. T. Pancreatic cancer. Lancet. 395 (10242), 2008-2020 (2020).
- Li, J., et al. Regulation and function of autophagy in pancreatic cancer. Autophagy. 17 (11), 3275-3296 (2021).
- Ropolo, A., et al. A novel E2F1-EP300-VMP1 pathway mediates gemcitabine-induced autophagy in pancreatic cancer cells carrying oncogenic KRAS. Frontiers in Endocrinology. 11, 411(2020).
- Pardo, R., et al. Gemcitabine induces the VMP1-mediated autophagy pathway to promote apoptotic death in human pancreatic cancer cells. Pancreatology. 10 (1), 19-26 (2010).
- Logsdon, C. D., Moessner, J., Williams, J. A., Goldfine, I. D. Glucocorticoids increase amylase mRNA levels, secretory organelles, and secretion in pancreatic acinar AR42J cells. Journal of Cell Biology. 100 (4), 1200-1208 (1985).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (4th edition). Autophagy. 17 (1), 1(2021).
- Segeritz, C. -P., Vallier, L. Chapter 9 - Cell culture: Growing cells as model systems in vitro. Basic Science Methods for Clinical Researchers. Jalali, M., Saldanha, F. Y. L., Jalali, M. , Academic Press. Cambridge, MA. 151-172 (2017).
- Elliott, A. D. Confocal microscopy: Principles and modern practices. Current Protocols in Cytometry. 92 (1), 68(2020).
- Grasso, D., et al. a novel selective autophagy pathway mediated by VMP1-USP9x-p62, prevents pancreatic cell death. Journal of Biological Chemistry. 286 (10), 8308-8324 (2011).
- Ropolo, A., et al. The pancreatitis-induced vacuole membrane protein 1 triggers autophagy in mammalian cells. Journal of Biological Chemistry. 282 (51), 37124-37133 (2007).
- Karanasios, E., Stapleton, E., Walker, S. A., Manifava, M., Ktistakis, N. T. Live cell imaging of early autophagy events: Omegasomes and beyond. Journal of Visualized Experiments. (77), e50484(2013).
- Kuma, A., Matsui, M., Mizushima, N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: caution in the interpretation of LC3 localization. Autophagy. 3 (4), 323-328 (2007).
- Zhang, Z., Singh, R., Aschner, M. Methods for the detection of autophagy in mammalian cells. Current Protocols in Toxicology. 69, 1-26 (2016).
- Yoshii, S. R., Mizushima, N. Monitoring and measuring autophagy. International Journal of Molecular Sciences. 18 (9), 1865(2017).
- Betriu, N., Andreeva, A., Semino, C. E. Erlotinib promotes ligand-induced EGFR degradation in 3D but not 2D cultures of pancreatic ductal adenocarcinoma cells. Cancers. 13 (18), 4504(2021).
- Wang, W., Dong, L., Zhao, B., Lu, J., Zhao, Y. E-cadherin is downregulated by microenvironmental changes in pancreatic cancer and induces EMT. Oncology Reports. 40 (3), 1641-1649 (2018).
- Kim, S. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305(2020).
- Meng, Y., et al. Cytoplasmic EpCAM over-expression is associated with favorable clinical outcomes in pancreatic cancer patients with Hepatitis B virus negative infection. International Journal of Clinical and Experimental Medicine. 8 (12), 22204-22216 (2015).
- Brock, R., Hamelers, I. H., Jovin, T. M. Comparison of fixation protocols for adherent cultured cells applied to a GFP fusion protein of the epidermal growth factor receptor. Cytometry. 35 (4), 353-362 (1999).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены