需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用LC3免疫荧光评估两种不同胰腺细胞模型中的自噬水平
摘要
该协议的目标是通过LC3免疫荧光和LC3点定量确定胰腺癌和胰腺腺泡细胞中的自噬水平。
摘要
自噬是一种特殊的分解代谢过程,可选择性降解细胞质成分,包括蛋白质和受损细胞器。自噬允许细胞对压力刺激做出生理反应,从而维持细胞稳态。癌细胞可能会调节其自噬水平以适应不良条件,如缺氧、营养缺乏或化疗造成的损害。导管胰腺腺癌是最致命的癌症类型之一。胰腺癌细胞由于自噬蛋白的转录上调和翻译后激活而具有高自噬活性。
这里,PANC-1细胞系被用作胰腺人癌细胞的模型,AR42J胰腺腺泡细胞系被用作高度分化的哺乳动物细胞的生理模型。本研究使用微管相关蛋白轻链3(LC3)的免疫荧光作为自噬激活状态的指标。LC3是一种自噬蛋白,在基础条件下,在细胞质中显示出弥漫分布模式(在这种情况下称为LC3-I)。自噬诱导触发LC3与新形成的自噬体表面的磷脂酰乙醇胺的结合,形成LC3-II,这是一种有助于自噬体形成和扩增的膜结合蛋白。为了量化标记的自噬结构的数量,在"3D对象计数器"工具的帮助下使用了开源软件FIJI。
生理条件和癌细胞中自噬水平的测量使我们能够研究在缺氧、化疗或敲低某些蛋白质等不同条件下自噬的调节。
引言
巨自噬(通常称为自噬)是一种特殊的分解代谢过程,可选择性降解细胞质成分,包括蛋白质和受损细胞器1,2。自噬允许细胞对应激刺激做出生理反应,从而维持细胞稳态3。在自噬过程中,形成双膜囊泡:自噬体。自噬体包含货物分子并驱动它们到溶酶体进行降解1,4。
自噬体由自噬蛋白微管相关蛋白轻链3(LC3)5修饰。当不诱导自噬时,LC3以LC3-I构象扩散在细胞质和细胞核中。另一方面,当诱导自噬时,LC3与自噬结构6中的磷脂酰乙醇胺偶联。这种新的LC3构象被称为LC3-II1。LC3构象转移导致其细胞定位及其十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)迁移发生变化,这可以通过免疫荧光和蛋白质印迹5,7等技术检测到。通过这种方式,LC3偶联是自噬过程中的关键事件,可用于测量自噬活性。
胰腺腺泡细胞是一种高度分化的细胞,在健康条件下,自噬率较低。然而,在不同的生理条件下或在药物刺激下,它们可以激活自噬。因此,测定该细胞系中的自噬水平有助于研究不同药理学或生物制剂对自噬的潜在直接或间接影响8,9。
导管胰腺腺癌是最致命的癌症类型之一,因为它诊断较晚,化疗耐药性高10。由于自噬相关蛋白的转录上调和翻译后活化,胰腺癌细胞具有高自噬活性11。胰腺癌细胞可能会调整其自噬水平,以应对缺氧、营养剥夺或化疗引起的损伤等不利条件11。因此,分析胰腺癌细胞中的自噬水平可以帮助了解它们如何适应不同的环境,并评估自噬调节治疗的有效性。
这项研究展示了一种在两种不同的胰腺细胞模型中进行LC3免疫荧光的方法。第一个模型PANC-1细胞作为胰腺导管腺癌的模型。这些细胞用吉西他滨处理,吉西他滨是一种化疗药物,以前已被证明可以诱导自噬,特别是在携带致癌Kirsten大鼠肉瘤病毒基因(KRAS)的胰腺癌细胞中12,13。第二种模型AR42J细胞作为胰腺外分泌细胞的更生理模型。这些细胞用地塞米松分化,使其与腺泡胰腺细胞更相似14。在这些细胞中,通过使用PP242(一种有效的mTOR抑制剂15)在药理学上诱导自噬。在这项研究中,我们证明了用两种不同的胰腺模型描述的方案的适用性及其区分低自噬和高自噬状态的能力。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 细胞制备
- 将12毫米圆形盖玻片浸泡在无水乙醇中,并将它们垂直放置在24孔板的孔中。
- 取下盖子,将多孔板暴露在紫外线辐射下15分钟。
- 水平放置盖玻片,并用Dulbecco的改良鹰培养基(DMEM)清洗它们。
- 播种低传代数的胰腺细胞。应调整量,以在固定当天获得50%-75%的汇合度16。
注意:建议每孔接种2.5×104 PANC-1或4个×104 AR42J 细胞,以在3天后固定细胞。 - 在含有 10% 胎牛血清、100 U/mL 青霉素和 100 μg/mL 链霉素的 DMEM 中培养细胞,在 37 °C 的培养箱中,在含有 5% 二氧化碳 (CO2) 的潮湿气氛下。
注意:对于PANC-1细胞,建议在细胞接种和以下步骤之间孵育细胞2天。在此之后,可以转染,处理或固定细胞。该方案举例说明了在非转染的PANC-1细胞中使用吉西他滨的处理以及非转染的AR42J细胞的分化和PP242处理。
2. 处理细胞
- 吉西他滨治疗PANC-1细胞
- 接种后2天在DMEM中制备1μg/ μL吉西他滨溶液。用 2.6 μL 1 μg/μL 吉西他滨溶液处理每个孔,以达到 20 μM 的最终稀释度。
- 将细胞在培养箱中孵育24小时。
- AR42J 分化和 PP242 处理
- 在DMEM中制备4μg/ mL地塞米松的溶液。
- 用 4.9 μL 4 μg/mL 地塞米松溶液处理每个孔,以获得 100 nM 的最终稀释度。
- 将细胞在培养箱中孵育48小时。
- 除去培养基,并用 0.5 μL 的 1 mM PP242 处理每个孔,以获得 1 μM 的最终稀释液。
- 将细胞在培养箱中孵育2小时。
3. 固定和透化细胞
- 用冷甲醇制备 24 孔板和带有冷磷酸盐缓冲盐水的 6 孔板(PBS;137 mM NaCl、2.7 mM KCl、8 mM Na 2 HPO 4、2 mM KH2PO4)。将它们放在冰上。
- 用镊子取每个盖玻片,在PBS中洗涤两次,并在甲醇中孵育6分钟。
4. 阻塞细胞
- 在PBS中洗涤每个盖玻片两次,并在PBS(封闭溶液)中的10%胎牛血清中孵育1小时。
注意:在此步骤中,协议可能会暂停。盖玻片可以在封闭溶液中的冰箱中存放过夜,第二天可以继续该方案。
5. 用一抗孵育盖玻片
- 在封闭溶液中制备1:1,000的抗LC3溶液,并将其保持在冰上。
- 在多孔盖上放置一块实验室密封膜。
- 将抗LC3溶液的每张盖玻片一滴(25μL)放在密封膜上。
- 用镊子取每个盖玻片,并将其放在一抗液滴上,注意细胞侧与溶液接触。
- 通过将一张潮湿的纸放入平底塑料盒中来准备潮湿的房间。
- 将多孔板放入湿度室中,用箔纸盖住,并在冰箱中孵育过夜。
6. 用二抗孵育盖玻片
- 从湿度室中取出多孔板,然后将盖玻片放回多孔板中。
- 用PBS进行三次洗涤。
- 在封闭溶液中制备荧光标记的抗兔溶液,稀释度为1:800,并将其保存在避光的冰上。
- 将密封膜片放在多孔盖上。
- 将每张抗兔溶液盖玻片滴(25μL)放在密封膜上。
- 用镊子取每个盖玻片,并将其放在一抗液滴上,注意细胞侧与溶液接触。
- 将多孔板在室温(RT)避光下孵育2小时。
7. 用 4′ ,6-二脒基-2-苯基吲哚 (DAPI) 染色细胞
- 从湿度室中取出多孔板,然后将盖玻片放回多孔板中。
- 用PBS进行三次洗涤。
- 在PBS中制备300 nM的DAPI溶液(避光)。
- 用DAPI溶液孵育每个盖玻片10分钟。
- 用PBS进行三次洗涤。保持多孔板避光。
8. 蒙太奇
- 准备两个装有水和一张纸的烧杯。
- 将聚乙烯醇-双(三甲基铝)-1,4-二氮杂双环[2.2.2]辛烷加合物(PVA-DABCO)溶液的每个盖玻片滴(10μL)放在载玻片上。
注意:PVA-DABCO是通过在超纯水中混合0.25M DABCO,10%W / V PVA,20%甘油和50%Tris HCl(1.5M,pH 8.8)制备的。 - 用镊子取每个盖玻片,在每个水杯中清洗,在纸上干燥,然后将其放在PVA-DABCO液滴上(细胞与溶液接触)。
- 让它干燥过夜,避光。
9. 共聚焦显微镜观察和图像捕获
- 使用约63x17的物镜在倒置共聚焦显微镜中可视化盖玻片。
- 捕获标记细胞的代表性图像。
10. 量化LC3点
- 将包含捕获通道的每个图像文件(例如".czi")拖放到 ImageJ (FIJI) 屏幕中以打开。单击对话框中的" 确定 ",然后关闭 "控制台 "窗口。
- 从 "图像 "选项卡中,选择 "颜色">"拆分通道"。
- 关闭LC3图像以外的通道对应的图像。
- 从"图像"选项卡中,选择"调整>色彩平衡"
- 将" 最大值 "滑块向左移动,直到图像饱和以可视化单元格轮廓。
- 使用 手绘选择 工具绘制单元格轮廓。
- 单击重置按钮 以重置颜色 调整。
- 从" 编辑 "选项卡中,选择"剪切"以 剪切 所选项目。
- 关闭图像而不保存。
- 从 编辑 选项卡中,选择 粘贴。
- 在 分析 菜单中,选择工具 3D 对象计数器。
- 设置阈值。在本研究提供的示例中,阈值设置为 2,000。
- 设置大小筛选器。在这项研究中,它设定在 50 到 500 之间。
- 确保标记了"对象"和"摘要"框。
- 单击确定。点的数量将被描述为摘要中检测到的对象。
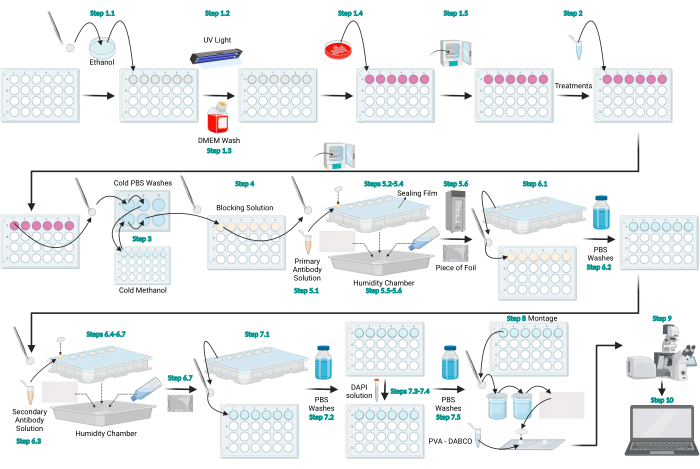
图 1:LC3 免疫荧光方案示意图。 表示LC3免疫荧光的一般方案的示意图。用 BioRender.com 创建的图。 请点击此处查看此图的大图。
Access restricted. Please log in or start a trial to view this content.
结果
该方案在胰腺细胞系中对LC3进行免疫荧光,以确定不同条件下的自噬水平。该实验的结果是从对应于LC3和DAPI的红色和蓝色通道获得细胞图像。LC3图像显示该蛋白的细胞分布,而DAPI显示核定位。 图2A 显示了在基础或吉西他滨处理条件下LC3的免疫荧光及其与PANC-1细胞中DAPI染色合并的代表性图像。使用斐济的 3D对象计数器 工具分析了一组LC3染色图像。使用该软件,...
Access restricted. Please log in or start a trial to view this content.
讨论
该协议中描述的方法允许可视化细胞中的内源性LC3分布并量化不同条件下的自噬水平。另一种用于分析LC3分布和确定自噬激活的类似方法涉及荧光标记的LC3转染(如RFP-LC3)19。RFP-LC3转染的优点是不需要固定(允许将该方法应用于活细胞成像20),更便宜,并且不依赖于LC3抗体反应性。另一方面,LC3的免疫荧光具有提供内源性LC3图像的优点,从而避免了与LC3过表?...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有宣布利益冲突。
致谢
这项工作得到了布宜诺斯艾利斯大学(UBACyT 2018-2020 20020170100082BA)、国家科学研究与技术委员会(CONICET)(PIP 2021-2023 GI− 11220200101549CO;和PUE 22920170100033)和国家科学技术促进局(PICT 2019-01664)的资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 10x Phosphate-Buffered Saline (PBS) | Corning | 46-013-CM | |
| 12 mm round coverslips | HDA | CBR_OBJ_6467 | |
| 24 Well- Cell Culture Plate | Sorfa | 220300 | |
| Absolute ethanol | Biopack | 2207.10.00 | |
| Alexa Fluor 594 Donkey anti-rabbit IgG (H+L) | Invitrogen | R37119 | |
| Confocal Laser Scanning Microscope | Zeiss | LSM 800 | |
| Dexamethasone | Sigma Aldrich | D4902 | |
| DMEN | Sartorius | 01-052-1A | |
| Fetal Bovine Serum | NATOCOR | Lintc-634 | |
| Gemcitabina | Eli Lilly | VL7502 | |
| LC3B (D11) XP Rabbit mAb | Cell Signaling Technology | 3868S | |
| Methanol | Anedra | 6197 | |
| Parafilm "M" (Laboratory Sealing Film) | Bemis/Curwood | PM-996 | |
| Pen-Strep Solution | Sartorius | 03-031-1B | |
| PP242 | Santa Cruz Biotechnology | SC-301606 | |
| Trypsin EDTA | Gibco | 11570626 |
参考文献
- Grasso, D., Renna, F. J., Vaccaro, M. I. Initial steps in mammalian autophagosome biogenesis. Frontiers in Cell and Developmental Biology. 6, 146(2018).
- Galluzzi, L., et al. Molecular definitions of autophagy and related processes. EMBO Journal. 36 (13), 1811-1836 (2017).
- Kitada, M., Koya, D. Autophagy in metabolic disease and ageing. Nature Reviews Endocrinology. 17 (11), 647-661 (2021).
- Ktistakis, N. T., Tooze, S. A. Digesting the expanding mechanisms of autophagy. Trends in Cell Biology. 26 (8), 624-635 (2016).
- Tanida, I., Ueno, T., Kominami, E. LC3 and autophagy. Methods in Molecular Biology. 445, 77-88 (2008).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. EMBO Journal. 19 (21), 5720-5728 (2000).
- Mizushima, N., Yoshimori, T. How to interpret LC3 immunoblotting. Autophagy. 3 (6), 542-545 (2007).
- Vanasco, V., et al. Mitochondrial dynamics and VMP1-related selective mitophagy in experimental acute pancreatitis. Frontiers in Cell and Developmental Biology. 9, 640094(2021).
- Williams, J. A. Regulatory mechanisms in pancreas and salivary acini. Annual Review of Physiology. 46, 361-375 (1984).
- Mizrahi, J. D., Surana, R., Valle, J. W., Shroff, R. T. Pancreatic cancer. Lancet. 395 (10242), 2008-2020 (2020).
- Li, J., et al. Regulation and function of autophagy in pancreatic cancer. Autophagy. 17 (11), 3275-3296 (2021).
- Ropolo, A., et al. A novel E2F1-EP300-VMP1 pathway mediates gemcitabine-induced autophagy in pancreatic cancer cells carrying oncogenic KRAS. Frontiers in Endocrinology. 11, 411(2020).
- Pardo, R., et al. Gemcitabine induces the VMP1-mediated autophagy pathway to promote apoptotic death in human pancreatic cancer cells. Pancreatology. 10 (1), 19-26 (2010).
- Logsdon, C. D., Moessner, J., Williams, J. A., Goldfine, I. D. Glucocorticoids increase amylase mRNA levels, secretory organelles, and secretion in pancreatic acinar AR42J cells. Journal of Cell Biology. 100 (4), 1200-1208 (1985).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (4th edition). Autophagy. 17 (1), 1(2021).
- Segeritz, C. -P., Vallier, L. Chapter 9 - Cell culture: Growing cells as model systems in vitro. Basic Science Methods for Clinical Researchers. Jalali, M., Saldanha, F. Y. L., Jalali, M. , Academic Press. Cambridge, MA. 151-172 (2017).
- Elliott, A. D. Confocal microscopy: Principles and modern practices. Current Protocols in Cytometry. 92 (1), 68(2020).
- Grasso, D., et al. a novel selective autophagy pathway mediated by VMP1-USP9x-p62, prevents pancreatic cell death. Journal of Biological Chemistry. 286 (10), 8308-8324 (2011).
- Ropolo, A., et al. The pancreatitis-induced vacuole membrane protein 1 triggers autophagy in mammalian cells. Journal of Biological Chemistry. 282 (51), 37124-37133 (2007).
- Karanasios, E., Stapleton, E., Walker, S. A., Manifava, M., Ktistakis, N. T. Live cell imaging of early autophagy events: Omegasomes and beyond. Journal of Visualized Experiments. (77), e50484(2013).
- Kuma, A., Matsui, M., Mizushima, N. LC3, an autophagosome marker, can be incorporated into protein aggregates independent of autophagy: caution in the interpretation of LC3 localization. Autophagy. 3 (4), 323-328 (2007).
- Zhang, Z., Singh, R., Aschner, M. Methods for the detection of autophagy in mammalian cells. Current Protocols in Toxicology. 69, 1-26 (2016).
- Yoshii, S. R., Mizushima, N. Monitoring and measuring autophagy. International Journal of Molecular Sciences. 18 (9), 1865(2017).
- Betriu, N., Andreeva, A., Semino, C. E. Erlotinib promotes ligand-induced EGFR degradation in 3D but not 2D cultures of pancreatic ductal adenocarcinoma cells. Cancers. 13 (18), 4504(2021).
- Wang, W., Dong, L., Zhao, B., Lu, J., Zhao, Y. E-cadherin is downregulated by microenvironmental changes in pancreatic cancer and induces EMT. Oncology Reports. 40 (3), 1641-1649 (2018).
- Kim, S. K., et al. Phenotypic heterogeneity and plasticity of cancer cell migration in a pancreatic tumor three-dimensional culture model. Cancers. 12 (5), 1305(2020).
- Meng, Y., et al. Cytoplasmic EpCAM over-expression is associated with favorable clinical outcomes in pancreatic cancer patients with Hepatitis B virus negative infection. International Journal of Clinical and Experimental Medicine. 8 (12), 22204-22216 (2015).
- Brock, R., Hamelers, I. H., Jovin, T. M. Comparison of fixation protocols for adherent cultured cells applied to a GFP fusion protein of the epidermal growth factor receptor. Cytometry. 35 (4), 353-362 (1999).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。