A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصوير الكالسيوم في القولون العلوي للفأر
* These authors contributed equally
In This Article
Summary
يفصل هذا البروتوكول الإجراء الخاص بتصوير استجابات الكالسيوم في القولون العلوي (SC) للفئران المستيقظة ، بما في ذلك تصوير نشاط الخلايا العصبية المفردة باستخدام المجهر ثنائي الفوتون مع ترك القشرة سليمة في الفئران البرية ، وتصوير SC بأكمله بالمجهر واسع المجال في الفئران الطافرة ذات القشرة الجزئية.
Abstract
القولون العلوي (SC) ، وهو هيكل دماغي متوسط محفوظ تطوريا في جميع الفقاريات ، هو المركز البصري الأكثر تطورا قبل ظهور القشرة الدماغية. يتلقى مدخلات مباشرة من ~ 30 نوعا من خلايا العقدة الشبكية (RGCs) ، مع كل ترميز ميزة بصرية محددة. لا يزال من بعيد المنال ما إذا كان SC يرث ببساطة ميزات الشبكية أو إذا حدثت معالجة إضافية وربما جديدة في SC. للكشف عن الترميز العصبي للمعلومات المرئية في SC ، نقدم هنا بروتوكولا مفصلا لتسجيل الاستجابات المرئية بصريا بطريقتين متكاملتين في الفئران المستيقظة. تستخدم إحدى الطرق الفحص المجهري ثنائي الفوتون لتصوير نشاط الكالسيوم بدقة خلية واحدة دون إزالة القشرة المتراكبة ، بينما تستخدم الطريقة الأخرى الفحص المجهري واسع المجال لتصوير SC بالكامل للفأر الطافر الذي تكون قشرته غير متطورة إلى حد كبير. يفصل هذا البروتوكول هاتين الطريقتين ، بما في ذلك تحضير الحيوانات ، والحقن الفيروسي ، وزرع الألواح الأمامية ، وزرع السدادة ، والحصول على البيانات ، وتحليل البيانات. تظهر النتائج التمثيلية أن تصوير الكالسيوم ثنائي الفوتون يكشف عن استجابات عصبية مستثارة بصريا بدقة خلية واحدة ، ويكشف تصوير الكالسيوم واسع المجال عن النشاط العصبي عبر SC بأكمله. من خلال الجمع بين هاتين الطريقتين ، يمكن للمرء أن يكشف عن الترميز العصبي في SC بمقاييس مختلفة ، ويمكن أيضا تطبيق هذا المزيج على مناطق الدماغ الأخرى.
Introduction
القولون العلوي (SC) هو مركز بصري مهم في جميع الفقاريات. في الثدييات ، يتلقى مدخلات مباشرة من شبكية العين والقشرة البصرية1. بينما تم تطبيق التسجيل البصري على نطاق واسع على القشرة2،3،4،5 ، فإن تطبيقه في SC يعوقه ضعف الوصول البصري6،7،8،9،10،11،12،13،14،15،16،17، 18,19. الهدف من هذا البروتوكول هو تقديم تفاصيل حول طريقتين تكميليتين للتسجيل البصري للنشاط العصبي في SC.
يقع SC تحت القشرة والجيب المستعرض ، مما يحد من الوصول البصري إلى الخلايا العصبية الغروية. تتمثل إحدى الطرق للتغلب على هذا القيد في استنشاق القشرة المتراكبة وكشف SCالأمامي الجانبي 7،9،10،13،14،19. ومع ذلك ، نظرا لأن SC يتلقى مدخلات قشرية ، فقد تؤثر مثل هذه العملية على كيفية استجابة الخلايا العصبية SC للمنبهات البصرية. للتغلب على هذا القيد ، نوضح هنا بروتوكولا بديلا لتصوير الطبقة السطحية من SC الخلفي الإنسي بسدادة سيليكون ، مع ترك القشرة سليمة 8,11. على وجه التحديد ، لتحقيق دقة خلية واحدة ، قمنا بتطبيق المجهر ثنائي الفوتون لتصوير استجابات الكالسيوم في SC الخلفي الإنسي للفئران البرية. بالإضافة إلى ذلك ، لتحقيق تغطية واسعة ، قمنا بتطبيق الفحص المجهري واسع المجال لتصوير SC بالكامل لفأر متحور لم تتطور قشرته الخلفية20.
الطريقتان الموصوفتان في هذا البروتوكول متكاملتان لبعضهما البعض. يعد تصوير الكالسيوم ثنائي الفوتون دون إزالة القشرة مناسبا لتسجيل النشاط العصبي بدقة خلية واحدة مع مدخلات قشرية سليمة. يعد تصوير الكالسيوم واسع المجال مناسبا لتسجيل النشاط العصبي في SC بأكمله مع التضحية بالدقة المكانية.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم تنفيذ جميع الإجراءات التجريبية وفقا لإرشادات رعاية الحيوان وتمت الموافقة عليها من قبل IACUC في المعهد الصيني لأبحاث الدماغ ، بكين.
ملاحظة: الجدول الزمني لهذا البروتوكول هو كما يلي: 1) جعل الالتصاق كوب. 2) حقن الفيروس. 3) زرع صفيحة الرأس. 4) بعد 3 أسابيع ، زرع القابس. 5) بعد ~ 3 أيام الانتعاش والتعود على حلقة مفرغة ، إجراء التصوير ثنائي الفوتون / واسع المجال.
1. تحضير كوب شفط (الشكل 1 أ)
- قم بإيداع قطرة من محلول ملحي مخزن بالفوسفات (PBS ، 1x) في طبق أكريليك ولمسه بإبرة مسطحة 21 جم لملء الطرف بالشعيرات الدموية.
- قم بتغطية طرف الإبرة بمادة لاصقة سيليكون شفافة واضبطها لمدة ~ 10 دقائق.
- قطع لاصق السيليكون مع مقص إلى قرص بقطر ~ 2 مم.
2. تحضير المقابس (الشكل 1 ب)
- قم بإعداد مخزون رقاقة بلاستيكي بسمك 0.75 مم واقطع مربعا بحجم 1 سم × 1 سم في المنتصف. تحضير اثنين من كتل الاكريليك. نظف مخزون الرقاقة وكتل الأكريليك بالكحول وامسحها بورق العدسة.
- ضع مخزون الرقاقة على كتلة أكريليك واحدة ، وقم بإيداع لاصق السيليكون في المنتصف لملء ~ 90٪ من الفتحة (تجنب الفقاعات) ، وأضف كتلة أكريليك أخرى وقوة ~ 1 كجم ، وانتظر 20 دقيقة.
- تحت المجهر الجراحي ، قم بقطع لاصق السيليكون بمشرط إلى منشورات مثلثة بارتفاع 1 مم وعرض 1.5 مم فوق قطعة من الورق مع مثلثات مطبوعة عليها.
- قم بإزالة أي غبار من المنشور الثلاثي بشريط لاصق بلاستيكي وضعه على غطاء زجاجي بقطر 5 مم وسمك 0.15 مم.
- ضع غطاء الغطاء مع المنشور الثلاثي تحت معالج الهالة ، وقم بتشغيل معالج الهالة ، واجعله أقرب إلى غطاء الغطاء حتى يظهر البرق. احتفظ بها في هذا الموضع لبضع دقائق حتى يتم ربطها ببعضها البعض.
ملاحظة: قد تكون هذه الخطوة مختلفة بالنسبة لمعالجي كورونا الآخرين. - ضع المقابس في طبق بتري وضعها في حاضنة على حرارة 70 درجة مئوية طوال الليل.
3. إعداد الحيوانات وحقن البناء الفيروسي
- استخدم C57BL / 6J (النوع البري) و Emx1-Cre: Pals1flox / wt (القشرة الجزئية) 20 فأرا من كلا الجنسين في عمر 6 أسابيع (9 أسابيع في وقت التصوير).
- تعقيم جميع المواد والأدوات المستخدمة في العملية الجراحية.
- تخدير الفأر بنسبة 5٪ إيزوفلوران ثم الحفاظ على الأيزوفلوران عند 1٪ -2٪ بمعدل تدفق 1 لتر / دقيقة أثناء الجراحة. تأكيد مستوى التخدير من خلال عدم وجود منعكس قرصة اصبع القدم.
- إصلاح رأس الماوس على إطار مجسم مع قضبان الأذن. طوال الجراحة ، ضع مرهما للعيون على عيون الفأر لمنع الجفاف ، وحافظ على درجة حرارة جسمه عند 37 درجة مئوية باستخدام وسادة تسخين ثرموستاتي.
- حلق الفراء وعقم سطح الجلد باليودوفور و 75٪ من الإيثانول. حقن ليدوكائين (5 ملغ/كغ، حقن تحت الجلد [SQ])، تيليدين (2 ملغ/كغ، SQ)، وميلوكسيكام (2 ملغ/كغ، SQ).
ملاحظة: قد يختلف الإجراء الجراحي للتعقيم وتسكين الألم والتخدير الموضعي باختلاف المؤسسات. - قم بإزالة الجلد فوق SC بمقص جراحي لكشف الجمجمة. تنظيف الجمجمة مع مسحة القطن.
- اضبط الإطار التجسيمي حتى يصبح سطح الجمجمة مسطحا. حفر حفرة 0.5 مم جانبية و 0.42 مم أمام لامدا حتى تتعرض الجافية.
- حقن الفيروس المرتبط بالغدي (AAV) الذي يعبر عن GCaMP6m (rAAV2 / 9-hsyn-GCaMP6m ؛ 1 × 10 13 GC / mL مذاب في1x PBS) على أعماق 1 مم و 1.6 مم من لامدا باستخدام ميكروبيت زجاجي مشطوف (الطرف مشطوف إلى 25 درجة بقطر 40-50 ميكرومتر).
- في كل عمق ، احقن 100 نانولتر بسرعة 50 نانولتر / دقيقة وانتظر 5 دقائق بعد كل حقنة. بعد الحقن ، اسحب الحاقن ببطء.
4. زرع صفيحة الرأس
- تنظيف العضلات والأنسجة فوق الجمجمة وخدش الجمجمة بشفرة. في حالة حدوث نزيف ، أوقفه برغوة الجل ونظف الدم. قم بتوصيل صفيحة الرأس (الشكل 1 ج) بالجمجمة باستخدام أسمنت راتنج لاصق للأسنان ذاتي المعالجة. على وجه التحديد ، امزج 3/4 ملعقة من البوليمر وثلاث قطرات من المونومر وقطرة واحدة من العامل الحفاز في وعاء خزفي على الجليد. ضع الخليط على لوح الرأس والجمجمة. قم بإرفاقها معا وانتظر 5 دقائق حتى يتم تثبيت المادة اللاصقة.
- حقن المضادات الحيوية (سيفتيوفور الصوديوم، 5 ملغ/كغ، SQ) لمنع العدوى. قم بإزالة الماوس من الإطار التجسيمي وضعه على وسادة التدفئة للتعافي. إعادته إلى قفص المنزل بعد التعافي من التخدير. لإدارة الألم ، قم بتوفير مياه الشرب المحتوية على الإيبوبروفين (0.5 مل / 50 مل) للفأر لمدة 3 أيام بعد الجراحة.
5. زرع القابس (الشكل 2)
- زرع القابس بعد 3 أسابيع من الحقن الفيروسي. تخدير الماوس وتثبيته على إطار مجسم، كما هو موضح في الخطوات 3.2-3.5. تحضير رغوة هلام غارقة في المياه المالحة لوقف النزيف المحتمل.
- حفر بيضاوي 3 مم × 2 مم باستخدام مثقاب صغير متمركز عند 0.5 مم خلف لامدا. رقيقة حدود البيضاوي حتى الشقوق. قم بتخفيف الجمجمة أمام نافذة التسجيل البيضاوية لجعل الغطاء قريبا من SC.
- خلع اللوحات العظمية باستخدام ملقط ناعم. قم بعمل قطع على الجافية الخلفية للجيب المستعرض وإزالة قطعة الجافية. إذا لزم الأمر ، أضف السائل النخاعي الاصطناعي (ACSF) إلى الدماغ باستخدام حقنة سعة 3 مل لمنع الجفاف. تجفيف الجمجمة ونافذة التسجيل مع رغوة هلام ومسحات القطن.
- قم بإيداع قطرة من لاصق السيليكون في نافذة التسجيل. استخدم كوب الشفط لتثبيت القابس بضغط سلبي. استخدم مناولة دقيقة آلية لتحريك كوب الشفط وخفض القابس في لاصق السيليكون حتى يلامس غطاء الجمجمة. بعد ذلك ، حرك القابس للأمام ~ 1 مم لدفع الجيب المستعرض بعيدا وفضح SC. يجب أن تتم هذه الخطوة في 1-2 دقيقة قبل أن يصبح لاصق السيليكون لزجا.
- نظف صفيحة الرأس وضع البوتيل سيانواكريلات والأسمنت الراتنج حول حدود القابس لتثبيته على لوح الرأس.
ملاحظة: توفير رعاية ما بعد الجراحة، كما هو موضح في الخطوة 4.2.
6. التصوير ثنائي الفوتون (الشكل 3)
- إصلاح رأس الحيوان على حلقة مفرغة دوارة مع لوح الرأس. ضع جهاز المشي تحت مجهر ثنائي الفوتون واضبط الارتفاع على الموضع المناسب. ضع مخروطا أسود من الألومنيوم بين الهدف ولوح الرأس لمنع تلوث الضوء من الشاشة للتحفيز البصري. تعويد الماوس لمدة ~ 15 دقيقة.
- قم بإجراء تصوير ثنائي الفوتون على المجهر بتكبير 16x وفتحة عددية 0.8 (NA) ومسافة عمل 3 مم (WD). استخدم ليزر Ti: sapphire مع تقنية قفل الوضع التي يتم التحكم فيها بواسطة ماسحين ضوئيين galvo لإثارة GCaMP6m عند 920 نانومتر. اضبط طاقة الليزر في مستوى العينة بين 20-80 ميجاوات.
- امسح مجال رؤية 600 ميكرومتر × 600 ميكرومتر عند 4.8 هرتز بدقة مكانية تبلغ 2.4 μ م / بكسل ، والنشاط العصبي للصورة عبر عمق يصل إلى 350 μ م.
ملاحظة: معدل أخذ العينات والدقة المكانية مخصصان لماسحات galvo ، ويجب تعديلهما للماسحات الضوئية الرنانة. - اجمع التألق المنبعث باستخدام مرآة ثنائية اللون واكتشفه باستخدام أنبوب مضاعف ضوئي (PMT) بعد تمريره عبر مرشح تمرير النطاق.
- سجل حركة الماوس على جهاز المشي باستخدام جهاز تشفير دوار. استخدم كاميرا مزودة بعدسة مقاس 50 مم لتسجيل حجم حدقة العين وموضعها. قم بمزامنة هذه التسجيلات وعمليات التقاط الصور مع التحفيز البصري عن طريق تسجيل المشغلات المرسلة بواسطة كمبيوتر التحفيز.
7. تحليل استجابات الكالسيوم المقاسة بالتصوير ثنائي الفوتون
- صحح حركة الدماغ أثناء التصوير باستخدام SIMA21 أو NoRMCorre22.
- ارسم منطقة اهتمام (ROI) يدويا باستخدام أداة العصا السحرية للخلية (ImageJ) وقم بتركيبها مع القطع الناقص في MATLAB. استخراج آثار مضان لكل عائد استثمار بعد إزالة التلوث العصبي:
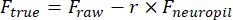
Ftrue و F rawهما السعة الفلورية المصححة والخام لعائد الاستثمار ، على التوالي ، F neuropil هي السعة الفلورية لل neuropil المحيط ، و r هو عامل تلوث neuropilخارج التركيز (0.7 لإعدادنا). يتم تقدير r عن طريق قياس الإشارات الموجودة على الأوعية الدموية التي Ftrue = 0 ، كما هو موضح سابقا23,24. - قم بإزالة تقلبات خط الأساس البطيئة عن طريق طرح القيمة المئوية الثامنة من نافذة 15 s المتمركزة على كل إطار25.
- حدد الاستجابات البصرية للخلية العصبية على أنها التغير النسبي لسعة التألق في عائد الاستثمار خلال فترة التحفيز:
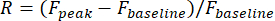
ذروة F هي سعة الذروة لتتبع التألق أثناء التحفيز البصري ، وخط الأساسFهو متوسط السعة خلال فترة 0.5 ثانية قبل التحفيز.
8. التصوير واسع المجال وتحليل البيانات (الشكل 4)
- بناء المجهر واسع المجال مع عدسة جنبا إلى جنب4 (الشكل 4A). المجهر ذو العدسة الترادفية عبارة عن عدستين للكاميرا (50 مم و 105 مم) متصلتين عبر محول ، والتكبير ~ 2x.
- تحضير الفئران الطافرة ذات القشرة الجزئية كما هو موضح في الخطوات 3.2-3.5. حقن 100 nL من AAV معبرا عن GCaMP6m على عمق 200 ميكرومتر في وسط كل جانب من SC.
- بعد ~ 3 أسابيع ، قم بزرع غطاء قطره 5 مم فوق SC. قم بإجراء حج القحف البيضاوي 4 مم × 3 مم في منتصف SC وقم بتخفيف العظم المحيط به. ثم اضغط على غطاء الغطاء مباشرة على SC وقم بتثبيته بالأسمنت الراتنجي.
- قم بإثارة GCaMP6m باستخدام الصمام الثنائي الباعث للضوء الأزرق (LED) مع مرشح الإثارة (469 نانومتر ± 35 نانومتر). التقط صورا باستخدام كاميرا تكميلية لأشباه موصلات أكسيد المعادن (CMOS) بعد تمرير مرشح انبعاث (525 نانومتر ± 39 نانومتر) عند 10 هرتز. تغطي الكاميرا مساحة 5.36 مم × 2.85 مم بدقة مكانية تبلغ 2.63 ميكرومتر / بكسل.
- قم بتجميع كل صورة تم الحصول عليها باستخدام مرشح مربع طبيعي وقم بتقليلها إلى 1/4 من الحجم الأصلي. لكل بكسل في الصورة، حدد الاستجابة، كما هو موضح في الخطوة 7.4.
ملاحظة: توفير رعاية ما بعد الجراحة، كما هو موضح في الخطوة 4.2.
Access restricted. Please log in or start a trial to view this content.
النتائج
يوضح الشكلان 1 أ ، ب كيفية صنع كوب الشفط والمقابس ، على التوالي. يوضح الشكل 2 كيفية زرع القابس بنجاح. بعد زرع القابس ، يتم الكشف عن SC الخلفي الإنسي ، كما هو موضح في الشكل 2D. يوضح الشكل 3 استجابات الكالسيوم للخلايا العصب?...
Access restricted. Please log in or start a trial to view this content.
Discussion
الخطوات الحاسمة في البروتوكول
الخطوة الأكثر أهمية هي حج القحف في الخطوتين 5.2 و 5.3. أولا ، العظم عند 0.5 مم خلف لامدا سميك ويحتوي على أوعية دموية بداخله ، مما قد يسبب النزيف أثناء عملية الحفر. يجب تحضير رغوة هلام كافية لوقف النزيف. ثانيا ، هناك فرصة جيدة للإصابة بالتهاب الأوعية الدمو...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يتم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (32271060). صمم Y.-t.L. البحث ، وأجرى التجربة ، وحلل البيانات ، وكتب المخطوطة. أجرى Z.L. و R.W. التجربة.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 16x objective | Nikon | ||
| 50-mm lens | Computar | M5018-MP2 | |
| 5-mm coverslip | Warner instruments | CS-5R | |
| bandpass filter | Chroma Technology | HQ575/250 m-2p | |
| butyl cyanoacrylate | Vetbond, World Precision Instruments | ||
| camera for monitoring pupil | FLIR | BFS-U3-04S2M-CS | |
| camera for widefield imaging | Basler | acA2000-165µm | |
| corona treater | Electro-Technic Products | BD-20AC | |
| dichroic | Chroma Technology | T600/200dcrb | |
| galvanometers | Cambridge Technology | ||
| glass bead sterilizer | RWD | RS1502 | |
| microdrill | RWD | 78001 | |
| micromanipulator | Sutter Instruments | QUAD | |
| photomultiplier tube | Hamamatsu | R3896 | |
| rotory encoder | USdigital | MA3-A10-125-N | |
| self-curing dental adhesive resin cement | SuperBond C&B, Sun Medical Co, Ltd. Moriyama, Japan | ||
| thermostatic heating pad | RWD | 69020 | |
| Ti:Sapphire laser | Spectra-Physics | Mai Tai HP DeepSee | |
| translucent silicone adhesive | Kwik-Sil, World Precision Instruments | ||
| treadmill | Xinglin Biology | ||
| Virus Strains | |||
| rAAV2/9-hsyn-Gcamp6m | Vector Core at Chinese Institute for Brain Research, Beijing | ||
| Animals | |||
| C57BL/6J wild type | Laboratory Animal Resource Center at Chinese Institute for Brain Research, Beijing | ||
| Emx1-Cre | The Jackson Laboratory | 5628 | |
| Pals1flox/wt | Christopher A. Walsh Lab | ||
| Software | |||
| ImageJ | NIH Image | ||
| Labview | National Instruments | ||
| MATLAB | Mathworks |
References
- May, P. J. The mammalian superior colliculus: laminar structure and connections. Progress in Brain Research. 151, 321-378 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Ohki, K., Chung, S., Ch'ng, Y. H., Kara, P., Reid, R. C. Functional imaging with cellular resolution reveals precise micro-architecture in visual cortex. Nature. 433 (7026), 597-603 (2005).
- Ratzlaff, E. H., Grinvald, A. A tandem-lens epifluorescence macroscope: Hundred-fold brightness advantage for wide-field imaging. Journal of Neuroscience Methods. 36 (2-3), 127-137 (1991).
- de Vries, S. E. J., et al. A large-scale standardized physiological survey reveals functional organization of the mouse visual cortex. Nature Neuroscience. 23 (1), 138-151 (2020).
- Mrsic-Flogel, T. D., et al. Altered map of visual space in the superior colliculus of mice lacking early retinal waves. The Journal of Neuroscience. 25 (29), 6921-6928 (2005).
- Cang, J., Wang, L., Stryker, M. P., Feldheim, D. A. Roles of ephrin-as and structured activity in the development of functional maps in the superior colliculus. The Journal of Neuroscience. 28 (43), 11015-11023 (2008).
- Feinberg, E. H., Meister, M. Orientation columns in the mouse superior colliculus. Nature. 519 (7542), 229-232 (2015).
- Ahmadlou, M., Heimel, J. A. Preference for concentric orientations in the mouse superior colliculus. Nature Communications. 6, 6773(2015).
- de Malmazet, D., Kühn, N. K., Farrow, K. Retinotopic separation of nasal and temporal motion selectivity in the mouse superior colliculus. Current Biology. 28 (18), 2961-2969 (2018).
- Li, Y. T., Turan, Z., Meister, M. Functional architecture of motion direction in the mouse superior colliculus. Current Biology. 30 (17), 3304-3315 (2020).
- Gribizis, A., et al. Visual cortex gains independence from peripheral drive before eye opening. Neuron. 104 (4), 711-723 (2019).
- Inayat, S., et al. Neurons in the most superficial lamina of the mouse superior colliculus are highly selective for stimulus direction. The Journal of Neuroscience. 35 (20), 7992-8003 (2015).
- Barchini, J., Shi, X., Chen, H., Cang, J. Bidirectional encoding of motion contrast in the mouse superior colliculus. eLife. 7, 35261(2018).
- Savier, E. L., Chen, H., Cang, J. Effects of locomotion on visual responses in the mouse superior colliculus. The Journal of Neuroscience. 39 (47), 9360-9368 (2019).
- Schröder, S., et al. Arousal modulates retinal output. Neuron. 107 (3), 487-495 (2020).
- Ge, X., et al. Retinal waves prime visual motion detection by simulating future optic flow. Science. 373 (6553), (2021).
- Chen, H., Savier, E. L., DePiero, V. J., Cang, J. Lack of evidence for stereotypical direction columns in the mouse superior colliculus. The Journal of Neuroscience. 41 (3), 461-473 (2021).
- Kasai, M., Isa, T. Effects of light isoflurane anesthesia on organization of direction and orientation selectivity in the superficial layer of the mouse superior colliculus. The Journal of Neuroscience. 42 (4), 619-630 (2022).
- Kim, S., et al. The apical complex couples cell fate and cell survival to cerebral cortical development. Neuron. 66 (1), 69-84 (2010).
- Kaifosh, P., Zaremba, J. D., Danielson, N. B., Losonczy, A. S. I. M. A. Python software for analysis of dynamic fluorescence imaging data. Frontiers in Neuroinformatics. 8, 80(2014).
- Pnevmatikakis, E. A., Giovannucci, A. NoRMCorre: An online algorithm for piecewise rigid motion correction of calcium imaging data. Journal of Neuroscience Methods. 291, 83-94 (2017).
- Kerlin, A. M., Andermann, M. L., Berezovskii, V. K., Reid, R. C. Broadly tuned response properties of diverse inhibitory neuron subtypes in mouse visual cortex. Neuron. 67 (5), 858-871 (2010).
- Göbel, W., Helmchen, F. In vivo calcium imaging of neural network function. Physiology. 22 (6), 358-365 (2007).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56 (1), 43-57 (2007).
- Evans, D. A., et al. A synaptic threshold mechanism for computing escape decisions. Nature. 558 (7711), 590-594 (2018).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved