需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠上丘的钙成像
摘要
该方案详细介绍了在清醒小鼠的上丘(SC)中对钙反应进行成像的过程,包括用双光子显微镜成像单神经元活动,同时在野生型小鼠中保持皮层完整,以及在部分皮层突变小鼠中用宽场显微镜对整个SC进行成像。
摘要
上丘(SC)是所有脊椎动物进化上保守的中脑结构,是大脑皮层出现之前最复杂的视觉中心。它接收来自 ~30 种视网膜神经节细胞 (RGC) 的直接输入,每种细胞编码特定的视觉特征。SC 是否只是继承视网膜特征,或者 SC 中是否发生了额外的和潜在的 从头 处理,仍然难以捉摸。为了揭示SC中视觉信息的神经编码,我们在这里提供了一个详细的协议,以在清醒小鼠中使用两种互补方法光学记录视觉反应。一种方法使用双光子显微镜以单细胞分辨率对钙活性进行成像,而不消融覆盖的皮层,而另一种方法使用宽视场显微镜对皮层基本未发育的突变小鼠的整个SC进行成像。该协议详细介绍了这两种方法,包括动物制备、病毒注射、头板植入、栓子植入、数据采集和数据分析。代表性结果表明,双光子钙成像揭示了单细胞分辨率下的视觉诱发神经元反应,而宽视野钙成像揭示了整个SC的神经活动。通过结合这两种方法,人们可以揭示SC中不同尺度的神经编码,并且这种组合也可以应用于其他大脑区域。
引言
上丘(SC)是所有脊椎动物的重要视觉中枢。在哺乳动物中,它接收来自视网膜和视觉皮层的直接输入1。虽然光学记录已广泛应用于皮层 2,3,4,5,但其在 SC 中的应用受到不良光学访问的阻碍 6,7,8,9,10,11,12,13,14,15,16,17 ,18,19.该协议的目标是提供有关用于光学记录SC中神经活动的两种互补方法的详细信息。
SC 位于皮层和横窦下方,这限制了对胶状神经元的光学接触。克服这一限制的一种方法是吸出覆盖的皮层并暴露前外侧 SC 7,9,10,13,14,19。然而,由于 SC 接收皮层输入,这样的操作可能会影响 SC 神经元对视觉刺激的反应。为了克服这一限制,我们在这里详细介绍了一种替代方案,即用硅塞对后内侧 SC 的浅层进行成像,同时保持皮层完整 8,11。具体来说,为了实现单细胞分辨率,我们应用双光子显微镜对野生型小鼠后内侧SC的钙反应进行成像。此外,为了实现广泛的覆盖范围,我们应用宽视野显微镜对后皮层尚未发育的突变小鼠的整个SC进行成像20。
该协议中描述的两种方法是相互补充的。不消融皮层的双光子钙成像适用于以单细胞分辨率记录具有完整皮层输入的神经活动。宽视场钙成像适用于记录整个SC的神经活动,同时牺牲空间分辨率。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有实验程序均按照动物福利指南进行,并得到北京中国脑科学研究院IACUC的批准。
注意:该协议的时间表如下:1)制作吸盘;2)注射病毒;3)植入头板;4)3周后,植入塞子;5) 在跑步机上恢复和适应 ~3 天后,进行双光子/宽视场成像。
1.吸盘的准备(图1A)
- 将一滴磷酸盐缓冲盐水(PBS,1x)放入丙烯酸培养皿中,并用21G扁平针触摸它,以通过毛细管填充尖端。
- 用半透明的硅胶粘合剂覆盖针尖,并放置约~10分钟。
- 用剪刀将硅胶粘合剂剪成直径为 ~2 毫米的圆盘。
2.插头的准备(图1B)
- 准备一个 0.75 毫米厚的塑料垫片,并在中心切出一个 1 厘米 x 1 厘米的正方形。准备两个亚克力块。用酒精清洁垫片和亚克力块,然后用镜头纸擦拭。
- 将垫片放在一个亚克力块上,将硅胶粘合剂沉积到中心以填充~90%的开口(避免气泡),添加另一个亚克力块和~1 kg力,然后等待20分钟。
- 在手术显微镜下,用手术刀将硅胶粘合剂切割成 1 毫米高 x 1.5 毫米宽的三棱柱,上面印有三角形。
- 用塑料胶带清除三棱镜上的所有灰尘,并将其放在直径为 5 毫米、厚度为 0.15 毫米的玻璃盖玻片上。
- 将带有三棱柱的盖玻片放在电晕处理机下,打开电晕处理器,并将其靠近盖玻片,直到出现闪电。将它保持在该位置几分钟,直到它们相互连接。
注意: 对于其他电晕处理机,此步骤可能有所不同。 - 将塞子放入培养皿中,并将其置于70°C的培养箱中过夜。
3.动物的制备和病毒构建体的注射
- 在6周龄(成像时9周)使用C57BL / 6J(野生型)和Emx1-Cre:Pals1flox / wt (部分皮层)20 只小鼠。
- 对用于外科手术的所有材料和器械进行消毒。
- 用5%异氟烷麻醉小鼠,然后在手术过程中以1L / min的流速将异氟烷维持在1%-2%。通过缺乏脚趾捏合反射来确认麻醉水平。
- 将鼠标头部固定在带有耳杆的立体定位框架上。在整个手术过程中,将眼药膏涂在小鼠眼睛上以防止干燥,并用恒温加热垫将其体温保持在37°C。
- 剃掉毛皮并用碘伏和75%乙醇对皮肤表面进行消毒。注射利多卡因(5 mg/kg,皮下注射 [SQ])、替利定(2 mg/kg,SQ)和美洛昔康(2 mg/kg,SQ)。
注意:绝育、镇痛和局部麻醉的手术程序可能因机构而异。 - 用手术剪刀去除SC上的皮肤,露出颅骨。用棉签清洁头骨。
- 调整立体定位框架,直到颅骨表面平坦。在λ的侧面和0.42毫米的侧面钻一个孔,直到硬脑膜暴露出来。
- 用斜面玻璃微量移液管(尖端斜面至25°,直径为40-50μm)在距λ1mm和1.6mm的深度注射表达GCaMP6m(rAAV2 / 9-hsyn-GCaMP6m;1×1013GC / mL溶解在1x PBS中的腺相关病毒(AAV)。
- 在每个深度,以 50 nL/min 的速度进样 100 nL,每次进样后等待 5 分钟。注射后,慢慢抽出注射器。
4.头板的植入
- 清洁颅骨上方的肌肉和组织,并用刀片刮擦颅骨。如果发生出血,请用凝胶泡沫将其止住并清洁血液。用自固化牙科粘合剂树脂水泥将头板(图1C)连接到颅骨上。具体来说,将 3/4 勺聚合物、三滴单体和一滴催化剂混合在冰上的陶瓷碗中。将混合物涂抹在头板和头骨上。将它们连接在一起并等待 5 分钟让粘合剂凝固。
- 注射抗生素(头孢噻呋钠,5 mg/kg,SQ)以预防感染。将鼠标从立体定位框架中取出,并将其放在加热垫上进行恢复。从麻醉中恢复后将其放回家笼。为了控制疼痛,在手术后向小鼠提供含布洛芬的饮用水(0.5 mL / 50 mL)3天。
5.插入插头(图2)
- 在病毒注射后 3 周植入塞子。麻醉鼠标并将其固定在立体定位框架上,如步骤 3.2-3.5 中所述。准备浸泡在盐水中的凝胶泡沫以阻止潜在的出血。
- 用微钻钻在λ后方0.5mm处钻出3 mm x 2 mm的椭圆形。将椭圆形的边界变薄,直到它破裂。在椭圆形记录窗口前将头骨变薄,使盖玻片靠近SC。
- 使用细镊子取下骨瓣。在横窦后方的硬脑膜上做一个切口,取出硬脑膜。如有必要,用 3 mL 注射器向大脑中添加人工脑脊液 (ACSF) 以防止干燥。用凝胶泡沫和棉签擦干头骨和记录窗口。
- 将一滴有机硅粘合剂沉积到记录窗口中。使用吸盘负压固定塞子。使用电动显微操纵器移动吸盘并将塞子放入硅胶粘合剂中,直到盖玻片接触颅骨。然后,将插头向前移动 ~1 毫米以推开横窦并露出 SC。此步骤应在有机硅粘合剂变粘之前 1-2 分钟内完成。
- 清洁顶板,在塞子边界周围涂上氰基丙烯酸丁酯和树脂水泥,将其固定在顶板上。
注意:提供术后护理,如步骤 4.2 所述。
6. 双光子成像(图3)
- 将动物头部固定在带有头板的旋转跑步机上。将跑步机放在双光子显微镜下,并将高度调整到合适的位置。在物镜和头板之间放置一个黑色铝制锥体,以防止显示器的光污染,从而获得视觉刺激。使鼠标习惯~15分钟。
- 使用16倍放大倍率、0.8数值孔径(NA)和3毫米工作距离(WD)物镜在显微镜上进行双光子成像。使用由两个振镜扫描仪控制的具有锁模技术的钛蓝宝石激光器在 920 nm 处激发 GCaMP6m。在 20-80 mW 之间调整样品平面的激光功率。
- 以 4.8 Hz 的频率扫描 600 μm x 600 μm 的视野,空间分辨率为 2.4 μ m/像素,并在深度达 350 μ m 的范围内对神经活动进行成像。
注意: 采样率和空间分辨率适用于振镜扫描仪,应针对共振扫描仪进行调整。 - 用二向色镜收集发射的荧光,并在通过带通滤光片后使用光电倍增管(PMT)进行检测。
- 使用旋转编码器记录鼠标在跑步机上的运动。使用带有 50 毫米镜头的相机记录其瞳孔大小和位置。通过记录刺激计算机发送的触发器,将这些记录和图像采集与视觉刺激同步。
7. 双光子成像测量的钙反应分析
- 使用 SIMA21 或 NoRMCorre22 纠正成像过程中的大脑运动。
- 使用细胞魔棒工具 (ImageJ) 手动绘制感兴趣区域 (ROI),并在 MATLAB 中用椭圆拟合。去除神经细胞污染后提取每个ROI的荧光痕迹:
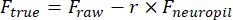
F true 和 F raw分别是 ROI 的校正和原始荧光振幅,F neuropil 是周围 neuropil 的荧光振幅,r 是离焦的 neuropil污染因子(我们的设置为 0.7)。r 是通过测量血管上的信号来估计的,其中 Ftrue = 0,如前所述23,24。 - 通过从以每帧为中心的 15 秒窗口中减去第八个百分位值来消除缓慢的基线波动25.
- 将神经元的视觉反应定义为刺激期间其 ROI 中荧光振幅的相对变化:
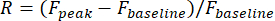
F峰 是视觉刺激期间荧光迹线的峰值振幅,F基线是刺激前0.5秒内的平均振幅。
8. 宽视场成像和数据分析(图4)
- 使用串联透镜4 构建宽视场宏镜(图4A)。串联镜头宏量镜是通过 适配器连接的两个 相机镜头(50 mm 和 105 mm),放大倍率为 ~2 倍。
- 如步骤3.2-3.5所述制备部分皮层突变小鼠。在SC每侧中心200μm的深度注射100nL表达GCaMP6m的AAV。
- ~3 周后,在 SC 上植入直径为 5 mm 的盖玻片,以 SC 为中心进行 4 mm x 3 mm 的椭圆形开颅手术,并稀释其周围的骨头。然后,将盖玻片直接压在SC上,并用树脂水泥固定。
- 使用带有激发滤光片(469 nm ± 35 nm)的蓝光发光二极管 (LED) 激发 GCaMP6m。在以 10 Hz 通过发射滤光片(525 nm ± 39 nm)后,使用互补金属氧化物半导体 (CMOS) 相机采集图像。该相机覆盖面积为 5.36 mm x 2.85 mm,空间分辨率为 2.63 μm/像素。
- 使用归一化盒式滤波器对每个采集的图像进行卷积,并将其下采样到原始大小的 1/4。对于图像中的每个像素,定义响应,如步骤 7.4 中所述。
注意:提供术后护理,如步骤 4.2 所述。
Access restricted. Please log in or start a trial to view this content.
结果
图 1A、B 分别显示了如何制作吸盘和塞子。图 2 显示了如何成功植入插头。植入塞子后,后内侧SC暴露在外,如图2D所示。图 3 显示了使用双光子显微镜成像的野生型小鼠示例的 SC 神经元的钙反应。在显微镜下很容易捕捉到的三棱柱可用于定位成像部位(图3B)。视觉反应?...
Access restricted. Please log in or start a trial to view this content.
讨论
协议中的关键步骤
最关键的一步是步骤 5.2 和 5.3 中的开颅手术。首先,λ后方 0.5 毫米处的骨头很厚,里面有血管,在钻孔过程中会导致出血。应准备足够的凝胶泡沫来止血。其次,切除横窦上方的骨头时,很有可能发生血管出血。对于故障排除,另一种方法是将椭圆形内的骨头变薄并一块一块地移除。另一个技巧是在提升前浸泡骨头,使硬脑膜更容易从骨头上分离并防止出血。
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
这项工作得到了中国国家自然科学基金(32271060)的支持。Y.-t.L.设计了研究,进行了实验,分析了数据,并撰写了手稿。Z.L.和R.W.进行了实验。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 16x objective | Nikon | ||
| 50-mm lens | Computar | M5018-MP2 | |
| 5-mm coverslip | Warner instruments | CS-5R | |
| bandpass filter | Chroma Technology | HQ575/250 m-2p | |
| butyl cyanoacrylate | Vetbond, World Precision Instruments | ||
| camera for monitoring pupil | FLIR | BFS-U3-04S2M-CS | |
| camera for widefield imaging | Basler | acA2000-165µm | |
| corona treater | Electro-Technic Products | BD-20AC | |
| dichroic | Chroma Technology | T600/200dcrb | |
| galvanometers | Cambridge Technology | ||
| glass bead sterilizer | RWD | RS1502 | |
| microdrill | RWD | 78001 | |
| micromanipulator | Sutter Instruments | QUAD | |
| photomultiplier tube | Hamamatsu | R3896 | |
| rotory encoder | USdigital | MA3-A10-125-N | |
| self-curing dental adhesive resin cement | SuperBond C&B, Sun Medical Co, Ltd. Moriyama, Japan | ||
| thermostatic heating pad | RWD | 69020 | |
| Ti:Sapphire laser | Spectra-Physics | Mai Tai HP DeepSee | |
| translucent silicone adhesive | Kwik-Sil, World Precision Instruments | ||
| treadmill | Xinglin Biology | ||
| Virus Strains | |||
| rAAV2/9-hsyn-Gcamp6m | Vector Core at Chinese Institute for Brain Research, Beijing | ||
| Animals | |||
| C57BL/6J wild type | Laboratory Animal Resource Center at Chinese Institute for Brain Research, Beijing | ||
| Emx1-Cre | The Jackson Laboratory | 5628 | |
| Pals1flox/wt | Christopher A. Walsh Lab | ||
| Software | |||
| ImageJ | NIH Image | ||
| Labview | National Instruments | ||
| MATLAB | Mathworks |
参考文献
- May, P. J. The mammalian superior colliculus: laminar structure and connections. Progress in Brain Research. 151, 321-378 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Ohki, K., Chung, S., Ch'ng, Y. H., Kara, P., Reid, R. C. Functional imaging with cellular resolution reveals precise micro-architecture in visual cortex. Nature. 433 (7026), 597-603 (2005).
- Ratzlaff, E. H., Grinvald, A. A tandem-lens epifluorescence macroscope: Hundred-fold brightness advantage for wide-field imaging. Journal of Neuroscience Methods. 36 (2-3), 127-137 (1991).
- de Vries, S. E. J., et al. A large-scale standardized physiological survey reveals functional organization of the mouse visual cortex. Nature Neuroscience. 23 (1), 138-151 (2020).
- Mrsic-Flogel, T. D., et al. Altered map of visual space in the superior colliculus of mice lacking early retinal waves. The Journal of Neuroscience. 25 (29), 6921-6928 (2005).
- Cang, J., Wang, L., Stryker, M. P., Feldheim, D. A. Roles of ephrin-as and structured activity in the development of functional maps in the superior colliculus. The Journal of Neuroscience. 28 (43), 11015-11023 (2008).
- Feinberg, E. H., Meister, M. Orientation columns in the mouse superior colliculus. Nature. 519 (7542), 229-232 (2015).
- Ahmadlou, M., Heimel, J. A. Preference for concentric orientations in the mouse superior colliculus. Nature Communications. 6, 6773(2015).
- de Malmazet, D., Kühn, N. K., Farrow, K. Retinotopic separation of nasal and temporal motion selectivity in the mouse superior colliculus. Current Biology. 28 (18), 2961-2969 (2018).
- Li, Y. T., Turan, Z., Meister, M. Functional architecture of motion direction in the mouse superior colliculus. Current Biology. 30 (17), 3304-3315 (2020).
- Gribizis, A., et al. Visual cortex gains independence from peripheral drive before eye opening. Neuron. 104 (4), 711-723 (2019).
- Inayat, S., et al. Neurons in the most superficial lamina of the mouse superior colliculus are highly selective for stimulus direction. The Journal of Neuroscience. 35 (20), 7992-8003 (2015).
- Barchini, J., Shi, X., Chen, H., Cang, J. Bidirectional encoding of motion contrast in the mouse superior colliculus. eLife. 7, 35261(2018).
- Savier, E. L., Chen, H., Cang, J. Effects of locomotion on visual responses in the mouse superior colliculus. The Journal of Neuroscience. 39 (47), 9360-9368 (2019).
- Schröder, S., et al. Arousal modulates retinal output. Neuron. 107 (3), 487-495 (2020).
- Ge, X., et al. Retinal waves prime visual motion detection by simulating future optic flow. Science. 373 (6553), (2021).
- Chen, H., Savier, E. L., DePiero, V. J., Cang, J. Lack of evidence for stereotypical direction columns in the mouse superior colliculus. The Journal of Neuroscience. 41 (3), 461-473 (2021).
- Kasai, M., Isa, T. Effects of light isoflurane anesthesia on organization of direction and orientation selectivity in the superficial layer of the mouse superior colliculus. The Journal of Neuroscience. 42 (4), 619-630 (2022).
- Kim, S., et al. The apical complex couples cell fate and cell survival to cerebral cortical development. Neuron. 66 (1), 69-84 (2010).
- Kaifosh, P., Zaremba, J. D., Danielson, N. B., Losonczy, A. S. I. M. A. Python software for analysis of dynamic fluorescence imaging data. Frontiers in Neuroinformatics. 8, 80(2014).
- Pnevmatikakis, E. A., Giovannucci, A. NoRMCorre: An online algorithm for piecewise rigid motion correction of calcium imaging data. Journal of Neuroscience Methods. 291, 83-94 (2017).
- Kerlin, A. M., Andermann, M. L., Berezovskii, V. K., Reid, R. C. Broadly tuned response properties of diverse inhibitory neuron subtypes in mouse visual cortex. Neuron. 67 (5), 858-871 (2010).
- Göbel, W., Helmchen, F. In vivo calcium imaging of neural network function. Physiology. 22 (6), 358-365 (2007).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56 (1), 43-57 (2007).
- Evans, D. A., et al. A synaptic threshold mechanism for computing escape decisions. Nature. 558 (7711), 590-594 (2018).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。