É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem de cálcio no colículo superior de camundongos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo detalha o procedimento para obter imagens de respostas de cálcio no colículo superior (CS) de camundongos acordados, incluindo a obtenção de imagens da atividade de um único neurônio com microscopia de dois fótons, deixando o córtex intacto em camundongos selvagens, e a obtenção de imagens de todo o SC com microscopia de campo largo em camundongos mutantes do córtex parcial.
Resumo
O colículo superior (CS), uma estrutura mesencefálica conservada evolutivamente em todos os vertebrados, é o centro visual mais sofisticado antes do surgimento do córtex cerebral. Ele recebe entradas diretas de ~30 tipos de células ganglionares da retina (RGCs), com cada uma codificando uma característica visual específica. Permanece indefinido se o CT simplesmente herda características retinianas ou se ocorre processamento adicional e potencialmente de novo no CS. Para revelar a codificação neural da informação visual no CS, fornecemos aqui um protocolo detalhado para registrar opticamente as respostas visuais com dois métodos complementares em camundongos acordados. Um método usa microscopia de dois fótons para obter imagens da atividade do cálcio em resolução de célula única sem ablar o córtex sobreposto, enquanto o outro usa microscopia de campo largo para obter imagens de toda a CT de um camundongo mutante cujo córtex é em grande parte subdesenvolvido. Este protocolo detalha esses dois métodos, incluindo preparação animal, injeção viral, implante de placa cefálica, implante de plug, aquisição de dados e análise de dados. Os resultados representativos mostram que a imagem de cálcio de dois fótons revela respostas neuronais visualmente evocadas em resolução de célula única, e a imagem de cálcio de campo largo revela atividade neural em toda a CT. Combinando esses dois métodos, pode-se revelar a codificação neural no CT em diferentes escalas, e tal combinação também pode ser aplicada a outras regiões cerebrais.
Introdução
O colículo superior (CS) é um importante centro visual em todos os vertebrados. Em mamíferos, recebe entradas diretas da retina e do córtex visual1. Embora o registro óptico tenha sido amplamente aplicado no córtex 2,3,4,5, sua aplicação no CT é dificultada por acessos ópticos precários 6,7,8,9,10,11,12,13,14,15,16,17 ,18,19. O objetivo deste protocolo é fornecer detalhes sobre dois métodos complementares para o registro óptico da atividade neural no CT.
A CT está localizada abaixo do córtex e do seio transverso, o que limita o acesso óptico aos neurônios coliculares. Uma abordagem para superar essa limitação é aspirar a cortical sobreposta e expor o SC ântero-lateral7,9,10,13,14,19. No entanto, como o CT recebe entradas corticais, tal operação pode afetar a forma como os neurônios do CT respondem aos estímulos visuais. Para superar essa limitação, detalhamos aqui um protocolo alternativo para obter imagens da camada superficial do SC póstero-medial com um tampão de silicone, deixando o córtexintacto8,11. Especificamente, para alcançar a resolução de célula única, aplicamos microscopia de dois fótons para obter imagens de respostas de cálcio na CT póstero-medial de camundongos selvagens. Além disso, para obter ampla cobertura, aplicamos microscopia de campo largo para obter imagens de toda a CT de um camundongo mutante cujo córtex posterior não se desenvolveu20.
Os dois métodos descritos neste protocolo são complementares entre si. A imagem de cálcio de dois fótons sem ablação do córtex é apropriada para registrar a atividade neural em resolução de célula única com entradas corticais intactas. A imagem de cálcio de campo largo é apropriada para registrar a atividade neural em toda a CT enquanto sacrifica a resolução espacial.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os procedimentos experimentais foram realizados de acordo com as diretrizes de bem-estar animal e aprovados pela IACUC no Instituto Chinês de Pesquisa do Cérebro, Pequim.
OBS: O cronograma para este protocolo é o seguinte: 1) fazer a ventosa; 2) injetar o vírus; 3) implantar a placa cefálica; 4) após 3 semanas, implantar o plug; 5) após uma recuperação de ~3 dias e habituação na esteira, realizar imagens de dois fótons/campo largo.
1. Preparo de uma ventosa (Figura 1A)
- Deposite uma gota de solução salina tamponada com fosfato (PBS, 1x) em uma placa de acrílico e toque-a com uma agulha plana de 21 G para preencher a ponta por capilaridade.
- Cubra a ponta da agulha com um adesivo de silicone translúcido e ajuste por cerca de ~10 min.
- Corte o adesivo de silicone com tesoura em um disco com ~2 mm de diâmetro.
2. Preparação dos plugues (Figura 1B)
- Prepare um calço de plástico de 0,75 mm de espessura e corte um quadrado de 1 cm x 1 cm no centro. Prepare dois blocos de acrílico. Limpe o calço de calço e os blocos de acrílico com álcool e limpe-os com papel de lente.
- Coloque o calço em um bloco de acrílico, deposite o adesivo de silicone no centro para preencher ~90% da abertura (evite bolhas), adicione outro bloco de acrílico e ~1 kg de força, e aguarde 20 min.
- Sob um microscópio cirúrgico, corte o adesivo de silicone com bisturi a 1 mm de altura por prismas triangulares de 1,5 mm de largura acima de um pedaço de papel com triângulos impressos.
- Retire qualquer pó dos prismas triangulares com fita adesiva de plástico e coloque-o numa tampa de vidro de 5 mm de diâmetro e 0,15 mm de espessura.
- Coloque a tampa com os prismas triangulares sob um tratado corona, ligue o tratado corona e aproxime-o da tampa até que o clarão apareça. Segure-o nessa posição por alguns minutos até que eles estejam presos um ao outro.
NOTA: Este passo pode ser diferente para outros tratamentos corona. - Coloque os plugues em uma placa de Petri e coloque-o em uma incubadora a 70 °C durante a noite.
3. Preparação de animais e injeção de construto viral
- Use C57BL/6J (wild-type) e Emx1-Cre:Pals1flox/wt (parcial-cortex)20 camundongos de ambos os sexos com 6 semanas de idade (9 semanas no momento da imagem).
- Esterilizar todos os materiais e instrumentais utilizados para o procedimento cirúrgico.
- Anestesiar o camundongo com isoflurano a 5% e, em seguida, manter o isoflurano a 1%-2% com fluxo de 1 L/min durante a cirurgia. Confirme o nível de anestesia pela ausência do reflexo de pinça dos dedos.
- Fixe o mouse em uma estrutura estereotáxica com barras auriculares. Durante toda a cirurgia, coloque pomada oftálmica nos olhos do rato para evitar o ressecamento e mantenha a temperatura corporal em 37 °C com uma almofada de aquecimento termostático.
- Raspar o pelo e esterilizar a superfície da pele com iodóforo e etanol 75%. Injetar lidocaína (5 mg/kg, injeção subcutânea [SQ]), tilidina (2 mg/kg, SQ) e meloxicam (2 mg/kg, SQ).
NOTA: O procedimento cirúrgico para esterilização, analgesia e anestesia local pode diferir entre as instituições. - Retire a pele sobre o SC com tesoura cirúrgica para expor o crânio. Limpe o crânio com um cotonete.
- Ajuste a estrutura estereotáxica até que a superfície do crânio esteja plana. Faça um orifício 0,5 mm lateral e 0,42 mm anterior ao lambda até que a dura-máter fique exposta.
- Injetar vírus adenoassociado (AAV) expressando GCaMP6m (rAAV2/9-hsyn-GCaMP6m; 1 x10 13 GC/mL dissolvido em 1x PBS) a profundidades de 1 mm e 1,6 mm do lambda com uma micropipeta de vidro chanfrada (a ponta é chanfrada a 25° com um diâmetro de 40-50 μm).
- Em cada profundidade, injetar 100 nL a uma velocidade de 50 nL/min e aguardar 5 min após cada injeção. Após a injeção, retire lentamente o injetor.
4. Implantação da placa de cabeça
- Limpe os músculos e tecidos sobre o crânio e coce o crânio com uma lâmina. Se ocorrer sangramento, pare com espuma de gel e limpe o sangue. Fixar a placa frontal (Figura 1C) ao crânio com um cimento resinoso adesivo odontológico autopolimerizável. Especificamente, misture uma colher 3/4 de polímero, três gotas de monômero e uma gota de catalisador em uma tigela de cerâmica sobre gelo. Aplique a mistura na placa de cabeça e no crânio. Fixe-os e aguarde 5 minutos para que o adesivo se fixe.
- Injetar antibióticos (ceftiofur sódico, 5 mg/kg, SQ) para prevenir infecções. Remova o mouse do quadro estereotáxico e coloque-o em uma almofada de aquecimento para recuperação. Devolva-o à gaiola de casa depois de se recuperar da anestesia. Para o controle da dor, fornecer água potável contendo ibuprofeno (0,5 mL/50 mL) ao camundongo por 3 dias após a cirurgia.
5. Implantação do plugue (Figura 2)
- Implante o plugue 3 semanas após a injeção viral. Anestesie e fixe o mouse em um quadro estereotáxico, conforme descrito nas etapas 3.2-3.5. Prepare espuma de gel embebida em soro fisiológico para parar o sangramento potencial.
- Perfurar um oval de 3 mm x 2 mm com uma microbroca centrada a 0,5 mm posterior ao lambda. Afinar o limite do oval até rachar. Afinar o crânio em frente à janela oval de gravação para fazer a tampa perto do SC.
- Retire os retalhos ósseos usando pinças finas. Faça um corte na dura-máter posterior ao seio transverso e retire o pedaço da dura-máter. Se necessário, adicione líquido cefalorraquidiano artificial (ACSF) ao cérebro com uma seringa de 3 mL para evitar o ressecamento. Seque o crânio e a janela de gravação com espuma de gel e cotonetes.
- Deposite uma gota de adesivo de silicone na janela de gravação. Use a ventosa para segurar o plugue com pressão negativa. Use um micromanipulador motorizado para mover a ventosa e abaixe o plugue no adesivo de silicone até que a tampa toque o crânio. Em seguida, mova o plugue para frente ~1 mm para afastar o seio transverso e expor o SC. Esta etapa deve ser feita em 1-2 min antes que o adesivo de silicone se torne pegajoso.
- Limpe a placa de cabeça e aplique butilcianoacrilato e cimento de resina ao redor do limite do plugue para fixá-lo à placa de cabeça.
NOTA: Prestar cuidados pós-operatórios, conforme descrito na etapa 4.2.
6. Imagem com dois fótons (Figura 3)
- Fixe a cabeça do animal em uma esteira giratória com sua cabeceira. Coloque a esteira sob um microscópio de dois fótons e ajuste a altura para uma posição apropriada. Coloque um cone de alumínio preto entre a objetiva e a placa de cabeça para evitar a contaminação luminosa do monitor para estimulação visual. Habitue o mouse por ~15 min.
- Realizar imagens de dois fótons no microscópio com uma objetiva de aumento de 16x, abertura numérica (NA) de 0,8 e distância de trabalho (WD) de 3 mm. Use um laser Ti:safira com técnica de bloqueio de modo controlado por dois scanners galvo para excitar GCaMP6m a 920 nm. Ajuste a potência do laser no plano da amostra entre 20-80 mW.
- Digitalize um campo de visão de 600 μm x 600 μm a 4,8 Hz com uma resolução espacial de 2,4 μ m/pixel, e visualize a atividade neural na profundidade até 350 μ m.
NOTA: A taxa de amostragem e a resolução espacial são para scanners galvo e devem ser ajustadas para scanners ressonantes. - Colete a fluorescência emitida com um espelho dicroico e detecte-a usando um tubo fotomultiplicador (PMT) depois de passá-la por um filtro passa-banda.
- Registre a locomoção do mouse na esteira com um codificador rotativo. Use uma câmera com uma lente de 50 mm para registrar o tamanho e a posição da pupila. Sincronize essas gravações e aquisições de imagens com a estimulação visual gravando os gatilhos enviados pelo computador de estimulação.
7. Análise das respostas do cálcio medidas por imagens de dois fótons
- Corrija o movimento cerebral durante a aquisição de imagens usando SIMA21 ou NoRMCorre22.
- Desenhe manualmente uma região de interesse (ROI) usando a ferramenta Varinha Mágica de Célula (ImageJ) e encaixe-a com uma elipse no MATLAB. Extraia traços de fluorescência de cada ROI após remover a contaminação do neurópilo:
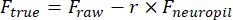
F verdadeiro e F rawsão as amplitudes de fluorescência corrigida e bruta da ROI, respectivamente, Fneuropilé a amplitude de fluorescência do neurópilo circundante, e r é o fator de contaminação do neurópilo fora de foco (0,7 para nossa configuração). O r é estimado medindo-se os sinais em um vaso para o qual Fverdadeiro= 0, conforme descrito anteriormente23,24. - Remova as flutuações lentas da linha de base subtraindo o valor do oitavo percentil de uma janela de 15 s centrada em cada quadro25.
- Defina respostas visuais de um neurônio como a mudança relativa da amplitude da fluorescência em sua ROI durante o período de estímulo:
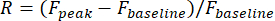
F pico é a amplitude de pico do traço de fluorescência durante a estimulação visual, e Fbasalé a amplitude média durante um período de 0,5 s antes da estimulação.
8. Imagem de campo amplo e análise de dados (Figura 4)
- Crie um macroscópio de campo largo com uma lente tandem4 (Figura 4A). O macroscópio de lente tandem é duas lentes de câmera (50 mm e 105 mm) conectadas através de um adaptador, e a ampliação é de ~2x.
- Preparar camundongos mutantes de córtex parcial conforme descrito nas etapas 3.2-3.5. Injetar 100 nL de AAV expressando GCaMP6m a uma profundidade de 200 μm no centro de cada lado do SC.
- Após ~3 semanas, implante uma lamínula de 5 mm de diâmetro sobre o SC. Realize uma craniotomia oval de 4 mm x 3 mm centrada no SC e afina o osso ao seu redor. Em seguida, pressione a tampa diretamente sobre o SC e fixe-o com cimento resinoso.
- Excite o GCaMP6m com um diodo emissor de luz azul (LED) com um filtro de excitação (469 nm ± 35 nm). Adquira imagens usando uma câmera complementar de óxido metálico semicondutor (CMOS) após passar por um filtro de emissão (525 nm ± 39 nm) a 10 Hz. A câmera cobre uma área de 5,36 mm x 2,85 mm com uma resolução espacial de 2,63 μm/pixel.
- Envolva cada imagem adquirida com um filtro de caixa normalizado e reduza a resolução para 1/4 do tamanho original. Para cada pixel na imagem, defina a resposta, conforme descrito na etapa 7.4.
NOTA: Prestar cuidados pós-operatórios, conforme descrito na etapa 4.2.
Access restricted. Please log in or start a trial to view this content.
Resultados
As Figuras 1A,B mostram como fazer a ventosa e os plugs, respectivamente. A Figura 2 mostra como implantar o plugue com sucesso. Após o implante do plug, o SC póstero-medial é exposto, como mostra a Figura 2D. A Figura 3 mostra as respostas de cálcio dos neurônios SC de um exemplo de camundongo selvagem fotografado usando microscopia de dois fótons. O prisma triangular, que é fac...
Access restricted. Please log in or start a trial to view this content.
Discussão
Etapas críticas do protocolo
A etapa mais crítica é a craniotomia nas etapas 5.2 e 5.3. Primeiro, o osso 0,5 mm posterior ao lambda é espesso e tem vasos sanguíneos dentro, o que pode causar sangramento durante o processo de perfuração. Espuma de gel adequada deve ser preparada para parar o sangramento. Em segundo lugar, há uma boa chance de angiorrhexis ao remover o osso logo acima do seio transverso. Para solução de problemas, uma abordagem alternativa é afinar o osso dentro do oval e rem...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho é apoiado pela Fundação Nacional de Ciências Naturais da China (32271060). Y.-t.L. desenhou a pesquisa, realizou o experimento, analisou os dados e escreveu o manuscrito. Z.L. e R.W. realizaram o experimento.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 16x objective | Nikon | ||
| 50-mm lens | Computar | M5018-MP2 | |
| 5-mm coverslip | Warner instruments | CS-5R | |
| bandpass filter | Chroma Technology | HQ575/250 m-2p | |
| butyl cyanoacrylate | Vetbond, World Precision Instruments | ||
| camera for monitoring pupil | FLIR | BFS-U3-04S2M-CS | |
| camera for widefield imaging | Basler | acA2000-165µm | |
| corona treater | Electro-Technic Products | BD-20AC | |
| dichroic | Chroma Technology | T600/200dcrb | |
| galvanometers | Cambridge Technology | ||
| glass bead sterilizer | RWD | RS1502 | |
| microdrill | RWD | 78001 | |
| micromanipulator | Sutter Instruments | QUAD | |
| photomultiplier tube | Hamamatsu | R3896 | |
| rotory encoder | USdigital | MA3-A10-125-N | |
| self-curing dental adhesive resin cement | SuperBond C&B, Sun Medical Co, Ltd. Moriyama, Japan | ||
| thermostatic heating pad | RWD | 69020 | |
| Ti:Sapphire laser | Spectra-Physics | Mai Tai HP DeepSee | |
| translucent silicone adhesive | Kwik-Sil, World Precision Instruments | ||
| treadmill | Xinglin Biology | ||
| Virus Strains | |||
| rAAV2/9-hsyn-Gcamp6m | Vector Core at Chinese Institute for Brain Research, Beijing | ||
| Animals | |||
| C57BL/6J wild type | Laboratory Animal Resource Center at Chinese Institute for Brain Research, Beijing | ||
| Emx1-Cre | The Jackson Laboratory | 5628 | |
| Pals1flox/wt | Christopher A. Walsh Lab | ||
| Software | |||
| ImageJ | NIH Image | ||
| Labview | National Instruments | ||
| MATLAB | Mathworks |
Referências
- May, P. J. The mammalian superior colliculus: laminar structure and connections. Progress in Brain Research. 151, 321-378 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Ohki, K., Chung, S., Ch'ng, Y. H., Kara, P., Reid, R. C. Functional imaging with cellular resolution reveals precise micro-architecture in visual cortex. Nature. 433 (7026), 597-603 (2005).
- Ratzlaff, E. H., Grinvald, A. A tandem-lens epifluorescence macroscope: Hundred-fold brightness advantage for wide-field imaging. Journal of Neuroscience Methods. 36 (2-3), 127-137 (1991).
- de Vries, S. E. J., et al. A large-scale standardized physiological survey reveals functional organization of the mouse visual cortex. Nature Neuroscience. 23 (1), 138-151 (2020).
- Mrsic-Flogel, T. D., et al. Altered map of visual space in the superior colliculus of mice lacking early retinal waves. The Journal of Neuroscience. 25 (29), 6921-6928 (2005).
- Cang, J., Wang, L., Stryker, M. P., Feldheim, D. A. Roles of ephrin-as and structured activity in the development of functional maps in the superior colliculus. The Journal of Neuroscience. 28 (43), 11015-11023 (2008).
- Feinberg, E. H., Meister, M. Orientation columns in the mouse superior colliculus. Nature. 519 (7542), 229-232 (2015).
- Ahmadlou, M., Heimel, J. A. Preference for concentric orientations in the mouse superior colliculus. Nature Communications. 6, 6773(2015).
- de Malmazet, D., Kühn, N. K., Farrow, K. Retinotopic separation of nasal and temporal motion selectivity in the mouse superior colliculus. Current Biology. 28 (18), 2961-2969 (2018).
- Li, Y. T., Turan, Z., Meister, M. Functional architecture of motion direction in the mouse superior colliculus. Current Biology. 30 (17), 3304-3315 (2020).
- Gribizis, A., et al. Visual cortex gains independence from peripheral drive before eye opening. Neuron. 104 (4), 711-723 (2019).
- Inayat, S., et al. Neurons in the most superficial lamina of the mouse superior colliculus are highly selective for stimulus direction. The Journal of Neuroscience. 35 (20), 7992-8003 (2015).
- Barchini, J., Shi, X., Chen, H., Cang, J. Bidirectional encoding of motion contrast in the mouse superior colliculus. eLife. 7, 35261(2018).
- Savier, E. L., Chen, H., Cang, J. Effects of locomotion on visual responses in the mouse superior colliculus. The Journal of Neuroscience. 39 (47), 9360-9368 (2019).
- Schröder, S., et al. Arousal modulates retinal output. Neuron. 107 (3), 487-495 (2020).
- Ge, X., et al. Retinal waves prime visual motion detection by simulating future optic flow. Science. 373 (6553), (2021).
- Chen, H., Savier, E. L., DePiero, V. J., Cang, J. Lack of evidence for stereotypical direction columns in the mouse superior colliculus. The Journal of Neuroscience. 41 (3), 461-473 (2021).
- Kasai, M., Isa, T. Effects of light isoflurane anesthesia on organization of direction and orientation selectivity in the superficial layer of the mouse superior colliculus. The Journal of Neuroscience. 42 (4), 619-630 (2022).
- Kim, S., et al. The apical complex couples cell fate and cell survival to cerebral cortical development. Neuron. 66 (1), 69-84 (2010).
- Kaifosh, P., Zaremba, J. D., Danielson, N. B., Losonczy, A. S. I. M. A. Python software for analysis of dynamic fluorescence imaging data. Frontiers in Neuroinformatics. 8, 80(2014).
- Pnevmatikakis, E. A., Giovannucci, A. NoRMCorre: An online algorithm for piecewise rigid motion correction of calcium imaging data. Journal of Neuroscience Methods. 291, 83-94 (2017).
- Kerlin, A. M., Andermann, M. L., Berezovskii, V. K., Reid, R. C. Broadly tuned response properties of diverse inhibitory neuron subtypes in mouse visual cortex. Neuron. 67 (5), 858-871 (2010).
- Göbel, W., Helmchen, F. In vivo calcium imaging of neural network function. Physiology. 22 (6), 358-365 (2007).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56 (1), 43-57 (2007).
- Evans, D. A., et al. A synaptic threshold mechanism for computing escape decisions. Nature. 558 (7711), 590-594 (2018).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados