A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نسيج مضاد للميكروبات باستخدام تغليف نانو عشبي للزيوت العطرية
In This Article
Summary
تمنع معاطف المختبر المضادة للميكروبات التلوث المتبادل لتراكم مسببات الأمراض والانسكابات الحيوية العرضية. هنا ، نصف بروتوكول تطوير نسيج مضاد للميكروبات صديق للبشرة باستخدام تغليف الأعشاب النانوية والاختبارات القياسية المعدلة لتقييم فعالية وملاءمة الاستخدام النموذجي لمعطف المختبر بدقة.
Abstract
تستخدم معاطف المختبر على نطاق واسع في مختبرات المخاطر البيولوجية ومرافق الرعاية الصحية كملابس واقية لمنع التعرض المباشر لمسببات الأمراض والانسكابات والحروق. توفر هذه المعاطف الواقية المصنوعة من القطن ظروفا مثالية لنمو الميكروبات ومواقع التعلق نظرا لطبيعتها المسامية وقدرتها على الاحتفاظ بالرطوبة والاحتفاظ بالدفء من جسم المستخدم. أظهرت العديد من الدراسات بقاء البكتيريا المسببة للأمراض على ملابس المستشفيات ومعاطف المختبر ، حيث تعمل كناقلات لانتقال الميكروبات.
النهج الشائع لإصلاح هذه المشاكل هو تطبيق العوامل المضادة للميكروبات في تشطيب المنسوجات ، ولكن أثيرت مخاوف بسبب السمية والآثار البيئية للعديد من المواد الكيميائية الاصطناعية. كما فتحت الجائحة المستمرة نافذة للتحقيق في مضادات الميكروبات الفعالة والتركيبات الصديقة للبيئة والخالية من السموم. تستخدم هذه الدراسة مركبين طبيعيين نشطين بيولوجيا ، كارفاكرول وثيمول ، مغلفين بجسيمات الشيتوزان النانوية ، والتي تضمن حماية فعالة ضد أربعة مسببات الأمراض البشرية مع تقليل يصل إلى 4 سجلات (99.99٪). يتم اكتشاف مسببات الأمراض هذه بشكل متكرر في معاطف المختبر المستخدمة في مختبرات المخاطر البيولوجية.
قاومت الأقمشة المعالجة أيضا ما يصل إلى 10 دورات غسيل مع تقليل الميكروبات بنسبة 90٪ ، وهو ما يكفي للاستخدام المقصود. لقد أجرينا تعديلات على اختبارات النسيج القياسية الحالية لتمثيل السيناريوهات النموذجية لاستخدام معطف المختبر بشكل أفضل. تسمح هذه التحسينات بإجراء تقييم أكثر دقة لفعالية معاطف المختبر المضادة للميكروبات ومحاكاة مصير أي انسكابات ميكروبية عرضية يجب تحييدها في غضون فترة زمنية قصيرة. يوصى بإجراء مزيد من الدراسات للتحقيق في تراكم مسببات الأمراض بمرور الوقت على معاطف المختبر المضادة للميكروبات مقارنة بالمعاطف الواقية العادية.
Introduction
المعطف الأبيض الواقي هو عنصر إلزامي لمعدات الحماية الشخصية (PPE) في مختبرات علم الأحياء الدقيقة ومرافق الرعاية الصحية ، ويحمي من التعرض المباشر لمسببات الأمراض والانسكابات والحروق. تعزز هذه المعاطف القطنية نمو الميكروبات بسبب العديد من العوامل - يوفر النسيج المنسوج مواقع التعلق والتهوية والقطن والنشا المستخدم في عملية التصنيع جنبا إلى جنب مع الخلايا الظهارية المقشرة من المستخدم التي توفر العناصر الغذائية ، والقرب من المستخدم يعطي الدفء والرطوبة. يمكن أن يسبب تراكم الميكروبات على المنسوجات أيضا مشاكل صحية مثل الحساسية وعدوى المستشفيات والروائح الكريهة وتدهور النسيج1.
على عكس الملابس العادية ، نادرا ما يتم غسل المعاطف الواقية أو تطهيرها ، كما هو موجود في العديد من الاستطلاعات 2,3. تظهر العديد من الدراسات أدلة على أن معاطف المختبر تعمل كناقل لانتقال الميكروبات وخطر الإصابة بعدوى المستشفيات في بيئة الرعاية الصحية 2,4 ، وخاصة السلالات المقاومة3 مثل المكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA) ؛ وبالتالي ، فإنها تثير مخاوف صحية من معدات الوقاية الشخصية ، والتي تهدف إلى الحماية من التلوث الميكروبي. لا توجد دراسات مقطعية كافية حول العدوى المرتبطة بمعطف المختبر في سياق مرافق السلامة الأحيائية المستوى 2 (BSL-2) أو مختبرات تدريس الأحياء الدقيقة ، ولكن العديد من السلطات التنظيمية تقيد استخدام معاطف المختبر ضمن مستوى الاحتواء. ومع ذلك ، فإن العديد من المؤسسات الأكاديمية في أمريكا الشمالية تكافح لتلبية المتطلبات بسبب القيود العملية ، مثل الغسيل والتخزين داخل المنشأة ، وحوادث ارتداء معاطف المختبر في الأماكن العامة مثل الكافيتريات والمكتبات شائعة. أحد الحلول العملية لهذه القضايا هو تطبيق العوامل المضادة للميكروبات في تشطيب المنسوجات.
تكتسب الأقمشة المضادة للميكروبات شعبية متزايدة في الملابس الرياضية والملابس الرياضية والجوارب ، والتي تهدف بشكل أساسي إلى تقليل رائحة الجسم. ومع ذلك ، فإن استخدام هذه الأقمشة ليس شائعا في تطوير معدات الوقاية الشخصية ، باستثناء بعض الأقنعة القطنية المطلية بالفضة وملابس الرعاية الصحية5. أبلغنا عن تطوير نسيج مضاد للميكروبات لمعاطف المختبر ، والذي يثبط مسببات الأمراض الشائعة الموجودة في مختبرات BSL-2 ويوفر حماية فعالة من التلوث المتبادل لمسببات الأمراض الشائعة.
حاليا ، تتوفر مجموعة متنوعة من الأقمشة والتشطيبات المضادة للميكروبات في السوق ، ولكن معظمها يستخدم جزيئات معدنية ثقيلة غروانية (مثل الفضة والنحاس والزنك) أو المواد العضوية أو المواد الكيميائية الاصطناعية مثل التريكلوسان ومركبات الأمونيوم الرباعية ، وهي ليست صديقة للبيئة1 وقد تؤدي إلى مشاكل صحية مثل تهيج الجلد والحساسية6. تثير بعض التركيبات الاصطناعية مخاوف بسبب الميكروبات غير المستهدفة ، مثل النباتات الطبيعية أو تحفيز مقاومة مضادات الميكروبات (AMR). تنظم إدارة الغذاء والدواء الأمريكية (FDA) الأقمشة التجارية المضادة للميكروبات ، والتي يجب أن تكون غير سامة للمستخدم وخالية من السمية البيئية. لذلك ، يفضل استخدام الأقمشة المضادة للميكروبات القائمة على المبيدات الحيوية الطبيعية التي تمنع مجموعة واسعة من الميكروبات. تستخدم الزيوت الأساسية (EOs) على نطاق واسع كعوامل مضادة للميكروبات وعلاجية ، لكن استخدامها في التشطيب المضاد للميكروبات محدود بسبب متانتها6،7،8. بناء على معرفتنا وأبحاث السوق حول التشطيب النانويالعشبي 8 ، لا يتوفر أي نسيج مضاد للميكروبات قائم على الأعشاب تجاريا. وذلك لأن الطلاءات الاصطناعية سهلة التصنيع ولها متانة طويلة. بعض المنسوجات المطلية بالأعشاب النانوية التي تم الإبلاغ عنها لأغراض البحث فقط تشمل النيم7 والمورينجا 9 وأوراق الكاري9.
تستخدم الدراسة الحالية مكونين نشطين بيولوجيا مستخرجين من OEOs من الأوريجانو ، كارفاكرول وثيمول ، وهما فعالان ضد مجموعة واسعة من مسببات الأمراض البكتيرية والفيروسات ولكن من المسلم به عموما أنهما آمنان للبشر10. ومع ذلك ، فإن هذه المكونات النشطة بيولوجيا متطايرة ، وبالتالي فإن إمكاناتها المضادة للميكروبات قصيرة الأجل إذا تم تطبيقها مباشرة على النسيج. تغليف الأعشاب النانوية هو عملية يتم فيها تحميل المكونات أو الأدوية النشطة بيولوجيا داخل غلاف بوليمري يحمي القلب من التدهور البيئي ، وبالتالي يعزز مدة الصلاحية. بالإضافة إلى ذلك ، فإن الحجم الصغير للجزيئات البوليمرية ، والتي تتراوح عموما من 10 نانومتر إلى 100 نانومتر ، يعزز فعالية التطبيق ويبطئ إطلاق المركبات النشطة بيولوجيا على النسيج. تستخدم هذه المركبات النشطة بيولوجيا لأغراض مختلفة ، مثل حفظ الطعام10 ، ولكن ليس لطلاء النسيج.
من بين العديد من الأغلفة البوليمرية ، يعتبر الشيتوزان مرشحا جذابا بسبب العديد من سماته ، مثل عدم السمية ، والتحلل البيولوجي ، والالتصاق المخاطي ، والتوافق الحيوي11. وهو عديد السكاريد الطبيعي ، الذي تم الحصول عليه عن طريق عملية نزع الأستيل من الكيتين ، الموجود في الصدف وجدران الخلايا الفطرية. يتم استخدامه في تطبيقات الكيمياء الحيوية وحفظ الأغذية مثل توصيل الأدوية أو البروتين 11،12،13 ، والإطلاق الخاضع للرقابة 14 ، والأفلام المضادة للميكروبات 10. الشيتوزان غير قابل للذوبان في الماء بسهولة ولكنه يشكل معلقا غروانيا في الوسائط الحمضية. يتم تحميل الجزيئات النشطة بيولوجيا في جسيمات الشيتوزان النانوية (NPs) بواسطة طريقة هلام أيونية بسيطة من خطوتين14،15،16. في هذه العملية ، تشكل المركبات النشطة بيولوجيا الكارهة للماء مثل carvacrol و thymol مستحلب زيت في الماء ، والذي يساعده خافض للتوتر السطحي ، Tween 80. بعد ذلك ، يتم استخدام مركب بولي أنيوني ، خماسي الصوديوم ترايبوليفوسفيت (TPP) ، لتشكيل الروابط المتقاطعة بين المجموعات الأمينية على طول جزيئات البوليمر متعددة التكاثنات ومجموعات الفوسفات لجزيئات TPP لتحقيق الاستقرار في المعقد. تعمل عملية التعقيد هذه على ترسيخ المركبات النشطة بيولوجيا داخل مصفوفة الشيتوزان ، والتي يتم تنقيتها لاحقا وتغطيتها على حوامل قطنية لإنتاج نسيج مضاد للميكروبات.
يجب اختبار تركيبات النانو أولا للتأكد من فعاليتها المضادة للميكروبات في شكل مستحلب قبل تطبيقها على القماش. يمكن تقييم ذلك بسهولة من خلال طريقة نوعية ، مثل انتشار قرص Kirby-Bauer ، وانتشار البئر ، وفحص لوحة الأسطوانة. ومع ذلك ، فإن فحص لوحة الأسطوانة17 يوفر المرونة لتحميل أحجام مختلفة من التركيبة ومقارنة منطقة الخلوص. في هذه الطريقة ، يتم تحميل التركيبات المضادة للميكروبات في أسطوانات من الفولاذ المقاوم للصدأ وتوضع على طبقة أجار ناعمة ، يتم تلقيحها بالكائنات الحية الدقيقة أو مسببات الأمراض. يتناسب قطر منطقة الخلوص المنتجة ضد كائن الاختبار مع الإمكانات المثبطة للتركيبة المضادة للميكروبات ، وبالتالي يمكن استخدامها كبديل لطرق تخفيف المرق. ومع ذلك ، فإن حجم المناطق الواضحة ليس سوى مقياس مقارن أو نوعي داخل لوحة معينة ما لم يتم الحفاظ على معايير محددة. تعمل العوامل المضادة للميكروبات ضد مسببات الأمراض إما عن طريق تثبيط نموها (بيوستاتيك) أو قتل الخلايا (مبيد حيوي) ، والتي يمكن قياسها كميا عن طريق الحد الأدنى من التركيز المثبط (MIC) والحد الأدنى من تركيز مبيد الجراثيم (MBC) ، على التوالي. ومع ذلك ، فإن فعالية وسلوك المواد الكيميائية النشطة بيولوجيا تختلف في تركيباتها (الحالة السائلة) وعند طلائها على ركيزة مثل النسيج18. وذلك لأن هناك عوامل متعددة تلعب دورا في الفعالية ، مثل استقرار التصاق العوامل المضادة للميكروبات بالنسيج ، ومحتوى الرطوبة ، ونوع الركيزة ، والتصاق الميكروبات. إذا كان الغرض المقصود هو النشاط المضاد للجراثيم فقط ، فإن الفحص النوعي مثل "طريقة الخط المتوازي"19 يمكن أن يوفر تقييما سريعا وسهلا نسبيا لتركيبة مضادات الميكروبات القابلة للانتشار. ومع ذلك ، إذا تم تحديد تأثيرات مبيد للجراثيم ، فيمكن استخدام "تقييم التشطيبات المضادة للبكتيريا على المواد النسيجية"20 ، مما يوفر تقليل سجل العامل الممرض المسننة.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. تحضير الجسيمات النانوية
- تغليف نانو العشبية
- تحضير 50 مل من 1٪ (v / v) حمض الخليك.
تنبيه: حمض الخليك الجليدي مهيج ، والذي يمكن أن يسبب حروقا شديدة في الجلد وتلف العين. ارتد معطف مختبر كامل الطول وقفازات النتريل ونظارات واقية واعمل تحت غطاء دخان. - تحضير محلول الشيتوزان (1.2٪ وزن / حجم) عن طريق إذابة 0.6 جم من رقائق الشيتوزان (الوزن الجزيئي المتوسط) في 50 مل من حمض الخليك 1٪ (المحضر أعلاه). حرك طوال الليل (O / N) في درجة حرارة الغرفة (R / T) للحصول على مستحلب متجانس.
- أضف 0.5 جم من Tween 80 وحرك (1000 دورة في الدقيقة) عند 60 درجة مئوية لمدة 2 ساعة للحصول على محلول متجانس. أحضر المحلول إلى R / T قبل إضافة المركبات النشطة بيولوجيا (كارفاكرول أو ثيمول).
- أضف 0.75 جم من كارفاكرول (أو ثيمول) بالتنقيط أو تدريجيا مع التحريك (1000 دورة في الدقيقة) الخليط لمدة 20 دقيقة عند R / T. نسبة وزن الشيتوزان إلى المركب النشط بيولوجيا هي 1: 1.25.
- أضف 50 مل (0.5٪ وزن / حجم) من TPP بالتنقيط إلى الخليط مع التحريك عند R / T. استمر في التقليب لمدة 30 دقيقة للحصول على مستحلب متجانس.
- قم بإعداد عنصر تحكم سلبي باتباع نفس الإجراء ولكن دون إضافة مركبات نشطة بيولوجيا.
- تحضير 50 مل من 1٪ (v / v) حمض الخليك.
- تنقيه
- أجهزة الطرد المركزي المستحلب عند 10000 جم × لمدة 30 دقيقة عند 4 درجات مئوية وجمع NPs المشكلة (الحبيبات) بعد صب المادة الطافية. احتفظ بالمادة الطافية لاختبار فعالية التغليف.
- اغسل الجسيمات (من الخطوة 1.2.1) باستخدام Tween 80 المائي (1٪ v / v) مع ضعف حجم الكريات المتكونة لإزالة المركبات النشطة بيولوجيا غير المنضمة أو الحرة. تأكد من إزعاج الحبيبات عن طريق الدوامة حتى يتم تشكيل محلول متجانس في كل خطوة غسيل.
- اغسل الجسيمات (من الخطوة 1.2.2) بالماء منزوع الأيونات مرتين للتخلص من الشوائب.
- إعادة تكوين NPs عن طريق تعليق الحبيبات (من الخطوة 1.2.3) في 30 مل من الماء منزوع الأيونات. قم بتخزين NPs في 4 درجات مئوية لمدة تصل إلى 6 أشهر.
ملاحظة: يمكن إيقاف التجربة مؤقتا في هذه المرحلة.
- توصيف
- قم بتخفيف NPs في الماء منزوع الأيونات حتى تقع قراءات الأشعة فوق البنفسجية المرئية (UV-Vis) بين 250 إلى 400 نانومتر ضمن النطاق (الامتصاص >1).
- سجل أطياف امتصاص الأشعة المرئية وفوق البنفسجية ل NPs على الأطوال الموجية التي تتراوح من 250 إلى 400 نانومتر باستخدام مقياس الطيف الضوئي للأشعة المرئية وفوق البنفسجية.
- قم بتخزين قسمة (1 مل) من NPs عند R / T لمجموعة من الفترات (على سبيل المثال ، من 1 إلى 6 أشهر) واختبر التأثير المضاد للميكروبات بطريقة لوحة الأسطوانة جنبا إلى جنب مع عينة جديدة.
- طلاء على القماش
- ضع NPs على نسيج قطني منسوج باستخدام طريقة المعالجة الجافة 7,21.
- اغمر حوامل القماش في المحلول الذي يحتوي على NPs الممزوجة بمادة رابطة من القماش لمدة 3 دقائق حتى تنقع. بعد ذلك ، مرر الحوامل من خلال مجداف مختبر ثنائي الأسطوانة لإزالة السائل الزائد.
- جففي الحوامل في الفرن على حرارة 100 درجة مئوية لمدة 30 دقيقة وعالجيها على حرارة 130 درجة مئوية لمدة 10 دقائق.
- أخيرا ، اغسل الحوامل في حمام الموجات فوق الصوتية لمدة 15 دقيقة لإزالة NPs غير المنضمة.
ملاحظة: بدلا من ذلك، اتبع الطريقة المبسطة الموضحة أدناه.
- قطع النسيج القطني (أو حوامل معطف المختبر) إلى مربعات 10 سم × 10 سم.
- اغمر القطع المقطوعة في 2 مل من NP المركب (10٪) في وعاء بلاستيكي (12 سم × 12 سم) لمدة دقيقتين في R / T. قم بإزالة السائل الزائد عن طريق التجفيف بالهواء.
- اضغط على الحرارة عند 100 درجة مئوية لمدة 3 دقائق لربط NPs.
- قم بإزالة NPs غير المنضمة عن طريق الشطف في Tween 80 المائي (2٪ وزن / حجم) وجففها في الفرن على حرارة 100 درجة مئوية لمدة 30 دقيقة.
ملاحظة: يمكن تخزين هذا النسيج المضاد للميكروبات لمدة 2 سنوات في R / T.
- ضع NPs على نسيج قطني منسوج باستخدام طريقة المعالجة الجافة 7,21.
- متانة الغسيل
- قطع النسيج إلى حوامل مربعة 50 مم × 50 مم.
- ضع الحوامل في 50 مل من ماء الصنبور الدافئ (40 درجة مئوية) في وعاء زجاجي / بلاستيكي وأضف قطرتين من المنظفات العادية (غير المضادة للميكروبات).
- شطف على شاكر منصة هزاز أو محرك مغناطيسي لمدة 30 دقيقة.
- جفف في الهواء أو احتضن عند 60 درجة مئوية لمدة 2 ساعة واختبر فعالية مضادات الميكروبات.
2. مقايسة لوحة الأسطوانة لفحص الجسيمات النانوية
- تحضير أجار الصويا التربتيكيس (TSA) ، مرق الصويا التربتيكيس (TSB) ، أجار قاعدة المضادات الحيوية (ABA) ، وأجار بذور المضادات الحيوية (ASA) ، وفقا لتعليمات الشركات المصنعة ، وتعقيم الوسائط عن طريق التعقيم عند 121 درجة مئوية عند 15 رطل لكل بوصة مربعة لمدة 15 دقيقة.
- الاستزراع الفرعي للميكروبات (من المخزون) ذات الأهمية ، والتي يتم إجراء اختبارات الفعالية عليها ، على ألواح TSA المحضرة حديثا (أو أي وسائط مناسبة) بطريقة لوحة الخطوط ثلاثية الاتجاهات واحتضانها لإنتاج ألواح نقاء. (الأنواع الموصى بها: S. aureus ، E. coli ، P. aeruginosa ، و C. albicans.)
- تلقيح المستنبتات من ألواح نقاء جديدة في TSB (أنابيب سعة 10 مل) عند 35 درجة مئوية O / N مع اهتزاز معتدل (100-200 دورة في الدقيقة).
- القسمة 5.0 مل من ASA المنصهر في كل أنبوب من أنابيب الاختبار. يتوافق عدد الأنابيب مع عدد الكائنات الحية الدقيقة التي تم اختبارها.
- صب 20 مل من ABA المنصهر المعقم مسبقا في كل لوحة بتري (100 مم × 20 مم) بشكل معقم لتشكيل الطبقة الأساسية. يتوافق عدد ألواح أجار مع عدد الكائنات الحية الدقيقة المراد اختبارها. انتظر حتى يتم ترسيخ وسائل الإعلام.
- بعد تصلب الطبقة الأساسية ، قم بتلقيح كل ASA منصهر بثقافة ليلية من الخطوة 2.3 (1.0 مل ، مسخن مسبقا إلى 35 درجة مئوية) وانقل المحتويات على الفور (خليط ASA والثقافة) إلى سطح لوحة ABA. قم بتدوير اللوحة لتوزيع طبقة الآجار المنصهرة بالتساوي. تأكد من أن طبقة البذور تبدو ناعمة وخالية من المطبات أو الفقاعات.
- ضع ما يصل إلى ست أسطوانات من الفولاذ المقاوم للصدأ (6 مم × 6 مم × 10 مم ؛ معقم مسبقا) ، متباعدة بالتساوي على نمط سداسي ، لكل صفيحة أجار باستخدام زوج من الملقط المعقم (الشكل 1).
- قم بتحميل الأسطوانات باستخدام NPs المركبة بأحجام مختلفة (30 ميكرولتر ، 50 ميكرولتر ، 75 ميكرولتر ، و 100 ميكرولتر) ليتم فحصها بحثا عن التأثيرات المضادة للميكروبات. السيطرة السلبية هي التي لا تحتوي على أي مركبات نشطة بيولوجيا.
- احتضان مسببات الأمراض البكتيرية الشائعة (على سبيل المثال ، الإشريكية القولونية ، المكورات العنقودية الذهبية ، P. aeruginosa) عند 35 درجة مئوية لمدة 24 ساعة والأنواع الفطرية (على سبيل المثال ، C. albicans) عند R / T لمدة 3 أيام.
- قياس قطر المنطقة الواضحة ومقارنة فعالية NPs توليفها.
ملاحظة: يمكن استخدام هذا الاختبار للفحص المسبق لأفضل NPs المراد طلاؤها على القماش.
3. طريقة الخط المتوازي (معدلة من AATCC 147)
- إعداد المواد
- قطع النسيج المعالج NP إلى حوامل 50 مم × 25 مم.
- قم بإعداد أجار مولر-هينتون (MHA) و TSA و TSB ، وفقا لتعليمات الشركات المصنعة ، وقم بتعقيم الوسائط عن طريق التعقيم عند 121 درجة مئوية عند 15 رطل لكل بوصة مربعة لمدة 15 دقيقة.
- الاستزراع الفرعي للميكروبات (من المخزون) ذات الأهمية ، والتي يتم إجراء اختبارات الفعالية ضدها ، على ألواح TSA المعدة حديثا (أو أي وسائط مناسبة) بطريقة لوحة الخطوط ثلاثية الاتجاهات وتحضن عند 35 درجة مئوية لمدة 2 أيام للبقع البكتيرية وفي R / T لمدة 5 أيام للسلالات الفطرية لإنتاج ألواح النقاء. (الأنواع الموصى بها: S. aureus ، E. coli ، P. aeruginosa ، و C. albicans.)
- ارتفاع الثقافات الميكروبية
- تلقيح المستنبتات من ألواح نقاء جديدة في TSB (أنابيب سعة 10 مل) عند 35 درجة مئوية O / N مع اهتزاز معتدل (100-200 دورة في الدقيقة).
- تمييع ثقافات O / N إلى 1.5 × 108 وحدات تشكيل مستعمرة (CFU) / مل أو المقابلة لتعكر معيار 0.5 McFarland (عادة ما يكون تخفيف 1/10 إلى 1/20 لمعظم الثقافات الصحية).
- تلقيح الثقافة المخففة أعلاه باستخدام حلقة معقمة 4 مم على النحو التالي. قم بتحميل حلقة من ثقافة المرق ونقلها إلى سطح صفيحة أجار MHA عن طريق عمل خمسة خطوط متوازية ، طول كل منها 6 سم ومسافة 1 سم ، وفقا للشكل 2. لا تقم بإعادة ملء الحلقة.
- اضغط برفق على حامل القماش باستخدام ملعقة معقمة عبر الخطوط الخمسة بحيث يكون القماش في المنتصف ويلمس جميع خطوط الخطوط الخمسة. احتضان في 35 درجة مئوية لمدة 24 ساعة.
- التقييم النوعي لفعالية مضادات الميكروبات
- افحص الصفيحة المحتضنة لانقطاع النمو على طول الخطوط خارج حواف القماش (تشير المنطقة الواضحة إلى تثبيط النمو).
- احسب متوسط عرض منطقة تثبيط على طول خط الخط (W) على جانبي حامل النسيج باستخدام المعادلة (1).
W = (T - D) / 2 (1)
W = عرض المنطقة الواضحة ؛ T = الطول الإجمالي للمنطقة الواضحة ، بما في ذلك عرض الحامل ؛ D = عرض حامل القماش (25 مم).
4. طريقة تقليل اللوغاريتم الكمي (معدلة من AATCC 100)
- التحضير التجريبي
- قطع النسيج إلى حوامل مربعة 50 مم × 50 مم.
- قم بإعداد TSA و TSB ومرق Letheen والمحلول الملحي المخزن بالفوسفات (PBS) ، وفقا لتعليمات الشركات المصنعة ، وقم بتعقيم الوسائط عن طريق التعقيم.
- تحضير مزارع O / N للميكروبات ذات الأهمية ، والتي يتم إجراء اختبارات الفعالية ضدها ، عن طريق تلقيح المستعمرات المعزولة من ألواح النقاء في TSB المعقمة والحضانة عند 35 درجة مئوية لمدة 18-24 ساعة (الأنواع الموصى بها: S. aureus ، E. coli ، P. aeruginosa ، و C. albicans.)
- ارتفاع الثقافات الميكروبية
- تمييع ثقافات O / N إلى 1.5 × 108 CFU / مل أو المقابلة لتعكر معيار 0.5 McFarland (عادة ما يكون تخفيف 1/10 إلى 1/20 لمعظم الثقافات الصحية).
- تحديد الحجم المناسب للمزارع للارتفاع عن طريق قياس قدرة الاحتفاظ بالسائل للنسيج على النحو التالي.
- أضف سلسلة من أحجام مستنبت المرق المخفف (على سبيل المثال ، 100-500 ميكرولتر) على حوامل النسيج (في ألواح بتري منفصلة) واختر الحجم بحيث يمتص حامل النسيج الماء بالكامل ولا يترك أي سائل متبقي / خال. تختلف قدرة الاحتفاظ بالسائل عن نوع وسمك القماش. بالنسبة لمعاطف المختبر القطنية العادية ، فهي حوالي 200 ميكرولتر.
- قم برفع الحجم (قدرة الاحتفاظ بالسائل المحددة أعلاه [على سبيل المثال ، 200 ميكرولتر]) لكل مزرعة على الحوامل الموضوعة في ألواح بتري المعقمة. يتوافق عدد الحوامل مع عدد الاختبارات (على سبيل المثال ، النسيج الذي تم اختباره فورا وبعد الغسيل [ودورات الغسيل التي تم اختبارها]) ، والتأثيرات المضادة للميكروبات التي تم اختبارها خلال وقت / يوم محدد [على سبيل المثال ، 30 دقيقة ، 2 ساعة ، اليوم 1-3]).
ملاحظة: استخدم ماصة صغيرة مع أطراف مرشح الهباء الجوي (لمنع تلوث الماصة في الاستخدامات اللاحقة) لتلقيح المزارع على الحوامل بتوزيع متساو. - للتحكم السلبي ، استخدم نفس النوع من حوامل القماش غير المعالجة. قم بإجراء التحكم السلبي لكل نوع من أنواع الاختبار الميكروبية المقابلة ، وفترة التلامس ، والأقمشة المختلفة ، ودورات الغسيل.
- استعادة الميكروبات عن طريق تعداد الصفائح القابلة للحياة
- اترك الحوامل الملقحة (المعالجة وغير المعالجة) تجف في الهواء داخل ألواح بتري (أغطية مواربة) عند R / T لفترة / فترات التلامس المطلوبة المراد اختبارها (على سبيل المثال ، 0 دقيقة ، 30 دقيقة ، 60 دقيقة ، إلخ ، أو حتى أيام للتأثيرات طويلة المدى). قم دائما بتضمين "0 دقيقة" لتمثيل تأثير فوري وتحييد الفعالية.
- انقل الحوامل بشكل معقم لفصل أنابيب الطرد المركزي المعقمة (50 مل) وقم بربط الأغطية بإحكام.
- أضف مرق Letheen (أي مخازن عازلة معادلة ذات صلة) لعمل تخفيف 1/100 (على سبيل المثال ، 19.8 مل للقاح 200 ميكرولتر).
- أغلق أنابيب الطرد المركزي بأغطية لولبية بإحكام ودوامة لمدة 1 دقيقة بسرعة متوسطة.
- قم بتخفيف التعليق بشكل متسلسل باستخدام PBS المعقم في التخفيفات اللاحقة 1/10 ، بحيث يصبح عدد مستعمرات المجموعة "غير المعالجة" منخفضا جدا بحيث لا يمكن حسابه (TLTC).
- ضع التخفيفات (0.1 مل) على ألواح الوسائط المناسبة ، والتي تدعم نمو الكائنات الحية الدقيقة (على سبيل المثال ، TSA للبكتيريا أو Sabouraud dextrose agar [SDA] للفطريات) أو أي وسائط تعمل على تحسين النمو وتوفر تباينا جيدا لجعل حساب المستعمرة دقيقا.
- احتضان الصفائح البكتيرية عند 35 درجة مئوية لمدة 2 أيام والصفائح الفطرية عند R / T لمدة 5 أيام.
- عد وحدات CFU القابلة للحياة مباشرة باستخدام عداد مستعمرة أو باستخدام برنامج تصوير (على سبيل المثال ، CFU الذكاء الاصطناعي).
- احسب انخفاض اللوغاريتم الميكروبي (R) بسبب النسيج المضاد للميكروبات باستخدام المعادلة (2):
ص =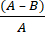 × 100 (2)
× 100 (2)
A = القيمة اللوغاريتمية لعدد وحدات CFU المستردة من النسيج غير المعالج ؛ B = القيمة اللوغاريتمية لعدد وحدات CFU المستردة من النسيج المعالج.
Access restricted. Please log in or start a trial to view this content.
النتائج
الفحص الأولي ل NPs المركبة
باتباع تقنية مستحلب الزيت في الماء المكونة من خطوتين16 ، تم تغليف المركبات النشطة بيولوجيا (كارفاكرول وثيمول) بنجاح في الشيتوزان. تم تأكيد ذلك من خلال القياس الطيفي للأشعة المرئية وفوق البنفسجية لامتصاص ذروة المركبات النشطة بيولوجيا مقارن?...
Access restricted. Please log in or start a trial to view this content.
Discussion
يتم اختبار فعالية مضادات الميكروبات للمبيدات الحيوية تقليديا من خلال المقايسات الكمية ، مثل الحد الأدنى للتركيز المثبط (MIC) والحد الأدنى لتركيز مبيد الجراثيم (MBC) ، حيث يتم غمر البكتيريا في سائل مضاد للميكروبات لمدة 24 ساعة. ومع ذلك ، فإن هذه المقايسات ليست مناسبة للأقمشة المطلية ، حيث تفتقر...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
تم تمويل هذه الدراسة من قبل "خدمات البحوث التطبيقية والابتكار وريادة الأعمال" (ARIES) ، كلية سينتينيال ، كندا.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid | Millipore Sigma | 64-19-7 | |
| Antibiotic base agar | BD Difco | DF0270-17-4 | Also known as Antibiotic Medium 2 |
| Antibiotic seed agar | BD Difco | DF0263-17-3 | Also known as Antibiotic Medium 1 |
| Blood Agar (Nutrient Agar with 5% Sheep Blood) | Donated by CFIA | ||
| Bromcresol Purple Lactose Agar | Donated by CFIA | ||
| Candida albicans | ATCC The Global Bioresource Center | ATTC 10231 | |
| Carvacrol | Millipore Sigma | 282197 (CAS# 499-75-2) | |
| Centrifuge Allergra X-22R Centrifuge | Beckman Coulter | Model # X-22R | Refrigerated. Wait at least 20 min or until the temperature reach the set low value (e.g., 4 °C) as the refrigeration takes time. |
| Chitosan Medium Molecular Weight (CS) | Millipore Sigma | 448877 (CAS # 9012-76-4) | |
| Clamshell Heat Press | Intiva | IM1200 | |
| Escherichia coli (E. coli) | ATCC The Global Bioresource Center | ATTC 23725 | |
| Incubator | Thermo Scientific | 1205M34 | |
| Letheen Broth | BD Difco | DF0681-17-7 | Used to neutralize antimicrobial effects. Product from different manufacturers may require to add Polysorbate 80, which is already added in Difco product. |
| Milli Q water | Millipore Sigma | ZR0Q16WW | Deionized water |
| Mueller-Hinton Agar | BD Difco | DF0252-17-6 | |
| Pentasodium tripolyphosphate (TPP) | Millipore Sigma | 238503 (CAS# 7758-29-4) | |
| Phospahte Buffered Saline (PBS) | Thermo Scientific | AM9624 | |
| Pseudomonas aeruginosa | ATCC The Global Bioresource Center | ATTC 9027 | |
| Sabouraud Dextrose Agar | BD Difco | DF0109-17-1 | |
| Shaking incubator/ Thermo shaker | VWR | Model# SHKA2000 | |
| Staphylococcus aureus | ATCC The Global Bioresource Center | ATTC 6538 | |
| Thymol | Millipore Sigma | T0501 (CAS# 89-83-8) | |
| Trypticase Soy Agar | BD Difco | 236950 | |
| Trypticase Soy Broth | BD Difco | 215235 | |
| Tween 80 | Millipore Sigma | STS0204 (CAS # 9005-65-6) | |
| UV-Vis Spectrophometer | Thermo Scientific | GENESYS 30 (840-277000) |
References
- Schmidt-Emrich, S., et al. Rapid assay to assess bacterial adhesion on textiles. Materials. 9 (4), 249(2016).
- Qaday, J., et al. Bacterial contamination of medical doctors and students white coats at Kilimanjaro Christian Medical Centre, Moshi, Tanzania. International Journal of Bacteriology. 2015, 507890(2015).
- Treakle, A. M., et al. Bacterial contamination of health care workers' white coats. American Journal of Infection Control. 37 (2), 101-105 (2009).
- Wong, D., Nye, K., Hollis, P. Microbial flora on doctors' white coats. BMJ. 303 (6817), 1602-1604 (1991).
- Gouveia, I. C. Nanobiotechnology: A new strategy to develop non-toxic antimicrobial textiles for healthcare applications. Journal of Biotechnology. (150), 349(2010).
- Joshi, M., Ali, S. W., Purwar, R., Rajendran, S. Ecofriendly antimicrobial finishing of textiles using bioactive agents based on natural products. Indian Journal of Fibre and Textile Research. 34, 295-304 (2009).
- Ahmed, H. A., Rajendran, R., Balakumar, C. Nanoherbal coating of cotton fabric to enhance antimicrobial durability. Elixir Applied Chemistry. 45, 7840-7843 (2012).
- Morais, D. S., Guedes, R. M., Lopes, M. A. Antimicrobial approaches for textiles: From research to market. Materials. 9 (6), 498(2016).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Development of advanced textile finishes using nano-emulsions from herbal extracts for organic cotton fabrics. Coatings. 11 (8), 939(2021).
- Martínez-Hernández, G. B., Amodio, M. L., Colelli, G. Carvacrol-loaded chitosan nanoparticles maintain quality of fresh-cut carrots. Innovative Food Science & Emerging Technologies. 41, 56-63 (2017).
- Zhang, H. L., Wu, S. H., Tao, Y., Zang, L. Q., Su, Z. Q. Preparation and characterization of water-soluble chitosan nanoparticles as protein delivery system. Journal of Nanomaterials. 2010, 1-5 (2010).
- Patel, R., Gajra, B., Parikh, R. H., Patel, G. Ganciclovir loaded chitosan nanoparticles: preparation and characterization. Journal of Nanomedicine & Nanotechnology. 7 (6), 1-8 (2016).
- Merodio, M., Arnedo, A., Renedo, M. J., Irache, J. M. Ganciclovir-loaded albumin nanoparticles: characterization and in vitro release properties. European Journal of Pharmaceutical Sciences. 12 (3), 251-259 (2001).
- Hsieh, W. C., Chang, C. P., Gao, Y. L. Controlled release properties of Chitosan encapsulated volatile Citronella Oil microcapsules by thermal treatments. Colloids and Surfaces B: Biointerfaces. 53 (2), 209-214 (2006).
- Yoksan, R., Jirawutthiwongchai, J., Arpo, K. Encapsulation of ascorbyl palmitate in chitosan nanoparticles by oil-in-water emulsion and ionic gelation processes. Colloids and Surfaces B: Biointerfaces. 76 (1), 292-297 (2010).
- Keawchaoon, L., Yoksan, R. Preparation, characterization and in vitro release study of carvacrol-loaded chitosan nanoparticles. Colloids and Surfaces B: Biointerfaces. 84 (1), 163-171 (2011).
- Cazedey, E. C. L., Salgado, H. R. N. Development and validation of a microbiological agar assay for determination of orbifloxacin in pharmaceutical preparations. Pharmaceutics. 3 (3), 572-581 (2011).
- Jayapriya, S., Bagyalakshmi, G. Textile antimicrobial testing and standards. International Journal of Textile and Fashion Technology. 4 (1), 2250-2378 (2013).
- AATCC 100. Antibacterial Finishes on Textile Materials: Assessment of Developed from American Association of Textile Chemists and Colorists. AATCC 100. , (2004).
- AATCC 147. Antimicrobial Activity Assessment of Textile Materials: Parallel Streak Method from American Association of Textile Chemists and Colorists. AATCC 147. , (2004).
- Ortelli, S., Costa, A. L., Dondi, M. TiO2 nanosols applied directly on textiles using different purification treatments. Materials. 8 (11), 7988-7996 (2015).
- Poole, K. Pseudomonas aeruginosa: resistance to the max. Frontiers in Microbiology. 2, 65(2011).
- Pinho, E., Magalhães, L., Henriques, M., Oliveira, R. Antimicrobial activity assessment of textiles: standard methods comparison. Annals of Microbiology. 61 (3), 493-498 (2010).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Novel antimicrobial finishing of organic cotton fabrics using nano-emulsions derived from Karanja and Gokhru plants. Textile Research Journal. 92 (23-24), 5015-5032 (2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved