È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un tessuto antimicrobico che utilizza l'incapsulamento nano-erboristico di oli essenziali
In questo articolo
Riepilogo
I camici da laboratorio antimicrobici prevengono la contaminazione incrociata dell'accumulo di agenti patogeni e delle fuoriuscite accidentali di sostanze biologiche. Qui, descriviamo il protocollo per lo sviluppo di un tessuto antimicrobico delicato sulla pelle utilizzando l'incapsulamento nano-a base di erbe e test standard modificati per valutare con precisione l'efficacia e l'idoneità per l'uso tipico del camice da laboratorio.
Abstract
I camici da laboratorio sono ampiamente utilizzati nei laboratori a rischio biologico e nelle strutture sanitarie come indumenti protettivi per prevenire l'esposizione diretta a agenti patogeni, fuoriuscite e ustioni. Questi rivestimenti protettivi a base di cotone forniscono le condizioni ideali per la crescita microbica e i siti di attacco grazie alla loro natura porosa, alla capacità di trattenere l'umidità e alla ritenzione del calore dal corpo dell'utente. Diversi studi hanno dimostrato la sopravvivenza di batteri patogeni su indumenti ospedalieri e camici da laboratorio, agendo come vettori di trasmissione microbica.
Un approccio comune per risolvere questi problemi è l'applicazione di agenti antimicrobici nel finissaggio tessile, ma sono state sollevate preoccupazioni a causa della tossicità e degli effetti ambientali di molte sostanze chimiche sintetiche. La pandemia in corso ha anche aperto una finestra per lo studio di antimicrobici efficaci e formulazioni ecologiche e prive di tossicità. Questo studio utilizza due composti bioattivi naturali, carvacrolo e timolo, incapsulati in nanoparticelle di chitosano, che garantiscono una protezione efficace contro quattro patogeni umani con una riduzione fino a 4 log (99,99%). Questi agenti patogeni sono frequentemente rilevati nei camici da laboratorio utilizzati nei laboratori a rischio biologico.
I tessuti trattati hanno inoltre resistito fino a 10 cicli di lavaggio con riduzione microbica del 90%, sufficiente per l'uso previsto. Abbiamo apportato modifiche ai test standard esistenti sui tessuti per rappresentare meglio gli scenari tipici dell'utilizzo del camice da laboratorio. Questi perfezionamenti consentono una valutazione più accurata dell'efficacia dei camici da laboratorio antimicrobici e la simulazione del destino di eventuali fuoriuscite microbiche accidentali che devono essere neutralizzate in breve tempo. Ulteriori studi sono raccomandati per studiare l'accumulo di agenti patogeni nel tempo sui camici da laboratorio antimicrobici rispetto ai normali camici protettivi.
Introduzione
Il camice bianco protettivo è un dispositivo di protezione individuale (DPI) obbligatorio nei laboratori di microbiologia e nelle strutture sanitarie e protegge dall'esposizione diretta a agenti patogeni, fuoriuscite e ustioni. Questi cappotti di cotone promuovono la crescita microbica a causa di molti fattori: il tessuto fornisce siti di attacco e aerazione, cotone e amido utilizzati nel processo di produzione insieme alle cellule epiteliali esfoliate dall'utente forniscono nutrienti e la vicinanza all'utente dà calore e umidità. L'accumulo di microbi sui tessuti può anche causare problemi di salute come allergie e infezioni nosocomiali, odori sgradevoli e deterioramento dei tessuti1.
A differenza degli indumenti normali, i cappotti protettivi sono raramente lavati o disinfettati, come si trova in molte indagini 2,3. Molti studi mostrano prove di camici da laboratorio che agiscono come vettore di trasmissione microbica e il rischio di infezioni nosocomiali in ambito sanitario2,4, ceppi particolarmente resistenti3 come lo Staphylococcus aureus meticillino-resistente (MRSA); pertanto, sollevano preoccupazioni per la salute dei DPI, che hanno lo scopo di proteggere dalla contaminazione microbica. Non ci sono abbastanza studi trasversali sulle infezioni associate al camice da laboratorio nel contesto delle strutture di biosicurezza di livello 2 (BSL-2) o dei laboratori didattici di microbiologia, ma molte autorità di regolamentazione limitano l'uso di camici da laboratorio all'interno del livello di contenimento. Tuttavia, molte istituzioni accademiche in Nord America lottano per soddisfare i requisiti a causa di vincoli pratici, come il lavaggio e la conservazione all'interno della struttura, gli incidenti di indossare camici da laboratorio in aree pubbliche come mense e biblioteche sono comuni. Una soluzione pratica a questi problemi è l'applicazione di agenti antimicrobici nella finissaggio tessile.
I tessuti antimicrobici stanno guadagnando sempre più popolarità nell'abbigliamento sportivo, nell'abbigliamento sportivo e nelle calze, principalmente destinati a ridurre l'odore del corpo. Tuttavia, l'uso di questi tessuti non è comune nello sviluppo di DPI, ad eccezione di alcune maschere di cotone rivestite d'argento e indumenti sanitari5. Riportiamo lo sviluppo di un tessuto antimicrobico per camici da laboratorio, che inibisce i patogeni comuni trovati nei laboratori BSL-2 e rende efficace la protezione dalla contaminazione incrociata di agenti patogeni comuni.
Attualmente sul mercato sono disponibili una varietà di tessuti e finiture antimicrobici, ma la maggior parte di questi utilizza particelle colloidali di metalli pesanti (ad esempio, argento, rame, zinco), organometallici o sostanze chimiche sintetiche come triclosan e composti di ammonio quaternario, che non sono rispettosi dell'ambiente1 e possono portare a problemi di salute come irritazione cutanea e allergie6. Alcune formulazioni sintetiche pongono preoccupazioni a causa di microbi non bersaglio, come la flora normale o l'induzione di resistenza antimicrobica (AMR). La Food and Drug Administration (FDA) degli Stati Uniti regola i tessuti antimicrobici commerciali, che devono essere non tossici per l'utente e privi di ecotossicità. Pertanto, sono preferibili tessuti antimicrobici a base di biocidi naturali che inibiscono un ampio spettro di microbi. Gli oli essenziali (EO) sono ampiamente utilizzati come agenti antimicrobici e terapeutici, ma il loro uso nella finitura antimicrobica è limitato a causa della loro durata 6,7,8. Sulla base delle nostre conoscenze e ricerche di mercato sulla finitura nano-erboristica8, nessun tessuto antimicrobico a base di erbe è disponibile in commercio. Questo perché i rivestimenti sintetici sono facili da produrre e hanno una lunga durata. Alcuni tessuti rivestiti di nano-erbe segnalati solo per scopi di ricerca includono neem7, moringa 9 e foglie di curry9.
Il presente studio utilizza due componenti bioattivi estratti dagli OE di origano, carvacrolo e timolo, che sono efficaci contro una vasta gamma di agenti patogeni batterici e virus, ma sono generalmente riconosciuti come sicuri per l'uomo10. Tuttavia, questi componenti bioattivi sono volatili e quindi il loro potenziale antimicrobico è di breve durata se applicato direttamente al tessuto. L'incapsulamento nano-erboristico è un processo in cui componenti o farmaci bioattivi vengono caricati all'interno di un guscio polimerico che protegge il nucleo dal degrado ambientale e quindi migliora la durata di conservazione. Inoltre, le piccole dimensioni delle particelle polimeriche, che generalmente vanno da 10 nm a 100 nm, migliorano l'efficacia dell'applicazione e rallentano il rilascio dei composti bioattivi sul tessuto. Questi composti bioattivi sono utilizzati per vari scopi, come la conservazione degli alimenti10, ma non per il rivestimento tessile.
Tra i molti incapsulanti polimerici, il chitosano è un candidato attraente a causa di molti dei suoi attributi, come non tossicità, biodegradabilità, mucoadesività e biocompatibilità11. È un polisaccaride naturale, ottenuto dal processo di deacetilazione dalla chitina, che si trova nelle conchiglie e nelle pareti cellulari fungine. Viene utilizzato in applicazioni biochimiche e di conservazione degli alimenti come la somministrazione di farmaci o proteine 11,12,13, il rilascio controllato 14 e le pellicole antimicrobiche 10. Il chitosano non è facilmente solubile in acqua, ma forma una sospensione colloidale in mezzi acidi. Le molecole bioattive vengono caricate in nanoparticelle di chitosano (NP) con un semplice metodo di gelificazione ionica in due fasi14,15,16. In questo processo, composti bioattivi idrofobici come il carvacrolo e il timolo formano un'emulsione olio-in-acqua, che è aiutata da un tensioattivo, Tween 80. Successivamente, un composto polianionico, il tripolifosfato pentasodico (TPP), viene utilizzato per formare i legami incrociati tra i gruppi amminici lungo le molecole polimeriche policationiche e i gruppi fosfato delle molecole TPP per stabilizzare il complesso. Questo processo di complessazione solidifica i composti bioattivi all'interno della matrice di chitosano, che viene successivamente purificata e rivestita su campioni di cotone per produrre tessuto antimicrobico.
Le nano-formulazioni devono essere testate prima per l'efficacia antimicrobica in forma di emulsione prima di essere applicate al tessuto. Questo può essere convenientemente valutato con un metodo qualitativo, come la diffusione del disco di Kirby-Bauer, la diffusione del pozzo e il saggio della piastra del cilindro. Tuttavia, il saggio della piastra cilindrica17 offre la flessibilità di caricare volumi variabili della formulazione e confrontare la zona di gioco. In questo metodo, le formulazioni antimicrobiche vengono caricate in cilindri di acciaio inossidabile e poste su uno strato di agar morbido, che viene inoculato con il microrganismo o l'agente patogeno di prova. Il diametro della zona di clearance prodotta contro l'organismo in esame è proporzionale al potenziale inibitorio della formulazione antimicrobica e pertanto può essere utilizzato come alternativa ai metodi di diluizione del brodo. Tuttavia, la dimensione delle zone chiare è solo una misura comparativa o qualitativa all'interno di una piastra specifica, a meno che non vengano mantenuti standard specifici. Gli agenti antimicrobici agiscono contro i patogeni inibendo la loro crescita (biostatica) o uccidendo le cellule (biocida), che possono essere quantificati rispettivamente dalla concentrazione minima inibitoria (MIC) e dalla concentrazione minima battericida (MBC). Tuttavia, l'efficacia e il comportamento delle sostanze chimiche bioattive sono diversi nelle loro formulazioni (stato liquido) e quando rivestite su un substrato come un tessuto18. Questo perché molteplici fattori svolgono un ruolo nell'efficacia, come la stabilità dell'aderenza degli agenti antimicrobici al tessuto, il contenuto di umidità, il tipo di substrato e l'aderenza dei microbi. Se lo scopo previsto è solo l'attività batteriostatica, un test qualitativo come il "Parallel Streak Method"19 può fornire una valutazione relativamente rapida e semplice della formulazione antimicrobica diffusibile. Tuttavia, se si devono determinare gli effetti battericidi, può essere impiegata la "Valutazione delle finiture antibatteriche sui materiali tessili"20 , che fornisce la riduzione logaritmica dell'agente patogeno potenziato.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Preparazione di nanoparticelle
- Incapsulamento nano-erboristico
- Preparare 50 mL di acido acetico all'1% (v/v).
ATTENZIONE: L'acido acetico glaciale è irritante, che può causare gravi ustioni cutanee e danni agli occhi. Indossa un camice da laboratorio a figura intera, guanti in nitrile e occhiali e lavora sotto una cappa aspirante. - Preparare la soluzione di chitosano (1,2% p/v) sciogliendo 0,6 g di scaglie di chitosano (peso molecolare medio) in 50 ml di acido acetico all'1% (preparato sopra). Agitare per una notte (O/N) a temperatura ambiente (R/T) per ottenere un'emulsione omogenea.
- Aggiungere 0,5 g di Tween 80 e agitare (1.000 giri/min) a 60 °C per 2 ore per ottenere una soluzione omogenea. Portare la soluzione a R / T prima di aggiungere composti bioattivi (carvacrolo o timolo).
- Aggiungere 0,75 g di carvacrolo (o timolo) goccia a goccia o gradualmente mescolando (1.000 giri / min) la miscela per 20 minuti a R / T. Il rapporto in peso tra chitosano e composto bioattivo è 1:1.25.
- Aggiungere 50 mL (0,5% p/v) di TPP goccia per goccia alla miscela mescolando a R/T. Continuare a mescolare per 30 minuti per ottenere un'emulsione omogenea.
- Preparare un controllo negativo seguendo la stessa procedura ma senza l'aggiunta di composti bioattivi.
- Preparare 50 mL di acido acetico all'1% (v/v).
- Purificazione
- Centrifugare l'emulsione a 10.000 × g per 30 minuti a 4 °C e raccogliere le NP formate (pellet) dopo aver travasato il surnatante. Riservare il surnatante per testare l'efficacia dell'incapsulamento.
- Lavare le particelle (dal punto 1.2.1) utilizzando Tween 80 acquoso (1% v/v) con il doppio del volume di pellet formato per rimuovere i composti bioattivi liberi o non legati. Assicurati di disturbare il pellet vorticando fino a formare una soluzione omogenea in ogni fase di lavaggio.
- Lavare le particelle (dal punto 1.2.2) con acqua deionizzata due volte per eliminare le impurità.
- Ricostituire le NP risospendendo il pellet (dal punto 1.2.3) in 30 ml di acqua deionizzata. Conservare le NP a 4 °C per un massimo di 6 mesi.
NOTA: l'esperimento può essere sospeso in questa fase.
- Caratterizzazione
- Diluire le NP in acqua deionizzata fino a quando le letture ultraviolette-visibili (UV-Vis) tra 250 e 400 nm rientrano nell'intervallo (assorbanza >1).
- Registrare gli spettri di assorbimento UV-Vis delle NP sulle lunghezze d'onda comprese tra 250 e 400 nm utilizzando uno spettrofotometro UV-Vis.
- Conservare un'aliquota (1 ml) di NP a R/T per un intervallo di durate (ad esempio, da 1 a 6 mesi) e testare l'effetto antimicrobico con il metodo della piastra cilindrica insieme a un campione fresco.
- Rivestimento su tessuto
- Applicare NP su un tessuto di cotone intrecciato utilizzandoun metodo di polimerizzazione tampone 7,21.
- Immergere i campioni di tessuto nella soluzione contenente NP mescolata con un legante per tessuti per 3 minuti fino a quando non sono in ammollo. Quindi, passare i campioni attraverso una padella da laboratorio a due rulli per rimuovere il liquido in eccesso.
- Asciugare i campioni in forno a 100 °C per 30 minuti e polimerizzare a 130 °C per 10 minuti.
- Infine, lavare i campioni in un bagno ad ultrasuoni per 15 minuti per rimuovere le NP non legate.
NOTA: in alternativa, seguire il metodo semplificato descritto di seguito.
- Taglia il tessuto di cotone (o i campioni di camice da laboratorio) in quadrati di 10 cm x 10 cm.
- Immergere i pezzi tagliati in 2 ml di NP sintetizzato (10%) in un contenitore di plastica (12 cm x 12 cm) per 2 minuti a R/T. Rimuovere il liquido in eccesso asciugando all'aria.
- Spremere a caldo a 100 °C per 3 minuti per legare le NP.
- Rimuovere le NP non legate risciacquando in Tween 80 acquoso (2% p/v) e asciugare in forno a 100 °C per 30 min.
NOTA: Questo tessuto antimicrobico può essere conservato per 2 anni presso R/T.
- Applicare NP su un tessuto di cotone intrecciato utilizzandoun metodo di polimerizzazione tampone 7,21.
- Durata del lavaggio
- Tagliare il tessuto in campioni quadrati da 50 x 50 mm.
- Mettere i campioni in 50 ml di acqua calda di rubinetto (40 °C) in un contenitore di vetro/plastica e aggiungere due gocce di detergente normale (non antimicrobico).
- Risciacquare su uno shaker a dondolo o su un agitatore magnetico per 30 minuti.
- Asciugare all'aria o incubare a 60 °C per 2 ore e testare l'efficacia antimicrobica.
2. Saggio della piastra cilindrica per lo screening delle nanoparticelle
- Preparare l'agar di soia tripticase (TSA), il brodo di soia di tripticase (TSB), l'agar a base antibiotica (ABA) e l'agar di semi antibiotici (ASA), secondo le istruzioni del produttore, e sterilizzare il terreno di coltura in autoclave a 121 °C a 15 psi per 15 minuti.
- Sottocoltura dei microbi (da stock) di interesse, contro i quali vengono eseguiti i test di efficacia, su piastre TSA appena preparate (o qualsiasi mezzo appropriato) con il metodo della piastra striata a tre vie e incubare per produrre piastre di purezza. (Specie consigliate: S. aureus, E. coli, P. aeruginosa e C. albicans.)
- Inoculare le colture da piastre di purezza fresca in TSB (tubi da 10 ml) a 35 °C O/N con agitazione moderata (100-200 rpm).
- Aliquot 5,0 mL di ASA fuso in ciascuna provetta. Il numero di provette corrisponde al numero di microrganismi testati.
- Versare 20 ml di ABA fuso presterilizzato in ciascuna piastra di Petri (100 mm x 20 mm) in modo asettico per formare lo strato di base. Il numero di piastre di agar corrisponde al numero di microrganismi da testare. Aspetta che i media si solidifichino.
- Dopo la solidificazione dello strato di base, inoculare ogni ASA fuso con una coltura notturna dal punto 2.3 (1,0 ml, preriscaldato a 35 °C) e trasferire immediatamente il contenuto (miscela di ASA e coltura) sulla superficie di una piastra ABA. Ruotare la piastra per distribuire uniformemente lo strato di agar fuso. Assicurarsi che lo strato di seme appaia liscio e privo di urti o bolle.
- Posizionare fino a sei cilindri di acciaio inossidabile (6 mm x 6 mm x 10 mm; preautoclavati), uniformemente distanziati su uno schema esagonale, per piastra di agar utilizzando una coppia di pinzette sterili (Figura 1).
- Caricare i cilindri con le NP sintetizzate di diversi volumi (30 μL, 50 μL, 75 μL e 100 μL) da sottoporre a screening per gli effetti antimicrobici. Il controllo negativo è quello senza composti bioattivi.
- Incubare patogeni batterici comuni (ad esempio, E. coli, S. aureus, P. aeruginosa) a 35 °C per 24 ore e specie fungine (ad esempio, C. albicans) a R/T per 3 giorni.
- Misurare il diametro della zona libera e confrontare l'efficacia delle NP sintetizzate.
NOTA: Questo test può essere utilizzato per preselezionare le migliori NP da rivestire sul tessuto.
3. Metodo della striscia parallela (modificato da AATCC 147)
- Preparazione del materiale
- Tagliate il tessuto trattato NP in campioni da 50 x 25 mm.
- Preparare l'agar Mueller-Hinton (MHA), TSA e TSB, secondo le istruzioni del produttore, e sterilizzare il fluido in autoclave a 121 °C a 15 psi per 15 minuti.
- Sottocoltura dei microbi (da stock) di interesse, contro i quali vengono eseguiti i test di efficacia, su piastre TSA appena preparate (o qualsiasi altro mezzo appropriato) con il metodo della piastra striata a tre vie e incubare a 35 °C per 2 giorni per le macchie batteriche e a R/T per 5 giorni per ceppi fungini per produrre piastre di purezza. (Specie consigliate: S. aureus, E. coli, P. aeruginosa e C. albicans.)
- Spiking di colture microbiche
- Inoculare le colture da piastre di purezza fresca in TSB (tubi da 10 ml) a 35 °C O/N con agitazione moderata (100-200 rpm).
- Diluire le colture O/N a 1,5 × 108 unità formanti colonie (CFU)/mL o corrispondenti alla torbidità dello standard 0,5 McFarland (di solito una diluizione da 1/10 a 1/20 per la maggior parte delle colture sane).
- Inoculare la coltura diluita sopra usando un anello sterile di 4 mm come segue. Caricare un ciclo di coltura di brodo e trasferirlo sulla superficie della piastra di agar MHA facendo cinque strisce parallele, ciascuna di 6 cm di lunghezza e 1 cm di distanza, secondo la Figura 2. Non riempire nuovamente il ciclo.
- Premere delicatamente il campione di tessuto usando una spatola sterile sulle cinque strisce in modo che il tessuto sia al centro e tocchi tutte e cinque le linee di striatura. Incubare a 35 °C per 24 ore.
- Valutazione qualitativa dell'efficacia antimicrobica
- Esaminare la piastra incubata per l'interruzione della crescita lungo le strisce oltre i bordi del tessuto (la zona chiara indica l'inibizione della crescita).
- Calcolate la larghezza media di una zona di inibizione lungo la linea di striatura (W) su entrambi i lati del campione di tessuto utilizzando l'equazione (1).
W = (T - D)/2 (1)
W = larghezza della zona libera; T = lunghezza totale della zona libera, compresa la larghezza del campione; D = larghezza del campione di tessuto (25 mm).
4. Metodo di riduzione quantitativa del log (modificato da AATCC 100)
- Preparazione sperimentale
- Tagliare il tessuto in campioni quadrati da 50 x 50 mm.
- Preparare TSA, TSB, brodo di Letheen e soluzione salina tamponata con fosfato (PBS), secondo le istruzioni dei produttori, e sterilizzare il mezzo mediante autoclave.
- Preparare colture O/N di microbi di interesse, contro i quali vengono eseguiti i test di efficacia, inoculando colonie isolate da piastre di purezza in TSB sterile e incubando a 35 °C per 18-24 ore. (Specie consigliate: S. aureus, E. coli, P. aeruginosa e C. albicans.)
- Spiking di colture microbiche
- Diluire le colture O/N a 1,5 × 108 CFU/mL o corrispondenti alla torbidità dello standard 0,5 McFarland (di solito una diluizione da 1/10 a 1/20 per la maggior parte delle colture sane).
- Determinare il volume appropriato di colture per lo spiking misurando la capacità di ritenzione liquida del tessuto come segue.
- Aggiungere una serie di volumi della coltura del brodo diluito (ad esempio, 100-500 μL) su campioni di tessuto (in piastre di Petri separate) e scegliere il volume in modo tale che il campione di tessuto assorba completamente l'acqua e non lasci liquidi residui / liberi. La capacità di ritenzione del liquido differisce dal tipo e dallo spessore del tessuto. Per i normali camici da laboratorio in cotone, è di circa 200 μL.
- Aumentare il volume (capacità di ritenzione del liquido determinata al di sopra [ad esempio, 200 μL]) di ciascuna coltura sui campioni posti in piastre di Petri sterili. Il numero di campioni corrisponde al numero di test (ad esempio, tessuto testato immediatamente e dopo il lavaggio [e i cicli di lavaggio testati]) e agli effetti antimicrobici testati nel tempo di contatto (dopo un'ora / giorno prestabilito [ad esempio, 30 minuti, 2 ore, Giorno 1-3]).
NOTA: Utilizzare una micropipetta con punte del filtro aerosol (per evitare la contaminazione della pipetta negli usi successivi) per inoculare le colture sui campioni con una distribuzione uniforme. - Per il controllo negativo, utilizzare lo stesso tipo di campioni di tessuto non trattati. Eseguire il controllo negativo per ciascuna corrispondente specie microbica di prova, periodo di contatto, tessuti diversi e cicli di lavaggio.
- Recupero di microbi mediante conteggio delle piastre vitali
- Lasciare asciugare i campioni inoculati (sia trattati che non trattati) all'aria all'interno delle piastre di Petri (coperchi socchiusi) a R/T per il periodo o i periodi di contatto richiesti da testare (ad esempio, 0 min, 30 min, 60 min, ecc., o anche giorni per effetti a lungo termine). Includere sempre uno "0 min" per rappresentare un effetto immediato e un'efficacia neutralizzante.
- Trasferire i campioni in modo asettico in provette sterili separate (50 ml) e avvitare saldamente i tappi.
- Aggiungere brodo di Letheen (eventuali tamponi neutralizzanti rilevanti) per ottenere una diluizione di 1/100 (ad esempio, 19,8 ml per un inoculo di 200 μL).
- Chiudere saldamente i tubi della centrifuga con i tappi a vite e vortice per 1 minuto a velocità media.
- Diluire serialmente la sospensione con il PBS sterile nelle successive diluizioni 1/10, in modo tale che la conta delle colonie del gruppo "non trattato" diventi troppo bassa per contare (TLTC).
- Placcare le diluizioni (0,1 ml) su piastre di supporto appropriate, che supportano la crescita del microrganismo (ad esempio, TSA per i batteri o agar destrosio di Sabouraud [SDA] per i funghi) o qualsiasi mezzo che ottimizzi la crescita e fornisca un buon contrasto per rendere accurato il conteggio delle colonie.
- Incubare le placche batteriche a 35 °C per 2 giorni e le placche fungine a R/T per 5 giorni.
- Conta i CFU vitali direttamente utilizzando un contatore di colonie o utilizzando un software di imaging (ad esempio, CFU AI).
- Calcolare la riduzione del log microbico (R) dovuta al tessuto antimicrobico usando l'equazione (2):
R =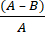 × 100 (2)
× 100 (2)
A = valore logaritmico del numero di CFU recuperati da tessuti non trattati; B = valore logaritmico del numero di CFU recuperati dal tessuto trattato.
Access restricted. Please log in or start a trial to view this content.
Risultati
Screening iniziale delle NP sintetizzate
Seguendo la tecnica dell'emulsione olio-in-acqua in due fasi16, i composti bioattivi (carvacrolo e timolo) sono stati incapsulati con successo nel chitosano. Ciò è stato confermato dalla spettrofotometria UV-Vis per l'assorbimento di picco dei rispettivi composti bioattivi rispetto ai controlli, che erano le NP del chitosano senza composti bioattivi. Le NP costituite sono risultate omogenee e stabili per 12 mesi a 4 °C. Lo screening ...
Access restricted. Please log in or start a trial to view this content.
Discussione
L'efficacia antimicrobica dei biocidi è convenzionalmente testata mediante saggi quantitativi, come la concentrazione minima inibitoria (MIC) e la concentrazione battericida minima (MBC), in cui i batteri sono immersi in un liquido antimicrobico per 24 ore. Tuttavia, questi saggi non sono adatti per tessuti spalmati, dove manca l'interfaccia liquida e i biocidi sono diffusi lentamente lungo le fibre del tessuto. Pertanto, sono stati stabiliti molti test standard sui tessuti, come AATCC 147, ISO 20645, AATCC 100 e JIS L ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti di interesse.
Riconoscimenti
Questo studio è stato finanziato da "Applied Research, Innovation and Entrepreneurship Services" (ARIES), Centennial College, Canada.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Acetic acid | Millipore Sigma | 64-19-7 | |
| Antibiotic base agar | BD Difco | DF0270-17-4 | Also known as Antibiotic Medium 2 |
| Antibiotic seed agar | BD Difco | DF0263-17-3 | Also known as Antibiotic Medium 1 |
| Blood Agar (Nutrient Agar with 5% Sheep Blood) | Donated by CFIA | ||
| Bromcresol Purple Lactose Agar | Donated by CFIA | ||
| Candida albicans | ATCC The Global Bioresource Center | ATTC 10231 | |
| Carvacrol | Millipore Sigma | 282197 (CAS# 499-75-2) | |
| Centrifuge Allergra X-22R Centrifuge | Beckman Coulter | Model # X-22R | Refrigerated. Wait at least 20 min or until the temperature reach the set low value (e.g., 4 °C) as the refrigeration takes time. |
| Chitosan Medium Molecular Weight (CS) | Millipore Sigma | 448877 (CAS # 9012-76-4) | |
| Clamshell Heat Press | Intiva | IM1200 | |
| Escherichia coli (E. coli) | ATCC The Global Bioresource Center | ATTC 23725 | |
| Incubator | Thermo Scientific | 1205M34 | |
| Letheen Broth | BD Difco | DF0681-17-7 | Used to neutralize antimicrobial effects. Product from different manufacturers may require to add Polysorbate 80, which is already added in Difco product. |
| Milli Q water | Millipore Sigma | ZR0Q16WW | Deionized water |
| Mueller-Hinton Agar | BD Difco | DF0252-17-6 | |
| Pentasodium tripolyphosphate (TPP) | Millipore Sigma | 238503 (CAS# 7758-29-4) | |
| Phospahte Buffered Saline (PBS) | Thermo Scientific | AM9624 | |
| Pseudomonas aeruginosa | ATCC The Global Bioresource Center | ATTC 9027 | |
| Sabouraud Dextrose Agar | BD Difco | DF0109-17-1 | |
| Shaking incubator/ Thermo shaker | VWR | Model# SHKA2000 | |
| Staphylococcus aureus | ATCC The Global Bioresource Center | ATTC 6538 | |
| Thymol | Millipore Sigma | T0501 (CAS# 89-83-8) | |
| Trypticase Soy Agar | BD Difco | 236950 | |
| Trypticase Soy Broth | BD Difco | 215235 | |
| Tween 80 | Millipore Sigma | STS0204 (CAS # 9005-65-6) | |
| UV-Vis Spectrophometer | Thermo Scientific | GENESYS 30 (840-277000) |
Riferimenti
- Schmidt-Emrich, S., et al. Rapid assay to assess bacterial adhesion on textiles. Materials. 9 (4), 249(2016).
- Qaday, J., et al. Bacterial contamination of medical doctors and students white coats at Kilimanjaro Christian Medical Centre, Moshi, Tanzania. International Journal of Bacteriology. 2015, 507890(2015).
- Treakle, A. M., et al. Bacterial contamination of health care workers' white coats. American Journal of Infection Control. 37 (2), 101-105 (2009).
- Wong, D., Nye, K., Hollis, P. Microbial flora on doctors' white coats. BMJ. 303 (6817), 1602-1604 (1991).
- Gouveia, I. C. Nanobiotechnology: A new strategy to develop non-toxic antimicrobial textiles for healthcare applications. Journal of Biotechnology. (150), 349(2010).
- Joshi, M., Ali, S. W., Purwar, R., Rajendran, S. Ecofriendly antimicrobial finishing of textiles using bioactive agents based on natural products. Indian Journal of Fibre and Textile Research. 34, 295-304 (2009).
- Ahmed, H. A., Rajendran, R., Balakumar, C. Nanoherbal coating of cotton fabric to enhance antimicrobial durability. Elixir Applied Chemistry. 45, 7840-7843 (2012).
- Morais, D. S., Guedes, R. M., Lopes, M. A. Antimicrobial approaches for textiles: From research to market. Materials. 9 (6), 498(2016).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Development of advanced textile finishes using nano-emulsions from herbal extracts for organic cotton fabrics. Coatings. 11 (8), 939(2021).
- Martínez-Hernández, G. B., Amodio, M. L., Colelli, G. Carvacrol-loaded chitosan nanoparticles maintain quality of fresh-cut carrots. Innovative Food Science & Emerging Technologies. 41, 56-63 (2017).
- Zhang, H. L., Wu, S. H., Tao, Y., Zang, L. Q., Su, Z. Q. Preparation and characterization of water-soluble chitosan nanoparticles as protein delivery system. Journal of Nanomaterials. 2010, 1-5 (2010).
- Patel, R., Gajra, B., Parikh, R. H., Patel, G. Ganciclovir loaded chitosan nanoparticles: preparation and characterization. Journal of Nanomedicine & Nanotechnology. 7 (6), 1-8 (2016).
- Merodio, M., Arnedo, A., Renedo, M. J., Irache, J. M. Ganciclovir-loaded albumin nanoparticles: characterization and in vitro release properties. European Journal of Pharmaceutical Sciences. 12 (3), 251-259 (2001).
- Hsieh, W. C., Chang, C. P., Gao, Y. L. Controlled release properties of Chitosan encapsulated volatile Citronella Oil microcapsules by thermal treatments. Colloids and Surfaces B: Biointerfaces. 53 (2), 209-214 (2006).
- Yoksan, R., Jirawutthiwongchai, J., Arpo, K. Encapsulation of ascorbyl palmitate in chitosan nanoparticles by oil-in-water emulsion and ionic gelation processes. Colloids and Surfaces B: Biointerfaces. 76 (1), 292-297 (2010).
- Keawchaoon, L., Yoksan, R. Preparation, characterization and in vitro release study of carvacrol-loaded chitosan nanoparticles. Colloids and Surfaces B: Biointerfaces. 84 (1), 163-171 (2011).
- Cazedey, E. C. L., Salgado, H. R. N. Development and validation of a microbiological agar assay for determination of orbifloxacin in pharmaceutical preparations. Pharmaceutics. 3 (3), 572-581 (2011).
- Jayapriya, S., Bagyalakshmi, G. Textile antimicrobial testing and standards. International Journal of Textile and Fashion Technology. 4 (1), 2250-2378 (2013).
- AATCC 100. Antibacterial Finishes on Textile Materials: Assessment of Developed from American Association of Textile Chemists and Colorists. AATCC 100. , (2004).
- AATCC 147. Antimicrobial Activity Assessment of Textile Materials: Parallel Streak Method from American Association of Textile Chemists and Colorists. AATCC 147. , (2004).
- Ortelli, S., Costa, A. L., Dondi, M. TiO2 nanosols applied directly on textiles using different purification treatments. Materials. 8 (11), 7988-7996 (2015).
- Poole, K. Pseudomonas aeruginosa: resistance to the max. Frontiers in Microbiology. 2, 65(2011).
- Pinho, E., Magalhães, L., Henriques, M., Oliveira, R. Antimicrobial activity assessment of textiles: standard methods comparison. Annals of Microbiology. 61 (3), 493-498 (2010).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Novel antimicrobial finishing of organic cotton fabrics using nano-emulsions derived from Karanja and Gokhru plants. Textile Research Journal. 92 (23-24), 5015-5032 (2022).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon