JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
에센셜 오일의 나노 허브 캡슐화를 이용한 항균 직물
요약
항균 실험실 코트는 병원균 축적 및 우발적인 생물 유출의 교차 오염을 방지합니다. 여기에서는 실험실 코트의 일반적인 용도에 대한 효능과 적합성을 정확하게 평가하기 위해 나노 허브 캡슐화 및 수정된 표준 테스트를 사용하여 피부 친화적인 항균 직물을 개발하기 위한 프로토콜을 설명합니다.
초록
실험실 코트는 생물학적 위험 실험실 및 의료 시설에서 병원균, 유출 및 화상에 대한 직접적인 노출을 방지하기 위한 보호복으로 널리 사용됩니다. 이 면 기반 보호 코트는 다공성 특성, 수분 보유 능력 및 사용자 신체의 보온성 유지로 인해 미생물 성장 및 부착 부위에 이상적인 조건을 제공합니다. 여러 연구에서 병원 의류와 실험복에서 병원성 박테리아가 생존하여 미생물 전파 매개체 역할을 하는 것으로 나타났습니다.
이러한 문제를 해결하기 위한 일반적인 접근 방식은 섬유 마감재에 항균제를 적용하는 것이지만 많은 합성 화학 물질의 독성 및 환경 영향으로 인해 우려가 제기되었습니다. 진행중인 전염병은 또한 효과적인 항균제와 친환경적이고 독성이 없는 제형에 대한 조사의 창을 열었습니다. 이 연구는 키토산 나노 입자에 캡슐화 된 두 가지 천연 생리 활성 화합물 인 카바 크롤과 티몰을 사용하여 최대 4 로그 감소 (99.99 %)로 4 가지 인간 병원체에 대한 효과적인 보호를 보장합니다. 이러한 병원체는 생물학적 위험 실험실에서 사용되는 실험실 코트에서 자주 검출됩니다.
처리된 직물은 또한 90%의 미생물 감소로 최대 10회의 세탁 사이클에 저항하여 의도한 용도에 충분합니다. 실험실 코트 사용의 일반적인 시나리오를 더 잘 나타내기 위해 기존 표준 직물 테스트를 수정했습니다. 이러한 개선을 통해 항균 실험실 코트의 효과를 보다 정확하게 평가하고 짧은 시간 내에 중화해야 하는 우발적인 미생물 유출의 운명을 시뮬레이션할 수 있습니다. 일반 보호 코트와 비교하여 항균 실험실 코트에서 시간 경과에 따른 병원균 축적을 조사하기 위한 추가 연구가 권장됩니다.
서문
보호용 흰색 코트는 미생물학 실험실 및 의료 시설에서 필수 개인 보호 장비(PPE) 품목이며 병원균, 유출 및 화상에 직접 노출되지 않도록 보호합니다. 이러한 면 코트는 많은 요인으로 인해 미생물 성장을 촉진합니다 - 직조된 직물은 부착 부위 및 통기를 제공하며, 면과 전분은 사용자로부터 박리된 상피 세포와 함께 제조 공정에 사용되어 영양분을 공급하며, 사용자와의 근접성은 따뜻함과 습기를 제공합니다. 직물에 미생물이 축적되면 알레르기 및 병원 감염, 불쾌한 냄새 및 직물 변질과 같은 건강 문제가 발생할 수 있습니다1.
일반 의복과 달리 보호 코트는 많은 설문 조사 2,3에서 볼 수 있듯이 자주 세탁하거나 소독하지 않습니다. 많은 연구들은 실험실 외투가 미생물 전파의 매개체로 작용한다는 증거와 의료 환경에서 병원 감염의 위험성을 보여준다2,4, 특히 메티실린 내성 황색포도상구균(methicillin-resistant Staphylococcus aureus, MRSA)과 같은 내성 균주3; 따라서 미생물 오염으로부터 보호하기 위한 PPE의 건강 문제를 제기합니다. 생물 안전 레벨 2 (BSL-2) 시설 또는 미생물학 교육 실험실의 맥락에서 실험실 코트 관련 감염에 대한 단면 연구는 충분하지 않지만 많은 규제 당국은 격리 수준 내에서 실험실 코트 사용을 제한합니다. 그러나 북미의 많은 학술 기관은 시설 내 세탁 및 보관과 같은 실질적인 제약으로 인해 요구 사항을 충족하기 위해 고군분투하고 있으며, 카페테리아 및 도서관과 같은 공공 장소에서 실험복을 착용하는 사건이 일반적입니다. 이러한 문제에 대한 한 가지 실용적인 해결책은 섬유 마감재에 항균제를 적용하는 것입니다.
항균 직물은 주로 체취를 줄이기 위한 운동복, 활동복 및 양말에서 점점 더 인기를 얻고 있습니다. 그러나 일부 은도금 면 마스크와 의료용 의류를 제외하고는 PPE 개발에서 이러한 직물을 사용하는 것이 일반적이지 않다5. 우리는 BSL-2 실험실에서 발견되는 일반적인 병원체를 억제하고 일반적인 병원체의 교차 오염으로부터 효과적인 보호를 제공하는 실험실 코트용 항균 직물의 개발을 보고합니다.
현재 다양한 항균 직물 및 마감재가 시판되고 있지만, 이들 중 대부분은 중금속 콜로이드 입자(예: 은, 구리, 아연), 유기금속 또는 트리클로산 및 4차 암모늄 화합물과 같은 합성 화학 물질을 사용하며, 이는 환경 친화적이지 않으며1 피부 자극 및 알레르기와 같은 건강 문제를 유발할 수 있다6. 일부 합성 제제는 정상 세균총과 같은 비표적 미생물 또는 항생제 내성(AMR) 유도로 인해 우려를 제기합니다. 미국 식품의약국(FDA)은 상업용 항균 직물을 규제하며, 이는 사용자에게 무독성이고 환경 독성이 없어야 합니다. 따라서, 광범위한 미생물을 억제하는 천연 살생물제에 기초한 항균 직물이 바람직하다. 에센셜 오일(EO)은 항균 및 치료제로 널리 사용되지만, 항균 마감재에서의 사용은 이들의 내구성 6,7,8로 인해 제한적이다. 나노 허브 마감처리에 대한 당사의 지식과 시장 조사에 따르면 8 허브 기반 항균 원단은 상업적으로 이용 가능하지 않다. 합성 코팅은 제조가 쉽고 내구성이 길기 때문입니다. 연구 목적으로만 보고된 나노 허브 코팅 직물로는 님7, 모링가 9, 카레 잎9 등이 있다.
본 연구는 오레가노 EO에서 추출한 두 가지 생리 활성 성분인 카바크롤과 티몰을 사용하는데, 이는 광범위한 박테리아 병원체와 바이러스에 효과적이지만 일반적으로 인간에게 안전한 것으로 알려져 있다10. 그러나 이러한 생리 활성 성분은 휘발성이므로 직물에 직접 적용하면 항균 잠재력이 짧습니다. 나노 허브 캡슐화는 생리 활성 성분 또는 약물이 환경 분해로부터 코어를 보호하는 고분자 쉘 내부에 적재되어 유통 기한을 향상시키는 과정입니다. 또한, 일반적으로 10 nm 내지 100 nm 범위의 중합체 입자의 작은 크기는 적용의 효능을 향상시키고, 직물 상으로의 생리활성 화합물의 방출을 늦춘다. 이러한 생리활성 화합물은 식품 보존(10)과 같은 다양한 목적으로 사용되지만, 섬유 코팅에는 사용되지 않는다.
많은 고분자 봉지재 중에서 키토산은 무독성, 생분해성, 점막접착성 및 생체 적합성과 같은 많은 특성으로 인해 매력적인 후보입니다11. 조개껍데기와 곰팡이 세포벽에서 발견되는 키틴의 탈아세틸화 과정을 통해 얻은 천연 다당류입니다. 약물 또는 단백질 전달(11,12,13), 방출 제어(14) 및 항균 필름(10)과 같은 생화학 및 식품 보존 용도에 사용된다. 키토산은 물에 쉽게 용해되지 않지만 산성 매질에서 콜로이드 현탁액을 형성합니다. 생리활성 분자는 간단한 2단계 이온성 겔화 방법14,15,16에 의해 키토산 나노입자(NP)에 로딩됩니다. 이 과정에서 카바크롤 및 티몰과 같은 소수성 생리활성 화합물은 계면활성제인 Tween 80의 도움을 받아 수중유 에멀젼을 형성합니다. 이어서, 폴리음이온성 화합물인 펜타소듐 트리폴리포스페이트(TPP)를 사용하여 다양이온성 고분자 분자와 TPP 분자의 인산기를 따라 아미노기 사이의 가교결합을 형성하여 복합체를 안정화시킨다. 이 복합체화 과정은 키토산 매트릭스 내의 생리 활성 화합물을 고형화하고, 이후 정제되어 면 견본에 코팅되어 항균 직물을 생산합니다.
나노 제형은 직물에 적용하기 전에 에멀젼 형태의 항균 효과에 대해 먼저 테스트해야 합니다. 이는 Kirby-Bauer 디스크 확산, 웰 확산 및 실린더 플레이트 분석과 같은 정성적 방법에 의해 편리하게 평가될 수 있다. 그러나, 실린더 플레이트 분석(17 )은 제형의 다양한 부피를 로딩하고 클리어런스 영역을 비교할 수 있는 유연성을 제공한다. 이 방법에서, 항균 제제는 스테인레스 스틸 실린더에 적재되고 시험 미생물 또는 병원체로 접종되는 부드러운 한천 층에 놓인다. 시험 유기체에 대해 생성된 클리어런스 영역의 직경은 항균 제제의 억제 가능성에 비례하므로 브로스 희석 방법의 대안으로 사용할 수 있습니다. 그러나 클리어 존의 크기는 특정 표준이 유지되지 않는 한 특정 플레이트 내에서 비교 또는 정성적 측정일 뿐입니다. 항균제는 병원체의 성장을 억제 (생체 정적)하거나 세포를 죽이거나 (살 생물) 병원체에 대해 작용하며, 이는 각각 최소 억제 농도 (MIC) 및 최소 살균 농도 (MBC)로 정량화 할 수 있습니다. 그러나, 생리활성 화학물질의 효능 및 거동은 그들의 제형(액체 상태)과 직물과 같은 기재 상에 코팅될 때 상이하다(18). 이는 직물에 대한 항균제의 부착 안정성, 수분 함량, 기질 유형 및 미생물 부착과 같은 여러 요인이 효능에 중요한 역할을 하기 때문입니다. 의도된 목적이 정균 활성뿐인 경우, "평행 줄무늬 방법"19 과 같은 정성 분석을 통해 확산성 항균 제제를 비교적 빠르고 쉽게 평가할 수 있습니다. 그러나 살균 효과를 결정해야 하는 경우 "섬유 재료에 대한 항균 마감 평가"20 를 사용할 수 있으며, 이는 스파이크된 병원체의 로그 감소를 제공합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 나노입자의 제조
- 나노 허브 캡슐화
- 1%(v/v) 아세트산 50mL를 준비합니다.
주의: 빙초산은 심한 피부 화상과 눈 손상을 일으킬 수 있는 자극제입니다. 전신 실험복, 니트릴 장갑, 고글을 착용하고 흄 후드 아래에서 작업하십시오. - 0.6g의 키토산 플레이크(중간 분자량)를 50mL의 1% 아세트산(위에서 제조)에 용해시켜 키토산 용액(1.2% w/v)을 준비합니다. 실온(R/T)에서 하룻밤(O/N)을 교반하여 균질한 에멀젼을 얻습니다.
- 0.5g의 Tween 80을 첨가하고 60°C에서 2시간 동안 교반(1,000rpm)하여 균질한 용액을 얻습니다. 생리 활성 화합물(카바크롤 또는 티몰)을 추가하기 전에 용액을 R/T로 가져옵니다.
- 0.75g의 카바크롤(또는 티몰)을 R/T에서 20분 동안 교반(1,000rpm)하면서 또는 서서히 추가합니다. 생리 활성 화합물에 대한 키토산의 중량비는 1:1.25입니다.
- R/T에서 교반하면서 TPP 50mL(0.5% w/v)를 혼합물에 적가하고 30분 동안 계속 교반하여 균질한 에멀젼을 얻습니다.
- 생리 활성 화합물을 추가하지 않고 동일한 절차를 수행하여 음성 대조군을 준비하십시오.
- 1%(v/v) 아세트산 50mL를 준비합니다.
- 정화
- 에멀젼을 4°C에서 30분 동안 10,000× g 에서 원심분리하고 상층액을 디캔팅한 후 형성된 NP(펠릿)를 수집합니다. 캡슐화 효능을 시험하기 위해 상청액을 예약한다.
- 결합되지 않거나 유리 생리 활성 화합물을 제거하기 위해 형성된 펠릿 부피의 두 배로 수성 Tween 80(1% v/v)을 사용하여 입자(단계 1.2.1)를 세척합니다. 각 세척 단계에서 균일한 용액이 형성될 때까지 볼텍싱하여 펠릿을 방해해야 합니다.
- 입자 (1.2.2 단계부터)를 탈 이온수로 두 번 세척하여 불순물을 제거하십시오.
- 펠릿 (단계 1.2.3부터)을 30 mL의 탈이온수에 재현탁하여 NP를 재구성한다. NP를 4°C에서 최대 6개월 동안 보관합니다.
참고: 이 단계에서 실험을 일시 중지할 수 있습니다.
- 특징을 나타냄
- 250 내지 400 nm 사이의 자외선-가시광선(UV-Vis) 판독값이 범위 내에 떨어질 때까지 NP를 탈이온수로 희석한다(흡광도 >1).
- UV-Vis 분광 광도계를 사용하여 250 내지 400 nm 범위의 파장에 걸쳐 NP의 UV-Vis 흡수 스펙트럼을 기록한다.
- NP의 분취량(1mL)을 R/T에서 일정 기간(예: 1-6개월) 동안 보관하고 신선한 샘플과 함께 실린더 플레이트 방법으로 항균 효과를 테스트합니다.
- 직물에 코팅
- 패드 건조 경화 방법 7,21을 사용하여 짠 면직물에 NP를 도포합니다.
- 직물 견본을 직물 바인더와 혼합된 NP가 포함된 용액에 담글 때까지 3분 동안 담그십시오. 그런 다음 견본을 2롤러 실험실 패더에 통과시켜 과도한 액체를 제거합니다.
- 견본을 100°C에서 30분 동안 오븐에서 건조하고 130°C에서 10분 동안 경화시킵니다.
- 마지막으로 초음파 수조에서 견본을 15분 동안 세척하여 결합되지 않은 NP를 제거합니다.
참고: 또는 아래에 설명된 간단한 방법을 따르십시오.
- 면직물(또는 실험복 견본)을 10cm x 10cm 정사각형으로 자릅니다.
- 절단된 조각을 합성된 NP(10%) 2mL에 플라스틱 용기(12cm x 12cm)에 R/T에서 2분 동안 담그고 공기 건조로 과도한 액체를 제거합니다.
- 100°C에서 3분 동안 가열 프레스하여 NP를 결합합니다.
- 수성 트윈 80(2% w/v)으로 헹구어 결합되지 않은 NP를 제거하고 100°C의 오븐에서 30분 동안 건조시킵니다.
참고: 이 항균 직물은 R/T에서 2년 동안 보관할 수 있습니다.
- 패드 건조 경화 방법 7,21을 사용하여 짠 면직물에 NP를 도포합니다.
- 세탁 내구성
- 천을 50mm x 50mm 정사각형 견본으로 자릅니다.
- 유리/플라스틱 용기에 담긴 따뜻한 수돗물(40°C) 50mL에 견본을 넣고 일반 세제(비항균제) 두 방울을 추가합니다.
- 흔들리는 플랫폼 셰이커 또는 마그네틱 교반기에서 30분 동안 헹굽니다.
- 자연 건조 또는 60°C에서 2시간 동안 배양하고 항균 효능을 테스트합니다.
2. 나노입자 스크리닝을 위한 실린더판 분석
- 제조업체의 지침에 따라 트립티카제 대두 한천(TSA), 트립티카제 대두 브로스(TSB), 항생제 염기 한천(ABA) 및 항생제 종자 한천(ASA)을 준비하고 121°C에서 15psi에서 15분 동안 고압증기멸균하여 배지를 멸균합니다.
- 3방향 줄무늬 플레이트 방법으로 새로 준비된 TSA 플레이트(또는 적절한 배지)에서 효능 테스트가 수행되는 관심 미생물(스톡에서)을 계대 배양하고 배양하여 순도 플레이트를 생성합니다. (권장 종: S. aureus, E. coli, P. aeruginosa, C. albicans.)
- TSB(10mL 튜브)의 신선한 순도 플레이트에서 배양물을 35°C O/N에서 적당한 진탕(100-200rpm)으로 접종합니다.
- 용융된 ASA를 각각의 시험관에 5.0 mL 분취하였다. 튜브의 수는 테스트 된 미생물의 수와 일치합니다.
- 사전 멸균된 용융 ABA 20mL를 각 페트리 플레이트(100mm x 20mm)에 무균적으로 부어 베이스층을 형성합니다. 한천 플레이트의 수는 테스트 할 미생물의 수에 해당합니다. 미디어가 굳을 때까지 기다리십시오.
- 기층을 고형화시킨 후, 용융된 각 ASA를 2.3단계(1.0mL, 35°C로 예열)로부터의 하룻밤 배양물로 접종하고 즉시 내용물(ASA와 배양물의 혼합물)을 ABA 플레이트의 표면으로 옮긴다. 플레이트를 소용돌이 치면 용융 된 한천 층이 고르게 분포됩니다. 시드 레이어가 매끄럽고 범프나 기포가 없는지 확인합니다.
- 한 쌍의 멸균 핀셋을 사용하여 한천 플레이트당 최대 6개의 스테인리스강 실린더(6mm x 6mm x 10mm, 프리오토클레이브)를 육각형 패턴에 균일한 간격으로 배치합니다(그림 1).
- 항균 효과를 스크리닝할 다양한 부피(30μL, 50μL, 75μL 및 100μL)의 합성된 NP를 실린더에 로드합니다. 음성 대조군은 생리 활성 화합물이 없는 대조군입니다.
- 일반적인 박테리아 병원체(예: E. coli, S. aureus, P. aeruginosa)를 35°C에서 24시간 동안 배양하고 곰팡이 종(예: C. albicans)을 R/T에서 3일 동안 배양합니다.
- 클리어 존의 직경을 측정하고 합성된 NP의 효과를 비교합니다.
알림: 이 테스트는 직물에 코팅할 최상의 NP를 사전 스크리닝하는 데 사용할 수 있습니다.
3. 평행 줄무늬 방법 (AATCC 147에서 수정)
- 재료 준비
- NP 처리된 원단을 50mm x 25mm 견본으로 자릅니다.
- 제조업체의 지침에 따라 Mueller-Hinton 한천(MHA), TSA 및 TSB를 준비하고 121°C에서 15psi에서 15분 동안 고압증기멸균하여 매체를 멸균합니다.
- 3방향 줄무늬 플레이트 방법으로 새로 준비된 TSA 플레이트(또는 적절한 배지)에서 효능 테스트가 수행되는 관심 미생물(스톡에서)을 계대배양하고 박테리아 얼룩의 경우 35°C에서 2일 동안, 곰팡이 균주의 경우 R/T에서 5일 동안 배양하여 순도 플레이트를 생성합니다. (권장 종: S. aureus, E. coli, P. aeruginosa, C. albicans.)
- 미생물 배양의 스파이크
- TSB(10mL 튜브)의 신선한 순도 플레이트에서 배양물을 35°C O/N에서 적당한 진탕(100-200rpm)으로 접종합니다.
- O/N 배양액을 1.5 ×10 8 집락 형성 단위(CFU)/mL 또는 0.5 McFarland 표준의 탁도에 해당하는 것으로 희석합니다(일반적으로 대부분의 건강한 배양의 경우 1/10에서 1/20 희석).
- 위의 희석된 배양액을 4 mm 멸균 루프를 이용하여 다음과 같이 접종한다. 그림 2에 따라 브로스 배양물을 루프풀에 넣고 각각 길이 6cm, 간격 1cm의 평행한 줄무늬 5개를 만들어 MHA 한천 플레이트 표면으로 옮깁니다. 루프를 다시 채우지 마십시오.
- 멸균 주걱을 사용하여 직물 견본을 5개의 줄무늬에 걸쳐 부드럽게 눌러 직물이 중앙에 있고 5개의 줄무늬 선에 모두 닿도록 합니다. 35°C에서 24시간 동안 배양합니다.
- 항균 효능의 정성적 평가
- 직물 가장자리 너머의 줄무늬를 따라 성장 중단이 있는지 배양 된 플레이트를 검사하십시오 (명확한 영역은 성장 억제를 나타냄).
- 방정식 (1)을 사용하여 직물 견본의 양쪽에 있는 줄무늬 선(W)을 따라 억제 영역의 평균 너비를 계산합니다.
여 = (티 - 디)/2 (1)
W = 클리어 존의 폭; T = 견본 너비를 포함한 클리어 영역의 전체 길이; D = 직물 견본의 너비(25mm).
4. 정량적 로그 감소 방법 (AATCC 100에서 수정)
- 실험 준비
- 천을 50mm x 50mm 정사각형 견본으로 자릅니다.
- 제조업체의 지침에 따라 TSA, TSB, Letheen 브로스 및 인산염 완충 식염수(PBS)를 준비하고 오토클레이빙으로 배지를 멸균합니다.
- 멸균 TSB의 순도 플레이트에서 분리된 콜로니를 접종하고 35°C에서 18-24시간 동안 배양하여 효능 테스트가 수행되는 관심 미생물의 O/N 배양을 준비합니다. (권장 종: S. aureus, E. coli, P. aeruginosa 및 C. albicans.)
- 미생물 배양의 스파이크
- O/N 배양액을 1.5 × 108 CFU/mL 또는 0.5 McFarland 표준의 탁도에 해당하는 것으로 희석합니다(대부분의 건강한 배양의 경우 일반적으로 1/10에서 1/20 희석).
- 다음과 같이 직물의 액체 보유 용량을 측정하여 스파이킹을 위한 적절한 배양 부피를 결정합니다.
- 일련의 희석된 배양액 배양물(예: 100-500 μL)을 직물 견본(별도의 페트리 플레이트)에 추가하고 직물 견본이 물을 완전히 흡수하고 잔류/유리 액체를 남기지 않도록 부피를 선택합니다. 액체 보유 용량은 직물의 유형 및 두께와 다릅니다. 일반 면 실험복의 경우 약 200μL입니다.
- 각 배양액의 부피([예: 200μL] 이상으로 결정된 액체 보유 용량)를 멸균 페트리 플레이트에 놓인 견본에 스파이크합니다. 견본의 수는 테스트 횟수(예: 세탁 직후 및 세탁 후 테스트한 직물)와 접촉 시간(설정된 시간/일 후[예: 30분, 2시간, 1-3일]) 동안 테스트한 항균 효과에 해당합니다.
참고: 에어로졸 필터 팁이 있는 마이크로피펫을 사용하여(후속 사용 시 피펫의 오염을 방지하기 위해) 견본의 배양물을 균일한 분포로 접종합니다. - 음성 대조군의 경우 동일한 유형의 처리되지 않은 직물 견본을 사용하십시오. 각 해당 테스트 미생물 종, 접촉 기간, 다른 직물 및 세탁 주기에 대해 음성 대조군을 수행합니다.
- 생존 가능한 플레이트 수에 의한 미생물 회수
- 접종된 견본(처리 및 미처리 모두)을 테스트해야 하는 접촉 기간(예: 0분, 30분, 60분 등) 동안 R/T에서 페트리 플레이트(뚜껑이 열려 있음) 내부에서 자연 건조되도록 합니다. 즉각적인 효과와 중화 효능을 나타내기 위해 항상 "0분"을 포함하십시오.
- 견본을 무균 상태로 분리된 멸균 원심분리기 튜브(50mL)에 옮기고 캡을 단단히 조입니다.
- Letheen 국물(관련 중화 완충액)을 추가하여 1/100 희석액(예: 200μL 접종의 경우 19.8mL)을 만듭니다.
- 나사 캡으로 원심분리기 튜브를 단단히 닫고 중간 속도로 1분 동안 소용돌이칩니다.
- 현탁액을 후속 1/10 희석액에서 멸균 PBS로 연속적으로 희석하여 "처리되지 않은" 그룹의 콜로니 계수가 너무 낮아 계수할 수 없게 한다(TLTC).
- 미생물의 성장을 지원하는 적절한 배지 플레이트(예: 박테리아의 경우 TSA 또는 진균의 경우 Sabouraud dextrose 한천[SDA] 또는 성장을 최적화하고 콜로니 계수를 정확하게 하기 위해 우수한 대비를 제공하는 배지)에 희석액(0.1mL)을 플레이트합니다.
- 박테리아 플레이트를 35°C에서 2일 동안 배양하고 곰팡이 플레이트를 R/T에서 5일 동안 배양합니다.
- 콜로니 카운터를 사용하거나 이미징 소프트웨어(예: CFU AI)를 사용하여 생존 가능한 CFU를 직접 계산합니다.
- 식 (2)를 사용하여 항균 직물로 인한 미생물 로그 감소(R)를 계산합니다.
R =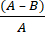 × 100 (2)
× 100 (2)
A = 처리되지 않은 직물에서 회수된 CFU 수의 로그 값; B = 처리된 직물에서 회수된 CFU 수의 로그 값.
Access restricted. Please log in or start a trial to view this content.
결과
합성된 NP의 초기 스크리닝
2-단계 수중유 에멀젼 기술(16)에 이어, 생리활성 화합물(카바크롤 및 티몰)이 키토산에 성공적으로 캡슐화되었다. 이는 대조군과 비교하여 각각의 생리활성 화합물의 피크 흡수에 대한 UV-Vis 분광광도법에 의해 확인되었으며, 이는 생리활성 화합물이 없는 키토산 NP였습니다. 구성된 NP는 4°C에서 12개월에 걸쳐 균질하고 안정하였다. 항균...
Access restricted. Please log in or start a trial to view this content.
토론
살 생물 제의 항균 효능은 통상적으로 최소 억제 농도 (MIC) 및 최소 살균 농도 (MBC)와 같은 정량 분석에 의해 테스트되며, 여기서 박테리아는 24 시간 동안 항균 액체에 담근다. 그러나 이러한 분석은 액체 계면이 부족하고 살생물제가 직물 섬유를 따라 천천히 확산되는 코팅된 직물에는 적합하지 않습니다. 따라서 AATCC 147, ISO 20645, AATCC 100 및 JIS L 1902와 같은 많은 표준 직물 테스트가 설정되었습니다...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 이해 상충이 없습니다.
감사의 말
이 연구는 캐나다 센테니얼 칼리지의 "응용 연구, 혁신 및 기업가 정신 서비스"(ARIES)의 자금 지원을 받았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Acetic acid | Millipore Sigma | 64-19-7 | |
| Antibiotic base agar | BD Difco | DF0270-17-4 | Also known as Antibiotic Medium 2 |
| Antibiotic seed agar | BD Difco | DF0263-17-3 | Also known as Antibiotic Medium 1 |
| Blood Agar (Nutrient Agar with 5% Sheep Blood) | Donated by CFIA | ||
| Bromcresol Purple Lactose Agar | Donated by CFIA | ||
| Candida albicans | ATCC The Global Bioresource Center | ATTC 10231 | |
| Carvacrol | Millipore Sigma | 282197 (CAS# 499-75-2) | |
| Centrifuge Allergra X-22R Centrifuge | Beckman Coulter | Model # X-22R | Refrigerated. Wait at least 20 min or until the temperature reach the set low value (e.g., 4 °C) as the refrigeration takes time. |
| Chitosan Medium Molecular Weight (CS) | Millipore Sigma | 448877 (CAS # 9012-76-4) | |
| Clamshell Heat Press | Intiva | IM1200 | |
| Escherichia coli (E. coli) | ATCC The Global Bioresource Center | ATTC 23725 | |
| Incubator | Thermo Scientific | 1205M34 | |
| Letheen Broth | BD Difco | DF0681-17-7 | Used to neutralize antimicrobial effects. Product from different manufacturers may require to add Polysorbate 80, which is already added in Difco product. |
| Milli Q water | Millipore Sigma | ZR0Q16WW | Deionized water |
| Mueller-Hinton Agar | BD Difco | DF0252-17-6 | |
| Pentasodium tripolyphosphate (TPP) | Millipore Sigma | 238503 (CAS# 7758-29-4) | |
| Phospahte Buffered Saline (PBS) | Thermo Scientific | AM9624 | |
| Pseudomonas aeruginosa | ATCC The Global Bioresource Center | ATTC 9027 | |
| Sabouraud Dextrose Agar | BD Difco | DF0109-17-1 | |
| Shaking incubator/ Thermo shaker | VWR | Model# SHKA2000 | |
| Staphylococcus aureus | ATCC The Global Bioresource Center | ATTC 6538 | |
| Thymol | Millipore Sigma | T0501 (CAS# 89-83-8) | |
| Trypticase Soy Agar | BD Difco | 236950 | |
| Trypticase Soy Broth | BD Difco | 215235 | |
| Tween 80 | Millipore Sigma | STS0204 (CAS # 9005-65-6) | |
| UV-Vis Spectrophometer | Thermo Scientific | GENESYS 30 (840-277000) |
참고문헌
- Schmidt-Emrich, S., et al. Rapid assay to assess bacterial adhesion on textiles. Materials. 9 (4), 249(2016).
- Qaday, J., et al. Bacterial contamination of medical doctors and students white coats at Kilimanjaro Christian Medical Centre, Moshi, Tanzania. International Journal of Bacteriology. 2015, 507890(2015).
- Treakle, A. M., et al. Bacterial contamination of health care workers' white coats. American Journal of Infection Control. 37 (2), 101-105 (2009).
- Wong, D., Nye, K., Hollis, P. Microbial flora on doctors' white coats. BMJ. 303 (6817), 1602-1604 (1991).
- Gouveia, I. C. Nanobiotechnology: A new strategy to develop non-toxic antimicrobial textiles for healthcare applications. Journal of Biotechnology. (150), 349(2010).
- Joshi, M., Ali, S. W., Purwar, R., Rajendran, S. Ecofriendly antimicrobial finishing of textiles using bioactive agents based on natural products. Indian Journal of Fibre and Textile Research. 34, 295-304 (2009).
- Ahmed, H. A., Rajendran, R., Balakumar, C. Nanoherbal coating of cotton fabric to enhance antimicrobial durability. Elixir Applied Chemistry. 45, 7840-7843 (2012).
- Morais, D. S., Guedes, R. M., Lopes, M. A. Antimicrobial approaches for textiles: From research to market. Materials. 9 (6), 498(2016).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Development of advanced textile finishes using nano-emulsions from herbal extracts for organic cotton fabrics. Coatings. 11 (8), 939(2021).
- Martínez-Hernández, G. B., Amodio, M. L., Colelli, G. Carvacrol-loaded chitosan nanoparticles maintain quality of fresh-cut carrots. Innovative Food Science & Emerging Technologies. 41, 56-63 (2017).
- Zhang, H. L., Wu, S. H., Tao, Y., Zang, L. Q., Su, Z. Q. Preparation and characterization of water-soluble chitosan nanoparticles as protein delivery system. Journal of Nanomaterials. 2010, 1-5 (2010).
- Patel, R., Gajra, B., Parikh, R. H., Patel, G. Ganciclovir loaded chitosan nanoparticles: preparation and characterization. Journal of Nanomedicine & Nanotechnology. 7 (6), 1-8 (2016).
- Merodio, M., Arnedo, A., Renedo, M. J., Irache, J. M. Ganciclovir-loaded albumin nanoparticles: characterization and in vitro release properties. European Journal of Pharmaceutical Sciences. 12 (3), 251-259 (2001).
- Hsieh, W. C., Chang, C. P., Gao, Y. L. Controlled release properties of Chitosan encapsulated volatile Citronella Oil microcapsules by thermal treatments. Colloids and Surfaces B: Biointerfaces. 53 (2), 209-214 (2006).
- Yoksan, R., Jirawutthiwongchai, J., Arpo, K. Encapsulation of ascorbyl palmitate in chitosan nanoparticles by oil-in-water emulsion and ionic gelation processes. Colloids and Surfaces B: Biointerfaces. 76 (1), 292-297 (2010).
- Keawchaoon, L., Yoksan, R. Preparation, characterization and in vitro release study of carvacrol-loaded chitosan nanoparticles. Colloids and Surfaces B: Biointerfaces. 84 (1), 163-171 (2011).
- Cazedey, E. C. L., Salgado, H. R. N. Development and validation of a microbiological agar assay for determination of orbifloxacin in pharmaceutical preparations. Pharmaceutics. 3 (3), 572-581 (2011).
- Jayapriya, S., Bagyalakshmi, G. Textile antimicrobial testing and standards. International Journal of Textile and Fashion Technology. 4 (1), 2250-2378 (2013).
- AATCC 100. Antibacterial Finishes on Textile Materials: Assessment of Developed from American Association of Textile Chemists and Colorists. AATCC 100. , (2004).
- AATCC 147. Antimicrobial Activity Assessment of Textile Materials: Parallel Streak Method from American Association of Textile Chemists and Colorists. AATCC 147. , (2004).
- Ortelli, S., Costa, A. L., Dondi, M. TiO2 nanosols applied directly on textiles using different purification treatments. Materials. 8 (11), 7988-7996 (2015).
- Poole, K. Pseudomonas aeruginosa: resistance to the max. Frontiers in Microbiology. 2, 65(2011).
- Pinho, E., Magalhães, L., Henriques, M., Oliveira, R. Antimicrobial activity assessment of textiles: standard methods comparison. Annals of Microbiology. 61 (3), 493-498 (2010).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Novel antimicrobial finishing of organic cotton fabrics using nano-emulsions derived from Karanja and Gokhru plants. Textile Research Journal. 92 (23-24), 5015-5032 (2022).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유