É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um tecido antimicrobiano usando encapsulação nano-herbal de óleos essenciais
Neste Artigo
Resumo
Os jalecos antimicrobianos previnem a contaminação cruzada do acúmulo de patógenos e os derramamentos acidentais de bionutrientes. Aqui, descrevemos o protocolo para o desenvolvimento de um tecido antimicrobiano amigável à pele usando encapsulamento nano-herbal e testes padrão modificados para avaliar precisamente a eficácia e adequação para o uso típico do jaleco.
Resumo
Os jalecos são amplamente utilizados em laboratórios de risco biológico e instalações de saúde como roupas de proteção para evitar a exposição direta a patógenos, derramamentos e queimaduras. Estes casacos protetores à base de algodão fornecem condições ideais para o crescimento microbiano e locais de fixação devido à sua natureza porosa, capacidade de retenção de umidade e retenção de calor do corpo do usuário. Diversos estudos têm demonstrado a sobrevivência de bactérias patogênicas em vestimentas hospitalares e jalecos, atuando como vetores de transmissão microbiana.
Uma abordagem comum para corrigir esses problemas é a aplicação de agentes antimicrobianos no acabamento têxtil, mas preocupações têm sido levantadas devido à toxicidade e aos efeitos ambientais de muitos produtos químicos sintéticos. A pandemia em curso também abriu uma janela para a investigação de antimicrobianos eficazes e formulações ecológicas e livres de tóxicos. Este estudo utiliza dois compostos bioativos naturais, carvacrol e timol, encapsulados em nanopartículas de quitosana, que garantem proteção efetiva contra quatro patógenos humanos com redução de até 4 log (99,99%). Esses patógenos são frequentemente detectados em jalecos usados em laboratórios de risco biológico.
Os tecidos tratados também resistiram a até 10 ciclos de lavagem com 90% de redução microbiana, o que é suficiente para o uso pretendido. Fizemos modificações nos testes de tecido padrão existentes para representar melhor os cenários típicos de uso de jaleco de laboratório. Esses refinamentos permitem uma avaliação mais precisa da eficácia dos jalecos antimicrobianos e a simulação do destino de eventuais vazamentos microbianos acidentais que devam ser neutralizados em um curto espaço de tempo. Mais estudos são recomendados para investigar o acúmulo de patógenos ao longo do tempo em jalecos antimicrobianos em comparação com jalecos protetores comuns.
Introdução
O jaleco branco de proteção é um item obrigatório de equipamento de proteção individual (EPIs) em laboratórios de microbiologia e unidades de saúde, e protege da exposição direta a patógenos, derramamentos e queimaduras. Estes casacos de algodão promovem o crescimento microbiano devido a muitos fatores - o tecido fornece locais de fixação e aeração, algodão e amido usados no processo de fabricação, juntamente com células epiteliais esfoliadas do usuário fornecem nutrientes, e a proximidade com o usuário dá calor e umidade. O acúmulo de micróbios nos têxteis também pode causar problemas de saúde, como alergias e infecções nosocomiais, odores desagradáveis e deterioração do tecido1.
Ao contrário das roupas comuns, os jalecos protetores são pouco lavados ou desinfetados, como encontrado em muitos inquéritos 2,3. Muitos estudos mostram evidências de que o jaleco atua como vetor de transmissão microbiana e o risco de infecções hospitalares no ambiente de assistência à saúde2,4, particularmente cepas resistentes3 como Staphylococcus aureus resistente à meticilina (MRSA); assim, levantam preocupações sanitárias com os EPIs, que se destinam a proteger da contaminação microbiana. Não há estudos transversais suficientes sobre infecções associadas ao jaleco no contexto de instalações de Nível de Biossegurança 2 (BSL-2) ou laboratórios de ensino de microbiologia, mas muitas autoridades regulatórias restringem o uso de jalecos dentro do nível de contenção. No entanto, muitas instituições acadêmicas na América do Norte lutam para atender aos requisitos devido a restrições práticas, como lavagem e armazenamento dentro das instalações, os incidentes de uso de jalecos em áreas públicas, como lanchonetes e bibliotecas, são comuns. Uma solução prática para essas questões é a aplicação de antimicrobianos no acabamento têxtil.
Os tecidos antimicrobianos estão ganhando cada vez mais popularidade em roupas esportivas, roupas ativas e meias, principalmente destinadas a reduzir o odor corporal. No entanto, o uso desses tecidos não é comum no desenvolvimento de EPIs, exceto para algumas máscaras de algodão revestidas de prata e roupas de saúde5. Relatamos o desenvolvimento de um tecido antimicrobiano para jalecos, que inibe patógenos comuns encontrados em laboratórios BSL-2 e fornece proteção eficaz contra a contaminação cruzada de patógenos comuns.
Atualmente, uma variedade de tecidos e acabamentos antimicrobianos está disponível no mercado, mas a maioria deles utiliza partículas coloidais de metais pesados (por exemplo, prata, cobre, zinco), organometálicos ou produtos químicos sintéticos, como triclosan e compostos de amônio quaternário, que não são ecologicamente corretos1 e podem levar a problemas de saúde, como irritação da pele e alergias6. Algumas formulações sintéticas apresentam preocupações devido a micróbios não alvo, como flora normal ou indução de resistência antimicrobiana (RAM). A Food and Drug Administration (FDA) dos EUA regulamenta os tecidos antimicrobianos comerciais, que devem ser atóxicos para o usuário e livres de ecotoxicidade. Portanto, tecidos antimicrobianos à base de biocidas naturais que inibem um amplo espectro de micróbios são preferíveis. Os óleos essenciais (OEs) são amplamente utilizados como agentes antimicrobianos e terapêuticos, mas seu uso no acabamento antimicrobiano é limitado devido à sua durabilidade 6,7,8. Com base em nosso conhecimento e pesquisa de mercado sobre acabamento nano-herbal8, nenhum tecido antimicrobiano à base de ervas está comercialmente disponível. Isso porque os revestimentos sintéticos são fáceis de fabricar e possuem longa durabilidade. Alguns tecidos nano-revestidos com ervas relatados apenas para fins de pesquisa incluem nim7, moringa 9 e folhas de curry9.
O presente estudo utiliza dois componentes bioativos extraídos dos OEs orégano, o carvacrol e o timol, que são eficazes contra uma ampla gama de patógenos bacterianos e vírus, mas geralmente reconhecidos como seguros para humanos10. No entanto, esses componentes bioativos são voláteis e, portanto, seu potencial antimicrobiano é de curta duração se aplicado diretamente no tecido. O encapsulamento nano-herbal é um processo no qual componentes bioativos ou fármacos são carregados dentro de uma casca polimérica que protege o núcleo da degradação ambiental e, assim, aumenta a vida útil. Além disso, o pequeno tamanho das partículas poliméricas, que geralmente variam de 10 nm a 100 nm, aumenta a eficácia da aplicação e retarda a liberação dos compostos bioativos no tecido. Esses compostos bioativos são utilizados para diversos fins, como conservação de alimentos10, mas não para revestimento têxtil.
Dentre os muitos encapsulantes poliméricos, a quitosana é uma candidata atraente devido a muitos de seus atributos, como não toxicidade, biodegradabilidade, mucoadesividade e biocompatibilidade11. É um polissacarídeo natural, obtido pelo processo de desacetilação da quitina, que é encontrada em conchas marinhas e paredes celulares de fungos. É utilizado em aplicações bioquímicas e de conservação de alimentos, como liberação de fármacos ou proteínas 11,12,13, liberação controlada 14 e filmes antimicrobianos 10. A quitosana não é facilmente solúvel em água, mas forma uma suspensão coloidal em meios ácidos. Moléculas bioativas são carregadas em nanopartículas de quitosana (NPs) por um método simples de gelificação iônica em duas etapas14,15,16. Nesse processo, compostos bioativos hidrofóbicos, como carvacrol e timol, formam uma emulsão óleo-em-água, que é auxiliada por um surfactante, o Tween 80. Posteriormente, um composto polianiônico, tripolifosfato pentassódico (TPP), é usado para formar as ligações cruzadas entre os grupos amino ao longo das moléculas policatiônicas de polímero e grupos fosfato de moléculas de TPP para estabilizar o complexo. Este processo de complexação solidifica os compostos bioativos dentro da matriz de quitosana, que é posteriormente purificada e revestida em amostras de algodão para produzir tecido antimicrobiano.
As nanoformulações devem ser testadas primeiro quanto à eficácia antimicrobiana na forma de emulsão antes de serem aplicadas no tecido. Isso pode ser convenientemente avaliado por um método qualitativo, como a difusão em disco de Kirby-Bauer, a difusão de poços e o ensaio de placa de cilindro. No entanto, o ensaio da placa do cilindro17 fornece a flexibilidade para carregar volumes variáveis da formulação e comparar a zona de folga. Neste método, as formulações antimicrobianas são carregadas em cilindros de aço inoxidável e colocadas sobre uma camada macia de ágar, que é inoculada com o microrganismo ou patógeno teste. O diâmetro da zona de depuração produzida contra o organismo em estudo é proporcional ao potencial inibitório da formulação antimicrobiana e, por conseguinte, pode ser utilizado como alternativa aos métodos de diluição em caldo. No entanto, o tamanho das zonas claras é apenas uma medida comparativa ou qualitativa dentro de uma placa específica, a menos que padrões específicos sejam mantidos. Os antimicrobianos atuam contra os patógenos, inibindo seu crescimento (biostático) ou matando as células (biocidas), que podem ser quantificadas pela concentração inibitória mínima (CIM) e concentração bactericida mínima (CBM), respectivamente. Entretanto, a eficácia e o comportamento dos produtos químicos bioativos são diferentes em suas formulações (estado líquido) e quando revestidos sobre um substrato como um tecido18. Isso ocorre porque múltiplos fatores desempenham um papel na eficácia, como a estabilidade da aderência dos agentes antimicrobianos ao tecido, o teor de umidade, o tipo de substrato e a aderência dos micróbios. Se o objetivo pretendido for apenas a atividade bacteriostática, um ensaio qualitativo como o "Parallel Streak Method"19 pode fornecer uma avaliação relativamente rápida e fácil da formulação de antimicrobianos difusíveis. No entanto, se os efeitos bactericidas forem determinados, pode-se empregar a "Avaliação de Acabamentos Antibacterianos em Materiais Têxteis"20 , o que proporciona a redução logarítmica do patógeno fortificado.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparação de nanopartículas
- Encapsulação nano-herbal
- Preparar 50 mL de ácido acético a 1% (v/v).
CUIDADO: O ácido acético glacial é um irritante, que pode causar queimaduras graves na pele e danos nos olhos. Use um jaleco completo, luvas de nitrilo e óculos de proteção, e trabalhe sob um exaustor. - Preparar solução de quitosana (1,2% p/v) dissolvendo 0,6 g de flocos de quitosana (peso molecular médio) em 50 mL de ácido acético a 1% (preparado acima). Agitar durante a noite (O/N) à temperatura ambiente (R/T) para obter uma emulsão homogénea.
- Adicionar 0,5 g de Tween 80 e agitar (1.000 rpm) a 60 °C durante 2 h para obter uma solução homogénea. Levar a solução a R/T antes de adicionar compostos bioativos (carvacrol ou timol).
- Adicionar 0,75 g de carvacrol (ou timol) gota ou gradualmente enquanto agita (1.000 rpm) a mistura durante 20 min a R/T. A relação peso da quitosana para o composto bioativo é de 1:1,25.
- Adicione 50 mL (0,5% p/v) de TPP dropwise à mistura enquanto agita em R/T. Continue mexendo por 30 min para obter uma emulsão homogênea.
- Preparar um controle negativo seguindo o mesmo procedimento, mas sem a adição de compostos bioativos.
- Preparar 50 mL de ácido acético a 1% (v/v).
- Purificação
- Centrifugar a emulsão a 10.000 × g por 30 min a 4 °C e coletar os NPs formados (pellet) após decantar o sobrenadante. Reserve o sobrenadante para testar a eficácia do encapsulamento.
- Lavar as partículas (do passo 1.2.1) utilizando Tween 80 aquoso (1% v/v) com o dobro do volume de pellets formados para remover os compostos bioactivos não ligados ou livres. Certifique-se de perturbar o pellet por vórtice até que uma solução homogênea seja formada em cada etapa de lavagem.
- Lavar as partículas (a partir do passo 1.2.2) com água deionizada duas vezes para se livrar das impurezas.
- Reconstituir os NPs ressuspendendo o pellet (a partir do passo 1.2.3) em 30 mL de água deionizada. Conservar os NPs a 4 °C por até 6 meses.
NOTA: O experimento pode ser pausado neste estágio.
- Caracterização
- Diluir os NPs em água deionizada até que as leituras ultravioleta-visível (UV-Vis) entre 250 e 400 nm estejam dentro da faixa (absorbância >1).
- Registrar os espectros de absorção UV-Vis dos NPs nos comprimentos de onda que variam de 250 a 400 nm usando um espectrofotômetro UV-Vis.
- Armazenar uma alíquota (1 mL) de NPs em R/T por um intervalo de durações (por exemplo, 1 a 6 meses) e testar o efeito antimicrobiano pelo método da placa do cilindro juntamente com uma nova amostra.
- Revestimento em tecido
- Aplicar NPs sobre um tecido de algodão usando um método de pad-dry-cure 7,21.
- Mergulhe as amostras de tecido na solução contendo NPs misturadas com um aglutinante de tecido por 3 min até ficar de molho. Em seguida, passe as amostras por uma pá de laboratório de dois rolos para remover o excesso de líquido.
- Secar as amostras em estufa a 100 °C durante 30 min e curar a 130 °C durante 10 min.
- Finalmente, lave as amostras em um banho de ultrassom por 15 minutos para remover NPs não ligados.
NOTA: Alternativamente, siga o método simplificado descrito abaixo.
- Corte o tecido de algodão (ou amostras de jaleco de laboratório) em quadrados de 10 cm x 10 cm.
- Imergir as peças cortadas em 2 mL do NP sintetizado (10%) em um recipiente plástico (12 cm x 12 cm) por 2 min a R/T. Retire o excesso de líquido por secagem ao ar.
- Prensar a 100 °C durante 3 minutos para ligar os NP.
- Retire os NPs não ligados enxaguando em Tween 80 aquoso (2% p/v) e seque no forno a 100 °C por 30 min.
NOTA: Este tecido antimicrobiano pode ser armazenado por 2 anos em R/T.
- Aplicar NPs sobre um tecido de algodão usando um método de pad-dry-cure 7,21.
- Durabilidade da lavagem
- Corte o tecido em amostras quadradas de 50 mm x 50 mm.
- Colocar as amostras em 50 ml de água morna da torneira (40 °C) num recipiente de vidro/plástico e adicionar duas gotas de detergente normal (não antimicrobiano).
- Enxágue em um agitador de plataforma de balanço ou agitador magnético por 30 min.
- Secar ao ar ou incubar a 60 °C durante 2 h e testar a eficácia antimicrobiana.
2. Ensaio em placa de cilindro para triagem de nanopartículas
- Preparar ágar de soja tripticase (TSA), caldo de soja tripticase (TSB), ágar base antibiótico (ABA) e ágar semente antibiótico (ASA), de acordo com as instruções do fabricante, e esterilizar o meio por autoclavagem a 121 °C a 15 psi por 15 min.
- Subcultivar os micróbios (do estoque) de interesse, contra os quais os testes de eficácia são realizados, em placas de TSA recém-preparadas (ou qualquer meio apropriado) pelo método de placa de raia de três vias e incubar para produzir placas de pureza. (Espécies recomendadas: S. aureus, E. coli, P. aeruginosa e C. albicans.)
- Inocular as culturas a partir de placas de pureza fresca em TSB (tubos de 10 mL) a 35 °C O/N com agitação moderada (100-200 rpm).
- Alíquota 5,0 mL do AAS fundido em cada um dos tubos de ensaio. O número de tubos corresponde ao número de microrganismos testados.
- Despeje 20 mL de ABA fundido pré-esterilizado em cada placa de Petri (100 mm x 20 mm) assepticamente para formar a camada de base. O número de placas de ágar corresponde ao número de microrganismos a serem testados. Espere até que a mídia se solidifique.
- Após a solidificação da camada de base, inocular cada AAS fundido com uma cultura noturna a partir da etapa 2.3 (1,0 mL, pré-aquecido a 35 °C) e transferir imediatamente o conteúdo (mistura de AAS e cultura) para a superfície de uma placa ABA. Agite a placa para distribuir uniformemente a camada de ágar fundida. Certifique-se de que a camada de semente pareça lisa e livre de solavancos ou bolhas.
- Colocar até seis cilindros de aço inoxidável (6 mm x 6 mm x 10 mm; pré-autoclavados), espaçados uniformemente em padrão hexagonal, por placa de ágar, utilizando uma pinça estéril (Figura 1).
- Carregar os cilindros com os NPs sintetizados de diferentes volumes (30 μL, 50 μL, 75 μL e 100 μL) para serem rastreados quanto aos efeitos antimicrobianos. O controle negativo é aquele sem compostos bioativos.
- Incubar patógenos bacterianos comuns (por exemplo, E. coli, S. aureus, P. aeruginosa) a 35 °C por 24 h e espécies fúngicas (por exemplo, C. albicans) a R/T por 3 dias.
- Meça o diâmetro da zona livre e compare a eficácia dos NPs sintetizados.
NOTA: Este teste pode ser usado para pré-selecionar os melhores NPs a serem revestidos no tecido.
3. Método de raia paralela (modificado da AATCC 147)
- Preparação do material
- Corte o tecido tratado com NP em amostras de 50 mm x 25 mm.
- Preparar ágar Mueller-Hinton (MHA), TSA e TSB, de acordo com as instruções do fabricante, e esterilizar o meio por autoclavagem a 121 °C a 15 psi por 15 min.
- Subcultivar os micróbios (de stock) de interesse, contra os quais são realizados os testes de eficácia, em placas de TSA recém-preparadas (ou qualquer meio apropriado) pelo método de três vias de placa de raia e incubar a 35 °C durante 2 dias para corantes bacterianas e a R/T durante 5 dias para estirpes fúngicas para produzir placas de pureza. (Espécies recomendadas: S. aureus, E. coli, P. aeruginosa e C. albicans.)
- Spiking de culturas microbianas
- Inocular as culturas a partir de placas de pureza fresca em TSB (tubos de 10 mL) a 35 °C O/N com agitação moderada (100-200 rpm).
- Diluir as culturas de O/N para 1,5 × 108 unidades formadoras de colônias (UFC)/mL ou correspondendo à turbidez do padrão de 0,5 McFarland (geralmente uma diluição de 1/10 a 1/20 para a maioria das culturas saudáveis).
- Inocular a cultura diluída acima usando uma alça estéril de 4 mm da seguinte forma. Coloque uma alça de cultura em caldo e transfira-a para a superfície da placa de ágar MHA fazendo cinco estrias paralelas, cada uma com 6 cm de comprimento e 1 cm de distância, conforme Figura 2. Não recarregue o loop.
- Pressione suavemente a amostra de tecido usando uma espátula estéril nas cinco estrias para que o tecido fique no centro e toque todas as cinco linhas de estria. Incubar a 35 °C durante 24 h.
- Avaliação qualitativa da eficácia antimicrobiana
- Examine a placa incubada para a interrupção do crescimento ao longo das estrias além das bordas do tecido (zona clara indica inibição do crescimento).
- Calcule a largura média de uma zona de inibição ao longo da linha de raia (W) em cada lado da amostra de tecido usando a equação (1).
W = (T - D)/2 (1)
W = largura da zona livre; T = comprimento total da zona livre, incluindo a largura da amostra; D = largura da amostra de tecido (25 mm).
4. Método quantitativo de redução logarítmica (modificado da AATCC 100)
- Preparo experimental
- Corte o tecido em amostras quadradas de 50 mm x 50 mm.
- Preparar TSA, TSB, caldo Letheen e solução salina tamponada com fosfato (PBS), de acordo com as instruções do fabricante, e esterilizar o meio por autoclavagem.
- Preparar culturas O/N de micróbios de interesse, contra as quais são realizados os testes de eficácia, inoculando colônias isoladas de placas de pureza em TSB estéril e incubando a 35 °C por 18-24 h. (Espécies recomendadas: S. aureus, E. coli, P. aeruginosa e C. albicans.)
- Spiking de culturas microbianas
- Diluir as culturas de O/N para 1,5 × 108 UFC/mL ou correspondendo à turbidez do padrão de 0,5 McFarland (geralmente uma diluição de 1/10 a 1/20 para a maioria das culturas saudáveis).
- Determine o volume adequado de culturas para picar medindo a capacidade de retenção de líquidos do tecido da seguinte forma.
- Adicione uma série de volumes da cultura de caldo diluído (por exemplo, 100-500 μL) em amostras de tecido (em placas de Petri separadas) e escolha o volume de tal forma que a amostra de tecido absorva totalmente a água e não deixe líquido residual/livre. A capacidade de retenção de líquidos difere do tipo e da espessura do tecido. Para jalecos de algodão comuns, é de aproximadamente 200 μL.
- Aumentar o volume (capacidade de retenção de líquido determinada acima [por exemplo, 200 μL]) de cada cultura nas amostras colocadas em placas de Petri estéreis. O número de amostras corresponde ao número de testes (por exemplo, tecido testado imediatamente e após a lavagem [e os ciclos de lavagem testados]) e aos efeitos antimicrobianos testados ao longo do tempo de contato (após um determinado tempo/dia [por exemplo, 30 min, 2 h, Dia 1-3]).
OBS: Utilizar uma micropipeta com pontas de filtro de aerossol (para evitar contaminação da pipeta em usos subsequentes) para inocular as culturas nas amostras com distribuição uniforme. - Para o controle negativo, use o mesmo tipo de amostras de tecido não tratadas. Realizar o controle negativo para cada espécie microbiana de teste correspondente, período de contato, diferentes tecidos e ciclos de lavagem.
- Recuperação de micróbios por contagem de placas viáveis
- Permitir que as amostras inoculadas (tratadas e não tratadas) sequem ao ar no interior das placas de Petri (tampas entreabertas) em R/T durante o(s) período(s) de contacto requerido(s) a testar (por exemplo, 0 min, 30 min, 60 min, etc., ou mesmo dias para efeitos a longo prazo). Sempre inclua um "0 min" para representar um efeito imediato e eficácia neutralizante.
- Transfira as amostras assepticamente para separar os tubos centrífugos estéreis (50 mL) e rosqueie bem as tampas.
- Adicionar caldo de Letheen (quaisquer tampões neutralizantes relevantes) para fazer uma diluição de 1/100 (por exemplo, 19,8 mL para um inóculo de 200 μL).
- Feche os tubos da centrífuga com tampas de rosca firmemente e vórtice por 1 min em velocidade média.
- Diluir a suspensão com o PBS estéril em diluições subsequentes de 1/10, de modo que a contagem de colônias do grupo "não tratado" se torne muito baixa para contar (TLTC).
- Plaquear as diluições (0,1 mL) em placas de meios apropriados, que suportam o crescimento do microrganismo (por exemplo, TSA para bactérias ou ágar Sabouraud dextrose [SDA] para fungos) ou qualquer meio que otimize o crescimento e forneça bom contraste para tornar a contagem de colônias precisa.
- Incubar as placas bacterianas a 35 °C durante 2 dias e as placas fúngicas a R/T durante 5 dias.
- Conte as CFUs viáveis diretamente usando um contador de colônias ou usando software de imagem (por exemplo, CFU AI).
- Calcular a redução de log microbiano (R) devido ao tecido antimicrobiano usando a equação (2):
R =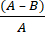 × 100 (2)
× 100 (2)
A = valor logarítmico do número de CFU recuperadas de tecido não tratado; B = valor logarítmico do número de UFC recuperadas do tecido tratado.
Access restricted. Please log in or start a trial to view this content.
Resultados
Triagem inicial dos NPs sintetizados
Seguindo a técnica de emulsão óleo-em-água em duas etapas16, os compostos bioativos (carvacrol e timol) foram encapsulados com sucesso em quitosana. Isso foi confirmado por espectrofotometria UV-Vis para o pico de absorção dos respectivos compostos bioativos em comparação com os controles, que foram os NPs de quitosana sem quaisquer compostos bioativos. Os NPs constituídos foram homogêneos e estáveis ao longo de 12 meses a 4 °C. ...
Access restricted. Please log in or start a trial to view this content.
Discussão
A eficácia antimicrobiana dos biocidas é convencionalmente testada por ensaios quantitativos, como concentração inibitória mínima (CIM) e concentração bactericida mínima (CBM), nos quais as bactérias são imersas em um líquido antimicrobiano por 24 horas. No entanto, esses ensaios não são adequados para tecidos revestidos, onde a interface líquida é insuficiente e os biocidas são difundidos lentamente ao longo das fibras do tecido. Portanto, muitos testes de tecido padrão foram estabelecidos, como AATCC ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
O presente estudo foi financiado por "Applied Research, Innovation and Entrepreneurship Services" (ARIES), Centennial College, Canadá.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetic acid | Millipore Sigma | 64-19-7 | |
| Antibiotic base agar | BD Difco | DF0270-17-4 | Also known as Antibiotic Medium 2 |
| Antibiotic seed agar | BD Difco | DF0263-17-3 | Also known as Antibiotic Medium 1 |
| Blood Agar (Nutrient Agar with 5% Sheep Blood) | Donated by CFIA | ||
| Bromcresol Purple Lactose Agar | Donated by CFIA | ||
| Candida albicans | ATCC The Global Bioresource Center | ATTC 10231 | |
| Carvacrol | Millipore Sigma | 282197 (CAS# 499-75-2) | |
| Centrifuge Allergra X-22R Centrifuge | Beckman Coulter | Model # X-22R | Refrigerated. Wait at least 20 min or until the temperature reach the set low value (e.g., 4 °C) as the refrigeration takes time. |
| Chitosan Medium Molecular Weight (CS) | Millipore Sigma | 448877 (CAS # 9012-76-4) | |
| Clamshell Heat Press | Intiva | IM1200 | |
| Escherichia coli (E. coli) | ATCC The Global Bioresource Center | ATTC 23725 | |
| Incubator | Thermo Scientific | 1205M34 | |
| Letheen Broth | BD Difco | DF0681-17-7 | Used to neutralize antimicrobial effects. Product from different manufacturers may require to add Polysorbate 80, which is already added in Difco product. |
| Milli Q water | Millipore Sigma | ZR0Q16WW | Deionized water |
| Mueller-Hinton Agar | BD Difco | DF0252-17-6 | |
| Pentasodium tripolyphosphate (TPP) | Millipore Sigma | 238503 (CAS# 7758-29-4) | |
| Phospahte Buffered Saline (PBS) | Thermo Scientific | AM9624 | |
| Pseudomonas aeruginosa | ATCC The Global Bioresource Center | ATTC 9027 | |
| Sabouraud Dextrose Agar | BD Difco | DF0109-17-1 | |
| Shaking incubator/ Thermo shaker | VWR | Model# SHKA2000 | |
| Staphylococcus aureus | ATCC The Global Bioresource Center | ATTC 6538 | |
| Thymol | Millipore Sigma | T0501 (CAS# 89-83-8) | |
| Trypticase Soy Agar | BD Difco | 236950 | |
| Trypticase Soy Broth | BD Difco | 215235 | |
| Tween 80 | Millipore Sigma | STS0204 (CAS # 9005-65-6) | |
| UV-Vis Spectrophometer | Thermo Scientific | GENESYS 30 (840-277000) |
Referências
- Schmidt-Emrich, S., et al. Rapid assay to assess bacterial adhesion on textiles. Materials. 9 (4), 249(2016).
- Qaday, J., et al. Bacterial contamination of medical doctors and students white coats at Kilimanjaro Christian Medical Centre, Moshi, Tanzania. International Journal of Bacteriology. 2015, 507890(2015).
- Treakle, A. M., et al. Bacterial contamination of health care workers' white coats. American Journal of Infection Control. 37 (2), 101-105 (2009).
- Wong, D., Nye, K., Hollis, P. Microbial flora on doctors' white coats. BMJ. 303 (6817), 1602-1604 (1991).
- Gouveia, I. C. Nanobiotechnology: A new strategy to develop non-toxic antimicrobial textiles for healthcare applications. Journal of Biotechnology. (150), 349(2010).
- Joshi, M., Ali, S. W., Purwar, R., Rajendran, S. Ecofriendly antimicrobial finishing of textiles using bioactive agents based on natural products. Indian Journal of Fibre and Textile Research. 34, 295-304 (2009).
- Ahmed, H. A., Rajendran, R., Balakumar, C. Nanoherbal coating of cotton fabric to enhance antimicrobial durability. Elixir Applied Chemistry. 45, 7840-7843 (2012).
- Morais, D. S., Guedes, R. M., Lopes, M. A. Antimicrobial approaches for textiles: From research to market. Materials. 9 (6), 498(2016).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Development of advanced textile finishes using nano-emulsions from herbal extracts for organic cotton fabrics. Coatings. 11 (8), 939(2021).
- Martínez-Hernández, G. B., Amodio, M. L., Colelli, G. Carvacrol-loaded chitosan nanoparticles maintain quality of fresh-cut carrots. Innovative Food Science & Emerging Technologies. 41, 56-63 (2017).
- Zhang, H. L., Wu, S. H., Tao, Y., Zang, L. Q., Su, Z. Q. Preparation and characterization of water-soluble chitosan nanoparticles as protein delivery system. Journal of Nanomaterials. 2010, 1-5 (2010).
- Patel, R., Gajra, B., Parikh, R. H., Patel, G. Ganciclovir loaded chitosan nanoparticles: preparation and characterization. Journal of Nanomedicine & Nanotechnology. 7 (6), 1-8 (2016).
- Merodio, M., Arnedo, A., Renedo, M. J., Irache, J. M. Ganciclovir-loaded albumin nanoparticles: characterization and in vitro release properties. European Journal of Pharmaceutical Sciences. 12 (3), 251-259 (2001).
- Hsieh, W. C., Chang, C. P., Gao, Y. L. Controlled release properties of Chitosan encapsulated volatile Citronella Oil microcapsules by thermal treatments. Colloids and Surfaces B: Biointerfaces. 53 (2), 209-214 (2006).
- Yoksan, R., Jirawutthiwongchai, J., Arpo, K. Encapsulation of ascorbyl palmitate in chitosan nanoparticles by oil-in-water emulsion and ionic gelation processes. Colloids and Surfaces B: Biointerfaces. 76 (1), 292-297 (2010).
- Keawchaoon, L., Yoksan, R. Preparation, characterization and in vitro release study of carvacrol-loaded chitosan nanoparticles. Colloids and Surfaces B: Biointerfaces. 84 (1), 163-171 (2011).
- Cazedey, E. C. L., Salgado, H. R. N. Development and validation of a microbiological agar assay for determination of orbifloxacin in pharmaceutical preparations. Pharmaceutics. 3 (3), 572-581 (2011).
- Jayapriya, S., Bagyalakshmi, G. Textile antimicrobial testing and standards. International Journal of Textile and Fashion Technology. 4 (1), 2250-2378 (2013).
- AATCC 100. Antibacterial Finishes on Textile Materials: Assessment of Developed from American Association of Textile Chemists and Colorists. AATCC 100. , (2004).
- AATCC 147. Antimicrobial Activity Assessment of Textile Materials: Parallel Streak Method from American Association of Textile Chemists and Colorists. AATCC 147. , (2004).
- Ortelli, S., Costa, A. L., Dondi, M. TiO2 nanosols applied directly on textiles using different purification treatments. Materials. 8 (11), 7988-7996 (2015).
- Poole, K. Pseudomonas aeruginosa: resistance to the max. Frontiers in Microbiology. 2, 65(2011).
- Pinho, E., Magalhães, L., Henriques, M., Oliveira, R. Antimicrobial activity assessment of textiles: standard methods comparison. Annals of Microbiology. 61 (3), 493-498 (2010).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Novel antimicrobial finishing of organic cotton fabrics using nano-emulsions derived from Karanja and Gokhru plants. Textile Research Journal. 92 (23-24), 5015-5032 (2022).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados