A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מארג אנטי-מיקרוביאלי באמצעות אנקפסולציה ננו-צמחית של שמנים אתריים
In This Article
Summary
ציפוי מעבדה אנטי-מיקרוביאלי מונע זיהום צולב של הצטברות פתוגנים ודליפה ביולוגית בשוגג. כאן, אנו מתארים את הפרוטוקול לפיתוח בד אנטי-מיקרוביאלי ידידותי לעור באמצעות אנקפסולציה ננו-צמחית ובדיקות סטנדרטיות מותאמות כדי להעריך במדויק את היעילות וההתאמה לשימוש טיפוסי בחלוק המעבדה.
Abstract
מעילי מעבדה נמצאים בשימוש נרחב במעבדות ובמתקני בריאות מסוכנים ביולוגית כבגדי מגן למניעת חשיפה ישירה לפתוגנים, שפיכות וכוויות. מעילי מגן אלה על בסיס כותנה מספקים תנאים אידיאליים לאתרי גדילה וחיבור מיקרוביאליים בשל אופיים הנקבובי, יכולת אחיזת הלחות ושמירת החום מגוף המשתמש. מספר מחקרים הוכיחו את הישרדותם של חיידקים פתוגניים על בגדי בתי חולים ומעילי מעבדה, הפועלים כווקטורים של העברה מיקרוביאלית.
גישה נפוצה לתיקון בעיות אלה היא יישום של חומרים אנטי-מיקרוביאליים בגימור טקסטיל, אך חששות הועלו בשל הרעילות וההשפעות הסביבתיות של כימיקלים סינתטיים רבים. המגפה המתמשכת פתחה גם צוהר לחקירה של תכשירים אנטי-מיקרוביאליים יעילים ופורמולציות ידידותיות לסביבה ונטולות רעלים. מחקר זה משתמש בשתי תרכובות ביו-אקטיביות טבעיות, קרבקרול ותימול, העטופות בננו-חלקיקי צ'יטוסן, המבטיחות הגנה יעילה מפני ארבעה פתוגנים אנושיים עם הפחתה של עד 4 לוגים (99.99%). פתוגנים אלה מזוהים לעתים קרובות במעילי מעבדה המשמשים במעבדות מסוכנות ביולוגית.
הבדים המטופלים גם עמדו בפני עד 10 מחזורי כביסה עם הפחתה מיקרוביאלית של 90%, וזה מספיק לשימוש המיועד. ביצענו שינויים בבדיקות הבד הסטנדרטיות הקיימות כדי לייצג טוב יותר את התרחישים האופייניים לשימוש במעיל מעבדה. חידודים אלה מאפשרים הערכה מדויקת יותר של יעילותם של מעילי מעבדה אנטי-מיקרוביאליים ולסימולציה של גורלן של דליפות מיקרוביאליות מקריות שיש לנטרל תוך זמן קצר. מחקרים נוספים מומלצים כדי לחקור את הצטברות הפתוגנים לאורך זמן על מעילי מעבדה אנטי-מיקרוביאליים בהשוואה למעילי מגן רגילים.
Introduction
החלוק הלבן המגן הוא פריט חובה של ציוד מגן אישי (PPE) במעבדות מיקרוביולוגיה ובמתקני בריאות, והוא מגן מפני חשיפה ישירה לפתוגנים, שפיכות וכוויות. מעילי כותנה אלו מקדמים צמיחה מיקרוביאלית בשל גורמים רבים – הבד הארוג מספק אתרי חיבור ואוורור, כותנה ועמילן המשמשים בתהליך הייצור יחד עם תאי אפיתל מתקלפים מהמשתמש מספקים חומרים מזינים, והקרבה למשתמש מעניקה חום ולחות. הצטברות חיידקים על טקסטיל יכולה גם לגרום לבעיות בריאותיות כגון אלרגיות וזיהום nosocomial, ריחות לא נעימים, הידרדרות בד1.
שלא כמו בגדים רגילים, מעילי מגן נשטפים או מחוטאים לעתים רחוקות, כפי שנמצא בסקרים רבים 2,3. מחקרים רבים מראים עדויות לכך שמעילי מעבדה משמשים כווקטור של העברה מיקרוביאלית ואת הסיכון לזיהומים נוסוקומיאליים בסביבה הבריאותית2,4, במיוחד זנים עמידים3 כגון סטפילוקוקוס אאורוס עמיד למתיצילין (MRSA); לפיכך, הם מעלים חששות בריאותיים של PPE, אשר נועד להגן מפני זיהום מיקרוביאלי. אין מספיק מחקרי חתך על זיהומים הקשורים למעילי מעבדה בהקשר של מתקני בטיחות ביולוגית ברמה 2 (BSL-2) או מעבדות הוראה למיקרוביולוגיה, אך רשויות רגולטוריות רבות מגבילות את השימוש במעילי מעבדה ברמת ההכלה. עם זאת, מוסדות אקדמיים רבים בצפון אמריקה מתקשים לעמוד בדרישות בשל אילוצים מעשיים, כגון כביסה ואחסון בתוך המתקן, המקרים של לבישת מעילי מעבדה באזורים ציבוריים כגון קפיטריות וספריות הם נפוצים. פתרון מעשי אחד לבעיות אלה הוא יישום של חומרים אנטי-מיקרוביאליים בגימור טקסטיל.
בדים אנטי-מיקרוביאליים צוברים פופולריות גוברת בבגדי ספורט, בגדי פעילות וגרביים, שנועדו בעיקר להפחית את ריח הגוף. עם זאת, השימוש בבדים אלה אינו נפוץ בפיתוח PPE, למעט כמה מסכות כותנה מצופות כסף ובגדי בריאות5. אנו מדווחים על פיתוח בד אנטי-מיקרוביאלי למעילי מעבדה, המעכב פתוגנים נפוצים הנמצאים במעבדות BSL-2 ומספק הגנה יעילה מפני זיהום צולב של פתוגנים נפוצים.
כיום, קיימים בשוק מגוון בדים וגימורים אנטי-מיקרוביאליים, אך רובם משתמשים בחלקיקי מתכת כבדה קולואידית (למשל, כסף, נחושת, אבץ), אורגנומטליקה, או כימיקלים סינתטיים כגון תרכובות טריקלוזן ואמוניום רבעוני, שאינם ידידותיים לסביבה1 ועלולים להוביל לבעיות בריאותיות כגון גירוי בעור ואלרגיות6. חלק מהפורמולציות הסינתטיות מעוררות חששות עקב חיידקים שאינם מטרה, כגון פלורה רגילה או גרימת עמידות מיקרוביאלית (AMR). מנהל המזון והתרופות האמריקני (FDA) מסדיר בדים אנטי-מיקרוביאליים מסחריים, שחייבים להיות לא רעילים למשתמש וחופשיים מרעילות אקולוגית. לכן, עדיף להשתמש בבדים אנטי-מיקרוביאליים המבוססים על ביוצידים טבעיים המעכבים ספקטרום רחב של חיידקים. שמנים אתריים (EOs) נמצאים בשימוש נרחב כחומרים אנטי-מיקרוביאליים וטיפוליים, אך השימוש בהם בגימור אנטי-מיקרוביאלי מוגבל בשל עמידותם 6,7,8. בהתבסס על הידע ומחקר השוק שלנו על גימור ננו-צמחי8, אין בד אנטי-מיקרוביאלי מבוסס צמחים זמין מסחרית. הסיבה לכך היא שציפויים סינתטיים קלים לייצור ובעלי עמידות ארוכה. מספר אריגים מצופים ננו-צמחי מרפא שדווחו רק למטרות מחקר כוללים נים7, מורינגה 9 ועלי קארי9.
המחקר הנוכחי משתמש בשני רכיבים ביו-אקטיביים המופקים מאורגנו EOs, קרבקרול ותימול, אשר יעילים נגד מגוון רחב של פתוגנים חיידקיים ונגיפים, אך מוכרים בדרך כלל כבטוחים לבני אדם10. עם זאת, רכיבים ביו-אקטיביים אלה הם נדיפים, ולכן הפוטנציאל האנטי-מיקרוביאלי שלהם הוא קצר מועד אם מיישמים אותם ישירות על הבד. אנקפסולציה ננו-צמחית היא תהליך שבו רכיבים או תרופות ביו-אקטיביים נטענים בתוך מעטפת פולימרית המגנה על הליבה מפני התפרקות סביבתית, ובכך מאריכה את חיי המדף. בנוסף, הגודל הקטן של החלקיקים הפולימריים, אשר בדרך כלל נע בין 10 ננומטר ל 100 ננומטר, משפר את היעילות של היישום ומאט את שחרורם של תרכובות ביו-אקטיביות על הבד. תרכובות ביו-אקטיביות אלה משמשות למטרות שונות, כגון שימור מזון10, אך לא לציפוי טקסטיל.
בין אנקפסולנטים פולימריים רבים, צ'יטוזן הוא מועמד אטרקטיבי בשל רבות מתכונותיו, כגון אי-רעילות, יכולת התכלות, הידבקות ותאימות ביולוגית11. זהו פוליסכריד טבעי, המתקבל על ידי תהליך deacetylation מ chitin, אשר נמצא צדפים קירות התא פטרייתי. הוא משמש ביישומים ביוכימיים ושימור מזון כגון אספקת תרופות או חלבונים 11,12,13, שחרור מבוקר14, ויריעות מיקרוביאליות 10. צ'יטוזן אינו מסיס בקלות במים אלא יוצר תרחיף קולואידי במדיה חומצית. מולקולות ביו-אקטיביות נטענות לננו-חלקיקי צ'יטוזן (NPs) בשיטת ג'לציה יונית פשוטה בת שני שלבים14,15,16. בתהליך זה, תרכובות ביו-אקטיביות הידרופוביות כמו קרבקרול ותימול יוצרות תחליב שמן במים, אשר נעזר בסורפקטנט בשם Tween 80. לאחר מכן, תרכובת פוליאניונית, פנטסודיום טריפוליפוספט (TPP), משמשת ליצירת קשרים צולבים בין קבוצות האמינו לאורך מולקולות פולימר פוליקטיוני וקבוצות פוספט של מולקולות TPP כדי לייצב את המכלול. תהליך מורכבות זה ממצק את התרכובות הביו-אקטיביות בתוך המטריצה של צ'יטוזן, אשר לאחר מכן מטוהרת ומצופה על דוגמיות כותנה כדי לייצר בד אנטי-מיקרוביאלי.
יש לבדוק תחילה את הננו-פורמולציות ליעילות אנטי-מיקרוביאלית בצורת תחליב לפני היישום על הבד. זה יכול להיות מוערך בנוחות על ידי שיטה איכותית, כגון קירבי-באואר דיפוזיה דיסק, דיפוזיה באר, ואת צלחת צילינדר assay. עם זאת, בדיקת צלחת הצילינדר17 מספקת את הגמישות לטעון נפחים משתנים של הנוסחה ולהשוות את אזור הסילוק. בשיטה זו, ניסוחים מיקרוביאלית נטענים בגלילי נירוסטה ומניחים על שכבת אגר רכה, אשר מחוסן עם מיקרואורגניזם הבדיקה או פתוגן. קוטר אזור הסילוק המיוצר כנגד האורגניזם הנבדק פרופורציונלי לפוטנציאל המעכב של הפורמולציה האנטי-מיקרוביאלית, ולכן ניתן להשתמש בו כחלופה לשיטות דילול מרק. עם זאת, גודל האזורים השקופים הוא רק מדד השוואתי או איכותי בתוך לוח מסוים, אלא אם כן נשמרים סטנדרטים ספציפיים. סוכנים אנטי-מיקרוביאליים פועלים נגד הפתוגנים על ידי עיכוב צמיחתם (ביוסטטי) או הריגת התאים (ביוצידלים), אשר ניתן לכמת על ידי ריכוז מעכב מינימלי (MIC) וריכוז חיידקים מינימלי (MBC), בהתאמה. עם זאת, יעילותם והתנהגותם של הכימיקלים הביו-אקטיביים שונים בפורמולציות שלהם (מצב נוזלי) וכאשר הם מצופים על מצע כגון בד18. הסיבה לכך היא שגורמים רבים משחקים תפקיד ביעילות, כגון יציבות ההיצמדות של החומרים האנטי-מיקרוביאליים לבד, תכולת הלחות, סוג המצע והיצמדות החיידקים. אם המטרה המיועדת היא רק פעילות בקטריוסטטית, בדיקה איכותית כגון "שיטת הפס המקבילי"19 יכולה לספק הערכה מהירה וקלה יחסית של ניסוח אנטי-מיקרוביאלי מפוזר. עם זאת, אם יש לקבוע את ההשפעות החיידקיות, ניתן להשתמש ב"הערכת גימורים אנטיבקטריאליים על חומרי טקסטיל"20 , המספקת את הפחתת היומן של הפתוגן הקוצני.
Protocol
1. הכנת ננו-חלקיקים
- אנקפסולציה ננו-צמחית
- להכין 50 מ"ל של 1% (v/v) חומצה אצטית.
אזהרה: חומצה אצטית קרחונית היא חומר מגרה, שעלול לגרום לכוויות חמורות בעור ולנזק לעיניים. לבשו מעיל מעבדה באורך מלא, כפפות ניטריל ומשקפי מגן, ועבדו מתחת למכסה מנוע. - הכינו תמיסת צ'יטוזן (1.2% w/v) על ידי המסת 0.6 גרם פתיתי צ'יטוזן (משקל מולקולרי בינוני) ב-50 מ"ל של 1% חומצה אצטית (שהוכנה לעיל). יש להתסיס במשך הלילה (O/N) בטמפרטורת החדר (R/T) כדי לקבל תחליב הומוגני.
- מוסיפים 0.5 גרם של Tween 80 ומערבבים (1,000 סל"ד) ב-60°C למשך שעתיים לקבלת תמיסה הומוגנית. הביאו את התמיסה ל-R/T לפני הוספת תרכובות ביו-אקטיביות (קרבקרול או תימול).
- מוסיפים 0.75 גרם קרבקרול (או תימול) טיפה או בהדרגה תוך כדי ערבוב (1,000 סל"ד) את התערובת למשך 20 דקות ב-R/T. יחס המשקל של צ'יטוזן לתרכובת ביו-אקטיבית הוא 1:1.25.
- הוסיפו 50 מ"ל (0.5% w/v) של TPP טיפה לתערובת תוך כדי ערבוב ב-R/T. המשיכו לערבב במשך 30 דקות לקבלת תחליב הומוגני.
- הכינו בקרה שלילית על ידי ביצוע אותו הליך אך ללא תוספת של תרכובות ביו-אקטיביות.
- להכין 50 מ"ל של 1% (v/v) חומצה אצטית.
- טיהור
- צנטריפוגה את התחליב ב 10,000 × גרם במשך 30 דקות ב 4 ° C ולאסוף NPs שנוצרו (גלולה) לאחר decanting supernatant. שמור את supernatant כדי לבדוק את יעילות אנקפסולציה.
- שטפו את החלקיקים (משלב 1.2.1) באמצעות Tween 80 מימי (1% v/v) עם נפח כפול של כדוריות שנוצרו כדי להסיר את התרכובות הביו-אקטיביות הלא קשורות או החופשיות. הקפידו להפריע לגלולה על ידי ערבול עד שתיווצר תמיסה הומוגנית בכל שלב שטיפה.
- שטפו את החלקיקים (משלב 1.2.2) במים נטולי יונים, פעמיים כדי להיפטר מזיהומים.
- לבנות מחדש את NPs על ידי השעיה מחדש של הגלולה (משלב 1.2.3) ב 30 מ"ל של מים deionized. אחסן את NPs ב 4 ° C עד 6 חודשים.
הערה: ניתן להשהות את הניסוי בשלב זה.
- איפיון
- לדלל את NPs במים deionized עד קריאות אולטרה סגול גלוי (UV-Vis) בין 250 ל 400 ננומטר נופל בטווח (ספיגה >1).
- הקלט את ספקטרום בליעת UV-Vis של NPs על פני אורכי גל הנעים בין 250 ל -400 ננומטר באמצעות ספקטרופוטומטר UV-Vis.
- אחסן aliquot (1 מ"ל) של NPs ב- R/T למשך טווח של משכי זמן (למשל, 1 עד 6 חודשים) ובדוק את ההשפעה האנטי-מיקרוביאלית בשיטת צלחת הגליל יחד עם דגימה טרייה.
- ציפוי על בד
- יש למרוח NPs על בד כותנה ארוג בשיטת כרית-ייבוש-ריפוי 7,21.
- טבלו את דוגמיות הבד בתמיסה המכילה NPs מעורבבים עם קושר בד במשך 3 דקות עד להשריה. לאחר מכן, העבירו את הדוגמיות דרך משטח מעבדה בעל שני גלילים כדי להסיר נוזלים עודפים.
- יש לייבש את דוגמיות הצבע בתנור בטמפרטורה של 100°C למשך 30 דקות ולרפא בטמפרטורה של 130°C למשך 10 דקות.
- לבסוף, שטפו את דוגמיות הצבע באמבט אולטרסאונד למשך 15 דקות כדי להסיר NPs לא קשורים.
הערה: לחלופין, בצע את השיטה הפשוטה המתוארת להלן.
- גזרו את בד הכותנה (או דוגמיות מעיל המעבדה) לריבועים בגודל 10X10 ס"מ.
- לטבול את החתיכות החתוכות ב 2 מ"ל של NP מסונתז (10%) במיכל פלסטיק (12 ס"מ x 12 ס"מ) במשך 2 דקות ב R/T. להסיר את עודפי הנוזלים על ידי ייבוש באוויר.
- לחץ בחום ב-100°C למשך 3 דקות כדי לקשור את NPs.
- יש להסיר NPs לא קשורים על ידי שטיפה ב-Tween 80 מימי (2% w/v) ולייבש בתנור ב-100°C למשך 30 דקות.
הערה: בד אנטי-מיקרוביאלי זה ניתן לאחסון במשך שנתיים ב-R/T.
- יש למרוח NPs על בד כותנה ארוג בשיטת כרית-ייבוש-ריפוי 7,21.
- עמידות כביסה
- חתכו את הבד לדוגמיות מרובעות בגודל 50 מ"מ x 50 מ"מ.
- הניחו את דוגמיות הצבע במי ברז חמימים (40°C) במיכל זכוכית/פלסטיק והוסיפו שתי טיפות של חומר ניקוי רגיל (לא אנטי-מיקרוביאלי).
- יש לשטוף על שייקר פלטפורמה נדנדה או בוחש מגנטי במשך 30 דקות.
- יש לייבש באוויר או לדגור בטמפרטורה של 60°C למשך שעתיים ולבדוק יעילות אנטי-מיקרוביאלית.
2. בדיקת צלחת גליל לסינון ננו-חלקיקים
- הכינו אגר סויה טריפטיקז (TSA), ציר סויה טריפטיקז (TSB), אגר בסיס אנטיביוטי (ABA) ואגר זרעים אנטיביוטי (ASA), על פי הוראות היצרנים, ועיקרו את המדיה על ידי אוטוקלאבינג ב 121 מעלות צלזיוס ב 15 psi למשך 15 דקות.
- תת-תרבית את המיקרובים (מהמלאי) המעניינים, שמולם מבוצעות בדיקות היעילות, על לוחות TSA טריים שהוכנו (או כל מדיה מתאימה) בשיטת צלחת הפסים התלת-כיוונית ודוגרת ליצירת לוחות טוהר. (מינים מומלצים: S. aureus, E. coli, P. aeruginosa, ו-C. albicans).
- יש לחסן את התרביות מצלחות טוהר טריות בצינורות TSB (10 מ"ל) בטמפרטורה של 35°C O/N עם רעידות מתונות (100-200 סל"ד).
- Aliquot 5.0 מ"ל של ASA מותך בכל אחת מהמבחנות. מספר הצינורות מתאים למספר המיקרואורגניזמים שנבדקו.
- יוצקים 20 מ"ל של ABA מותך מעוקר לתוך כל צלחת פטרי (100 מ"מ x 20 מ"מ) כדי ליצור את שכבת הבסיס. מספר לוחות אגר מתאים למספר המיקרואורגניזמים שיש לבדוק. חכו עד שהתקשורת תתמצק.
- לאחר התמצקות שכבת הבסיס, לחסן כל ASA מותך עם תרבית לילה משלב 2.3 (1.0 מ"ל, מחומם מראש ל 35 ° C) ומיד להעביר את התוכן (תערובת של ASA ותרבית) על פני השטח של צלחת ABA. מערבלים את הצלחת כדי לפזר את שכבת האגר המותך באופן שווה. ודאו ששכבת הזרעים נראית חלקה ונטולת בליטות או בועות.
- הניחו עד שישה גלילי נירוסטה (6 מ"מ x 6 מ"מ x 10 מ"מ; לפני autoclaved), במרווחים שווים על תבנית משושה, לכל צלחת אגר באמצעות זוג פינצטות סטריליות (איור 1).
- טען את הצילינדרים עם NPs מסונתז של נפחים שונים (30 μL, 50 μL, 75 μL, ו 100 μL) כדי להיות מוקרן עבור השפעות מיקרוביאליות. הבקרה השלילית היא זו ללא חומרים ביו-אקטיביים.
- לדגור על פתוגנים חיידקיים נפוצים (למשל, E. coli, S. aureus, P. aeruginosa) ב 35 ° C במשך 24 שעות ומיני פטריות (למשל, C. albicans) ב R/T במשך 3 ימים.
- למדוד את הקוטר של האזור הברור ולהשוות את האפקטיביות של NPs מסונתז.
הערה: ניתן להשתמש בבדיקה זו כדי לסנן מראש את NPs הטובים ביותר לציפוי על הבד.
3. שיטת פס מקבילי (שונה מ- AATCC 147)
- הכנת חומרים
- גזרו את הבד שעבר טיפול NP לדוגמיות בגודל 50 מ"מ x 25 מ"מ.
- הכינו אגר מולר-הינטון (MHA), TSA ו-TSB, בהתאם להוראות היצרנים, ועיקרו את המדיה על ידי אוטוקלאבינג בטמפרטורה של 121°C ב-15 psi למשך 15 דקות.
- תת-תרבית את המיקרובים (מהמלאי) המעניינים, שמולם מבוצעות בדיקות היעילות, על צלחות TSA טריות שהוכנו (או כל מדיה מתאימה) בשיטת צלחת הפסים התלת-כיוונית ודוגרים ב-35 מעלות צלזיוס למשך יומיים עבור כתמים חיידקיים וב-R/T במשך 5 ימים עבור זנים פטרייתיים לייצור צלחות טוהר. (מינים מומלצים: S. aureus, E. coli, P. aeruginosa, ו-C. albicans).
- ספייק של תרביות מיקרוביאליות
- יש לחסן את התרביות מצלחות טוהר טריות בצינורות TSB (10 מ"ל) בטמפרטורה של 35°C O/N עם רעידות מתונות (100-200 סל"ד).
- לדלל את תרביות O/N ל 1.5 × 108 יחידות יוצרות מושבה (CFU) / מ"ל או מתאים לעכירות של תקן 0.5 מקפרלנד (בדרך כלל דילול של 1/10 עד 1/20 עבור רוב התרבויות הבריאות).
- יש לחסן את התרבית המדוללת לעיל באמצעות לולאה סטרילית בקוטר 4 מ"מ באופן הבא. העמיסו לולאה של תרבית מרק והעבירו אותה לפני השטח של צלחת האגר MHA על-ידי יצירת חמישה פסים מקבילים, כל אחד באורך 6 ס"מ ובהפרש של 1 ס"מ זה מזה, לפי איור 2. אל תמלאו מחדש את הלולאה.
- לחצו בעדינות על דוגמית הבד באמצעות מרית סטרילית לרוחב חמשת הפסים, כך שהבד יהיה במרכז וייגע בכל חמשת קווי הפסים. יש לדגור ב-35°C למשך 24 שעות.
- הערכה איכותית של יעילות מיקרוביאלית
- בדקו את הצלחת המודגרת להפרעה בצמיחה לאורך הפסים שמעבר לשולי הבד (אזור ברור מציין עיכוב צמיחה).
- חשב את הרוחב הממוצע של אזור עיכוב לאורך קו הפס (W) משני צדי דוגמית הבד באמצעות משוואה (1).
W = (T - D)/2 (1)
W = רוחב של אזור ברור; T = האורך הכולל של האזור הנקי, כולל רוחב דוגמית הצבע; D = רוחב דוגמית הבד (25 מ"מ).
4. שיטת הפחתת יומן כמותי (שונה מ- AATCC 100)
- הכנה ניסיונית
- חתכו את הבד לדוגמיות מרובעות בגודל 50 מ"מ x 50 מ"מ.
- הכינו מרק TSA, TSB, Letheen ומלח חוצץ פוספט (PBS), על פי הוראות היצרנים, ועיקרו את המדיה על ידי autoclaving.
- הכינו תרביות O/N של חיידקים מעניינים, שמולן מבוצעות בדיקות היעילות, על ידי חיסון מושבות מבודדות מצולחות טוהר ב-TSB סטרילי ודגרה ב-35°C למשך 18-24 שעות. (מינים מומלצים: S. aureus, E. coli, P. aeruginosa, ו-C. albicans).
- ספייק של תרביות מיקרוביאליות
- לדלל את תרביות O/N ל 1.5 × 108 CFU/mL או מתאים לעכירות של תקן 0.5 McFarland (בדרך כלל דילול של 1/10 עד 1/20 עבור רוב התרבויות הבריאות).
- קבע את נפח התרביות המתאים לדוקרציה על ידי מדידת יכולת החזקת הנוזל של הבד באופן הבא.
- הוסיפו סדרה של נפחים של תרבית המרק המדולל (למשל, 100-500 מיקרוליטר) לדוגמיות בד (בלוחות פטרי נפרדים) ובחרו את הנפח כך שדוגמית הבד תספוג את המים במלואם ולא תשאיר שאריות/נוזלים חופשיים. כושר החזקת הנוזל שונה מסוג ועובי הבד. עבור מעילי מעבדה רגילים מכותנה, זה בערך 200 μL.
- הקפיצו את הנפח (קיבולת החזקת נוזל שנקבעה לעיל [למשל, 200 מיקרוליטר]) של כל תרבית על גבי דוגמיות המונחות בלוחות פטרי סטריליים. מספר דוגמיות הצבע תואם למספר הבדיקות (למשל, בד שנבדק מיד ולאחר הכביסה [ומחזורי הכביסה שנבדקו]), וההשפעות האנטי-מיקרוביאליות שנבדקו לאורך זמן המגע (לאחר שעה/יום מוגדרים [למשל, 30 דקות, שעתיים, יום 1-3]).
הערה: השתמש במיקרופיפטה עם קצוות מסנן תרסיס (כדי למנוע זיהום של פיפטה בשימושים הבאים) כדי לחסן את התרביות על דוגמיות עם פיזור שווה. - עבור הבקרה השלילית, השתמש באותו סוג של דוגמיות בד לא מטופלות. בצעו את הבקרה השלילית עבור כל מין מיקרוביאלי מתאים, תקופת מגע, בדים שונים ומחזורי כביסה.
- התאוששות של חיידקים על ידי ספירת צלחות קיימא
- אפשרו לדוגמיות המחוסנות (מטופלות ולא מטופלות) להתייבש באוויר בתוך לוחות פטרי (מכסים פתוחים) ב-R/T למשך תקופת המגע הנדרשת לבדיקה (למשל, 0 דקות, 30 דקות, 60 דקות וכו', או אפילו ימים להשפעות ארוכות טווח). יש לכלול תמיד "0 דקות" כדי לייצג השפעה מיידית ויעילות מנטרלת.
- מעבירים את הדוגמיות לצינורות צנטריפוגות סטריליים נפרדים (50 מ"ל) ומבריחים את הפקקים בחוזקה.
- הוסיפו ציר Letheen (כל מאגרים מנטרלים רלוונטיים) כדי לבצע דילול של 1/100 (למשל, 19.8 מ"ל עבור חיסון של 200 μL).
- סגור את צינורות הצנטריפוגות עם מכסי הברגים בחוזקה ומערבול למשך דקה אחת במהירות בינונית.
- לדלל באופן סדרתי את המתלה עם PBS סטרילי בדילול 1/10 לאחר מכן, כך שספירת המושבה של הקבוצה "הלא מטופלת" הופכת נמוכה מדי לספירה (TLTC).
- לוחים את הדילולים (0.1 מ"ל) על לוחות מדיה מתאימים, התומכים בצמיחת המיקרואורגניזם (למשל, TSA לחיידקים או אגר דקסטרוז סאבורו [SDA] לפטריות) או כל מדיה הממטבת את הגידול ומספקת ניגודיות טובה כדי להפוך את ספירת המושבה למדויקת.
- לדגור על לוחות החיידקים ב 35 ° C במשך 2 ימים ואת לוחות פטרייתי ב R / T במשך 5 ימים.
- ספור את יחידות ה-CFUs הקיימות ישירות באמצעות מונה מושבה או באמצעות תוכנת הדמיה (למשל, CFU AI).
- חשב את הפחתת היומן המיקרוביאלית (R) עקב מארג אנטי-מיקרוביאלי באמצעות משוואה (2):
R =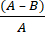 × 100 (2)
× 100 (2)
A = ערך יומן של מספר CFUs שנמצאו מבד לא מטופל; B = ערך יומן של מספר יחידות ה-CFUs שנמצאו מבד מטופל.
תוצאות
סינון ראשוני של NPs מסונתזים
בעקבות טכניקת תחליב שמן במיםדו-שלבית 16, התרכובות הביו-אקטיביות (קרבקרול ותימול) נעטפו בהצלחה בצ'יטוזן. זה אושר על ידי ספקטרופוטומטריה UV-Vis עבור ספיגת שיא של תרכובות ביו-אקטיביות בהתאמה בהשוואה לבקרות, שהיו NPs chitosan ללא כל תרכובות ביו-אקטיבי?...
Discussion
היעילות האנטי-מיקרוביאלית של ביוצידים נבדקת באופן קונבנציונלי על ידי בדיקות כמותיות, כגון ריכוז מעכב מינימלי (MIC) וריכוז חיידקים מינימלי (MBC), שבו החיידקים שקועים בנוזל אנטי-מיקרוביאלי למשך 24 שעות. עם זאת, בדיקות אלה אינן מתאימות לבדים מצופים, שבהם הממשק הנוזלי חסר והביוצידים מפוזרים באיטי?...
Disclosures
למחברים אין ניגודי עניינים.
Acknowledgements
מחקר זה מומן על ידי "מחקר יישומי, חדשנות ושירותי יזמות" (ARIES), סנטניאל קולג ', קנדה.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid | Millipore Sigma | 64-19-7 | |
| Antibiotic base agar | BD Difco | DF0270-17-4 | Also known as Antibiotic Medium 2 |
| Antibiotic seed agar | BD Difco | DF0263-17-3 | Also known as Antibiotic Medium 1 |
| Blood Agar (Nutrient Agar with 5% Sheep Blood) | Donated by CFIA | ||
| Bromcresol Purple Lactose Agar | Donated by CFIA | ||
| Candida albicans | ATCC The Global Bioresource Center | ATTC 10231 | |
| Carvacrol | Millipore Sigma | 282197 (CAS# 499-75-2) | |
| Centrifuge Allergra X-22R Centrifuge | Beckman Coulter | Model # X-22R | Refrigerated. Wait at least 20 min or until the temperature reach the set low value (e.g., 4 °C) as the refrigeration takes time. |
| Chitosan Medium Molecular Weight (CS) | Millipore Sigma | 448877 (CAS # 9012-76-4) | |
| Clamshell Heat Press | Intiva | IM1200 | |
| Escherichia coli (E. coli) | ATCC The Global Bioresource Center | ATTC 23725 | |
| Incubator | Thermo Scientific | 1205M34 | |
| Letheen Broth | BD Difco | DF0681-17-7 | Used to neutralize antimicrobial effects. Product from different manufacturers may require to add Polysorbate 80, which is already added in Difco product. |
| Milli Q water | Millipore Sigma | ZR0Q16WW | Deionized water |
| Mueller-Hinton Agar | BD Difco | DF0252-17-6 | |
| Pentasodium tripolyphosphate (TPP) | Millipore Sigma | 238503 (CAS# 7758-29-4) | |
| Phospahte Buffered Saline (PBS) | Thermo Scientific | AM9624 | |
| Pseudomonas aeruginosa | ATCC The Global Bioresource Center | ATTC 9027 | |
| Sabouraud Dextrose Agar | BD Difco | DF0109-17-1 | |
| Shaking incubator/ Thermo shaker | VWR | Model# SHKA2000 | |
| Staphylococcus aureus | ATCC The Global Bioresource Center | ATTC 6538 | |
| Thymol | Millipore Sigma | T0501 (CAS# 89-83-8) | |
| Trypticase Soy Agar | BD Difco | 236950 | |
| Trypticase Soy Broth | BD Difco | 215235 | |
| Tween 80 | Millipore Sigma | STS0204 (CAS # 9005-65-6) | |
| UV-Vis Spectrophometer | Thermo Scientific | GENESYS 30 (840-277000) |
References
- Schmidt-Emrich, S., et al. Rapid assay to assess bacterial adhesion on textiles. Materials. 9 (4), 249 (2016).
- Qaday, J., et al. Bacterial contamination of medical doctors and students white coats at Kilimanjaro Christian Medical Centre, Moshi, Tanzania. International Journal of Bacteriology. 2015, 507890 (2015).
- Treakle, A. M., et al. Bacterial contamination of health care workers' white coats. American Journal of Infection Control. 37 (2), 101-105 (2009).
- Wong, D., Nye, K., Hollis, P. Microbial flora on doctors' white coats. BMJ. 303 (6817), 1602-1604 (1991).
- Gouveia, I. C. Nanobiotechnology: A new strategy to develop non-toxic antimicrobial textiles for healthcare applications. Journal of Biotechnology. (150), 349 (2010).
- Joshi, M., Ali, S. W., Purwar, R., Rajendran, S. Ecofriendly antimicrobial finishing of textiles using bioactive agents based on natural products. Indian Journal of Fibre and Textile Research. 34, 295-304 (2009).
- Ahmed, H. A., Rajendran, R., Balakumar, C. Nanoherbal coating of cotton fabric to enhance antimicrobial durability. Elixir Applied Chemistry. 45, 7840-7843 (2012).
- Morais, D. S., Guedes, R. M., Lopes, M. A. Antimicrobial approaches for textiles: From research to market. Materials. 9 (6), 498 (2016).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Development of advanced textile finishes using nano-emulsions from herbal extracts for organic cotton fabrics. Coatings. 11 (8), 939 (2021).
- Martínez-Hernández, G. B., Amodio, M. L., Colelli, G. Carvacrol-loaded chitosan nanoparticles maintain quality of fresh-cut carrots. Innovative Food Science & Emerging Technologies. 41, 56-63 (2017).
- Zhang, H. L., Wu, S. H., Tao, Y., Zang, L. Q., Su, Z. Q. Preparation and characterization of water-soluble chitosan nanoparticles as protein delivery system. Journal of Nanomaterials. 2010, 1-5 (2010).
- Patel, R., Gajra, B., Parikh, R. H., Patel, G. Ganciclovir loaded chitosan nanoparticles: preparation and characterization. Journal of Nanomedicine & Nanotechnology. 7 (6), 1-8 (2016).
- Merodio, M., Arnedo, A., Renedo, M. J., Irache, J. M. Ganciclovir-loaded albumin nanoparticles: characterization and in vitro release properties. European Journal of Pharmaceutical Sciences. 12 (3), 251-259 (2001).
- Hsieh, W. C., Chang, C. P., Gao, Y. L. Controlled release properties of Chitosan encapsulated volatile Citronella Oil microcapsules by thermal treatments. Colloids and Surfaces B: Biointerfaces. 53 (2), 209-214 (2006).
- Yoksan, R., Jirawutthiwongchai, J., Arpo, K. Encapsulation of ascorbyl palmitate in chitosan nanoparticles by oil-in-water emulsion and ionic gelation processes. Colloids and Surfaces B: Biointerfaces. 76 (1), 292-297 (2010).
- Keawchaoon, L., Yoksan, R. Preparation, characterization and in vitro release study of carvacrol-loaded chitosan nanoparticles. Colloids and Surfaces B: Biointerfaces. 84 (1), 163-171 (2011).
- Cazedey, E. C. L., Salgado, H. R. N. Development and validation of a microbiological agar assay for determination of orbifloxacin in pharmaceutical preparations. Pharmaceutics. 3 (3), 572-581 (2011).
- Jayapriya, S., Bagyalakshmi, G. Textile antimicrobial testing and standards. International Journal of Textile and Fashion Technology. 4 (1), 2250-2378 (2013).
- AATCC 100. Antibacterial Finishes on Textile Materials: Assessment of Developed from American Association of Textile Chemists and Colorists. AATCC 100. , (2004).
- AATCC 147. Antimicrobial Activity Assessment of Textile Materials: Parallel Streak Method from American Association of Textile Chemists and Colorists. AATCC 147. , (2004).
- Ortelli, S., Costa, A. L., Dondi, M. TiO2 nanosols applied directly on textiles using different purification treatments. Materials. 8 (11), 7988-7996 (2015).
- Poole, K. Pseudomonas aeruginosa: resistance to the max. Frontiers in Microbiology. 2, 65 (2011).
- Pinho, E., Magalhães, L., Henriques, M., Oliveira, R. Antimicrobial activity assessment of textiles: standard methods comparison. Annals of Microbiology. 61 (3), 493-498 (2010).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Novel antimicrobial finishing of organic cotton fabrics using nano-emulsions derived from Karanja and Gokhru plants. Textile Research Journal. 92 (23-24), 5015-5032 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved