Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein antimikrobielles Gewebe mit nanopflanzlicher Verkapselung ätherischer Öle
In diesem Artikel
Zusammenfassung
Antimikrobielle Laborkittel verhindern die Kreuzkontamination durch die Ansammlung von Krankheitserregern und das versehentliche Verschütten von Biodaten. Hier beschreiben wir das Protokoll zur Entwicklung eines hautfreundlichen antimikrobiellen Gewebes unter Verwendung von nanopflanzlicher Verkapselung und modifizierten Standardtests, um die Wirksamkeit und Eignung des Laborkittels für die typische Verwendung genau zu bewerten.
Zusammenfassung
Laborkittel werden häufig in Labors für biologische Gefahren und in Gesundheitseinrichtungen als Schutzkleidung verwendet, um eine direkte Exposition gegenüber Krankheitserregern, Verschüttungen und Verbrennungen zu verhindern. Diese Schutzmäntel auf Baumwollbasis bieten aufgrund ihrer porösen Beschaffenheit, ihrer Feuchtigkeitsspeicherkapazität und ihrer Wärmespeicherung vom Körper des Benutzers ideale Bedingungen für mikrobielles Wachstum und Anheftungsstellen. Mehrere Studien haben gezeigt, dass pathogene Bakterien auf Krankenhauskleidung und Laborkitteln überleben und als Vektoren der mikrobiellen Übertragung fungieren.
Ein gängiger Ansatz zur Behebung dieser Probleme ist der Einsatz antimikrobieller Wirkstoffe in der Textilveredelung, aber aufgrund der Toxizität und der Umweltauswirkungen vieler synthetischer Chemikalien wurden Bedenken geäußert. Die anhaltende Pandemie hat auch ein Fenster für die Untersuchung wirksamer antimikrobieller Mittel und umweltfreundlicher und giftfreier Formulierungen geöffnet. In dieser Studie werden zwei natürliche bioaktive Verbindungen, Carvacrol und Thymol, verwendet, die in Chitosan-Nanopartikeln verkapselt sind und einen wirksamen Schutz gegen vier menschliche Krankheitserreger mit einer Reduktion von bis zu 4 Log-Stoffen (99,99 %) garantieren. Diese Krankheitserreger werden häufig in Laborkitteln nachgewiesen, die in Laboratorien für biologische Gefahren verwendet werden.
Die behandelten Stoffe hielten außerdem bis zu 10 Waschgängen mit 90% mikrobieller Reduktion stand, was für den vorgesehenen Verwendungszweck ausreichend ist. Wir haben Modifikationen an den bestehenden Standard-Stofftests vorgenommen, um die typischen Szenarien der Verwendung von Laborkitteln besser abzubilden. Diese Verfeinerungen ermöglichen eine genauere Bewertung der Wirksamkeit von antimikrobiellen Laborkitteln und die Simulation des Verbleibs versehentlicher mikrobieller Verschüttungen, die innerhalb kurzer Zeit neutralisiert werden müssen. Weitere Studien werden empfohlen, um die Anreicherung von Krankheitserregern im Laufe der Zeit auf antimikrobiellen Laborkitteln im Vergleich zu herkömmlichen Schutzkitteln zu untersuchen.
Einleitung
Der weiße Schutzkittel ist eine obligatorische persönliche Schutzausrüstung (PSA) in mikrobiologischen Labors und Gesundheitseinrichtungen und schützt vor direkter Exposition gegenüber Krankheitserregern, Verschüttungen und Verbrennungen. Diese Baumwollmäntel fördern das mikrobielle Wachstum aufgrund vieler Faktoren - der gewebte Stoff bietet Ansatzstellen und Belüftung, Baumwolle und Stärke, die im Herstellungsprozess verwendet werden, sowie abgeblätterte Epithelzellen des Benutzers liefern Nährstoffe, und die Nähe zum Benutzer gibt Wärme und Feuchtigkeit. Die Ansammlung von Mikroben auf Textilien kann auch zu gesundheitlichen Problemen wie Allergien und nosokomialen Infektionen, unangenehmen Gerüchen und Stoffverfall führen1.
Im Gegensatz zu normaler Kleidung werden Schutzmäntel nur selten gewaschen oder desinfiziert, wie in vielen Umfragen festgestellt wurde 2,3. Viele Studien belegen die Wirkung von Laborkitteln als Vektor der mikrobiellen Übertragung und das Risiko nosokomialer Infektionen im Gesundheitswesen2,4, insbesondere resistente Stämme3 wie Methicillin-resistente Staphylococcus aureus (MRSA); Daher werfen sie gesundheitliche Bedenken hinsichtlich der PSA auf, die vor mikrobieller Kontamination schützen soll. Es gibt nicht genügend Querschnittsstudien zu Laborkittel-assoziierten Infektionen im Zusammenhang mit Einrichtungen der biologischen Sicherheitsstufe 2 (BSL-2) oder mikrobiologischen Lehrlaboren, aber viele Zulassungsbehörden schränken die Verwendung von Laborkitteln innerhalb der Eindämmungsstufe ein. Viele akademische Einrichtungen in Nordamerika haben jedoch aufgrund praktischer Zwänge Schwierigkeiten, die Anforderungen zu erfüllen, wie z. B. das Waschen und Lagern in der Einrichtung, die Vorfälle des Tragens von Laborkitteln in öffentlichen Bereichen wie Cafeterias und Bibliotheken sind häufig. Eine praktikable Lösung für diese Probleme ist der Einsatz antimikrobieller Wirkstoffe in der Textilveredlung.
Antimikrobielle Stoffe werden in Sportbekleidung, Sportbekleidung und Socken immer beliebter, da sie hauptsächlich Körpergeruch reduzieren sollen. Die Verwendung dieser Stoffe ist jedoch bei der Entwicklung von PSA nicht üblich, mit Ausnahme einiger silberbeschichteter Baumwollmasken und Kleidungsstücke für das Gesundheitswesen5. Wir berichten über die Entwicklung eines antimikrobiellen Gewebes für Laborkittel, das häufige Krankheitserreger in BSL-2-Laboren hemmt und einen wirksamen Schutz vor der Kreuzkontamination durch häufige Krankheitserreger bietet.
Derzeit ist eine Vielzahl von antimikrobiellen Stoffen und Ausrüstungen auf dem Markt erhältlich, aber die meisten von ihnen verwenden kolloidale Schwermetallpartikel (z. B. Silber, Kupfer, Zink), Organometalle oder synthetische Chemikalien wie Triclosan und quartäre Ammoniumverbindungen, die nicht umweltfreundlich sind1 und zu gesundheitlichen Problemen wie Hautreizungen und Allergien führen können6. Einige synthetische Formulierungen sind aufgrund von Nicht-Zielmikroben, wie z. B. einer normalen Flora oder der Induktion von antimikrobiellen Resistenzen (AMR), besorgniserregend. Die US-amerikanische Food and Drug Administration (FDA) reguliert kommerzielle antimikrobielle Stoffe, die für den Benutzer ungiftig und frei von Ökotoxizität sein müssen. Daher sind antimikrobielle Gewebe auf Basis natürlicher Biozide vorzuziehen, die ein breites Spektrum von Mikroben hemmen. Ätherische Öle (EOs) werden häufig als antimikrobielle und therapeutische Mittel verwendet, aber ihre Verwendung in der antimikrobiellen Ausrüstung ist aufgrund ihrer Haltbarkeit begrenzt 6,7,8. Basierend auf unserem Wissen und unserer Marktforschung über nano-pflanzliche Ausrüstung8 ist kein antimikrobielles Gewebe auf Kräuterbasis im Handel erhältlich. Das liegt daran, dass synthetische Beschichtungen einfach herzustellen sind und eine lange Haltbarkeit haben. Zu den wenigen nano-kräuterbeschichteten Textilien, die nur zu Forschungszwecken gemeldet wurden, gehören Neem7, Moringa 9 und Curryblätter9.
In der vorliegenden Studie werden zwei bioaktive Komponenten verwendet, die aus Oregano-EOs extrahiert werden, Carvacrol und Thymol, die gegen eine Vielzahl von bakteriellen Krankheitserregern und Viren wirksam sind, aber allgemein als sicher für den Menschen anerkannt sind10. Diese bioaktiven Komponenten sind jedoch flüchtig und daher ist ihr antimikrobielles Potenzial nur von kurzer Dauer, wenn sie direkt auf das Gewebe aufgetragen werden. Die Nano-Kräuterverkapselung ist ein Prozess, bei dem bioaktive Komponenten oder Medikamente in eine Polymerhülle geladen werden, die den Kern vor Umweltzerstörung schützt und so die Haltbarkeit verlängert. Darüber hinaus erhöht die geringe Größe der Polymerpartikel, die im Allgemeinen zwischen 10 nm und 100 nm liegen, die Wirksamkeit der Anwendung und verlangsamt die Freisetzung der bioaktiven Verbindungen auf das Gewebe. Diese bioaktiven Verbindungen werden für verschiedene Zwecke verwendet, z. B. für die Konservierung von Lebensmitteln10, jedoch nicht für die Beschichtung von Textilien.
Unter vielen polymeren Verkapselungsmitteln ist Chitosan aufgrund vieler seiner Eigenschaften wie Nichttoxizität, biologische Abbaubarkeit, Mukoadhäsivität und Biokompatibilität ein attraktiver Kandidat11. Es ist ein natürliches Polysaccharid, das durch den Deacetylierungsprozess aus Chitin gewonnen wird, das in Muscheln und Pilzzellwänden vorkommt. Es wird in biochemischen und lebensmittelkonservierenden Anwendungen wie der Verabreichung von Medikamenten oder Proteinen 11, 12, 13, der kontrollierten Freisetzung 14 und antimikrobiellen Filmen 10 verwendet. Chitosan ist nicht leicht wasserlöslich, bildet aber in sauren Medien eine kolloidale Suspension. Bioaktive Moleküle werden durch eine einfache zweistufige ionische Gelierungsmethode in Chitosan-Nanopartikel (NPs) geladen14,15,16. Dabei bilden hydrophobe bioaktive Verbindungen wie Carvacrol und Thymol eine Öl-in-Wasser-Emulsion, die durch ein Tensid, Tween 80, unterstützt wird. Anschließend wird eine polyanionische Verbindung, Pentanatriumtripolyphosphat (TPP), verwendet, um die Querverbindungen zwischen den Aminogruppen entlang der polykationischen Polymermoleküle und den Phosphatgruppen der TPP-Moleküle zu bilden, um den Komplex zu stabilisieren. Dieser Komplexierungsprozess verfestigt die bioaktiven Verbindungen in der Matrix von Chitosan, das anschließend gereinigt und auf Baumwollmuster aufgetragen wird, um antimikrobielles Gewebe herzustellen.
Die Nano-Formulierungen müssen zunächst auf ihre antimikrobielle Wirksamkeit in Emulsionsform getestet werden, bevor sie auf das Gewebe aufgetragen werden. Dies kann bequem durch eine qualitative Methode wie die Kirby-Bauer-Scheibendiffusion, die Well-Diffusion und den Zylinderplatten-Assay bewertet werden. Der Zylinderplattenassay17 bietet jedoch die Flexibilität, unterschiedliche Volumina der Formulierung zu laden und die Abstandszone zu vergleichen. Bei diesem Verfahren werden die antimikrobiellen Formulierungen in Edelstahlzylinder geladen und auf eine weiche Agarschicht aufgebracht, die mit dem Testmikroorganismus oder Krankheitserreger beimpft wird. Der Durchmesser der Clearance-Zone, die gegen den Testorganismus erzeugt wird, ist proportional zum Hemmpotenzial der antimikrobiellen Formulierung und kann daher als Alternative zu Brüheverdünnungsmethoden verwendet werden. Die Größe der klaren Zonen ist jedoch nur ein vergleichendes oder qualitatives Maß innerhalb einer bestimmten Platte, es sei denn, es werden bestimmte Standards eingehalten. Antimikrobielle Wirkstoffe wirken gegen die Krankheitserreger, indem sie entweder ihr Wachstum hemmen (biostatisch) oder die Zellen abtöten (biozid), was durch die minimale Hemmkonzentration (MHK) bzw. die minimale bakterizide Konzentration (MBC) quantifiziert werden kann. Die Wirksamkeit und das Verhalten der bioaktiven Chemikalien unterscheiden sich jedoch in ihren Formulierungen (flüssiger Zustand) und wenn sie auf einem Substrat, wie z. B. einem Gewebe18, beschichtet sind. Dies liegt daran, dass mehrere Faktoren eine Rolle bei der Wirksamkeit spielen, wie z. B. die Stabilität der Haftung der antimikrobiellen Wirkstoffe auf dem Gewebe, der Feuchtigkeitsgehalt, die Substratart und die Haftung der Mikroben. Wenn der beabsichtigte Zweck nur die bakteriostatische Aktivität ist, kann ein qualitativer Assay wie die "Parallel-Streak-Methode"19 eine relativ schnelle und einfache Bewertung der diffusionsfähigen antimikrobiellen Formulierung ermöglichen. Sollen jedoch die bakteriziden Wirkungen bestimmt werden, kann die "Bewertung antibakterieller Ausrüstungen auf textilen Materialien"20 eingesetzt werden, die für die logarithmische Reduktion des Stachelerregers sorgt.
Protokoll
1. Herstellung von Nanopartikeln
- Nano-pflanzliche Verkapselung
- Bereiten Sie 50 ml 1%ige (v/v) Essigsäure vor.
VORSICHT: Gletscheressig ist ein Reizstoff, der schwere Hautverbrennungen und Augenschäden verursachen kann. Tragen Sie einen Laborkittel in voller Länge, Nitrilhandschuhe und eine Schutzbrille und arbeiten Sie unter einem Abzug. - Stellen Sie Chitosanlösung (1,2 Gew.-%) her, indem Sie 0,6 g Chitosanflocken (mittleres Molekulargewicht) in 50 ml 1%iger Essigsäure (oben zubereitet) auflösen. Über Nacht (O/N) bei Raumtemperatur (R/T) rühren, um eine homogene Emulsion zu erhalten.
- 0,5 g Tween 80 zugeben und 2 h bei 60 °C rühren (1.000 U/min), um eine homogene Lösung zu erhalten. Bringen Sie die Lösung zu R/T, bevor Sie bioaktive Verbindungen (Carvacrol oder Thymol) hinzufügen.
- 0,75 g Carvacrol (oder Thymol) tropfenweise oder nach und nach unter Rühren (1.000 U/min) zugeben. Das Gewichtsverhältnis von Chitosan zu bioaktiver Verbindung beträgt 1:1,25.
- Fügen Sie der Mischung 50 ml (0,5 % w/v) TPP tropfenweise hinzu, während Sie bei R/T rühren. Rühren Sie 30 Minuten lang weiter, um eine homogene Emulsion zu erhalten.
- Bereiten Sie eine Negativkontrolle vor, indem Sie das gleiche Verfahren anwenden, jedoch ohne Zusatz von bioaktiven Verbindungen.
- Bereiten Sie 50 ml 1%ige (v/v) Essigsäure vor.
- Reinigung
- Zentrifugieren Sie die Emulsion bei 10.000 × g für 30 min bei 4 °C und sammeln Sie die gebildeten NPs (Pellets) nach dem Umfüllen des Überstands. Reservieren Sie den Überstand, um die Wirksamkeit der Verkapselung zu testen.
- Waschen Sie die Partikel (ab Schritt 1.2.1) mit wässrigem Tween 80 (1 % v/v) mit dem doppelten Volumen der gebildeten Pellets, um die ungebundenen oder freien bioaktiven Verbindungen zu entfernen. Achten Sie darauf, das Pellet durch Wirbeln zu stören, bis sich in jedem Waschschritt eine homogene Lösung bildet.
- Waschen Sie die Partikel (ab Schritt 1.2.2) zweimal mit deionisiertem Wasser, um Verunreinigungen zu entfernen.
- Die NPs werden rekonstituiert, indem das Pellet (aus Schritt 1.2.3) in 30 ml deionisiertem Wasser resuspendiert wird. Lagern Sie die NPs bei 4 °C für bis zu 6 Monate.
HINWEIS: Das Experiment kann zu diesem Zeitpunkt angehalten werden.
- Charakterisierung
- Verdünnen Sie die NPs in deionisiertem Wasser, bis die UV-Vis-Werte (UV-Vis) zwischen 250 und 400 nm in den Bereich (Absorption >1) fallen.
- Nehmen Sie die UV-Vis-Absorptionsspektren der NPs über die Wellenlängen von 250 bis 400 nm mit einem UV-Vis-Spektralphotometer auf.
- Lagern Sie ein aliquotes (1 ml) NPs bei R/T für einen bestimmten Zeitraum (z. B. 1 bis 6 Monate) und testen Sie die antimikrobielle Wirkung mit der Zylinderplattenmethode zusammen mit einer frischen Probe.
- Beschichtung auf Stoff
- Tragen Sie NPs mit einem Pad-Dry-Cure-Verfahren auf ein gewebtes Baumwollgewebeauf 7,21.
- Tauchen Sie die Stoffmuster 3 Minuten lang in die Lösung mit NPs, die mit einem Stoffbindemittel vermischt sind, bis sie durchnässt sind. Führen Sie dann die Farbfelder durch einen Zwei-Walzen-Laborsticker, um überschüssige Flüssigkeit zu entfernen.
- Die Proben bei 100 °C 30 min im Ofen trocknen und bei 130 °C 10 min aushärten.
- Zum Schluss waschen Sie die Proben 15 Minuten lang in einem Ultraschallbad, um ungebundene NPs zu entfernen.
HINWEIS: Befolgen Sie alternativ die unten beschriebene vereinfachte Methode.
- Schneiden Sie den Baumwollstoff (oder die Muster des Laborkittels) in 10 cm x 10 cm große Quadrate.
- Tauchen Sie die geschnittenen Stücke in 2 ml des synthetisierten NP (10%) in einen Kunststoffbehälter (12 cm x 12 cm) für 2 Minuten bei R/T. Entfernen Sie überschüssige Flüssigkeit durch Lufttrocknung.
- 3 min bei 100 °C erhitzen, um die NPs zu binden.
- Ungebundene NPs durch Spülen in wässrigem Tween 80 (2 Gew.-%) entfernen und im Ofen bei 100 °C für 30 min trocknen.
HINWEIS: Dieses antimikrobielle Gewebe kann 2 Jahre bei R / T gelagert werden.
- Tragen Sie NPs mit einem Pad-Dry-Cure-Verfahren auf ein gewebtes Baumwollgewebeauf 7,21.
- Haltbarkeit der Waschung
- Schneiden Sie den Stoff in quadratische Maschen von 50 mm x 50 mm.
- Legen Sie die Farbfelder in 50 ml warmes Leitungswasser (40 °C) in einen Glas-/Kunststoffbehälter und fügen Sie zwei Tropfen normales Reinigungsmittel (nicht antimikrobiell) hinzu.
- 30 Minuten lang auf einem Schaukelplattform-Shaker oder Magnetrührer abspülen.
- 2 h an der Luft trocknen oder bei 60 °C inkubieren und auf antimikrobielle Wirksamkeit testen.
2. Zylinderplattenassay für das Screening von Nanopartikeln
- Bereiten Sie Trypticase-Sojaagar (TSA), Trypticase-Sojabrühe (TSB), antibiotisches Basisagar (ABA) und antibiotisches Samenagar (ASA) gemäß den Anweisungen des Herstellers zu und sterilisieren Sie das Medium durch Autoklavieren bei 121 °C bei 15 psi für 15 Minuten.
- Subkulturieren Sie die interessierenden Mikroben (aus dem Lager), gegen die die Wirksamkeitstests durchgeführt werden, auf frisch präparierten TSA-Platten (oder einem geeigneten Medium) nach der Drei-Wege-Streak-Plate-Methode und inkubieren Sie sie, um Reinheitsplatten herzustellen. (Empfohlene Arten: S. aureus, E. coli, P. aeruginosa und C. albicans.)
- Beimpfen Sie die Kulturen aus frischen Reinheitsplatten in TSB (10-ml-Röhrchen) bei 35 °C O/N unter mäßigem Schütteln (100-200 U/min).
- Aliquotieren Sie 5,0 ml der geschmolzenen ASA in jedem der Reagenzgläser. Die Anzahl der Röhrchen entspricht der Anzahl der getesteten Mikroorganismen.
- Gießen Sie 20 ml vorsterilisiertes geschmolzenes ABA aseptisch in jede Petriplatte (100 mm x 20 mm), um die Basisschicht zu bilden. Die Anzahl der Agarplatten entspricht der Anzahl der zu testenden Mikroorganismen. Warten Sie, bis sich das Medium verfestigt hat.
- Nach dem Erstarren der Basisschicht wird jede geschmolzene ASA mit einer Übernachtkultur aus Schritt 2.3 (1,0 mL, vorgewärmt auf 35 °C) beimpft und der Inhalt (Mischung aus ASS und Kultur) sofort auf die Oberfläche einer ABA-Platte übertragen. Schwenken Sie die Platte, um die geschmolzene Agarschicht gleichmäßig zu verteilen. Achten Sie darauf, dass die Saatschicht glatt und frei von Unebenheiten oder Blasen erscheint.
- Platzieren Sie mit einer sterilen Pinzette bis zu sechs Edelstahlzylinder (6 mm x 6 mm x 10 mm; vorautoklaviert) in gleichmäßigen Abständen in einem sechseckigen Muster pro Agarplatte (Abbildung 1).
- Beladen Sie die Zylinder mit den synthetisierten NPs unterschiedlicher Volumina (30 μl, 50 μl, 75 μl und 100 μl), die auf antimikrobielle Wirkungen untersucht werden sollen. Die Negativkontrolle ist diejenige ohne bioaktive Verbindungen.
- Häufige bakterielle Krankheitserreger (z. B . E. coli, S. aureus, P. aeruginosa) bei 35 °C für 24 h und Pilzarten (z. B. C. albicans) bei R/T für 3 Tage inkubieren.
- Messen Sie den Durchmesser der klaren Zone und vergleichen Sie die Wirksamkeit der synthetisierten NPs.
HINWEIS: Dieser Test kann verwendet werden, um die besten NPs vorzuprüfen, die auf dem Stoff beschichtet werden sollen.
3. Parallelstreifen-Methode (modifiziert von AATCC 147)
- Materialaufbereitung
- Schneiden Sie den NP-behandelten Stoff in 50 mm x 25 mm große Muster.
- Bereiten Sie Mueller-Hinton-Agar (MHA), TSA und TSB gemäß den Anweisungen des Herstellers vor und sterilisieren Sie die Medien durch Autoklavieren bei 121 °C bei 15 psi für 15 Minuten.
- Subkulturieren Sie die interessierenden Mikroben (aus dem Lager), an denen die Wirksamkeitstests durchgeführt werden, auf frisch präparierten TSA-Platten (oder einem geeigneten Medium) nach der Drei-Wege-Streak-Plate-Methode und inkubieren Sie sie bei 35 °C für 2 Tage für bakterielle Färbungen und bei R/T für 5 Tage für Pilzstämme, um Reinheitsplatten herzustellen. (Empfohlene Arten: S. aureus, E. coli, P. aeruginosa und C. albicans.)
- Spiking von mikrobiellen Kulturen
- Beimpfen Sie die Kulturen aus frischen Reinheitsplatten in TSB (10-ml-Röhrchen) bei 35 °C O/N unter mäßigem Schütteln (100-200 U/min).
- Verdünnen Sie die O/N-Kulturen auf 1,5 × 108 koloniebildende Einheiten (KBE)/ml oder entsprechend der Trübung von 0,5 McFarland-Standard (normalerweise eine Verdünnung von 1/10 bis 1/20 für die meisten gesunden Kulturen).
- Beimpfen Sie die obige verdünnte Kultur mit einer 4 mm sterilen Schlaufe wie folgt. Laden Sie eine Schlaufe voll Brühekultur und übertragen Sie sie auf die Oberfläche der MHA-Agarplatte, indem Sie fünf parallele Streifen mit einer Länge von jeweils 6 cm und einem Abstand von 1 cm gemäß Abbildung 2 machen. Füllen Sie die Schlaufe nicht nach.
- Drücken Sie das Stoffmuster vorsichtig mit einem sterilen Spatel über die fünf Streifen, so dass sich der Stoff in der Mitte befindet und alle fünf Streifenlinien berührt. Bei 35 °C für 24 h inkubieren.
- Qualitative Bewertung der antimikrobiellen Wirksamkeit
- Untersuchen Sie die inkubierte Platte auf die Unterbrechung des Wachstums entlang der Streifen über die Ränder des Gewebes hinaus (eine klare Zone zeigt eine Hemmung des Wachstums an).
- Berechnen Sie die durchschnittliche Breite einer Hemmzone entlang der Streifenlinie (W) auf beiden Seiten des Stoffmusters mit Gleichung (1).
W = (T - D)/2 (1)
W = Breite der freien Zone; T = Gesamtlänge der lichten Zone, einschließlich der Farbfeldbreite; D = Breite des Stoffmusters (25 mm).
4. Quantitative logarithmische Reduktionsmethode (modifiziert von AATCC 100)
- Versuchsvorbereitung
- Schneiden Sie den Stoff in quadratische Maschen von 50 mm x 50 mm.
- Bereiten Sie TSA, TSB, Letheen-Brühe und phosphatgepufferte Kochsalzlösung (PBS) gemäß den Anweisungen des Herstellers vor und sterilisieren Sie die Medien durch Autoklavieren.
- Bereiten Sie O/N-Kulturen von Mikroben von Interesse vor, gegen die die Wirksamkeitstests durchgeführt werden, indem isolierte Kolonien von Reinheitsplatten in sterilem TSB inokuliert und bei 35 °C für 18-24 h inkubiert werden (empfohlene Arten: S. aureus, E. coli, P. aeruginosa und C. albicans.)
- Spiking von mikrobiellen Kulturen
- Verdünnen Sie die O/N-Kulturen auf 1,5 × 108 KBE/ml oder entsprechend der Trübung von 0,5 McFarland-Standard (normalerweise eine Verdünnung von 1/10 bis 1/20 für die meisten gesunden Kulturen).
- Bestimmen Sie das geeignete Volumen der Kulturen für das Spiking, indem Sie die Flüssigkeitsaufnahmekapazität des Gewebes wie folgt messen.
- Geben Sie eine Reihe von Volumina der verdünnten Bouillonkultur (z. B. 100-500 μL) auf Stoffmuster (in separaten Petriplatten) und wählen Sie das Volumen so, dass das Stoffmuster das Wasser vollständig aufnimmt und keine Restflüssigkeit hinterlässt. Die Flüssigkeitsaufnahmekapazität unterscheidet sich von der Art und Dicke des Gewebes. Bei normalen Laborkitteln aus Baumwolle sind es etwa 200 μl.
- Erhöhen Sie das Volumen (die oben ermittelte Flüssigkeitshaltekapazität [z. B. 200 μl]) jeder Kultur auf die Proben, die in sterile Petriplatten gelegt werden. Die Anzahl der Muster entspricht der Anzahl der Tests (z. B. getesteter Stoff unmittelbar und nach dem Waschen [und der getesteten Waschzyklen]) und der getesteten antimikrobiellen Wirkung über die Kontaktzeit (nach einer festgelegten Zeit/Tag [z. B. 30 min, 2 h, Tag 1-3]).
Anmerkungen: Verwenden Sie eine Mikropipette mit Aerosolfilterspitzen (um eine Kontamination der Pipette bei späteren Anwendungen zu vermeiden), um die Kulturen auf den Mustern gleichmäßig zu beimpfen. - Verwenden Sie für die Negativkontrolle die gleiche Art von unbehandelten Stoffmustern. Führen Sie die Negativkontrolle für jede entsprechende Testmikrobenspezies, die Kontaktdauer, die verschiedenen Stoffe und die Waschzyklen durch.
- Rückgewinnung von Mikroben durch lebensfähige Keimzahl
- Lassen Sie die geimpften Muster (sowohl behandelte als auch unbehandelte) in den Petriplatten (Deckel angelehnt) bei R/T für die erforderliche Kontaktzeit(en) trocknen, um sie zu testen (z. B. 0 min, 30 min, 60 min usw. oder sogar Tage für Langzeitwirkungen). Fügen Sie immer eine "0 min" hinzu, um eine sofortige Wirkung und neutralisierende Wirksamkeit darzustellen.
- Übertragen Sie die Proben aseptisch in separate sterile Zentrifugenröhrchen (50 ml) und schrauben Sie die Kappen fest.
- Fügen Sie Letheen-Bouillon (alle relevanten neutralisierenden Puffer) hinzu, um eine 1/100-Verdünnung herzustellen (z. B. 19,8 ml für ein Inokulum von 200 μl).
- Die Zentrifugenröhrchen mit Schraubverschlüssen fest verschließen und 1 min bei mittlerer Geschwindigkeit wirbeln.
- Die Suspension wird in nachfolgenden 1/10-Verdünnungen seriell mit dem sterilen PBS verdünnt, so dass die Koloniezahlen der "unbehandelten" Gruppe zu niedrig werden, um gezählt zu werden (TLTC).
- Legen Sie die Verdünnungen (0,1 ml) auf geeignete Medienplatten, die das Wachstum des Mikroorganismus unterstützen (z. B. TSA für Bakterien oder Sabouraud-Dextrose-Agar [SDA] für Pilze) oder andere Medien, die das Wachstum optimieren und einen guten Kontrast bieten, um die Koloniezählung genau zu machen.
- Inkubieren Sie die Bakterienplatten bei 35 °C für 2 Tage und die Pilzplatten bei R/T für 5 Tage.
- Zählen Sie die lebensfähigen KBE direkt mit einem Koloniezähler oder mit einer Bildgebungssoftware (z. B. KBE AI).
- Berechnen Sie die mikrobielle Log-Reduktion (R) aufgrund von antimikrobiellem Gewebe mit Gleichung (2):
R =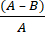 × 100 (2)
× 100 (2)
A = logarithmischer Wert der Anzahl der KBE, die aus unbehandeltem Gewebe gewonnen wurden; B = logarithmischer Wert der Anzahl der KBE, die aus behandeltem Gewebe gewonnen werden.
Ergebnisse
Erstes Screening der synthetisierten NPs
Nach der zweistufigen Öl-in-Wasser-Emulsionstechnik16 wurden die bioaktiven Verbindungen (Carvacrol und Thymol) erfolgreich in Chitosan verkapselt. Dies wurde durch UV-Vis-Spektrophotometrie für die maximale Absorption der jeweiligen bioaktiven Verbindungen im Vergleich zu Kontrollen, bei denen es sich um die Chitosan-NPs ohne bioaktive Verbindungen handelte, bestätigt. Die konstituierten NPs waren homogen und stabil über 12 Monate b...
Diskussion
Die antimikrobielle Wirksamkeit von Bioziden wird konventionell durch quantitative Assays wie die minimale Hemmkonzentration (MHK) und die minimale bakterizide Konzentration (MBC) getestet, bei denen die Bakterien 24 Stunden lang in eine antimikrobielle Flüssigkeit getaucht werden. Diese Assays sind jedoch nicht für beschichtete Gewebe geeignet, bei denen die flüssige Grenzfläche fehlt und die Biozide langsam entlang der Gewebefasern diffundieren. Aus diesem Grund haben sich viele Standard-Stofftests etabliert, wie z...
Offenlegungen
Die Autoren haben keine Interessenkonflikte.
Danksagungen
Diese Studie wurde gefördert durch "Applied Research, Innovation and Entrepreneurship Services" (ARIES), Centennial College, Kanada.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetic acid | Millipore Sigma | 64-19-7 | |
| Antibiotic base agar | BD Difco | DF0270-17-4 | Also known as Antibiotic Medium 2 |
| Antibiotic seed agar | BD Difco | DF0263-17-3 | Also known as Antibiotic Medium 1 |
| Blood Agar (Nutrient Agar with 5% Sheep Blood) | Donated by CFIA | ||
| Bromcresol Purple Lactose Agar | Donated by CFIA | ||
| Candida albicans | ATCC The Global Bioresource Center | ATTC 10231 | |
| Carvacrol | Millipore Sigma | 282197 (CAS# 499-75-2) | |
| Centrifuge Allergra X-22R Centrifuge | Beckman Coulter | Model # X-22R | Refrigerated. Wait at least 20 min or until the temperature reach the set low value (e.g., 4 °C) as the refrigeration takes time. |
| Chitosan Medium Molecular Weight (CS) | Millipore Sigma | 448877 (CAS # 9012-76-4) | |
| Clamshell Heat Press | Intiva | IM1200 | |
| Escherichia coli (E. coli) | ATCC The Global Bioresource Center | ATTC 23725 | |
| Incubator | Thermo Scientific | 1205M34 | |
| Letheen Broth | BD Difco | DF0681-17-7 | Used to neutralize antimicrobial effects. Product from different manufacturers may require to add Polysorbate 80, which is already added in Difco product. |
| Milli Q water | Millipore Sigma | ZR0Q16WW | Deionized water |
| Mueller-Hinton Agar | BD Difco | DF0252-17-6 | |
| Pentasodium tripolyphosphate (TPP) | Millipore Sigma | 238503 (CAS# 7758-29-4) | |
| Phospahte Buffered Saline (PBS) | Thermo Scientific | AM9624 | |
| Pseudomonas aeruginosa | ATCC The Global Bioresource Center | ATTC 9027 | |
| Sabouraud Dextrose Agar | BD Difco | DF0109-17-1 | |
| Shaking incubator/ Thermo shaker | VWR | Model# SHKA2000 | |
| Staphylococcus aureus | ATCC The Global Bioresource Center | ATTC 6538 | |
| Thymol | Millipore Sigma | T0501 (CAS# 89-83-8) | |
| Trypticase Soy Agar | BD Difco | 236950 | |
| Trypticase Soy Broth | BD Difco | 215235 | |
| Tween 80 | Millipore Sigma | STS0204 (CAS # 9005-65-6) | |
| UV-Vis Spectrophometer | Thermo Scientific | GENESYS 30 (840-277000) |
Referenzen
- Schmidt-Emrich, S., et al. Rapid assay to assess bacterial adhesion on textiles. Materials. 9 (4), 249 (2016).
- Qaday, J., et al. Bacterial contamination of medical doctors and students white coats at Kilimanjaro Christian Medical Centre, Moshi, Tanzania. International Journal of Bacteriology. 2015, 507890 (2015).
- Treakle, A. M., et al. Bacterial contamination of health care workers' white coats. American Journal of Infection Control. 37 (2), 101-105 (2009).
- Wong, D., Nye, K., Hollis, P. Microbial flora on doctors' white coats. BMJ. 303 (6817), 1602-1604 (1991).
- Gouveia, I. C. Nanobiotechnology: A new strategy to develop non-toxic antimicrobial textiles for healthcare applications. Journal of Biotechnology. (150), 349 (2010).
- Joshi, M., Ali, S. W., Purwar, R., Rajendran, S. Ecofriendly antimicrobial finishing of textiles using bioactive agents based on natural products. Indian Journal of Fibre and Textile Research. 34, 295-304 (2009).
- Ahmed, H. A., Rajendran, R., Balakumar, C. Nanoherbal coating of cotton fabric to enhance antimicrobial durability. Elixir Applied Chemistry. 45, 7840-7843 (2012).
- Morais, D. S., Guedes, R. M., Lopes, M. A. Antimicrobial approaches for textiles: From research to market. Materials. 9 (6), 498 (2016).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Development of advanced textile finishes using nano-emulsions from herbal extracts for organic cotton fabrics. Coatings. 11 (8), 939 (2021).
- Martínez-Hernández, G. B., Amodio, M. L., Colelli, G. Carvacrol-loaded chitosan nanoparticles maintain quality of fresh-cut carrots. Innovative Food Science & Emerging Technologies. 41, 56-63 (2017).
- Zhang, H. L., Wu, S. H., Tao, Y., Zang, L. Q., Su, Z. Q. Preparation and characterization of water-soluble chitosan nanoparticles as protein delivery system. Journal of Nanomaterials. 2010, 1-5 (2010).
- Patel, R., Gajra, B., Parikh, R. H., Patel, G. Ganciclovir loaded chitosan nanoparticles: preparation and characterization. Journal of Nanomedicine & Nanotechnology. 7 (6), 1-8 (2016).
- Merodio, M., Arnedo, A., Renedo, M. J., Irache, J. M. Ganciclovir-loaded albumin nanoparticles: characterization and in vitro release properties. European Journal of Pharmaceutical Sciences. 12 (3), 251-259 (2001).
- Hsieh, W. C., Chang, C. P., Gao, Y. L. Controlled release properties of Chitosan encapsulated volatile Citronella Oil microcapsules by thermal treatments. Colloids and Surfaces B: Biointerfaces. 53 (2), 209-214 (2006).
- Yoksan, R., Jirawutthiwongchai, J., Arpo, K. Encapsulation of ascorbyl palmitate in chitosan nanoparticles by oil-in-water emulsion and ionic gelation processes. Colloids and Surfaces B: Biointerfaces. 76 (1), 292-297 (2010).
- Keawchaoon, L., Yoksan, R. Preparation, characterization and in vitro release study of carvacrol-loaded chitosan nanoparticles. Colloids and Surfaces B: Biointerfaces. 84 (1), 163-171 (2011).
- Cazedey, E. C. L., Salgado, H. R. N. Development and validation of a microbiological agar assay for determination of orbifloxacin in pharmaceutical preparations. Pharmaceutics. 3 (3), 572-581 (2011).
- Jayapriya, S., Bagyalakshmi, G. Textile antimicrobial testing and standards. International Journal of Textile and Fashion Technology. 4 (1), 2250-2378 (2013).
- AATCC 100. Antibacterial Finishes on Textile Materials: Assessment of Developed from American Association of Textile Chemists and Colorists. AATCC 100. , (2004).
- AATCC 147. Antimicrobial Activity Assessment of Textile Materials: Parallel Streak Method from American Association of Textile Chemists and Colorists. AATCC 147. , (2004).
- Ortelli, S., Costa, A. L., Dondi, M. TiO2 nanosols applied directly on textiles using different purification treatments. Materials. 8 (11), 7988-7996 (2015).
- Poole, K. Pseudomonas aeruginosa: resistance to the max. Frontiers in Microbiology. 2, 65 (2011).
- Pinho, E., Magalhães, L., Henriques, M., Oliveira, R. Antimicrobial activity assessment of textiles: standard methods comparison. Annals of Microbiology. 61 (3), 493-498 (2010).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Novel antimicrobial finishing of organic cotton fabrics using nano-emulsions derived from Karanja and Gokhru plants. Textile Research Journal. 92 (23-24), 5015-5032 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten