Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un tejido antimicrobiano que utiliza nano-herbal encapsulación de aceites esenciales
En este artículo
Resumen
Las batas de laboratorio antimicrobianas evitan la contaminación cruzada de la acumulación de patógenos y los bioderrames accidentales. Aquí, describimos el protocolo para desarrollar un tejido antimicrobiano amigable con la piel utilizando encapsulación nano-herbal y pruebas estándar modificadas para evaluar con precisión la eficacia y la idoneidad para el uso típico de la bata de laboratorio.
Resumen
Las batas de laboratorio son ampliamente utilizadas en laboratorios de riesgo biológico y centros de salud como prendas de protección para prevenir la exposición directa a patógenos, derrames y quemaduras. Estas capas protectoras a base de algodón proporcionan las condiciones ideales para el crecimiento microbiano y los sitios de fijación debido a su naturaleza porosa, capacidad de retención de humedad y retención de calor del cuerpo del usuario. Varios estudios han demostrado la supervivencia de bacterias patógenas en prendas de hospital y batas de laboratorio, actuando como vectores de transmisión microbiana.
Un enfoque común para solucionar estos problemas es la aplicación de agentes antimicrobianos en el acabado textil, pero se han planteado preocupaciones debido a la toxicidad y los efectos ambientales de muchos productos químicos sintéticos. La pandemia en curso también ha abierto una ventana para la investigación de antimicrobianos eficaces y formulaciones ecológicas y libres de tóxicos. Este estudio utiliza dos compuestos bioactivos naturales, carvacrol y timol, encapsulados en nanopartículas de quitosano, que garantizan una protección efectiva contra cuatro patógenos humanos con una reducción de hasta 4 log (99,99%). Estos patógenos se detectan con frecuencia en batas de laboratorio utilizadas en laboratorios de riesgo biológico.
Los tejidos tratados también resistieron hasta 10 ciclos de lavado con una reducción microbiana del 90%, que es suficiente para el uso previsto. Hicimos modificaciones a las pruebas de tela estándar existentes para representar mejor los escenarios típicos del uso de batas de laboratorio. Estos refinamientos permiten una evaluación más precisa de la efectividad de las batas de laboratorio antimicrobianas y la simulación del destino de cualquier derrame microbiano accidental que deba neutralizarse en poco tiempo. Se recomiendan estudios adicionales para investigar la acumulación de patógenos a lo largo del tiempo en batas de laboratorio antimicrobianas en comparación con las capas protectoras regulares.
Introducción
La bata blanca protectora es un elemento obligatorio de equipo de protección personal (EPP) en laboratorios de microbiología y centros de salud, y protege de la exposición directa a patógenos, derrames y quemaduras. Estos abrigos de algodón promueven el crecimiento microbiano debido a muchos factores: la tela tejida proporciona sitios de fijación y aireación, el algodón y el almidón utilizados en el proceso de fabricación junto con las células epiteliales exfoliadas del usuario suministran nutrientes, y la proximidad al usuario proporciona calor y humedad. La acumulación de microbios en los textiles también puede causar problemas de salud como alergias e infección nosocomial, olores desagradables y deterioro de la tela1.
A diferencia de la ropa normal, los abrigos protectores se lavan o desinfectan con poca frecuencia, como se encuentra en muchas encuestas 2,3. Muchos estudios muestran evidencia de batas de laboratorio que actúan como vector de transmisión microbiana y el riesgo de infecciones nosocomiales en el ámbito sanitario2,4, cepas particularmente resistentes3 como Staphylococcus aureus resistente a la meticilina (SARM); por lo tanto, plantean problemas de salud del EPP, que está destinado a proteger de la contaminación microbiana. No hay suficientes estudios transversales sobre infecciones asociadas a batas de laboratorio en el contexto de las instalaciones de nivel de bioseguridad 2 (BSL-2) o los laboratorios de enseñanza de microbiología, pero muchas autoridades reguladoras restringen el uso de batas de laboratorio dentro del nivel de contención. Sin embargo, muchas instituciones académicas en América del Norte luchan por cumplir con los requisitos debido a limitaciones prácticas, como el lavado y el almacenamiento dentro de las instalaciones, los incidentes de usar batas de laboratorio en áreas públicas como cafeterías y bibliotecas son comunes. Una solución práctica a estos problemas es la aplicación de agentes antimicrobianos en el acabado textil.
Los tejidos antimicrobianos están ganando cada vez más popularidad en ropa deportiva, ropa deportiva y calcetines, destinados principalmente a reducir el olor corporal. Sin embargo, el uso de estos tejidos no es común en el desarrollo de EPP, a excepción de algunas máscaras de algodón recubiertas de plata y prendas de cuidado de la salud5. Informamos sobre el desarrollo de un tejido antimicrobiano para batas de laboratorio, que inhibe los patógenos comunes que se encuentran en los laboratorios BSL-2 y brinda una protección efectiva contra la contaminación cruzada de patógenos comunes.
Actualmente, una variedad de telas y acabados antimicrobianos están disponibles en el mercado, pero la mayoría de estos utilizan partículas coloidales de metales pesados (por ejemplo, plata, cobre, zinc), organometálicos o productos químicos sintéticos como triclosán y compuestos de amonio cuaternario, que no son respetuosos con el medio ambiente1 y pueden provocar problemas de salud como irritación de la piel y alergias6. Algunas formulaciones sintéticas plantean preocupaciones debido a microbios no objetivo, como la flora normal o la inducción de resistencia a los antimicrobianos (RAM). La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) regula los tejidos antimicrobianos comerciales, que deben ser no tóxicos para el usuario y libres de ecotoxicidad. Por lo tanto, son preferibles los tejidos antimicrobianos basados en biocidas naturales que inhiben un amplio espectro de microbios. Los aceites esenciales (OE) se utilizan ampliamente como agentes antimicrobianos y terapéuticos, pero su uso en el acabado antimicrobiano es limitado debido a su durabilidad 6,7,8. Según nuestro conocimiento e investigación de mercado sobre el acabado nano-herbal8, no hay tejido antimicrobiano a base de hierbas disponible comercialmente. Esto se debe a que los recubrimientos sintéticos son fáciles de fabricar y tienen una larga durabilidad. Algunos textiles recubiertos de nano-hierbas reportados solo con fines de investigación incluyen neem7, moringa 9 y hojas de curry9.
El presente estudio utiliza dos componentes bioactivos extraídos de los OE de orégano, carvacrol y timol, que son efectivos contra una amplia gama de patógenos y virus bacterianos, pero generalmente son reconocidos como seguros para los humanos10. Sin embargo, estos componentes bioactivos son volátiles y, por lo tanto, su potencial antimicrobiano es de corta duración si se aplican directamente al tejido. La encapsulación nano-herbal es un proceso en el que los componentes bioactivos o medicamentos se cargan dentro de una cubierta polimérica que protege el núcleo de la degradación ambiental y, por lo tanto, mejora la vida útil. Además, el pequeño tamaño de las partículas poliméricas, que generalmente oscilan entre 10 nm y 100 nm, mejora la eficacia de la aplicación y ralentiza la liberación de los compuestos bioactivos en el tejido. Estos compuestos bioactivos se utilizan para diversos fines, como la conservación de alimentos10, pero no para el recubrimiento textil.
Entre muchos encapsulantes poliméricos, el quitosano es un candidato atractivo debido a muchos de sus atributos, como la no toxicidad, la biodegradabilidad, la mucoadhesividad y la biocompatibilidad11. Es un polisacárido natural, obtenido por el proceso de desacetilación de la quitina, que se encuentra en conchas marinas y paredes celulares fúngicas. Se utiliza en aplicaciones bioquímicas y de conservación de alimentos, como la administración de fármacos o proteínas 11,12,13, liberación controlada 14 y películas antimicrobianas 10. El quitosano no es fácilmente soluble en agua, pero forma una suspensión coloidal en medios ácidos. Las moléculas bioactivas se cargan en nanopartículas de quitosano (NP) mediante un método simple de gelificación iónica de dos pasos14,15,16. En este proceso, los compuestos bioactivos hidrófobos como el carvacrol y el timol forman una emulsión de aceite en agua, que es ayudada por un surfactante, Tween 80. Posteriormente, un compuesto polianiónico, tripolifosfato pentasódico (TPP), se utiliza para formar los enlaces cruzados entre los grupos amino a lo largo de las moléculas policatiónicas de polímero y los grupos fosfato de las moléculas TPP para estabilizar el complejo. Este proceso de complejación solidifica los compuestos bioactivos dentro de la matriz de quitosano, que posteriormente se purifica y se recubre en muestras de algodón para producir tejido antimicrobiano.
Las nanoformulaciones deben probarse primero para determinar la eficacia antimicrobiana en forma de emulsión antes de aplicarlas al tejido. Esto se puede evaluar convenientemente mediante un método cualitativo, como la difusión del disco de Kirby-Bauer, la difusión de pozos y el ensayo de placa cilíndrica. Sin embargo, el ensayo de placa cilíndrica17 proporciona la flexibilidad para cargar volúmenes variables de la formulación y comparar la zona de espacio libre. En este método, las formulaciones antimicrobianas se cargan en cilindros de acero inoxidable y se colocan sobre una capa de agar blando, que se inocula con el microorganismo o patógeno de prueba. El diámetro de la zona de aclaramiento producida contra el organismo de ensayo es proporcional al potencial inhibitorio de la formulación antimicrobiana y, por lo tanto, puede utilizarse como alternativa a los métodos de dilución en caldo. Sin embargo, el tamaño de las zonas claras es solo una medida comparativa o cualitativa dentro de una placa específica a menos que se mantengan estándares específicos. Los agentes antimicrobianos actúan contra los patógenos ya sea inhibiendo su crecimiento (biostático) o matando las células (biocida), lo que puede cuantificarse por concentración inhibitoria mínima (CMI) y concentración bactericida mínima (CMB), respectivamente. Sin embargo, la eficacia y el comportamiento de los productos químicos bioactivos son diferentes en sus formulaciones (estado líquido) y cuando se recubren sobre un sustrato como un tejido18. Esto se debe a que múltiples factores juegan un papel en la eficacia, como la estabilidad de la adherencia de los agentes antimicrobianos a la tela, el contenido de humedad, el tipo de sustrato y la adherencia de los microbios. Si el propósito previsto es solo la actividad bacteriostática, un ensayo cualitativo como el "Método de rayas paralelas"19 puede proporcionar una evaluación relativamente rápida y fácil de la formulación antimicrobiana difusible. Sin embargo, si se deben determinar los efectos bactericidas, se puede emplear la "Evaluación de acabados antibacterianos en materiales textiles"20 , que proporciona la reducción logarítmica del patógeno pinchado.
Protocolo
1. Preparación de nanopartículas
- Encapsulación nano-herbal
- Prepare 50 ml de ácido acético al 1% (v/v).
PRECAUCIÓN: El ácido acético glacial es un irritante, que puede causar quemaduras graves en la piel y daño ocular. Use una bata de laboratorio completa, guantes de nitrilo y gafas, y trabaje bajo una campana extractora. - Preparar solución de quitosano (1,2% p/v) disolviendo 0,6 g de copos de quitosano (peso molecular medio) en 50 ml de ácido acético al 1% (preparado anteriormente). Agitar durante la noche (O/N) a temperatura ambiente (R/T) para obtener una emulsión homogénea.
- Añadir 0,5 g de Tween 80 y agitar (1.000 rpm) a 60 °C durante 2 h para obtener una solución homogénea. Llevar la solución a R/T antes de añadir compuestos bioactivos (carvacrol o timol).
- Añadir 0,75 g de carvacrol (o timol) gota a gota o gradualmente mientras se agita (1.000 rpm) la mezcla durante 20 minutos a R/T. La relación en peso del quitosano al compuesto bioactivo es de 1:1.25.
- Agregue 50 ml (0.5% p/v) de TPP gota a gota a la mezcla mientras remueve a R/T. Continúe revolviendo durante 30 minutos para obtener una emulsión homogénea.
- Preparar un control negativo siguiendo el mismo procedimiento pero sin la adición de compuestos bioactivos.
- Prepare 50 ml de ácido acético al 1% (v/v).
- Purificación
- Centrifugar la emulsión a 10.000 × g durante 30 min a 4 °C y recoger las NPs formadas (pellet) después de decantar el sobrenadante. Reserve el sobrenadante para probar la eficacia de encapsulación.
- Lavar las partículas (a partir del paso 1.2.1) utilizando Tween 80 acuoso (1% v/v) con el doble del volumen de pellets formados para eliminar los compuestos bioactivos libres o no unidos. Asegúrese de perturbar el pellet mediante vórtice hasta que se forme una solución homogénea en cada paso de lavado.
- Lave las partículas (del paso 1.2.2) con agua desionizada dos veces para eliminar las impurezas.
- Reconstituir las NP resuspendiendo el pellet (a partir de la etapa 1.2.3) en 30 ml de agua desionizada. Conservar las NP a 4 °C durante un máximo de 6 meses.
NOTA: El experimento se puede pausar en esta etapa.
- Caracterización
- Diluir las NP en agua desionizada hasta que las lecturas ultravioleta-visibles (UV-Vis) entre 250 y 400 nm caigan dentro del rango (absorbancia >1).
- Registre los espectros de absorción UV-Vis de las NP en las longitudes de onda que van desde 250 a 400 nm utilizando un espectrofotómetro UV-Vis.
- Almacene una alícuota (1 ml) de NP en R/T durante un intervalo de duraciones (p. ej., de 1 a 6 meses) y pruebe el efecto antimicrobiano mediante el método de la placa cilíndrica junto con una muestra fresca.
- Recubrimiento sobre tejido
- Aplicar NPs sobre un tejido de algodón utilizando un método de curado en seco 7,21.
- Sumerja las muestras de tela en la solución que contiene NP mezcladas con un aglutinante de tela durante 3 minutos hasta que estén empapadas. Luego, pase las muestras a través de un relleno de laboratorio de dos rodillos para eliminar el exceso de líquido.
- Secar al horno las muestras a 100 °C durante 30 min y curar a 130 °C durante 10 min.
- Finalmente, lave las muestras en un baño de ultrasonido durante 15 minutos para eliminar las NP no unidas.
NOTA: Alternativamente, siga el método simplificado que se describe a continuación.
- Corte la tela de algodón (o las muestras de bata de laboratorio) en cuadrados de 10 cm x 10 cm.
- Sumerja las piezas cortadas en 2 mL del NP sintetizado (10%) en un recipiente de plástico (12 cm x 12 cm) durante 2 min a R/T. Eliminar el exceso de líquido secando al aire.
- Presione con calor a 100 °C durante 3 min para unir los NP.
- Eliminar las NP no unidas enjuagando en Tween 80 acuoso (2% p/v) y secar en el horno a 100 °C durante 30 min.
NOTA: Este tejido antimicrobiano se puede almacenar durante 2 años en R/T.
- Aplicar NPs sobre un tejido de algodón utilizando un método de curado en seco 7,21.
- Durabilidad del lavado
- Corte la tela en muestras cuadradas de 50 mm x 50 mm.
- Coloque las muestras en 50 ml de agua tibia del grifo (40 °C) en un recipiente de vidrio/plástico y agregue dos gotas de detergente regular (no antimicrobiano).
- Enjuague en un agitador de plataforma oscilante o agitador magnético durante 30 minutos.
- Secar al aire o incubar a 60 °C durante 2 h y probar la eficacia antimicrobiana.
2. Ensayo de placa cilíndrica para cribado de nanopartículas
- Prepare agar tripticasa de soja (TSA), caldo de tripticasa de soja (TSB), agar base antibiótico (ABA) y agar de semilla antibiótico (ASA), de acuerdo con las instrucciones del fabricante, y esterilice el medio en autoclave a 121 °C a 15 psi durante 15 min.
- Subcultivar los microbios (de stock) de interés, contra los cuales se realizan las pruebas de eficacia, en placas de TSA recién preparadas (o cualquier medio apropiado) por el método de placa de rayas de tres vías e incubar para producir placas de pureza. (Especies recomendadas: S. aureus, E. coli, P. aeruginosa y C. albicans.)
- Inocular los cultivos de placas de pureza fresca en TSB (tubos de 10 ml) a 35 °C O/N con agitación moderada (100-200 rpm).
- Alícuota 5,0 mL de AAS fundido en cada uno de los tubos de ensayo. El número de tubos corresponde al número de microorganismos probados.
- Vierta 20 ml de ABA fundido preesterilizado en cada placa de Petri (100 mm x 20 mm) asépticamente para formar la capa base. El número de placas de agar corresponde al número de microorganismos a analizar. Espere hasta que los medios se solidifiquen.
- Después de la solidificación de la capa base, inocular cada ASA fundido con un cultivo nocturno desde el paso 2.3 (1,0 ml, precalentado a 35 °C) e inmediatamente transferir el contenido (mezcla de ASA y cultivo) a la superficie de una placa ABA. Agite la placa para distribuir la capa de agar fundido de manera uniforme. Asegúrese de que la capa de semillas se vea lisa y libre de protuberancias o burbujas.
- Coloque hasta seis cilindros de acero inoxidable (6 mm x 6 mm x 10 mm; preesterilizados), espaciados uniformemente en un patrón hexagonal, por placa de agar utilizando un par de pinzas estériles (Figura 1).
- Cargue los cilindros con las NP sintetizadas de diferentes volúmenes (30 μL, 50 μL, 75 μL y 100 μL) para detectar efectos antimicrobianos. El control negativo es el que no tiene compuestos bioactivos.
- Incubar patógenos bacterianos comunes (p. ej., E. coli, S. aureus, P. aeruginosa) a 35 °C durante 24 h y especies fúngicas (p. ej., C. albicans) a R/T durante 3 días.
- Medir el diámetro de la zona clara y comparar la efectividad de las NP sintetizadas.
NOTA: Esta prueba se puede utilizar para preseleccionar las mejores NP para ser recubiertas en la tela.
3. Método de raya paralela (modificado de AATCC 147)
- Preparación de materiales
- Corte la tela tratada con NP en muestras de 50 mm x 25 mm.
- Prepare el agar Mueller-Hinton (MHA), TSA y TSB, de acuerdo con las instrucciones del fabricante, y esterilice el medio en autoclave a 121 °C a 15 psi durante 15 min.
- Subcultivar los microbios (de stock) de interés, contra los cuales se realizan las pruebas de eficacia, en placas de TSA recién preparadas (o cualquier medio apropiado) por el método de placa de rayas de tres vías e incubar a 35 °C durante 2 días para manchas bacterianas y en R/T durante 5 días para cepas de hongos para producir placas de pureza. (Especies recomendadas: S. aureus, E. coli, P. aeruginosa y C. albicans.)
- Picos de cultivos microbianos
- Inocular los cultivos de placas de pureza fresca en TSB (tubos de 10 ml) a 35 °C O/N con agitación moderada (100-200 rpm).
- Diluir los cultivos O/N a 1,5 × 108 unidades formadoras de colonias (UFC)/ml o correspondientes a la turbidez del estándar de McFarland de 0,5 (generalmente una dilución de 1/10 a 1/20 para la mayoría de los cultivos sanos).
- Inocular el cultivo diluido anterior utilizando un asa estéril de 4 mm de la siguiente manera. Cargue un bucle de cultivo de caldo y transfiéralo a la superficie de la placa de agar MHA haciendo cinco rayas paralelas, cada una de 6 cm de longitud y 1 cm de distancia, de acuerdo con la Figura 2. No vuelva a llenar el bucle.
- Presione suavemente la muestra de tela con una espátula estéril a través de las cinco rayas para que la tela esté en el centro y toque las cinco líneas de rayas. Incubar a 35 °C durante 24 h.
- Evaluación cualitativa de la eficacia antimicrobiana
- Examine la placa incubada para detectar la interrupción del crecimiento a lo largo de las rayas más allá de los bordes de la tela (la zona clara indica inhibición del crecimiento).
- Calcule el ancho promedio de una zona de inhibición a lo largo de la línea de raya (W) a cada lado de la muestra de tela usando la ecuación (1).
W = (T - D)/2 (1)
W = anchura de la zona despejada; T = longitud total de la zona libre, incluida la anchura de la muestra; D = anchura de la muestra de tejido (25 mm).
4. Método cuantitativo de reducción logarítmica (modificado de AATCC 100)
- Preparación experimental
- Corte la tela en muestras cuadradas de 50 mm x 50 mm.
- Prepare TSA, TSB, caldo Letheen y solución salina tamponada con fosfato (PBS), de acuerdo con las instrucciones del fabricante, y esterilice los medios en autoclave.
- Preparar cultivos O/N de microbios de interés, contra los cuales se realizan las pruebas de eficacia, inoculando colonias aisladas a partir de placas de pureza en TSB estéril e incubando a 35 °C durante 18-24 h. (Especies recomendadas: S. aureus, E. coli, P. aeruginosa y C. albicans.)
- Picos de cultivos microbianos
- Diluir los cultivos O/N a 1,5 × 108 UFC/ml o correspondiente a la turbidez del estándar de McFarland de 0,5 (generalmente una dilución de 1/10 a 1/20 para la mayoría de los cultivos sanos).
- Determine el volumen apropiado de cultivos para el picoteo midiendo la capacidad de retención de líquido del tejido de la siguiente manera.
- Agregue una serie de volúmenes del cultivo de caldo diluido (por ejemplo, 100-500 μL) en muestras de tela (en placas de Petri separadas) y elija el volumen de tal manera que la muestra de tela absorba el agua completamente y no deje líquido residual/libre. La capacidad de retención del líquido difiere del tipo y grosor de la tela. Para batas de laboratorio de algodón regulares, es de aproximadamente 200 μL.
- Aumentar el volumen (capacidad de retención de líquido determinada anteriormente [por ejemplo, 200 μL]) de cada cultivo en las muestras colocadas en placas de Petri estériles. El número de muestras corresponde al número de pruebas (por ejemplo, tela probada inmediatamente y después del lavado [y los ciclos de lavado probados]), y los efectos antimicrobianos probados durante el tiempo de contacto (después de una hora / día establecidos [por ejemplo, 30 min, 2 h, día 1-3]).
NOTA: Utilice una micropipeta con puntas de filtro de aerosol (para evitar la contaminación de la pipeta en usos posteriores) para inocular los cultivos en las muestras con distribución uniforme. - Para el control negativo, use el mismo tipo de muestras de tela sin tratar. Realice el control negativo para cada especie microbiana de prueba correspondiente, período de contacto, diferentes tejidos y ciclos de lavado.
- Recuperación de microbios mediante recuentos viables en placa
- Permita que las muestras inoculadas (tanto tratadas como no tratadas) se sequen al aire dentro de las placas de Petri (tapas entreabiertas) en R/T durante el período de contacto requerido para ser probado (por ejemplo, 0 min, 30 min, 60 min, etc., o incluso días para efectos a largo plazo). Incluye siempre un "minuto 0" para representar un efecto inmediato y una eficacia neutralizante.
- Transfiera las muestras asépticamente para separar los tubos de centrífuga estériles (50 ml) y atornille bien las tapas.
- Agregue caldo Letheen (cualquier tampón neutralizante relevante) para hacer una dilución de 1/100 (por ejemplo, 19.8 ml para un inóculo de 200 μL).
- Cierre firmemente los tubos de la centrífuga con tapones de rosca y vórtice durante 1 minuto a velocidad media.
- Diluir en serie la suspensión con el PBS estéril en diluciones posteriores de 1/10, de modo que los recuentos de colonias del grupo "no tratado" se vuelvan demasiado bajos para contar (TLTC).
- Coloque las diluciones (0,1 ml) en placas de medios apropiados, que apoyen el crecimiento del microorganismo (por ejemplo, TSA para bacterias o agar dextrosa Sabouraud [SDA] para hongos) o cualquier medio que optimice el crecimiento y proporcione un buen contraste para que el conteo de colonias sea preciso.
- Incubar las placas bacterianas a 35 °C durante 2 días y las placas fúngicas a R/T durante 5 días.
- Cuente las UFC viables directamente usando un contador de colonias o usando software de imágenes (por ejemplo, UFC AI).
- Calcule la reducción logarítmica microbiana (R) debida al tejido antimicrobiano utilizando la ecuación (2):
R =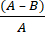 × 100 (2)
× 100 (2)
A = valor logarítmico del número de UFC recuperadas del tejido no tratado; B = valor logarítmico del número de UFC recuperadas del tejido tratado.
Resultados
Cribado inicial de las NPs sintetizadas
Siguiendo la técnica de emulsión de aceite en agua de dos pasos16, los compuestos bioactivos (carvacrol y timol) fueron encapsulados con éxito en quitosano. Esto fue confirmado por espectrofotometría UV-Vis para la absorción máxima de los respectivos compuestos bioactivos en comparación con los controles, que fueron los NP de quitosano sin ningún compuesto bioactivo. Los PN constituidos fueron homogéneos y estables durante 12 mes...
Discusión
La eficacia antimicrobiana de los biocidas se prueba convencionalmente mediante ensayos cuantitativos, como la concentración inhibitoria mínima (CMI) y la concentración bactericida mínima (CMM), en los que las bacterias se sumergen en un líquido antimicrobiano durante 24 h. Sin embargo, estos ensayos no son adecuados para tejidos recubiertos, donde falta la interfaz líquida y los biocidas se difunden lentamente a lo largo de las fibras del tejido. Por lo tanto, se han establecido muchas pruebas de tejido estándar,...
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Este estudio fue financiado por "Applied Research, Innovation and Entrepreneurship Services" (ARIES), Centennial College, Canadá.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetic acid | Millipore Sigma | 64-19-7 | |
| Antibiotic base agar | BD Difco | DF0270-17-4 | Also known as Antibiotic Medium 2 |
| Antibiotic seed agar | BD Difco | DF0263-17-3 | Also known as Antibiotic Medium 1 |
| Blood Agar (Nutrient Agar with 5% Sheep Blood) | Donated by CFIA | ||
| Bromcresol Purple Lactose Agar | Donated by CFIA | ||
| Candida albicans | ATCC The Global Bioresource Center | ATTC 10231 | |
| Carvacrol | Millipore Sigma | 282197 (CAS# 499-75-2) | |
| Centrifuge Allergra X-22R Centrifuge | Beckman Coulter | Model # X-22R | Refrigerated. Wait at least 20 min or until the temperature reach the set low value (e.g., 4 °C) as the refrigeration takes time. |
| Chitosan Medium Molecular Weight (CS) | Millipore Sigma | 448877 (CAS # 9012-76-4) | |
| Clamshell Heat Press | Intiva | IM1200 | |
| Escherichia coli (E. coli) | ATCC The Global Bioresource Center | ATTC 23725 | |
| Incubator | Thermo Scientific | 1205M34 | |
| Letheen Broth | BD Difco | DF0681-17-7 | Used to neutralize antimicrobial effects. Product from different manufacturers may require to add Polysorbate 80, which is already added in Difco product. |
| Milli Q water | Millipore Sigma | ZR0Q16WW | Deionized water |
| Mueller-Hinton Agar | BD Difco | DF0252-17-6 | |
| Pentasodium tripolyphosphate (TPP) | Millipore Sigma | 238503 (CAS# 7758-29-4) | |
| Phospahte Buffered Saline (PBS) | Thermo Scientific | AM9624 | |
| Pseudomonas aeruginosa | ATCC The Global Bioresource Center | ATTC 9027 | |
| Sabouraud Dextrose Agar | BD Difco | DF0109-17-1 | |
| Shaking incubator/ Thermo shaker | VWR | Model# SHKA2000 | |
| Staphylococcus aureus | ATCC The Global Bioresource Center | ATTC 6538 | |
| Thymol | Millipore Sigma | T0501 (CAS# 89-83-8) | |
| Trypticase Soy Agar | BD Difco | 236950 | |
| Trypticase Soy Broth | BD Difco | 215235 | |
| Tween 80 | Millipore Sigma | STS0204 (CAS # 9005-65-6) | |
| UV-Vis Spectrophometer | Thermo Scientific | GENESYS 30 (840-277000) |
Referencias
- Schmidt-Emrich, S., et al. Rapid assay to assess bacterial adhesion on textiles. Materials. 9 (4), 249 (2016).
- Qaday, J., et al. Bacterial contamination of medical doctors and students white coats at Kilimanjaro Christian Medical Centre, Moshi, Tanzania. International Journal of Bacteriology. 2015, 507890 (2015).
- Treakle, A. M., et al. Bacterial contamination of health care workers' white coats. American Journal of Infection Control. 37 (2), 101-105 (2009).
- Wong, D., Nye, K., Hollis, P. Microbial flora on doctors' white coats. BMJ. 303 (6817), 1602-1604 (1991).
- Gouveia, I. C. Nanobiotechnology: A new strategy to develop non-toxic antimicrobial textiles for healthcare applications. Journal of Biotechnology. (150), 349 (2010).
- Joshi, M., Ali, S. W., Purwar, R., Rajendran, S. Ecofriendly antimicrobial finishing of textiles using bioactive agents based on natural products. Indian Journal of Fibre and Textile Research. 34, 295-304 (2009).
- Ahmed, H. A., Rajendran, R., Balakumar, C. Nanoherbal coating of cotton fabric to enhance antimicrobial durability. Elixir Applied Chemistry. 45, 7840-7843 (2012).
- Morais, D. S., Guedes, R. M., Lopes, M. A. Antimicrobial approaches for textiles: From research to market. Materials. 9 (6), 498 (2016).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Development of advanced textile finishes using nano-emulsions from herbal extracts for organic cotton fabrics. Coatings. 11 (8), 939 (2021).
- Martínez-Hernández, G. B., Amodio, M. L., Colelli, G. Carvacrol-loaded chitosan nanoparticles maintain quality of fresh-cut carrots. Innovative Food Science & Emerging Technologies. 41, 56-63 (2017).
- Zhang, H. L., Wu, S. H., Tao, Y., Zang, L. Q., Su, Z. Q. Preparation and characterization of water-soluble chitosan nanoparticles as protein delivery system. Journal of Nanomaterials. 2010, 1-5 (2010).
- Patel, R., Gajra, B., Parikh, R. H., Patel, G. Ganciclovir loaded chitosan nanoparticles: preparation and characterization. Journal of Nanomedicine & Nanotechnology. 7 (6), 1-8 (2016).
- Merodio, M., Arnedo, A., Renedo, M. J., Irache, J. M. Ganciclovir-loaded albumin nanoparticles: characterization and in vitro release properties. European Journal of Pharmaceutical Sciences. 12 (3), 251-259 (2001).
- Hsieh, W. C., Chang, C. P., Gao, Y. L. Controlled release properties of Chitosan encapsulated volatile Citronella Oil microcapsules by thermal treatments. Colloids and Surfaces B: Biointerfaces. 53 (2), 209-214 (2006).
- Yoksan, R., Jirawutthiwongchai, J., Arpo, K. Encapsulation of ascorbyl palmitate in chitosan nanoparticles by oil-in-water emulsion and ionic gelation processes. Colloids and Surfaces B: Biointerfaces. 76 (1), 292-297 (2010).
- Keawchaoon, L., Yoksan, R. Preparation, characterization and in vitro release study of carvacrol-loaded chitosan nanoparticles. Colloids and Surfaces B: Biointerfaces. 84 (1), 163-171 (2011).
- Cazedey, E. C. L., Salgado, H. R. N. Development and validation of a microbiological agar assay for determination of orbifloxacin in pharmaceutical preparations. Pharmaceutics. 3 (3), 572-581 (2011).
- Jayapriya, S., Bagyalakshmi, G. Textile antimicrobial testing and standards. International Journal of Textile and Fashion Technology. 4 (1), 2250-2378 (2013).
- AATCC 100. Antibacterial Finishes on Textile Materials: Assessment of Developed from American Association of Textile Chemists and Colorists. AATCC 100. , (2004).
- AATCC 147. Antimicrobial Activity Assessment of Textile Materials: Parallel Streak Method from American Association of Textile Chemists and Colorists. AATCC 147. , (2004).
- Ortelli, S., Costa, A. L., Dondi, M. TiO2 nanosols applied directly on textiles using different purification treatments. Materials. 8 (11), 7988-7996 (2015).
- Poole, K. Pseudomonas aeruginosa: resistance to the max. Frontiers in Microbiology. 2, 65 (2011).
- Pinho, E., Magalhães, L., Henriques, M., Oliveira, R. Antimicrobial activity assessment of textiles: standard methods comparison. Annals of Microbiology. 61 (3), 493-498 (2010).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Novel antimicrobial finishing of organic cotton fabrics using nano-emulsions derived from Karanja and Gokhru plants. Textile Research Journal. 92 (23-24), 5015-5032 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados