Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un tissu antimicrobien utilisant l’encapsulation nano-végétale d’huiles essentielles
Dans cet article
Résumé
Les sarraus de laboratoire antimicrobiens préviennent la contamination croisée de l’accumulation d’agents pathogènes et des biodéversements accidentels. Ici, nous décrivons le protocole de développement d’un tissu antimicrobien respectueux de la peau en utilisant l’encapsulation nano-végétale et des tests standard modifiés pour évaluer avec précision l’efficacité et l’adéquation à une utilisation typique de la blouse de laboratoire.
Résumé
Les blouses de laboratoire sont largement utilisées dans les laboratoires à risques biologiques et les établissements de soins de santé comme vêtements de protection pour prévenir l’exposition directe aux agents pathogènes, les déversements et les brûlures. Ces manteaux protecteurs à base de coton offrent des conditions idéales pour la croissance microbienne et les sites de fixation en raison de leur nature poreuse, de leur capacité de rétention de l’humidité et de la rétention de la chaleur du corps de l’utilisateur. Plusieurs études ont démontré la survie de bactéries pathogènes sur les vêtements d’hôpital et les sarraus de laboratoire, agissant comme vecteurs de transmission microbienne.
Une approche courante pour résoudre ces problèmes est l’application d’agents antimicrobiens dans la finition des textiles, mais des préoccupations ont été soulevées en raison de la toxicité et des effets environnementaux de nombreux produits chimiques synthétiques. La pandémie actuelle a également ouvert une fenêtre pour la recherche d’antimicrobiens efficaces et de formulations écologiques et sans toxicité. Cette étude utilise deux composés bioactifs naturels, le carvacrol et le thymol, encapsulés dans des nanoparticules de chitosane, qui garantissent une protection efficace contre quatre agents pathogènes humains avec une réduction allant jusqu’à 4 log (99,99%). Ces agents pathogènes sont fréquemment détectés dans les blouses de laboratoire utilisées dans les laboratoires présentant des risques biologiques.
Les tissus traités ont également résisté jusqu’à 10 cycles de lavage avec une réduction microbienne de 90%, ce qui est suffisant pour l’utilisation prévue. Nous avons apporté des modifications aux tests de tissus standard existants afin de mieux représenter les scénarios typiques d’utilisation de la blouse de laboratoire. Ces améliorations permettent une évaluation plus précise de l’efficacité des sarraus de laboratoire antimicrobiens et la simulation du devenir de tout déversement microbien accidentel qui doit être neutralisé dans un court laps de temps. D’autres études sont recommandées pour étudier l’accumulation d’agents pathogènes au fil du temps sur les sarraus de laboratoire antimicrobiens par rapport aux blouses protectrices ordinaires.
Introduction
La blouse blanche de protection est un équipement de protection individuelle (EPI) obligatoire dans les laboratoires de microbiologie et les établissements de santé, et elle protège contre l’exposition directe aux agents pathogènes, aux déversements et aux brûlures. Ces manteaux de coton favorisent la croissance microbienne en raison de nombreux facteurs - le tissu tissé fournit des sites de fixation et d’aération, le coton et l’amidon utilisés dans le processus de fabrication ainsi que les cellules épithéliales exfoliées de l’utilisateur fournissent des nutriments, et la proximité de l’utilisateur donne chaleur et humidité. L’accumulation de microbes sur les textiles peut également causer des problèmes de santé tels que des allergies et des infections nosocomiales, des odeurs désagréables et la détérioration des tissus1.
Contrairement aux vêtements ordinaires, les manteaux de protection sont rarement lavés ou désinfectés, comme on le constate dans de nombreuses enquêtes 2,3. De nombreuses études montrent que les blouses de laboratoire agissent comme vecteur de transmission microbienne et le risque d’infections nosocomiales en milieu de soins2,4, en particulier les souches résistantes3 telles que Staphylococcus aureus résistant à la méthicilline (SARM); ainsi, ils soulèvent des préoccupations pour la santé de l’EPI, qui est destiné à protéger contre la contamination microbienne. Il n’y a pas assez d’études transversales sur les infections associées à la blouse de laboratoire dans le contexte des installations de niveau de biosécurité 2 (BSL-2) ou des laboratoires d’enseignement en microbiologie, mais de nombreux organismes de réglementation restreignent l’utilisation des sarraus de laboratoire dans le niveau de confinement. Cependant, de nombreux établissements universitaires en Amérique du Nord ont du mal à répondre aux exigences en raison de contraintes pratiques, telles que le lavage et le stockage à l’intérieur de l’installation, les incidents de port de sarraus de laboratoire dans les espaces publics tels que les cafétérias et les bibliothèques sont courants. Une solution pratique à ces problèmes est l’application d’agents antimicrobiens dans la finition textile.
Les tissus antimicrobiens gagnent en popularité dans les vêtements de sport, les vêtements de sport et les chaussettes, principalement destinés à réduire les odeurs corporelles. Cependant, l’utilisation de ces tissus n’est pas courante dans le développement des EPI, à l’exception de certains masques en coton enduits d’argent et vêtements de soins de santé5. Nous signalons le développement d’un tissu antimicrobien pour les blouses de laboratoire, qui inhibe les agents pathogènes courants trouvés dans les laboratoires BSL-2 et rend la protection efficace contre la contamination croisée des agents pathogènes courants.
Actuellement, une variété de tissus et de finitions antimicrobiens sont disponibles sur le marché, mais la plupart d’entre eux utilisent des particules colloïdales de métaux lourds (par exemple, argent, cuivre, zinc), des composés organométalliques ou des produits chimiques synthétiques tels que le triclosan et les composés d’ammonium quaternaire, qui ne sont pas respectueux de l’environnement1 et peuvent entraîner des problèmes de santé tels que des irritations cutanées et des allergies6. Certaines formulations synthétiques posent des problèmes en raison de microbes non ciblés, tels que la flore normale ou l’induction de la résistance aux antimicrobiens (RAM). La Food and Drug Administration (FDA) des États-Unis réglemente les tissus antimicrobiens commerciaux, qui doivent être non toxiques pour l’utilisateur et exempts d’écotoxicité. Par conséquent, les tissus antimicrobiens à base de biocides naturels qui inhibent un large spectre de microbes sont préférables. Les huiles essentielles (OE) sont largement utilisées comme agents antimicrobiens et thérapeutiques, mais leur utilisation dans la finition antimicrobienne est limitée en raison de leur durabilité 6,7,8. D’après nos connaissances et nos études de marché sur la finition nano-herboriale8, aucun tissu antimicrobien à base de plantes n’est disponible dans le commerce. En effet, les revêtements synthétiques sont faciles à fabriquer et ont une longue durabilité. Quelques textiles nano-enduits de plantes signalés uniquement à des fins de recherche comprennent le neem7, le moringa 9 et les feuillesde curry9.
La présente étude utilise deux composants bioactifs extraits des OE de l’origan, le carvacrol et le thymol, qui sont efficaces contre un large éventail d’agents pathogènes bactériens et de virus, mais qui sont généralement reconnus comme sûrs pour les humains10. Cependant, ces composants bioactifs sont volatils et, par conséquent, leur potentiel antimicrobien est de courte durée s’ils sont appliqués directement sur le tissu. L’encapsulation nano-végétale est un processus dans lequel des composants bioactifs ou des médicaments sont chargés à l’intérieur d’une coque polymère qui protège le noyau de la dégradation de l’environnement et améliore ainsi la durée de conservation. De plus, la petite taille des particules polymères, qui vont généralement de 10 nm à 100 nm, améliore l’efficacité de l’application et ralentit la libération des composés bioactifs sur le tissu. Ces composés bioactifs sont utilisés à diverses fins, telles que la conservation des aliments10, mais pas pour le revêtement textile.
Parmi de nombreux encapsulants polymères, le chitosane est un candidat attrayant en raison de bon nombre de ses attributs, tels que la non-toxicité, la biodégradabilité, la mucoadhésivité et la biocompatibilité11. C’est un polysaccharide naturel, obtenu par le processus de désacétylation de la chitine, qui se trouve dans les coquillages et les parois cellulaires fongiques. Il est utilisé dans des applications biochimiques et de conservation des aliments telles que l’administration de médicaments ou de protéines 11,12,13, la libération contrôlée 14 et les films antimicrobiens 10. Le chitosane n’est pas facilement soluble dans l’eau mais forme une suspension colloïdale dans les milieux acides. Les molécules bioactives sont chargées dans les nanoparticules de chitosane (NP) par une méthode simple de gélification ionique en deux étapes14,15,16. Dans ce processus, les composés bioactifs hydrophobes tels que le carvacrol et le thymol forment une émulsion huile dans eau, qui est aidée par un tensioactif, Tween 80. Par la suite, un composé polyanionique, le tripolyphosphate pentasodique (TPP), est utilisé pour former les liaisons croisées entre les groupes aminés le long des molécules polymères polycationiques et des groupes phosphate des molécules TPP afin de stabiliser le complexe. Ce processus de complexation solidifie les composés bioactifs dans la matrice de chitosane, qui est ensuite purifiée et enduite sur des échantillons de coton pour produire un tissu antimicrobien.
Les nanoformulations doivent d’abord être testées pour l’efficacité antimicrobienne sous forme d’émulsion avant d’être appliquées sur le tissu. Cela peut être facilement évalué par une méthode qualitative, telle que la diffusion sur disque de Kirby-Bauer, la diffusion de puits et le test de la plaque cylindrique. Cependant, le dosage sur plaque cylindrique17 offre la flexibilité nécessaire pour charger des volumes variables de la formulation et comparer la zone de dégagement. Dans cette méthode, les formulations antimicrobiennes sont chargées dans des cylindres en acier inoxydable et placées sur une couche de gélose molle, qui est inoculée avec le micro-organisme ou l’agent pathogène testé. Le diamètre de la zone de clairance produite par rapport à l’organisme d’essai est proportionnel au potentiel inhibiteur de la formulation antimicrobienne et peut donc être utilisé comme alternative aux méthodes de dilution du bouillon. Toutefois, la taille des zones claires n’est qu’une mesure comparative ou qualitative à l’intérieur d’une plaque spécifique, à moins que des normes spécifiques ne soient maintenues. Les agents antimicrobiens agissent contre les agents pathogènes soit en inhibant leur croissance (biostatique), soit en tuant les cellules (biocide), ce qui peut être quantifié par la concentration minimale inhibitrice (CMI) et la concentration bactéricide minimale (MBC), respectivement. Cependant, l’efficacité et le comportement des produits chimiques bioactifs sont différents dans leurs formulations (état liquide) et lorsqu’ils sont enduits sur un substrat tel qu’un tissu18. En effet, de multiples facteurs jouent un rôle dans l’efficacité, tels que la stabilité de l’adhérence des agents antimicrobiens au tissu, la teneur en humidité, le type de substrat et l’adhérence des microbes. Si l’objectif visé est uniquement l’activité bactériostatique, un essai qualitatif tel que la « méthode des traînées parallèles »19 peut fournir une évaluation relativement rapide et facile de la formulation antimicrobienne diffusible. Toutefois, si les effets bactéricides doivent être déterminés, on peut utiliser « Évaluation des finitions antibactériennes sur les matériaux textiles »20 , ce qui permet de réduire logarithmiquement l’agent pathogène enrichi.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Préparation des nanoparticules
- Encapsulation nano-végétale
- Préparer 50 mL d’acide acétique à 1 % (v/v).
ATTENTION: L’acide acétique glacial est un irritant, qui peut causer de graves brûlures cutanées et des lésions oculaires. Portez une blouse de laboratoire pleine longueur, des gants en nitrile et des lunettes de protection, et travaillez sous une hotte. - Préparer la solution de chitosane (1,2 % p/v) en dissolvant 0,6 g de flocons de chitosane (poids moléculaire moyen) dans 50 mL d’acide acétique à 1 % (préparé ci-dessus). Agiter pendant une nuit (H/N) à température ambiante (R/T) pour obtenir une émulsion homogène.
- Ajouter 0,5 g de Tween 80 et agiter (1 000 tr/min) à 60 °C pendant 2 h pour obtenir une solution homogène. Apporter la solution à R/T avant d’ajouter des composés bioactifs (carvacrol ou thymol).
- Ajouter goutte à goutte ou progressivement 0,75 g de carvacrol (ou thymol) en agitant (1 000 tr/min) le mélange pendant 20 min à R/T. Le rapport pondéral du chitosane au composé bioactif est de 1:1,25.
- Ajouter 50 ml (0,5 % p/v) de TPP goutte à goutte au mélange tout en agitant à R/T. Continuer à agiter pendant 30 minutes pour obtenir une émulsion homogène.
- Préparer un contrôle négatif en suivant la même procédure mais sans ajout de composés bioactifs.
- Préparer 50 mL d’acide acétique à 1 % (v/v).
- Purification
- Centrifuger l’émulsion à 10 000 × g pendant 30 min à 4 °C et recueillir les NP formés (pastille) après décantation du surnageant. Réserver le surnageant pour tester l’efficacité de l’encapsulation.
- Laver les particules (à partir de l’étape 1.2.1) à l’aide de Tween 80 aqueux (1 % v/v) avec le double du volume de granulés formés pour éliminer les composés bioactifs non liés ou libres. Assurez-vous de perturber la pastille en tourbillonnant jusqu’à ce qu’une solution homogène se forme à chaque étape de lavage.
- Lavez les particules (à partir de l’étape 1.2.2) avec de l’eau désionisée deux fois pour éliminer les impuretés.
- Reconstituer les NP en remettant en suspension le granulé (à partir de l’étape 1.2.3) dans 30 mL d’eau désionisée. Conservez les NP à 4 °C jusqu’à 6 mois.
REMARQUE: L’expérience peut être suspendue à ce stade.
- Caractérisation
- Diluer les NP dans de l’eau désionisée jusqu’à ce que les lectures ultraviolet-visible (UV-Vis) entre 250 et 400 nm se situent dans la plage (absorbance >1).
- Enregistrer les spectres d’absorption UV-Vis des NP sur les longueurs d’onde allant de 250 à 400 nm à l’aide d’un spectrophotomètre UV-Vis.
- Conservez une partie aliquote (1 mL) de NP à R/T pendant une plage de durées (p. ex. de 1 à 6 mois) et testez l’effet antimicrobien par la méthode de la plaque cylindrique avec un échantillon frais.
- Revêtement sur tissu
- Appliquer des NP sur un tissu de coton tissé en utilisant une méthode de séchage à tampon 7,21.
- Plongez les échantillons de tissu dans la solution contenant des NP mélangés à un liant de tissu pendant 3 minutes jusqu’à ce qu’ils soient trempés. Ensuite, passez les échantillons à travers une poutre de laboratoire à deux rouleaux pour éliminer l’excès de liquide.
- Sécher les échantillons à 100 °C pendant 30 min et durcir à 130 °C pendant 10 min.
- Enfin, lavez les échantillons dans un bain à ultrasons pendant 15 minutes pour éliminer les NP non liées.
Remarque : Vous pouvez également suivre la méthode simplifiée décrite ci-dessous.
- Coupez le tissu de coton (ou les échantillons de blouse de laboratoire) en carrés de 10 cm x 10 cm.
- Plongez les morceaux coupés dans 2 mL du NP synthétisé (10%) dans un récipient en plastique (12 cm x 12 cm) pendant 2 min à R/T. Éliminez l’excès de liquide par séchage à l’air.
- Presser à chauffer à 100 °C pendant 3 min pour lier les NP.
- Éliminer les NP non liés en les rinçant dans un Tween 80 aqueux (2 % p/v) et en les séchant au four à 100 °C pendant 30 min.
REMARQUE: Ce tissu antimicrobien peut être conservé pendant 2 ans chez R/T.
- Appliquer des NP sur un tissu de coton tissé en utilisant une méthode de séchage à tampon 7,21.
- Durabilité du lavage
- Coupez le tissu en échantillons carrés de 50 mm x 50 mm.
- Placer les échantillons dans 50 ml d’eau tiède du robinet (40 °C) dans un contenant en verre ou en plastique et ajouter deux gouttes de détergent ordinaire (non antimicrobien).
- Rincer sur une plate-forme à bascule ou un agitateur magnétique pendant 30 min.
- Sécher à l’air ou incuber à 60 °C pendant 2 h et tester l’efficacité antimicrobienne.
2. Essai sur plaque cylindrique pour le criblage de nanoparticules
- Préparer la gélose trypticase soja (TSA), le bouillon de soja trypticase (BST), la gélose base antibiotique (ABA) et la gélose antibiotique de graines (AAS), conformément aux instructions du fabricant, et stériliser le milieu à l’autoclavage à 121 °C à 15 psi pendant 15 min.
- Sous-culture des microbes (provenant du stock) d’intérêt, contre lesquels les tests d’efficacité sont effectués, sur des plaques TSA fraîchement préparées (ou tout milieu approprié) par la méthode de la plaque de stries à trois voies et incuber pour produire des plaques de pureté. ( Espèces recommandées : S. aureus, E. coli, P. aeruginosa et C. albicans.)
- Inoculer les cultures à partir de plaques fraîches de pureté dans du BST (tubes de 10 mL) à 35 °C O/N avec agitation modérée (100-200 tr/min).
- Aliquote 5,0 mL d’AAS fondu dans chacun des tubes à essai. Le nombre de tubes correspond au nombre de micro-organismes testés.
- Versez 20 mL d’ABA fondu préstérilisé dans chaque plaque de Petri (100 mm x 20 mm) de manière aseptique pour former la couche de base. Le nombre de plaques de gélose correspond au nombre de micro-organismes à tester. Attendez que les médias se solidifient.
- Après solidification de la couche de base, inoculer chaque AAS fondu avec une culture de nuit à partir de l’étape 2.3 (1,0 mL, préchauffé à 35 °C) et transférer immédiatement le contenu (mélange d’AAS et de culture) à la surface d’une plaque d’ABA. Remuez la plaque pour répartir uniformément la couche de gélose fondue. Assurez-vous que la couche de graines semble lisse et exempte de bosses ou de bulles.
- Placer jusqu’à six cylindres en acier inoxydable (6 mm x 6 mm x 10 mm; préautoclavés), espacés uniformément sur un motif hexagonal, par plaque de gélose à l’aide d’une paire de pinces stériles (figure 1).
- Charger les bouteilles avec les NP synthétisés de différents volumes (30 μL, 50 μL, 75 μL et 100 μL) à dépister pour les effets antimicrobiens. Le témoin négatif est celui sans composés bioactifs.
- Incuber des bactéries pathogènes courantes (p. ex. E. coli, S. aureus, P. aeruginosa) à 35 °C pendant 24 h et des espèces fongiques (p. ex. C. albicans) à R/T pendant 3 jours.
- Mesurer le diamètre de la zone claire et comparer l’efficacité des NP synthétisés.
REMARQUE: Ce test peut être utilisé pour présélectionner les meilleurs NP à enduire sur le tissu.
3. Méthode des stries parallèles (modifiée à partir de AATCC 147)
- Préparation du matériel
- Coupez le tissu traité au NP en échantillons de 50 mm x 25 mm.
- Préparer la gélose Mueller-Hinton (MHA), TSA et TSB, selon les instructions du fabricant, et stériliser le média à l’autoclave à 121 °C à 15 psi pendant 15 min.
- Sous-culture des microbes (provenant du stock) d’intérêt, contre lesquels les tests d’efficacité sont effectués, sur des plaques TSA fraîchement préparées (ou tout milieu approprié) par la méthode de la plaque de stries à trois voies et incuber à 35 °C pendant 2 jours pour les taches bactériennes et à R/T pendant 5 jours pour les souches fongiques afin de produire des plaques de pureté. ( Espèces recommandées : S. aureus, E. coli, P. aeruginosa et C. albicans.)
- Augmentation des cultures microbiennes
- Inoculer les cultures à partir de plaques fraîches de pureté dans du BST (tubes de 10 mL) à 35 °C O/N avec agitation modérée (100-200 tr/min).
- Diluer les cultures O/N à 1,5 × 108 unités formant colonies (UFC)/mL ou correspondant à la turbidité de 0,5 McFarland standard (habituellement une dilution de 1/10 à 1/20 pour la plupart des cultures saines).
- Inoculer la culture diluée ci-dessus à l’aide d’une boucle stérile de 4 mm comme suit. Chargez une boucle de culture de bouillon et transférez-la à la surface de la plaque de gélose MHA en faisant cinq stries parallèles, chacune de 6 cm de longueur et espacée de 1 cm, selon la figure 2. Ne remplissez pas la boucle.
- Appuyez doucement sur l’échantillon de tissu à l’aide d’une spatule stérile sur les cinq stries afin que le tissu soit au centre et touche les cinq lignes de stries. Incuber à 35 °C pendant 24 h.
- Évaluation qualitative de l’efficacité antimicrobienne
- Examiner la plaque incubée pour détecter l’interruption de la croissance le long des stries au-delà des bords du tissu (une zone claire indique une inhibition de la croissance).
- Calculer la largeur moyenne d’une zone d’inhibition le long de la ligne de stries (W) de part et d’autre de l’échantillon de tissu à l’aide de l’équation (1).
W = (T - D)/2 (1)
W = largeur de la zone dégagée; T = longueur totale de la zone claire, y compris la largeur de l’échantillon; D = largeur de l’échantillon de tissu (25 mm).
4. Méthode de réduction logarithmique quantitative (modifiée à partir de AATCC 100)
- Préparation expérimentale
- Coupez le tissu en échantillons carrés de 50 mm x 50 mm.
- Préparer le TSA, le TSB, le bouillon Letheen et la solution saline tamponnée au phosphate (PBS), conformément aux instructions du fabricant, et stériliser le milieu par autoclavage.
- Préparer des cultures O/N de microbes d’intérêt, contre lesquelles les tests d’efficacité sont effectués, en inoculant des colonies isolées à partir de plaques de pureté dans un BST stérile et en les incubant à 35 °C pendant 18 à 24 h. ( Espèces recommandées : S. aureus, E. coli, P. aeruginosa et C. albicans.)
- Augmentation des cultures microbiennes
- Diluer les cultures O/N à 1,5 × 108 UFC/mL ou correspondant à la turbidité de la norme de 0,5 McFarland (habituellement une dilution de 1/10 à 1/20 pour la plupart des cultures saines).
- Déterminer le volume approprié de cultures pour le pic en mesurant la capacité de rétention de liquide du tissu comme suit.
- Ajouter une série de volumes de la culture de bouillon dilué (par exemple, 100-500 μL) sur des échantillons de tissu (dans des plaques de Petri séparées) et choisir le volume de telle sorte que l’échantillon absorbe complètement l’eau et ne laisse aucun liquide résiduel/libre. La capacité de rétention de liquide diffère du type et de l’épaisseur du tissu. Pour les blouses de laboratoire en coton ordinaires, il est d’environ 200 μL.
- Augmenter le volume (capacité de rétention de liquide déterminée au-dessus [p. ex., 200 μL]) de chaque culture sur les échantillons placés dans des plaques de Petri stériles. Le nombre d’échantillons correspond au nombre d’essais (p. ex., tissus testés immédiatement et après lavage [et cycles de lavage testés]) et aux effets antimicrobiens testés pendant le temps de contact (après une heure ou un jour déterminé [p. ex., 30 min, 2 h, jours 1-3]).
REMARQUE: Utilisez une micropipette avec des embouts de filtre aérosol (pour éviter la contamination de la pipette lors d’utilisations ultérieures) pour inoculer les cultures sur les échantillons avec une répartition uniforme. - Pour le contrôle négatif, utilisez le même type d’échantillons de tissu non traités. Effectuer le contrôle négatif pour chaque espèce microbienne d’essai, période de contact, différents tissus et cycles de lavage.
- Récupération des microbes par numération sur plaque viable
- Laisser sécher à l’air libre les échantillons inoculés (traités et non traités) à l’intérieur des plaques de Petri (couvercles entrouverts) à R/T pendant la ou les périodes de contact requises à tester (p. ex., 0 min, 30 min, 60 min, etc., ou même plusieurs jours pour les effets à long terme). Toujours inclure un « 0 min » pour représenter un effet immédiat et une efficacité neutralisante.
- Transférer les échantillons de manière aseptique dans des tubes centrifugeux stériles séparés (50 ml) et visser hermétiquement les bouchons.
- Ajouter le bouillon Letheen (tout tampon neutralisant pertinent) pour obtenir une dilution de 1/100 (p. ex. 19,8 mL pour un inoculum de 200 μL).
- Fermez fermement les tubes de centrifugation avec des bouchons à vis et un vortex pendant 1 min à vitesse moyenne.
- Diluer la suspension en série avec le PBS stérile lors des dilutions 1/10 suivantes, de sorte que le nombre de colonies du groupe « non traité » devient trop faible pour être compté (TLTC).
- Plaquer les dilutions (0,1 mL) sur des plaques de milieu appropriées, qui favorisent la croissance du microorganisme (p. ex. TSA pour les bactéries ou gélose au dextrose Sabouraud [SDA] pour les champignons) ou tout milieu qui optimise la croissance et offre un bon contraste pour que le comptage des colonies soit précis.
- Incuber les plaques bactériennes à 35 °C pendant 2 jours et les plaques fongiques à R/T pendant 5 jours.
- Comptez les UFC viables directement à l’aide d’un compteur de colonies ou d’un logiciel d’imagerie (p. ex., UFC AI).
- Calculer la réduction logarithmique microbienne (R) due au tissu antimicrobien à l’aide de l’équation (2) :
R =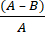 × 100 (2)
× 100 (2)
A = valeur logarithmique du nombre d’UFC récupérées à partir de tissus non traités; B = valeur logarithmique du nombre d’UFC récupérées du tissu traité.
Access restricted. Please log in or start a trial to view this content.
Résultats
Sélection initiale des IP synthétisées
Après la technique d’émulsion huile-dans-eau en deux étapes16, les composés bioactifs (carvacrol et thymol) ont été encapsulés avec succès dans du chitosane. Cela a été confirmé par spectrophotométrie UV-Vis pour le pic d’absorption des composés bioactifs respectifs par rapport aux témoins, qui étaient les NP de chitosane sans composés bioactifs. Les NP constitués étaient homogènes et stables sur 12 mois à 4 °C....
Access restricted. Please log in or start a trial to view this content.
Discussion
L’efficacité antimicrobienne des biocides est classiquement testée par des tests quantitatifs, tels que la concentration minimale inhibitrice (CMI) et la concentration bactéricide minimale (MBC), dans lesquels les bactéries sont immergées dans un liquide antimicrobien pendant 24 heures. Cependant, ces dosages ne conviennent pas aux tissus enduits, où l’interface liquide fait défaut et où les biocides sont diffusés lentement le long des fibres du tissu. Par conséquent, de nombreux tests de tissus standard on...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont pas de conflits d’intérêts.
Remerciements
Cette étude a été financée par « Applied Research, Innovation and Entrepreneurship Services » (ARIES), Centennial College, Canada.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Acetic acid | Millipore Sigma | 64-19-7 | |
| Antibiotic base agar | BD Difco | DF0270-17-4 | Also known as Antibiotic Medium 2 |
| Antibiotic seed agar | BD Difco | DF0263-17-3 | Also known as Antibiotic Medium 1 |
| Blood Agar (Nutrient Agar with 5% Sheep Blood) | Donated by CFIA | ||
| Bromcresol Purple Lactose Agar | Donated by CFIA | ||
| Candida albicans | ATCC The Global Bioresource Center | ATTC 10231 | |
| Carvacrol | Millipore Sigma | 282197 (CAS# 499-75-2) | |
| Centrifuge Allergra X-22R Centrifuge | Beckman Coulter | Model # X-22R | Refrigerated. Wait at least 20 min or until the temperature reach the set low value (e.g., 4 °C) as the refrigeration takes time. |
| Chitosan Medium Molecular Weight (CS) | Millipore Sigma | 448877 (CAS # 9012-76-4) | |
| Clamshell Heat Press | Intiva | IM1200 | |
| Escherichia coli (E. coli) | ATCC The Global Bioresource Center | ATTC 23725 | |
| Incubator | Thermo Scientific | 1205M34 | |
| Letheen Broth | BD Difco | DF0681-17-7 | Used to neutralize antimicrobial effects. Product from different manufacturers may require to add Polysorbate 80, which is already added in Difco product. |
| Milli Q water | Millipore Sigma | ZR0Q16WW | Deionized water |
| Mueller-Hinton Agar | BD Difco | DF0252-17-6 | |
| Pentasodium tripolyphosphate (TPP) | Millipore Sigma | 238503 (CAS# 7758-29-4) | |
| Phospahte Buffered Saline (PBS) | Thermo Scientific | AM9624 | |
| Pseudomonas aeruginosa | ATCC The Global Bioresource Center | ATTC 9027 | |
| Sabouraud Dextrose Agar | BD Difco | DF0109-17-1 | |
| Shaking incubator/ Thermo shaker | VWR | Model# SHKA2000 | |
| Staphylococcus aureus | ATCC The Global Bioresource Center | ATTC 6538 | |
| Thymol | Millipore Sigma | T0501 (CAS# 89-83-8) | |
| Trypticase Soy Agar | BD Difco | 236950 | |
| Trypticase Soy Broth | BD Difco | 215235 | |
| Tween 80 | Millipore Sigma | STS0204 (CAS # 9005-65-6) | |
| UV-Vis Spectrophometer | Thermo Scientific | GENESYS 30 (840-277000) |
Références
- Schmidt-Emrich, S., et al. Rapid assay to assess bacterial adhesion on textiles. Materials. 9 (4), 249(2016).
- Qaday, J., et al. Bacterial contamination of medical doctors and students white coats at Kilimanjaro Christian Medical Centre, Moshi, Tanzania. International Journal of Bacteriology. 2015, 507890(2015).
- Treakle, A. M., et al. Bacterial contamination of health care workers' white coats. American Journal of Infection Control. 37 (2), 101-105 (2009).
- Wong, D., Nye, K., Hollis, P. Microbial flora on doctors' white coats. BMJ. 303 (6817), 1602-1604 (1991).
- Gouveia, I. C. Nanobiotechnology: A new strategy to develop non-toxic antimicrobial textiles for healthcare applications. Journal of Biotechnology. (150), 349(2010).
- Joshi, M., Ali, S. W., Purwar, R., Rajendran, S. Ecofriendly antimicrobial finishing of textiles using bioactive agents based on natural products. Indian Journal of Fibre and Textile Research. 34, 295-304 (2009).
- Ahmed, H. A., Rajendran, R., Balakumar, C. Nanoherbal coating of cotton fabric to enhance antimicrobial durability. Elixir Applied Chemistry. 45, 7840-7843 (2012).
- Morais, D. S., Guedes, R. M., Lopes, M. A. Antimicrobial approaches for textiles: From research to market. Materials. 9 (6), 498(2016).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Development of advanced textile finishes using nano-emulsions from herbal extracts for organic cotton fabrics. Coatings. 11 (8), 939(2021).
- Martínez-Hernández, G. B., Amodio, M. L., Colelli, G. Carvacrol-loaded chitosan nanoparticles maintain quality of fresh-cut carrots. Innovative Food Science & Emerging Technologies. 41, 56-63 (2017).
- Zhang, H. L., Wu, S. H., Tao, Y., Zang, L. Q., Su, Z. Q. Preparation and characterization of water-soluble chitosan nanoparticles as protein delivery system. Journal of Nanomaterials. 2010, 1-5 (2010).
- Patel, R., Gajra, B., Parikh, R. H., Patel, G. Ganciclovir loaded chitosan nanoparticles: preparation and characterization. Journal of Nanomedicine & Nanotechnology. 7 (6), 1-8 (2016).
- Merodio, M., Arnedo, A., Renedo, M. J., Irache, J. M. Ganciclovir-loaded albumin nanoparticles: characterization and in vitro release properties. European Journal of Pharmaceutical Sciences. 12 (3), 251-259 (2001).
- Hsieh, W. C., Chang, C. P., Gao, Y. L. Controlled release properties of Chitosan encapsulated volatile Citronella Oil microcapsules by thermal treatments. Colloids and Surfaces B: Biointerfaces. 53 (2), 209-214 (2006).
- Yoksan, R., Jirawutthiwongchai, J., Arpo, K. Encapsulation of ascorbyl palmitate in chitosan nanoparticles by oil-in-water emulsion and ionic gelation processes. Colloids and Surfaces B: Biointerfaces. 76 (1), 292-297 (2010).
- Keawchaoon, L., Yoksan, R. Preparation, characterization and in vitro release study of carvacrol-loaded chitosan nanoparticles. Colloids and Surfaces B: Biointerfaces. 84 (1), 163-171 (2011).
- Cazedey, E. C. L., Salgado, H. R. N. Development and validation of a microbiological agar assay for determination of orbifloxacin in pharmaceutical preparations. Pharmaceutics. 3 (3), 572-581 (2011).
- Jayapriya, S., Bagyalakshmi, G. Textile antimicrobial testing and standards. International Journal of Textile and Fashion Technology. 4 (1), 2250-2378 (2013).
- AATCC 100. Antibacterial Finishes on Textile Materials: Assessment of Developed from American Association of Textile Chemists and Colorists. AATCC 100. , (2004).
- AATCC 147. Antimicrobial Activity Assessment of Textile Materials: Parallel Streak Method from American Association of Textile Chemists and Colorists. AATCC 147. , (2004).
- Ortelli, S., Costa, A. L., Dondi, M. TiO2 nanosols applied directly on textiles using different purification treatments. Materials. 8 (11), 7988-7996 (2015).
- Poole, K. Pseudomonas aeruginosa: resistance to the max. Frontiers in Microbiology. 2, 65(2011).
- Pinho, E., Magalhães, L., Henriques, M., Oliveira, R. Antimicrobial activity assessment of textiles: standard methods comparison. Annals of Microbiology. 61 (3), 493-498 (2010).
- Venkatraman, P. D., Sayed, U., Parte, S., Korgaonkar, S. Novel antimicrobial finishing of organic cotton fabrics using nano-emulsions derived from Karanja and Gokhru plants. Textile Research Journal. 92 (23-24), 5015-5032 (2022).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon