A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الطرق القائمة على الصور لدراسة أحداث الاتجار بالغشاء في خلايا سلالة الثغور
In This Article
Summary
يتم تقديم العديد من الطرق الشائعة الاستخدام هنا لدراسة أحداث الاتجار بالغشاء لمستقبلات غشاء البلازما كيناز. تصف هذه المخطوطة البروتوكولات التفصيلية بما في ذلك تحضير المواد النباتية والمعالجة الدوائية وإعداد التصوير متحد البؤر.
Abstract
في الخلايا حقيقية النواة، تنقل مكونات الغشاء، بما في ذلك البروتينات والليبيدات، زمانيا مكانيا إلى وجهتها داخل نظام الغشاء الداخلي. وهذا يشمل النقل الإفرازي للبروتينات المركبة حديثا إلى سطح الخلية أو خارج الخلية ، والنقل الداخلي للشحنات خارج الخلية أو مكونات غشاء البلازما إلى الخلية ، وإعادة تدوير أو نقل البضائع بين العضيات تحت الخلوية ، إلخ. تعتبر أحداث الاتجار بالأغشية حاسمة في التطور والنمو والتكيف البيئي لجميع الخلايا حقيقية النواة ، وبالتالي فهي تخضع لتنظيم صارم. تخضع كينازات مستقبلات سطح الخلية ، التي تدرك إشارات الرباط من الفضاء خارج الخلية ، لكل من النقل الإفرازي والداخلي. يتم وصف الأساليب الشائعة الاستخدام لدراسة أحداث الاتجار بالغشاء باستخدام كيناز مستقبلات الليوسين الغنية بالتكرار الموضعي بغشاء البلازما ، ERL1. تشمل الأساليب إعداد المواد النباتية ، والعلاج الدوائي ، وإعداد التصوير متحد البؤر. لمراقبة التنظيم الزماني المكاني ل ERL1 ، تصف هذه الدراسة تحليل التوطين المشترك بين ERL1 وبروتين علامة الجسم متعدد الحويصلات ، RFP-Ara7 ، وتحليل السلاسل الزمنية لهذين البروتينين ، وتحليل z-stack ل ERL1-YFP المعالج بمثبطات الاتجار بالغشاء brefeldin A و wortmannin.
Introduction
حركة مرور الغشاء هي عملية خلوية محفوظة توزع مكونات الغشاء (المعروفة أيضا باسم الشحنات) ، بما في ذلك البروتينات والدهون والمنتجات البيولوجية الأخرى ، بين عضيات مختلفة داخل خلية حقيقية النواة أو عبر غشاء البلازما من وإلى الفضاء خارج الخلية1. يتم تسهيل هذه العملية من خلال مجموعة من الأغشية والعضيات تسمى نظام الغشاء الداخلي ، والذي يتكون من الغشاء النووي ، والشبكة الإندوبلازمية ، وجهاز جولجي ، والفجوة / الجسيمات الحالة ، وغشاء البلازما ، وإندوسوماتمتعددة 1. يتيح نظام الغشاء الداخلي تعديل مكونات الغشاء وتعبئتها ونقلها باستخدام حويصلات ديناميكية تنتقل بين هذه العضيات. تعتبر أحداث الاتجار بالأغشية حاسمة لتطور الخلايا ونموها والتكيف البيئي ، وبالتالي فهي تخضع للائحة صارمة ومعقدة2. حاليا ، تم تطوير مناهج متعددة في البيولوجيا الجزيئية والبيولوجيا الكيميائية والفحص المجهري وقياس الطيف الكتلي وتطبيقها في مجال الاتجار بالأغشية وعززت بشكل كبير فهم التنظيم الزماني المكاني لنظام الغشاء الداخلي 3,4. تستخدم البيولوجيا الجزيئية للتلاعب الجيني الكلاسيكي للاعبين المفترضين المتورطين في الاتجار بالأغشية ، مثل تغيير التعبير الجيني للبروتين محل الاهتمام أو تسمية البروتين محل الاهتمام بعلامات معينة. تشمل الأدوات في البيولوجيا الكيميائية استخدام الجزيئات التي تتداخل على وجه التحديد مع حركة مرور طرق معينة 4,5. يعد قياس الطيف الكتلي قويا لتحديد المكونات في العضية التي تم عزلها ميكانيكيا بواسطة الأساليب الكيميائية الحيوية 3,4. ومع ذلك ، فإن حركة مرور الأغشية هي عملية بيولوجية ديناميكية ومتنوعة ومعقدة1. لتصور عملية الاتجار بالغشاء في الخلايا الحية في ظل ظروف مختلفة ، يعد الفحص المجهري الضوئي أداة أساسية. تم إحراز تقدم مستمر في تقنيات المجهر المتقدمة للتغلب على التحديات في قياس كفاءة وحركية وتنوع الأحداث4. هنا ، تركز هذه الدراسة على المنهجيات المعتمدة على نطاق واسع في البيولوجيا الكيميائية / الدوائية ، والبيولوجيا الجزيئية ، والفحص المجهري لدراسة أحداث الاتجار بالأغشية في نظام مبسط بشكل طبيعي ويمكن الوصول إليه تجريبيا ، وهي عملية تطور الثغور.
الثغور هي مسام دقيقة على الأسطح الهوائية للنبات تفتح وتغلق لتسهيل تبادل الغازات بين الخلايا الداخلية والبيئة6،7،8. ومن ثم، فإن الثغور ضرورية لعملية البناء الضوئي والنتح، وهما حدثان مهمان لبقاء النبات ونموه. يتم ضبط تطور الثغور ديناميكيا من خلال الإشارات البيئية لتحسين تكيف النبات مع البيئة المحيطة9. يعود تاريخ تحديد بروتين المستقبلات Too Many Mouths (TMM) إلى الدراسات التي أجريت في عام 2002 ، وفتح الباب أمام حقبة جديدة من التحقيق في الآليات الجزيئية لتطور الثغور في النبات النموذجي Arabidopsis thaliana10. بعد بضعة عقود فقط ، تم تحديد مسار الإشارات الكلاسيكية. من المنبع إلى المصب ، يتضمن هذا المسار مجموعة من روابط الببتيد الإفرازية في عائلة عوامل نمط البشرة (EFP) ، والعديد من كينازات مستقبلات الليوسين الغنية بالتكرار (LRR) على سطح الخلية في عائلة EREECTA (ER) ، وبروتين مستقبلات LRR TMM ، وشلال MAPK ، والعديد من عوامل النسخ bHLH بما في ذلك SPEECHLESS (SPCH) ، وكتم الصوت ، و FAMA ، والصراخ (SCRM) 11،12،13،14 ، 15,16,17,18,19,20,21,22,23,24,25,26. يشير العمل السابق إلى أن أحد كينازات المستقبلات ، ER-LIKE 1 (ERL1) ، يوضح سلوكيات تحت خلوية نشطة عند إدراك EPF20. ينتقل ERL2 أيضا ديناميكيا بين غشاء البلازما وبعض العضيات داخل الخلايا27. يؤدي منع خطوات الاتجار بالغشاء إلى ظهور نقوش ثغورية غير طبيعية ، مما يؤدي إلى مجموعات ثغور على سطح الورقة28. تشير هذه النتائج إلى أن حركة مرور الأغشية تلعب دورا أساسيا في نمو الثغور. تصف هذه الدراسة بروتوكولا للتحقيق الزماني المكاني لديناميكيات ERL1 باستخدام تحليل التوطين المشترك تحت الخلوي للبروتين البروتيني جنبا إلى جنب مع العلاج الدوائي باستخدام بعض مثبطات الاتجار بالغشاء.
Protocol
1. إعداد الحلول
- تحضير محلول تعقيم البذور عن طريق خلط 15 مل من المبيض مع 35 مل من الماء المقطر و 50 ميكرولتر من Triton X-100.
- تحضير محلول بريفيلدين أ (BFA) عن طريق إذابة مسحوق BFA في الإيثانول إلى تركيز نهائي قدره 10 mM (مخزون). تحضير محلول وورتمانين (Wm) عن طريق إذابة مسحوق Wm في DMSO إلى تركيز نهائي قدره 10 mM (مخزون).
2. بذر البذور
- القسمة 10-50 بذرة من كل من النباتات المعدلة وراثيا المطلوبة في أنابيب الطرد المركزي الدقيقة 1.5 مل. أضف 1 مل من محلول تعقيم البذور في كل أنبوب ، واخلطه جيدا عن طريق قلب الأنبوب برفق لمدة 10 دقائق على شاكر.
- تخلص من محلول تعقيم البذور ، واغسل البذور ب 1 مل من الماء المقطر المعقم خمس مرات.
- أضف 300 ميكرولتر من الماء المقطر المعقم في كل أنبوب ، وزرع البذور على وسائط MS نصف القوة التي تحتوي على 1٪ (وزن / حجم) سكروز و 0.75٪ (وزن / حجم) أجار. تكملة الوسط مع المضادات الحيوية المقابلة حسب الحاجة.
- الحفاظ على لوحة رأسا على عقب في 4 °C في الظلام لمدة 2 أيام لمزامنة الإنبات.
- بعد يومين ، انقل اللوحة إلى غرفة نمو ذات دورة مظلمة لمدة 16 ساعة / 8 ساعات (80 ميكرومول / م2 / ثانية1) عند 22 درجة مئوية. يعتبر هذا اليوم الأول بعد الإنبات (1 dpg).
- زرع الشتلات في التربة في 10 dpg لمزيد من النمو.
3. تحضير النباتات المعدلة وراثيا F1 ثنائية اللون
- قم بزراعة نباتات محورة وراثيا متماثلة الزيجوت تحمل ERL1-YFP (النبات أ) ونباتات محورة وراثيا متماثلة الزيجوت تحمل بروتين علامة RFP-Ara7 (النبات B) 20 جنبا إلى جنب حتى تزهر في غرفة نمو مع دورة مظلمة لمدة 16 ساعة / 8 ساعات (80 ميكرومول / م2 / ثانية1) عند 22 درجة مئوية.
- اختر إزهارا صغيرا من النبات أ. احتفظ بزهرة واحدة على وشك الفتح على الإزهار للتهجين الجيني. إزالة جميع الزهور القديمة والسيليك. بالإضافة إلى ذلك ، قم بإزالة الزهور الأصغر سنا و meristems الزهرية بعناية لتجنب الارتباك في المستقبل.
- قم بتشريح الزهرة غير المفتوحة برفق عن طريق إزالة الكؤوس والبتلات والسداة باستخدام زوج من الملقط الحاد. اترك المدقة فقط على الإزهار.
- خذ سداة ناضجة من زهرة مفتوحة على النبات B ، وقم بإيداع حبوب اللقاح على وصمة المدقة المشرحة في النبات A.
- قم بتسمية هذه الزهرة المتقاطعة يدويا بالإشارة إلى والدها ووالدتها وتاريخ التهجين الجيني. دع الزهرة تنضج ، واحصد بذور F1 عندما يتحول السيليك إلى اللون الأصفر / البني (~ 20 يوما بعد الصليب). تحقق من نجاح مصنع F1 يحتوي على إشارات YFP و RFP.
4. العلاج الدوائي
- لعلاج BFA ، قم بإزالة النبتات من الشتلات البالغة من العمر 7 أيام ، واغمر بقية الشتلات إما في محلول وهمي (0.3٪ إيثانول) أو محلول BFA 30 ميكرومتر ، ضع فراغا لمدة 1 دقيقة ، واحتفظ بالعينة مغمورة لمدة 30 دقيقة قبل التصوير.
- لعلاج وورتمانين ، قم بإزالة النبتات من الشتلات البالغة من العمر 7 أيام ، واغمر بقية الشتلات إما في محلول DMSO بنسبة 0.25٪ أو 25 مللي متر من نبتمانين ، وقم بتطبيق الفراغ لمدة 1 دقيقة ، واحتفظ بالعينة مغمورة لمدة 30 دقيقة قبل التصوير.
- للمعالجة الفراغية للعينات ، في أنبوب طرد مركزي دقيق سعة 1.5 مل ، أضف 500 ميكرولتر من محلول الدواء المقابل ، واغمر الشتلات المشرحة في المحلول. قم بتوصيل حقنة سعة 10 مل بإحكام بأنبوب الطرد المركزي الدقيق ، وقم بتطبيق الفراغ لمدة دقيقة واحدة (الشكل 1). قم بإزالة المحقنة ، واحتفظ بالعينة في المحلول للوقت المطلوب. أخرج الشتلات برفق لإعداد التصوير.

الشكل 1: جهاز فراغ بسيط. يتم توصيل حقنة سعة 10 مل بأنبوب طرد مركزي دقيق سعة 1.5 مل للمعالجة الفراغية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. إعداد عينة للتصوير
- تشريح الورقة الحقيقية من العينة المعالجة باستخدام شفرة حلاقة حادة. ضع الورقة الحقيقية برفق في قطرة ماء على شريحة زجاجية ، وحافظ على الجانب المحوري لأعلى. قم بتغطية الورقة الحقيقية ببطء بغطاء مع تجنب حبس أي فقاعات.
6. التصوير البؤري
ملاحظة: تم استخدام مجهر المسح المقلوب Leica SP8 لتصوير إشارة مضان العينات في هذا العمل.
- إعداد مسار الشعاع
- حدد ليزر 514 نانومتر لإثارة YFP. استخدم طاقة ليزر عالية لزيادة شدة الإشارة ، وبالتالي الحصول على جودة صورة عالية. ومع ذلك ، فإن قوى الليزر التي تزيد عن 5٪ تتعرض لخطر التبييض الضوئي ، وقد تتأثر صحة العينة. إذا لم تكن إشارة العينة خافتة جدا ، فابدأ بكثافة ليزر منخفضة.
- قم بتشغيل PMT / HyD للكشف ، وحدد عتبات نطاق الانبعاث العلوي والسفلي بناء على طيف فلوروفور YFP. اضبط نافذة كشف 530-570 نانومتر لتجميع إشارة YFP.
- التصوير المتسلسل للون الثاني: انقر فوق الزر Seq ، وأضف قناة جديدة. بشكل افتراضي ، سيكون مسار شعاع YFP المصمم مسبقا هو Seq 1. في Seq 2 ، حدد ليزر 561 نانومتر لإثارة RFP ، وقم بتعيين نافذة كشف 570-630 نانومتر لجمع إشارة RFP.
- إعداد شروط المسح الضوئي (الشكل 2)
- لتصوير نشاط حركة مرور الغشاء تحت الخلوي داخل خلايا السلائف الثغورية ، اختر عدسة Corr 63x / 1.2 W على النظام للتصوير.
- يشير التنسيق إلى حجم الصورة بالبكسل. ابدأ ب 1024 بكسل × 1024 بكسل ، ثم قم بتحسين ذلك بناء على عامل التكبير / التصغير والإعدادات الموضوعية للحصول على دقة جيدة لجودة النشر.
- تشير السرعة إلى سرعة رأس المسح الضوئي أثناء مرور الليزر فوق كل بكسل. على الرغم من أن سرعات المسح البطيئة غالبا ما تؤدي إلى نسبة إشارة إلى ضوضاء أفضل ، إلا أنها قد لا تلتقط بكفاءة أحداث الاتجار بالأغشية المتغيرة بسرعة. ابدأ بسرعة 400 هرتز ، وقم بتحسين ذلك بناء على الوضع المحدد للعينات.
- يستخدم عامل التكبير /التصغير لتكبير منطقة الاهتمام دون تغيير العدسة الموضوعية. ابدأ بعامل تكبير 1 ، وقم بتحسين ذلك بناء على الاحتياجات المحددة للتجربة.
- يشير متوسط الخط إلى عدد المرات التي سيتم فيها مسح كل خط X للحصول على متوسط النتيجة. يقلل متوسط الخط الأكبر من الضوضاء في الصورة الناتجة ، ولكنه يزيد أيضا من وقت المسح ووقت التعرض لضوء الليزر. لتصوير أحداث الاتجار بالأغشية ، لا تستخدم متوسط خط مرتفع. ابدأ بمتوسط خط 2x ، وقم بالتحسين حسب الحاجة.
- جمع سلسلة زمنية
ملاحظة: عند دراسة أحداث الاتجار بالأغشية ، غالبا ما تكون هناك حاجة إلى سلسلة زمنية لتسجيل الحركة السريعة للإندوسومات تحت الخلوية.- في وضع الاكتساب ، حدد وضع المسح الضوئي xyt لتمكين الأداة المساعدة للسلاسل الزمنية.
- حدد فترة انتظار بين النقاط الزمنية ضمن الفاصل الزمني. بدلا من ذلك ، انقر فوق تصغير لالتقاط الصور على الفور واحدة تلو الأخرى. تم استخدام فاصل زمني 7 ثوان في تجربة السلاسل الزمنية التالية.
- حدد المدة، وأدخل الوقت الإجمالي لتشغيل التجربة. بدلا من ذلك ، حدد عدد الإطارات المراد جمعها عن طريق تحديد الإطارات (الشكل 3).
- لجمع المعلومات ثلاثية الأبعاد المتعلقة بحدث الاتجار بالغشاء داخل الخلية بأكملها ، استخدم وضع مسح Z-stack. غالبا ما يتم استخدام الإسقاط الأقصى لكثافة صور Z-stack للتحليل.
- حدد وضع المسح الضوئي xyz في وضع الاستحواذ ، وبعد ذلك ستصبح الأداة المساعدة Z-Stack قابلة للوصول.
- حدد الخيار Z-wide. ضمن وضع المسح الضوئي ، حدد الصورة العلوية والصورة السفلية لمكدس Z باستخدام زري البدء والنهاية.
- حدد سمك الخطوة z بالنقر فوق حجم z-step. بدلا من ذلك ، حدد عدد الصور التي يجب التقاطها لتغطية النطاق الكامل لمكدس Z. لضمان الاتساق بين العينات ، حدد حجم الخطوة z (الشكل 4).
- معالجة الصور
- يتم إنشاء أقصى إسقاط كثافة لصور z-stack بواسطة البرنامج البؤري (http://www.leica-microsystems.com). في علامة تبويب العملية الأساسية ، اختر أولا ملف z-stack المهتم ضمن علامة التبويب فتح المشاريع في أقصى الجانب الأيسر. ثم قم بالتبديل إلى علامة التبويب الوسطى المسماة أدوات العملية ، وحدد وظيفة الإسقاط ، واختر الحد الأقصى في اللوحة المنسدلة للطريقة ، وانقر فوق الزر "تطبيق ". سيتم إنشاء صورة إسقاط z-stack ضمن علامة التبويب المشاريع المفتوحة.
- يتم إنشاء فيديو صور السلاسل الزمنية بواسطة فيجي (https://imagej.net/Fiji). في علامة التبويب ملف ، استخدم الدالة فتح لفتح جميع صور السلاسل الزمنية بالترتيب الصحيح. في علامة التبويب صورة ، ابحث عن وظيفة Stack ، واختر الصور المراد تكديسها لإنشاء مقطع فيديو. احفظ الملف بتنسيق .avi بمعدل الإطارات المطلوب (5 إطارات / ثانية للفيديو 1).
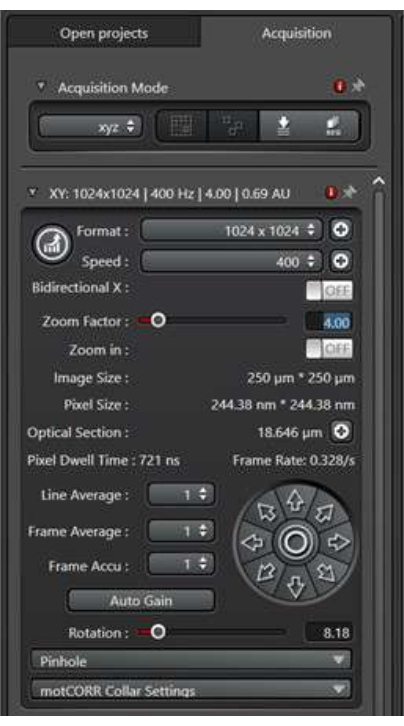
الشكل 2: لوحة وضع المسح الضوئي للبعد XY. يتم استخدام لوحة وضع المسح الضوئي لإعداد ظروف مسح الصور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
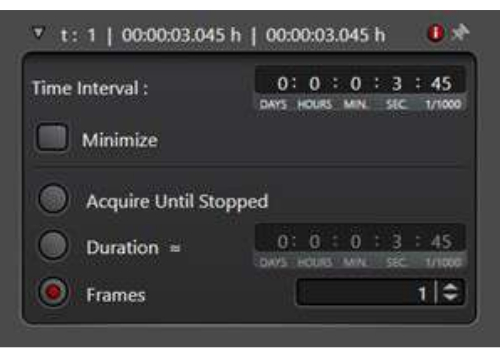
الشكل 3: الأداة المساعدة للسلسلة الزمنية ضمن وضع المسح الضوئي xyt. يتم استخدام الأداة المساعدة للسلسلة الزمنية لإعداد ظروف التصوير لجمع سلسلة من الصور على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
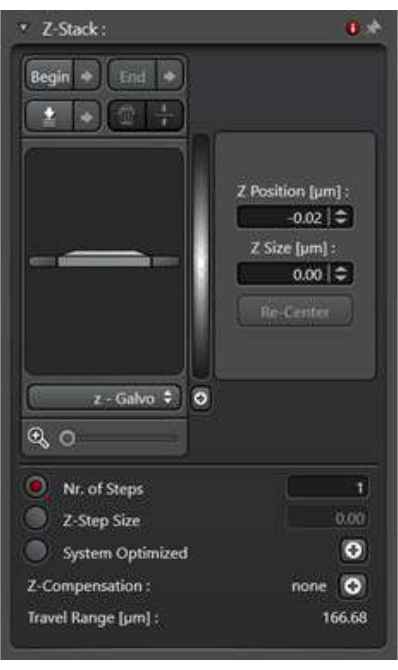
الشكل 4: الأداة المساعدة z-stack تحت وضع المسح الضوئي xyz. يتم استخدام الأداة المساعدة z-stack لإعداد ظروف التصوير لجمع سلسلة من الصور على المحور z. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
أشارت دراسة سابقة إلى أن ERL1 هو كيناز مستقبلات نشط يخضع لأحداث الاتجار بالغشاءالديناميكي 20. ERL1 هو كيناز مستقبلات LRR عبر الغشاء على غشاء البلازما. تتم معالجة ERL1 المركبة حديثا في الشبكة الإندوبلازمية في أجسام جولجي ويتم نقلها إلى غشاء البلازما. يمكن لجزيئات ERL1 الموجودة على غشاء ?...
Discussion
يفصل نظام الغشاء الداخلي سيتوبلازم الخلية الحقيقية النواة إلى مقصورات مختلفة ، مما يتيح الوظيفة الحيوية المتخصصة لهذه العضيات. لتوصيل بروتينات البضائع والجزيئات الكبيرة إلى وجهتها النهائية في الوقت المناسب ، يتم توجيه العديد من الحويصلات للتنقل بين هذه العضيات. تلعب أحداث الاتجار بالأ?...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم (IOS-2217757) (X.Q.) وجائزة مؤسسة برونسون بجامعة أركنساس للعلوم الطبية (UAMS).
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL syringes | VWR | BD309695 | Vacuum samples |
| Brefeldin A (BFA) | Sigma | B7651 | membrane trafficking drug |
| Confocal Microscope | Leica | Lecia SP8 TCS with LAS-X software package | Imaging |
| Dissecting Forceps | VWR | 82027-402 | Genetic cross |
| Fiji | NIH | https://imagej.net/Fiji | Image processing |
| Leica LAS AF software | Leica | http://www.leica-microsystems.com | Image processing |
| transgenic seeds of ERL1-YFP | Qi, X. et al. The manifold actions of signaling peptides on subcellular dynamics of a receptor specify stomatal cell fate. Elife. 9, doi:10.7554/eLife.58097, (2020). | ||
| transgenic seeds of RFP-Ara7 | Ebine, K. et al. A membrane trafficking pathway regulated by the plant-specific RAB GTPase ARA6. Nat Cell Biol. 13 (7), 853-859, doi:10.1038/ncb2270, (2011). | ||
| Wortmannin (Wm) | Sigma | W1628 | membrane trafficking drug |
References
- Aniento, F., Sanchez de Medina Hernandez, V., Dagdas, Y., Rojas-Pierce, M., Russinova, E. Molecular mechanisms of endomembrane trafficking in plants. Plant Cell. 34 (1), 146-173 (2022).
- Sigismund, S., et al. Endocytosis and signaling: Cell logistics shape the eukaryotic cell plan. Physiological Reviews. 92 (1), 273-366 (2012).
- Lyu, Z., Genereux, J. C. Methodologies for measuring protein trafficking across cellular membranes. ChemPlusChem. 86 (10), 1397-1415 (2021).
- Rodriguez-Furlan, C., Raikhel, N. V., Hicks, G. R. Merging roads: Chemical tools and cell biology to study unconventional protein secretion. Journal of Experimental Botany. 69 (1), 39-46 (2017).
- Foissner, I., Sommer, A., Hoeftberger, M., Hoepflinger, M. C., Absolonova, M. Is wortmannin-induced reorganization of the trans-Golgi network the key to explain charasome formation. Frontiers in Plant Science. 7, 756 (2016).
- Qi, X., Torii, K. U. Hormonal and environmental signals guiding stomatal development. BMC Biology. 16 (1), 21 (2018).
- Han, S. K., Kwak, J. M., Qi, X. Stomatal lineage control by developmental program and environmental cues. Frontiers in Plant Science. 12, 751852 (2021).
- Bharath, P., Gahir, S., Raghavendra, A. S. Abscisic acid-induced stomatal closure: An important component of plant defense against abiotic and biotic stress. Frontiers in Plant Science. 12, 615114 (2021).
- Becklin, K. M., Ward, J. K., Way, D. A. . Photosynthesis, Respiration, and Climate Change., 1st edition. , (2021).
- Yang, M., Sack, F. D. The too many mouths and four lips mutations affect stomatal production in Arabidopsis. Plant Cell. 7 (12), 2227-2239 (1995).
- Hara, K., Kajita, R., Torii, K. U., Bergmann, D. C., Kakimoto, T. The secretory peptide gene EPF1 enforces the stomatal one-cell-spacing rule. Genes & Development. 21 (14), 1720-1725 (2007).
- Hara, K., et al. Epidermal cell density is autoregulated via a secretory peptide, EPIDERMAL PATTERNING FACTOR 2 in Arabidopsis leaves. Plant & Cell Physiology. 50 (6), 1019-1031 (2009).
- Hunt, L., Gray, J. E. The signaling peptide EPF2 controls asymmetric cell divisions during stomatal development. Current Biology. 19 (10), 864-869 (2009).
- Sugano, S. S., et al. Stomagen positively regulates stomatal density in Arabidopsis. Nature. 463 (7278), 241-244 (2010).
- Kondo, T., et al. Stomatal density is controlled by a mesophyll-derived signaling molecule. Plant & Cell Physiology. 51 (1), 1-8 (2010).
- Hunt, L., Bailey, K. J., Gray, J. E. The signalling peptide EPFL9 is a positive regulator of stomatal development. New Phytologist. 186 (3), 609-614 (2010).
- Shpak, E. D., McAbee, J. M., Pillitteri, L. J., Torii, K. U. Stomatal patterning and differentiation by synergistic interactions of receptor kinases. Science. 309 (5732), 290-293 (2005).
- Lin, G., et al. A receptor-like protein acts as a specificity switch for the regulation of stomatal development. Genes & Development. 31 (9), 927-938 (2017).
- Lee, J. S., et al. Direct interaction of ligand-receptor pairs specifying stomatal patterning. Genes & Development. 26 (2), 126-136 (2012).
- Qi, X., et al. The manifold actions of signaling peptides on subcellular dynamics of a receptor specify stomatal cell fate. Elife. 9, e58097 (2020).
- MacAlister, C. A., Ohashi-Ito, K., Bergmann, D. C. Transcription factor control of asymmetric cell divisions that establish the stomatal lineage. Nature. 445 (7127), 537-540 (2007).
- Pillitteri, L. J., Sloan, D. B., Bogenschutz, N. L., Torii, K. U. Termination of asymmetric cell division and differentiation of stomata. Nature. 445 (7127), 501-505 (2007).
- Ohashi-Ito, K., Bergmann, D. C. Arabidopsis FAMA controls the final proliferation/differentiation switch during stomatal development. Plant Cell. 18 (10), 2493-2505 (2006).
- Kanaoka, M. M., et al. SCREAM/ICE1 and SCREAM2 specify three cell-state transitional steps leading to Arabidopsis stomatal differentiation. Plant Cell. 20 (7), 1775-1785 (2008).
- Bergmann, D. C., Lukowitz, W., Somerville, C. R. Stomatal development and pattern controlled by a MAPKK kinase. Science. 304 (5676), 1494-1497 (2004).
- Wang, H., Ngwenyama, N., Liu, Y., Walker, J. C., Zhang, S. Stomatal development and patterning are regulated by environmentally responsive mitogen-activated protein kinases in Arabidopsis. Plant Cell. 19 (1), 63-73 (2007).
- Ho, C. M., Paciorek, T., Abrash, E., Bergmann, D. C. Modulators of stomatal lineage signal transduction alter membrane contact sites and reveal specialization among ERECTA kinases. Developmental Cell. 38 (4), 345-357 (2016).
- Le, J., et al. Auxin transport and activity regulate stomatal patterning and development. Nature Communications. 5, 3090 (2014).
- Geldner, N., et al. The Arabidopsis GNOM ARF-GEF mediates endosomal recycling, auxin transport, and auxin-dependent plant growth. Cell. 112 (2), 219-230 (2003).
- Qi, X., et al. Autocrine regulation of stomatal differentiation potential by EPF1 and ERECTA-LIKE1 ligand-receptor signaling. Elife. 6, 24102 (2017).
- Heilemann, M., et al. Subdiffraction-resolution fluorescence imaging with conventional fluorescent probes. Angewandte Chemie. 47 (33), 6172-6176 (2008).
- Leighton, R. E., Alperstein, A. M., Frontiera, R. R. Label-free super-resolution imaging techniques. Annual Review of Analytical Chemistry. 15 (1), 37-55 (2022).
- Oreopoulos, J., Berman, R., Browne, M. Spinning-disk confocal microscopy: Present technology and future trends. Methods in Cell Biology. 123, 153-175 (2014).
- Gao, R., et al. Cortical column and whole-brain imaging with molecular contrast and nanoscale resolution. Science. 363 (6424), (2019).
- Nwaneshiudu, A., et al. Introduction to confocal microscopy. Journal of Investigative Dermatology. 132 (12), (2012).
- Sanderson, J. Multi-photon microscopy. Current Protocols. 3 (1), 634 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved