このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
気孔系譜細胞における膜輸送事象を研究するための画像ベースの手法
要約
ここでは、原形質膜受容体キナーゼの膜輸送イベントを研究するために、一般的に使用されるいくつかの方法を紹介します。この原稿では、植物材料の調製、薬理学的処理、共焦点イメージングのセットアップなど、詳細なプロトコルについて説明しています。
要約
真核細胞では、タンパク質や脂質などの膜成分が膜内システム内の目的地に時空間的に輸送されます。これには、新たに合成されたタンパク質の細胞表面または細胞外への分泌輸送、細胞外または原形質膜成分の細胞内細胞輸送、および細胞内オルガネラ間の貨物のリサイクルまたは往復輸送などが含まれます。膜輸送イベントは、すべての真核細胞の発生、成長、および環境適応にとって重要であるため、厳しい規制下にあります。細胞外空間からのリガンドシグナルを知覚する細胞表面受容体キナーゼは、分泌輸送とエンドサイトーシス輸送の両方を受けます。ここでは、原形質膜に局在するロイシンリッチリピート受容体キナーゼERL1を使用して膜輸送イベントを研究するために一般的に使用されるアプローチについて説明します。アプローチには、植物材料の調製、薬理学的処理、および共焦点イメージングのセットアップが含まれます。ERL1の時空間制御を監視するために、本研究では、ERL1と多胞体マーカータンパク質RFP-Ara7との共局在解析、これら2つのタンパク質の時系列解析、および膜輸送阻害剤であるブレフェルジンAとワートマニンで処理したERL1-YFPのzスタック解析について説明します。
概要
膜輸送は、タンパク質、脂質、その他の生物学的産物を含む膜成分(貨物とも呼ばれる)を、真核細胞内の異なる細胞小器官間または原形質膜を横切って細胞外空間との間で分配する保存された細胞プロセスです1。このプロセスは、核膜、小胞体、ゴルジ体、液胞/リソソーム、原形質膜、および複数のエンドソームで構成される膜内システムと呼ばれる膜と細胞小器官の集まりによって促進されます1。膜内システムは、これらの細胞小器官間を往復する動的小胞を使用して、膜成分の修飾、パッケージング、および輸送を可能にします。膜輸送イベントは、細胞の発生、成長、および環境適応に不可欠であるため、厳格で複雑な規制下にあります2。現在、分子生物学、ケミカルバイオロジー、顕微鏡、質量分析における複数のアプローチが開発され、膜輸送の分野に適用されており、膜内システムの時空間調節の理解を大幅に進めています3,4。分子生物学は、目的のタンパク質の遺伝子発現を変更したり、目的のタンパク質を特定のタグで標識したりするなど、膜輸送に関与する推定プレーヤーの古典的な遺伝子操作に使用されます。ケミカルバイオロジーのツールには、特定のルート4,5の交通を特に妨害する分子の使用が含まれます。質量分析は、生化学的アプローチによって機械的に単離された細胞小器官の成分を同定するのに強力です3,4。しかし、膜の交通は動的で多様で複雑な生物学的プロセスです1。さまざまな条件下で生細胞における膜輸送プロセスを可視化するには、光学顕微鏡法が不可欠なツールです。イベントの効率、動力学、および多様性を測定する際の課題を克服するために、高度な顕微鏡技術が継続的に進歩しています4。ここでは、化学/薬理生物学、分子生物学、および顕微鏡法で広く採用されている方法論に焦点を当て、自然に単純化され実験的にアクセス可能なシステムである気孔発生プロセスにおける膜輸送イベントを研究します。
気孔は、植物の空中表面上の微細孔であり、内部細胞と環境との間のガス交換を容易にするために開閉する6,7,8。したがって、気孔は光合成と蒸散に不可欠であり、植物の生存と成長に不可欠な2つのイベントです。気孔の発達は、環境の合図によって動的に調整され、植物の周囲への適応を最適化します9。2002年の研究にさかのぼり、受容体タンパク質Too Many Mouths(TMM)の同定は、モデル植物シロイヌナズナ10における気孔発生の分子メカニズムを調査する新しい時代への扉を開きました。わずか数十年後、古典的なシグナル伝達経路が同定されました。上流から下流まで、この経路には、表皮パターニング因子(EFP)ファミリーの分泌ペプチドリガンド群、EREETA(ER)ファミリーのいくつかの細胞表面ロイシンリッチリピート(LRR)受容体キナーゼ、LRR受容体タンパク質TMM、MAPKカスケード、およびスピーチレス(SPCH)、MUTE、FAMA、およびSCREAM(SCRM)11,12,13,14を含むいくつかのbHLH転写因子が含まれます 15、16、17、18、19、20、21、22、23、24、25、26。以前の研究では、受容体キナーゼの1つであるER-LIKE 1(ERL1)が、EPF知覚時に活発な細胞内挙動を示すことが示されています20。ERL2はまた、原形質膜といくつかの細胞内オルガネラとの間の動的に輸送する27。膜輸送ステップを遮断すると、異常な気孔パターニングが生じ、葉表面28上に気孔クラスターが生じる。これらの結果は、膜交通が気孔の発達に不可欠な役割を果たしていることを示唆しています。本研究では、タンパク質間細胞内共局在解析と膜輸送阻害剤を用いた薬理学的治療を組み合わせて、ERL1動態を時空間的に調べるためのプロトコルについて述べる。
プロトコル
1.溶液の調製
- 15 mLの漂白剤を35 mLの蒸留水および50 μLのTriton X-100と混合して、種子滅菌溶液を調製します。
- BFA粉末をエタノールに溶解して最終濃度10 mM(ストック)にしてブレフェルジンA(BFA)溶液を調製します。Wm粉末をDMSOに溶解してワートマニン(Wm)溶液を最終濃度10mM(ストック)に調製する。
2.種をまく
- 必要なトランスジェニック植物のそれぞれから10〜50個の種子を1.5 mLのマイクロ遠心チューブに分注します。各チューブに1 mLの種子殺菌液を加え、シェーカーで10分間チューブを静かに反転させて完全に混合します。
- 種子殺菌液を捨て、1 mLのオートクレーブ滅菌蒸留水で種子を5回洗浄します。
- 各チューブに300 μLのオートクレーブ滅菌蒸留水を加え、1%(w / v)スクロースと0.75%(w / v)寒天を含む半強度MS培地に種子を播種します。必要に応じて、対応する抗生物質を培地に補給します。
- プレートを逆さまにして4°Cの暗所で2日間保持し、発芽を同期させます。
- 2日後、プレートを22°Cで16時間の明暗サイクル(80 μmol/m2/s1)で成長室に移します。 これは発芽後の最初の日(1 dpg)と見なされます。
- さらなる成長のために10 dpgで苗を土壌に移植します。
3. 二色F1トランスジェニック植物の調製
- ERL1-YFPを有するホモ接合トランスジェニック植物(植物A)とRFP標識マーカータンパク質RFP-Ara7を有するホモ接合トランスジェニック植物(植物B)20を、22°Cで16時間の明/8時間の暗サイクル(80 μmol/m2/s1)の生育室で開花するまで並べて育てます。
- 植物Aから若い花序を選択してください遺伝的交配のために花序にちょうど開こうとしている1つの花を保ちます。古い花とシリケをすべて取り除きます。さらに、将来の混乱を避けるために、若い花と花の分裂組織を慎重に取り除きます。
- 鋭いピンセットを使用して、がく片、花びら、雄しべを取り除き、未開封の花をそっと解剖します。雌しべを花序に残すだけです。
- 植物Bの開いた花から成熟した雄しべを取り、花粉粒を植物Aの解剖された雌しべの柱頭に沈着させます。
- この手動で交配した花に、その父、母、および遺伝的交配の日付を示すことによってラベルを付けます。花を成熟させ、珪藻が黄色/茶色に変わったら(交配後~20日後)F1種子を収穫します。YFP信号とRFP信号の両方を持つ成功したF1プラントを確認します。
4.薬理学的治療
- BFA処理では、生後7日齢の苗の子葉を取り除き、残りの苗を模擬溶液(0.3%エタノール)または30μM BFA溶液のいずれかに浸し、1分間真空にし、サンプルを30分間浸漬してからイメージングします。
- 麦汁マニン処理では、7日齢の苗の子葉を取り除き、残りの苗を0.25%DMSO溶液または25 mMの麦汁マニンに浸し、1分間真空をかけ、サンプルを30分間浸してからイメージングします。
- サンプルの真空処理では、1.5 mLの微量遠心管に500 μLの対応する薬液を加え、解剖した苗を溶液に浸します。10 mLのシリンジをマイクロ遠心チューブにしっかりと取り付け、1分間真空にします(図1)。シリンジを取り外し、サンプルを必要な時間溶液に保持します。イメージングの準備のために苗をそっと取り出します。

図1:シンプルな真空装置。 真空処理のために、1.5 mLのマイクロ遠心チューブに10 mLのシリンジが取り付けられています。 この図の拡大版を表示するには、ここをクリックしてください。
5. イメージングのためのサンプル調製
- 鋭いかみそりの刃を使用して、処理されたサンプルから本物の葉を解剖します。スライドガラスの上の水滴に本物の葉をそっと入れ、軸側を上に保ちます。泡を閉じ込めないようにしながら、本物の葉をカバーガラスでゆっくりと覆います。
6. 共焦点イメージング
注:この研究では、ライカSP8倒立走査型共焦点顕微鏡を使用して、サンプルの蛍光信号を画像化しました。
- ビームパスの設定
- YFP励起には514nmレーザーを選択してください。高いレーザー出力を使用して信号強度を高め、高画質を実現します。ただし、5%を超えるレーザー出力は光退色のリスクがあり、サンプルの健康に影響を与える可能性があります。サンプル信号が暗すぎない場合は、低いレーザー強度から始めます。
- 検出のためにPMT/HyDをオンにし、YFP蛍光色素のスペクトルに基づいて発光バンドの上限と下限の閾値を定義します。YFP信号を収集するために、530〜570nmの検出ウィンドウを設定します。
- 2番目の色のシーケンシャルイメージング:Seqボタンをクリックして、新しいチャンネルを追加します。デフォルトでは、以前に設計されたYFPビームパスはシーケンス1になります。シーケンス2では、RFP励起に561 nmレーザーを選択し、RFP信号を収集するために570〜630 nmの検出ウィンドウを設定します。
- スキャン条件の設定(図2)
- 気孔前駆細胞内の細胞内膜交通活動をイメージングするには、イメージング用のシステム上の63x/1.2 W Corrレンズを選択します。
- 形式は、ピクセル単位の画像サイズを参照します。1,024 ピクセル x 1,024 ピクセルから始めて、ズーム倍率と目標設定に基づいてこれを最適化して、パブリケーション品質の解像度を高めます。
- 速度とは、レーザーが各ピクセルを通過するときのスキャンヘッドの速度を指します。スキャン速度が遅いと信号対雑音比が向上することがよくありますが、急速に変化する膜輸送イベントを効率的にキャプチャできない場合があります。400 Hzの速度から始めて、サンプルの特定の状況に基づいてこれを最適化します。
- ズーム係数は、対物レンズを変更せずに関心領域を拡大するために使用されます。ズーム倍率 1 から始めて、実験の特定のニーズに基づいてこれを最適化します。
- 線の平均とは、平均結果を得るために各X線をスキャンする回数を指します。線の平均を大きくすると、結果の画像のノイズが減少しますが、スキャン時間とレーザー光への露光時間も長くなります。膜輸送イベントを画像化するには、高いライン平均を使用しないでください。2倍のライン平均から始めて、必要に応じて最適化します。
- 時系列の収集
注:膜輸送イベントを研究する場合、細胞内エンドソームの急速な動きを記録するために時系列が必要になることがよくあります。- [集録モード]で、xytスキャンモードを選択して時系列ユーティリティを有効にします。
- [時間間隔] で、時点間の待機期間を決定します。または、[最小化]をクリックして、画像を次々にすぐに撮影します。7秒の時間間隔を次の時系列実験で使用しました。
- [期間] を選択し、実験を実行する合計時間を入力します。または、[フレーム]を選択して、収集するフレーム数を定義します(図3)。
- セル全体の膜輸送イベントに関する3次元情報を収集するには、Zスタックスキャンモードを使用します。Zスタック画像の最大強度投影は、多くの場合、分析に使用されます。
- アクイジションモードでxyzスキャンモードを選択すると、Z-Stackユーティリティにアクセスできるようになります。
- [Z 幅] オプションを選択します。[スキャン モード]で、[開始]ボタンと[終了]ボタンを使用して、Z スタックの上部の画像と下部の画像を定義します。
- Z ステップの太さを定義するには、Z ステップのサイズをクリックします。または、Z スタックの全範囲をカバーするために撮影する画像の数を定義します。サンプル間の一貫性を確保するには、zステップのサイズを定義します(図4)。
- 画像処理
- zスタック画像の最大強度投影は、共焦点ソフトウェア(http://www.leica-microsystems.com)によって生成されます。プライマリ [プロセス] タブで、まず、左端の [プロジェクトを開く] タブの下にある目的の z-stack ファイルを選択します。次に、[プロセスツール]という名前の中央のタブに切り替え、[投影]機能を選択し、[メソッド]のドロップダウンパネルで[最大]を選択して、[適用]ボタンをクリックします。Z スタック投影イメージが [開いているプロジェクト] タブの下に生成されます。
- 時系列画像のビデオはフィジー(https://imagej.net/Fiji)によって生成されます。[ファイル] タブで、[開く] 関数を使用して、すべての時系列画像を正しい順序で開きます。[画像]タブで、[スタック]関数を見つけ、[スタックする画像]を選択してビデオを生成します。希望のフレームレート(ビデオ1の場合は5フレーム/秒)で.avi形式でファイルを保存します。
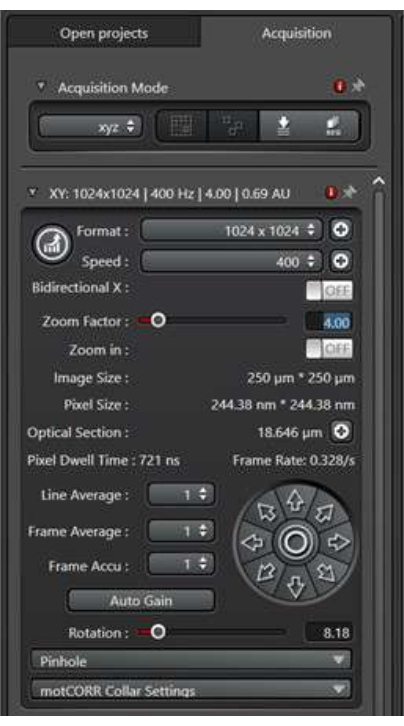
図2:XY寸法のスキャンモードパネル。 スキャンモードパネルは、イメージスキャン条件を設定するために使用します。 この図の拡大版を表示するには、ここをクリックしてください。
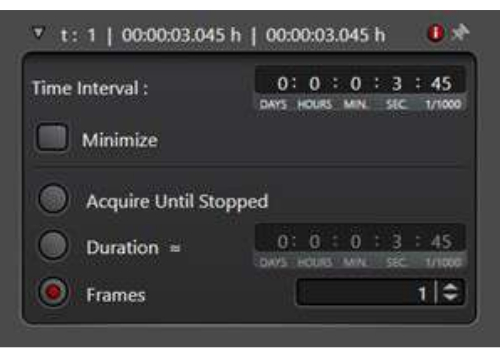
図3:xytスキャンモードでの時系列ユーティリティ。 時系列ユーティリティは、一連の画像を連続して収集するためのイメージング条件を設定するために使用されます。 この図の拡大版を表示するには、ここをクリックしてください。
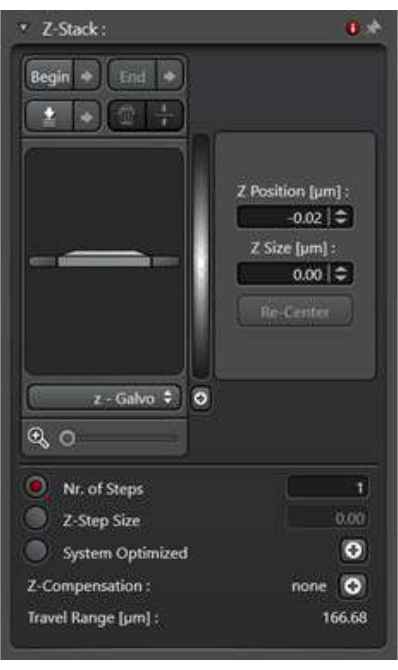
図4:xyzスキャンモードでのzスタックユーティリティ。 z-stackユーティリティは、z軸上の一連の画像を収集するためのイメージング条件を設定するために使用されます。 この図の拡大版を表示するには、ここをクリックしてください。
結果
以前の研究では、ERL1は動的な膜輸送イベントを受ける活性受容体キナーゼであることが示されました20。ERL1は、原形質膜上の膜貫通LRR受容体キナーゼです。小胞体で新たに合成されたERL1はゴルジ体で処理され、さらに原形質膜に輸送されます。原形質膜上のERL1分子は、それらの細胞外LRRドメイン18を用いてEPFリガンドを知覚することができる。EPF1を含む?...
ディスカッション
膜内システムは、真核細胞の細胞質を異なる区画に分離し、これらの細胞小器官の特殊な生物学的機能を可能にします。貨物タンパク質と高分子を適切なタイミングで最終目的地に送達するために、多数の小胞がこれらの細胞小器官間を往復するように誘導されます。高度に制御された膜輸送イベントは、細胞の生存率、発生、および成長において基本的な役割を果たします。この重要で複?...
開示事項
著者は利益相反を宣言しません。
謝辞
この研究は、国立科学財団(IOS-2217757)(X.Q.)およびアーカンソー医科大学(UAMS)ブロンソン財団賞(H.Z.)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 10 mL syringes | VWR | BD309695 | Vacuum samples |
| Brefeldin A (BFA) | Sigma | B7651 | membrane trafficking drug |
| Confocal Microscope | Leica | Lecia SP8 TCS with LAS-X software package | Imaging |
| Dissecting Forceps | VWR | 82027-402 | Genetic cross |
| Fiji | NIH | https://imagej.net/Fiji | Image processing |
| Leica LAS AF software | Leica | http://www.leica-microsystems.com | Image processing |
| transgenic seeds of ERL1-YFP | Qi, X. et al. The manifold actions of signaling peptides on subcellular dynamics of a receptor specify stomatal cell fate. Elife. 9, doi:10.7554/eLife.58097, (2020). | ||
| transgenic seeds of RFP-Ara7 | Ebine, K. et al. A membrane trafficking pathway regulated by the plant-specific RAB GTPase ARA6. Nat Cell Biol. 13 (7), 853-859, doi:10.1038/ncb2270, (2011). | ||
| Wortmannin (Wm) | Sigma | W1628 | membrane trafficking drug |
参考文献
- Aniento, F., Sanchez de Medina Hernandez, V., Dagdas, Y., Rojas-Pierce, M., Russinova, E. Molecular mechanisms of endomembrane trafficking in plants. Plant Cell. 34 (1), 146-173 (2022).
- Sigismund, S., et al. Endocytosis and signaling: Cell logistics shape the eukaryotic cell plan. Physiological Reviews. 92 (1), 273-366 (2012).
- Lyu, Z., Genereux, J. C. Methodologies for measuring protein trafficking across cellular membranes. ChemPlusChem. 86 (10), 1397-1415 (2021).
- Rodriguez-Furlan, C., Raikhel, N. V., Hicks, G. R. Merging roads: Chemical tools and cell biology to study unconventional protein secretion. Journal of Experimental Botany. 69 (1), 39-46 (2017).
- Foissner, I., Sommer, A., Hoeftberger, M., Hoepflinger, M. C., Absolonova, M. Is wortmannin-induced reorganization of the trans-Golgi network the key to explain charasome formation. Frontiers in Plant Science. 7, 756 (2016).
- Qi, X., Torii, K. U. Hormonal and environmental signals guiding stomatal development. BMC Biology. 16 (1), 21 (2018).
- Han, S. K., Kwak, J. M., Qi, X. Stomatal lineage control by developmental program and environmental cues. Frontiers in Plant Science. 12, 751852 (2021).
- Bharath, P., Gahir, S., Raghavendra, A. S. Abscisic acid-induced stomatal closure: An important component of plant defense against abiotic and biotic stress. Frontiers in Plant Science. 12, 615114 (2021).
- Becklin, K. M., Ward, J. K., Way, D. A. . Photosynthesis, Respiration, and Climate Change., 1st edition. , (2021).
- Yang, M., Sack, F. D. The too many mouths and four lips mutations affect stomatal production in Arabidopsis. Plant Cell. 7 (12), 2227-2239 (1995).
- Hara, K., Kajita, R., Torii, K. U., Bergmann, D. C., Kakimoto, T. The secretory peptide gene EPF1 enforces the stomatal one-cell-spacing rule. Genes & Development. 21 (14), 1720-1725 (2007).
- Hara, K., et al. Epidermal cell density is autoregulated via a secretory peptide, EPIDERMAL PATTERNING FACTOR 2 in Arabidopsis leaves. Plant & Cell Physiology. 50 (6), 1019-1031 (2009).
- Hunt, L., Gray, J. E. The signaling peptide EPF2 controls asymmetric cell divisions during stomatal development. Current Biology. 19 (10), 864-869 (2009).
- Sugano, S. S., et al. Stomagen positively regulates stomatal density in Arabidopsis. Nature. 463 (7278), 241-244 (2010).
- Kondo, T., et al. Stomatal density is controlled by a mesophyll-derived signaling molecule. Plant & Cell Physiology. 51 (1), 1-8 (2010).
- Hunt, L., Bailey, K. J., Gray, J. E. The signalling peptide EPFL9 is a positive regulator of stomatal development. New Phytologist. 186 (3), 609-614 (2010).
- Shpak, E. D., McAbee, J. M., Pillitteri, L. J., Torii, K. U. Stomatal patterning and differentiation by synergistic interactions of receptor kinases. Science. 309 (5732), 290-293 (2005).
- Lin, G., et al. A receptor-like protein acts as a specificity switch for the regulation of stomatal development. Genes & Development. 31 (9), 927-938 (2017).
- Lee, J. S., et al. Direct interaction of ligand-receptor pairs specifying stomatal patterning. Genes & Development. 26 (2), 126-136 (2012).
- Qi, X., et al. The manifold actions of signaling peptides on subcellular dynamics of a receptor specify stomatal cell fate. Elife. 9, e58097 (2020).
- MacAlister, C. A., Ohashi-Ito, K., Bergmann, D. C. Transcription factor control of asymmetric cell divisions that establish the stomatal lineage. Nature. 445 (7127), 537-540 (2007).
- Pillitteri, L. J., Sloan, D. B., Bogenschutz, N. L., Torii, K. U. Termination of asymmetric cell division and differentiation of stomata. Nature. 445 (7127), 501-505 (2007).
- Ohashi-Ito, K., Bergmann, D. C. Arabidopsis FAMA controls the final proliferation/differentiation switch during stomatal development. Plant Cell. 18 (10), 2493-2505 (2006).
- Kanaoka, M. M., et al. SCREAM/ICE1 and SCREAM2 specify three cell-state transitional steps leading to Arabidopsis stomatal differentiation. Plant Cell. 20 (7), 1775-1785 (2008).
- Bergmann, D. C., Lukowitz, W., Somerville, C. R. Stomatal development and pattern controlled by a MAPKK kinase. Science. 304 (5676), 1494-1497 (2004).
- Wang, H., Ngwenyama, N., Liu, Y., Walker, J. C., Zhang, S. Stomatal development and patterning are regulated by environmentally responsive mitogen-activated protein kinases in Arabidopsis. Plant Cell. 19 (1), 63-73 (2007).
- Ho, C. M., Paciorek, T., Abrash, E., Bergmann, D. C. Modulators of stomatal lineage signal transduction alter membrane contact sites and reveal specialization among ERECTA kinases. Developmental Cell. 38 (4), 345-357 (2016).
- Le, J., et al. Auxin transport and activity regulate stomatal patterning and development. Nature Communications. 5, 3090 (2014).
- Geldner, N., et al. The Arabidopsis GNOM ARF-GEF mediates endosomal recycling, auxin transport, and auxin-dependent plant growth. Cell. 112 (2), 219-230 (2003).
- Qi, X., et al. Autocrine regulation of stomatal differentiation potential by EPF1 and ERECTA-LIKE1 ligand-receptor signaling. Elife. 6, 24102 (2017).
- Heilemann, M., et al. Subdiffraction-resolution fluorescence imaging with conventional fluorescent probes. Angewandte Chemie. 47 (33), 6172-6176 (2008).
- Leighton, R. E., Alperstein, A. M., Frontiera, R. R. Label-free super-resolution imaging techniques. Annual Review of Analytical Chemistry. 15 (1), 37-55 (2022).
- Oreopoulos, J., Berman, R., Browne, M. Spinning-disk confocal microscopy: Present technology and future trends. Methods in Cell Biology. 123, 153-175 (2014).
- Gao, R., et al. Cortical column and whole-brain imaging with molecular contrast and nanoscale resolution. Science. 363 (6424), (2019).
- Nwaneshiudu, A., et al. Introduction to confocal microscopy. Journal of Investigative Dermatology. 132 (12), (2012).
- Sanderson, J. Multi-photon microscopy. Current Protocols. 3 (1), 634 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved