A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التأثيرات العلاجية ل مغلي Huazhuojiedu على الآفات السرطانية لسرطان المعدة عن طريق تنظيم الانقسام
In This Article
Summary
هنا ، نقدم بروتوكولا يوضح الفعالية العلاجية لمغلي Huazhuojiedu (HZJD) في التخفيف من الآفات السرطانية لسرطان المعدة باستخدام تنظيم الانقسام.
Abstract
يهدف هذا البحث إلى استكشاف التأثير العلاجي والآليات المحتملة لمغلي Huazhuojiedu (HZJD) للتخفيف من الآفات السرطانية لسرطان المعدة (PLGC) في الجسم الحي وفي المختبر. HZJD هي تركيبة عشبية صينية تقليدية تتكون من 11 عشبا. تم تقسيم فئران Sprague-Dawley (SD) بشكل عشوائي إلى أربع مجموعات فرعية: المجموعة الضابطة ، والمجموعة النموذجية ، ومجموعة الأدوية الإيجابية ، ومجموعة HZJD. تم إجراء تلطيخ الهيماتوكسيلين يوزين (H & E) ، وتلوين عالي الحديد ثنائي الأمين والأزرق ألسيان (HID-AB) ، وتلوين حمض ألسيان الأزرق الدوري شيف (AB-PAS) ، والكيمياء المناعية ، والتألق المناعي ، و RT-qPCR ، وفحوصات اللطخة الغربية بعد 10 أسابيع من العلاج ب HZJD. في المختبر ، تم استخدام فحوصات مجموعة عد الخلايا -8 (CCK-8) و 5-ethynyl-2'-deoxyuridine (EdU) للكشف عن تكاثر الخلايا. تم إجراء فحوصات RT-qPCR و Western blot لتقييم مستويات الانقسام. أشارت النتائج إلى أن HZJD يمكن أن يؤخر التقدم المرضي في فئران PLGC ويقلل من تكاثر خلايا PLGC. أدى العلاج ب HZJD إلى زيادة كبيرة في مستويات التعبير عن الرنا المرسال والبروتين ل Sirt3 و Foxo3a و Parkin و LC3 II / I ، مع تقليل مستويات التعبير عن mRNA والبروتين ل p62 و Tomm20. وجد أن HZJD لديه القدرة على عكس الانخفاض في نشاط الانقسام في كل من الجسم الحي وفي المختبر. في الختام ، قيمت الدراسة تأثير HZJD وقدمت أدلة بشأن آليته الجزيئية المحتملة.
Introduction
لا يزال سرطان المعدة (GC) أحد أكثر الأمراض الخبيثة شيوعا التي تصيب الجهاز الهضمي في جميع أنحاء العالم. تشير التقديرات إلى أن GC يمثل ما يقرب من 6٪ من جميع أنواع السرطان في جميع أنحاء العالم ، ويحتل المرتبة الخامسةبين أكثر أنواع السرطان التي يتم تشخيصها بشكل متكرر و3rd بين الوفيات المرتبطة بالسرطان1. يعرف GC على نطاق واسع بأنه عملية بيولوجية تقدمية متعددة الخطوات. قبل ظهور GC ، غالبا ما يخضع الغشاء المخاطي في المعدة لعدة سنوات من الآفات محتملة التسرطن ، والتي يشار إليها باسم الآفات السرطانية لمراحل سرطان المعدة (PLGC). نظرية Correa Cascade مقبولة على نطاق واسع وتقدم تفسيرا للتطور المتسلسل من الغشاء المخاطي الطبيعي إلى التهاب المعدة المزمن غير الضموري ، والتهاب المعدة الضموري ، وحؤول الأمعاء (IM) ، وخلل التنسج (Dys) ، وفي النهاية السرطان2. يمثل PLGC مرحلة حاسمة في تطوير GC ، والتدخل في الوقت المناسب ومراقبة PLGC أمر حيوي للوقاية المبكرة من GC.
أكدت التقييمات السريرية الحديثة والأبحاث التجريبية أن الطب الصيني التقليدي (TCM) يبرز كواحد من أكثر العلاجات فعالية لعلاج PLGC3،4. مغلي HZJD عبارة عن تركيبة للطب الصيني التقليدي تم تطويرها بناء على الخبرة السريرية ومتجذرة في نظرية الطب الصيني التقليدي لإزالة الحرارة والرطوبة. أظهرت الدراسات السابقة الآثار المفيدة لمغلي HZJD في علاج PLGC ، لا سيما في تخفيف الأعراض السريرية والمظاهر المرضية5،6. من خلال الدراسات المتعلقة بعلم الأدوية الشبكي ، حددنا المكونات النشطة لمغلي HZJD بالإضافة إلى أهدافها المحتملة ل PLGC7. أشارت نتائج دراسة سابقة إلى أن مغلي HZJD لديه القدرة على تعزيز التنوع ، وتحسين هيكل المجتمع ، وزيادة الوفرة النسبية للنباتات المعوية في فئران PLGC8. علاوة على ذلك ، تم التحقق من أن مغلي HZJD يمكن أن يحسن PLGC من خلال تنظيم الجراثيم المعوية ومستقلباتها9. في العمل الأخير ، أظهرنا أن مغلي HZJD يمكن أن ينظم التوازن الديناميكي لتكاثر الخلايا وموت الخلايا المبرمج في خلايا PLGC عن طريق تقليل تنظيم التعبير عن lnc 51736810.
أكد عدد متزايد من الدراسات أن الانقسام يلعب دورا مهما في أنواع السرطان المختلفة. يزيل الانقسام بشكل انتقائي الميتوكوندريا التالفة وإزالة الاستقطاب ويمنع التراكم المفرط لأنواع الأكسجين التفاعلي السامة للخلايا (ROS) من الميتوكوندريا المختلة ، والتي بدورها تمنع تكوين الأورام11. يرتبط الانقسام ، وهو التحلل الانتقائي للميتوكوندريا التالفة أو المختلة وظيفيا ، ارتباطا وثيقا بالفسفرة المؤكسدة للميتوكوندريا (OXPHOS). يمكن أن يؤدي ضعف أو عدم وجود انقسام الخلايا إلى تحول في استقلاب الطاقة الخلوية نحو تحلل السكر الهوائي ، وهي ظاهرة تعرف باسم تأثير واربورغ. يساهم الإنتاج المتزايد لأجسام اللاكتات والكيتون ، الناتج عن تأثير واربورغ ، في بناء بيئة مكروية للورم تساعد على تكاثرالخلايا 12.
تقدم هذه الدراسة بروتوكولا شاملا لاستخدام مغلي HZJD كنهج علاجي للتخفيف من تطور PLGC. من خلال تقييمنا ، لاحظنا تأثيرا إيجابيا كبيرا لمغلي HZJD ، لا سيما في قدرته على تنظيم الانقسام. تقدم الدراسة رؤى قيمة حول الآليات الجزيئية المحتملة لمغلي HZJD في علاج PLGC.
Protocol
تمت الموافقة على جميع الإجراءات التجريبية ورعاية من قبل إرشادات لجنة رعاية واستخدام المؤسسي بجامعة خبي للطب الصيني التقليدي (رقم الموافقة: DWLL2019031) وتم إجراؤها وفقا للإرشادات الأخلاقية. تم رفع ما مجموعه 90 فأرا من ذكور Sprague-Dawley (SD) الخالية من مسببات الأمراض (العمر = 6 أسابيع ؛ الوزن = 150-180 جم ؛ انظر جدول المواد) عند درجة حرارة ثابتة (24 درجة مئوية ± 4 درجات مئوية) والرطوبة (50٪ -60٪) تحت دورة مظلمة / ضوئية خاضعة للرقابة لمدة 12 ساعة. تأقلمت الفئران مع البيئة الجديدة لمدة أسبوع واحد قبل بدء التجارب.
1. التحضير للتجربة على
- نموذج الفئران من PLGC
- قم بتعيين الفئران بشكل عشوائي لمجموعة تحكم (ن = 20) ومجموعة نموذج PLGC (ن = 70). تزويد الفئران في المجموعة الضابطة بنظام غذائي قياسي من حبيبات القوارض والماء المجاني. قم بإطعام الفئران في مجموعة نموذج PLGC بنظام غذائي غير منتظم (1 يوم صيام ، 1 يوم رضاعة).
- إيواء الفئران في مجموعات من خمسة لكل قفص. تزويد المجموعة الضابطة ب 150 جم / يوم من العلف لكل قفص. اسمح لمجموعة طرازات PLGC بالوصول المجاني إلى الطعام لمدة 23 ساعة (150 جم / يوم / لكل قفص). بعد 23 ساعة ، قم بإزالة العلف المتبقي.
- تزويد الفئران في مجموعة نموذج PLGC بمحلول 1-methyl-3-nitro-1-nitrosoguanidine (MNNG) (200 ميكروغرام / مل) للشرب المجاني10،13. تزويد الفئران في مجموعة طرازات PLGC ب 200 مل من محلول MNNG لكل قفص. ضع محلول MNNG في زجاجات شرب غير شفافة واستبدله يوميا.
- تزقيم الفئران في مجموعة نموذج PLGC مع 2٪ ساليسيلات الصوديوم بعد 24 ساعة من الصيام (مرة كل يومين عن طريق التزقيم). للتزقيم ، استخدم إبرة سيليكون (انظر جدول المواد) بعمق لا يقل عن 6 سم. قم بإجراء التزقيم باستمرار في نفس الوقت في الصباح بين الساعة 8:30 صباحا و 9:30 صباحا.
- اختر فئران عشوائيا من مجموعة نموذج PLGC للفحص المرضي في الأسابيع 12 و 16 و 20 و 24 من أجل تقييم إنشاء نموذج PLGC. اعتبر النموذج ناجحا عندما يتم تشخيص كلا الفئران ب PLGC عن طريق التقييم المرضي كما هو موضح في9.
- تستغرق عملية النمذجة هذه حوالي 24 أسبوعا. السماح بإجراء التقييم المرضي بشكل مستقل من قبل اثنين من كبار أخصائيي علم الأمراض. تحديد التشخيص المرضي ل PLGC في الفئران من خلال التقييم التعاوني لاثنين من أخصائيي علم الأمراض. ضع آرائهم التشخيصية في الاعتبار واستخدم الإرشادات السابقة كمرجع أثناء عملية التقييم14،15،16،17.
- تحضير مغلي HZJD
- تحضير مغلي HZJD وفقا للطريقة الموضحة في7.
ملاحظة: تم شراء الأعشاب الموجودة في مغلي HZJD والمصادقة عليها من قبل مستشفى خبي للطب الصيني التقليدي.
- تحضير مغلي HZJD وفقا للطريقة الموضحة في7.
- التجميع والتدخل الدوائي
- قسم مجموعة نموذج PLGC بشكل عشوائي إلى ثلاث مجموعات فرعية: المجموعة النموذجية (ن = 20) ، ومجموعة الأدوية الإيجابية (ن = 20) ، ومجموعة مغلي Huazhuojiedu (HZJD ، ن = 20 ، الجدول 1).
- قم بتزقيم الفئران في مجموعة الأدوية الإيجابية ب 0.7 مجم / كجم / يوم من فيتامين ب 12 عن طريق التزقيم18. عالج الفئران في مجموعة HZJD مع مغلي HZJD بمعدل 14.81 جم / كجم / يوم8. يتم تطبيق الفئران في المجموعة الضابطة والمجموعة النموذجية بالماء المقطر (10 مل / كغ). تتلقى المجموعات الأربع الإعطاء داخل المعدة مرة واحدة يوميا لمدة 10 أسابيع.
ملاحظة: الجرعة اليومية الموصى بها من مغلي HZJD للإنسان هي 142 جم / يوم10. باستخدام طريقة حساب مساحة سطح الجسم ، تقرر أن الجرعة الموصى بها للفئران هي 6.25x من البشر. لذلك ، فإن الجرعة اليومية من مغلي HZJD للفئران هي 14.81 جم / كجم. تم تعديل الجرعة أسبوعيا وفقا لوزن الفئران. لم يتجاوز الحد الأقصى لحجم التزقيم 3 مل.
- جمع العينات
- ضحي بجميع الفئران بعد 24 ساعة من الصيام (مع حرية الوصول إلى الماء) في الأسبوع 35. قم بتخدير جميع الفئران بالأيزوفلوران (5٪ تحريض ، 2٪ للصيانة ، معدل تدفق 1 لتر / دقيقة).
- حلق منطقة البطن وتعقيم الجلد بالإيثانول واليود بعد التأكد من فقدان تحفيز الألم. قطع جلد البطن من الغضروف الخنجري على طول خط الوسط للبطن بمشرط.
- حادة افصل الأنسجة تحت الجلد بالملقط والمشرط حتى تعريض المعدة. قم بتشريح المعدة على طول الانحناء الأكبر باستخدام مقص واشطفها على الفور بمحلول ملحي مخزن بالفوسفات (PBS).
- افتح أنسجة المعدة على صفيحة جليدية. اجمع عينات المعدة (2 مم × 2 مم) من الفرع والجسم والانحناء الأصغر للمنطقة الزاوية. إذا كان هناك أي آفات مرئية على المعدة ، فقم بجمع ومعالجة تلك الأجزاء المحددة كعينات.
- إصلاح عينات المعدة في 4٪ بارافورمالدهيد لمدة 24 ساعة. ضع أنسجة المعدة المتبقية في أنابيب التبريد. قم بتجميدها في النيتروجين السائل ، ثم قم بتخزينها عند -80 درجة مئوية.
- قتل الفئران عن طريق استنشاق ثاني أكسيد الكربون. ضع جثث الفئران في أكياس محكمة الغلق ثم ضع الأكياس في خزانة تخزين جثة.
2. الفحص المرضي
- تقليم وتنعيم أنسجة المعدة الثابتة بالمقص. تجفيف الأنسجة بسلسلة كحول متدرجة ، أي 75٪ إيثانول لمدة 30 دقيقة ، و 85٪ إيثانول لمدة 30 دقيقة ، و 95٪ إيثانول لمدة 30 دقيقة ، و 2x في الإيثانول اللامائي لمدة 30 دقيقة لكل منهما. اغمر الأنسجة في محلول الزيلين / الإيثانول (1: 1) لمدة ساعة واحدة ، و 2x في 100٪ الزيلين لمدة 30 دقيقة لكل منهما.
- صب نصف الشمع المنصهر في القالب ، ثم ضع الأنسجة المنفذة في القالب بسرعة. ضع الأنسجة في النصف الآخر من الشمع المنصهر. ضع علامة على الصندوق المضمن واترك الشمع يتجمد تماما.
- استخدم الميكروتوم لتقطيعه إلى شرائح بسمك 4 ميكرومتر. ضع الشرائح على الشرائح.
- ضع الشرائح 2x في 100٪ زيلين لمدة 10 دقائق لكل منهما ، ثم في محلول الزيلين / الإيثانول (1: 1) لمدة 10 دقائق ، 2x مرة أخرى في الإيثانول اللامائي لمدة 5 دقائق ، ثم في 95٪ إيثانول لمدة 5 دقائق ، متبوعا بنسبة 85٪ إيثانول لمدة 5 دقائق ، وأخيرا في 70٪ إيثانول لمدة 5 دقائق. شطف الشرائح بالماء الجاري.
- تلطخ الشرائح بالهيماتوكسيلين لمدة 5 دقائق. تفريق عن طريق الغمس في 0.5٪ حمض الهيدروكلوريك والإيثانول لمدة 10 ثوان. تلطخ الشرائح باليوزين لمدة 2 دقيقة.
- شطف الشرائح بالماء المقطر. قم بتجفيف الشرائح بسلسلة كحول متدرجة ، أي 70٪ إيثانول لمدة 30 ثانية ، و 80٪ إيثانول لمدة 30 ثانية ، و 95٪ إيثانول لمدة 30 ثانية ، والإيثانول اللامائي لمدة 30 ثانية. تخلل الشرائح بنسبة 100٪ زيلين 2x. ختم الشرائح بالبلسم المحايد.
- امزج محلول HID A ومحلول HID B بنسبة 50: 3 لإعداد حل عمل HID. تلطخ الشرائح بمحلول عمل HID لمدة 24 ساعة.
- اشطفها تحت الماء الجاري ثم تلطخ الشرائح بالألسيا لمدة 20 دقيقة. قم بتغطية الشرائح بالمحلول الأحمر السريع لمدة 10 دقائق. جفف الشرائح وأغلقها كما هو موضح في الخطوة 2.6.
- تلطخ الشرائح بالألسيان لمدة 20 دقيقة. احتضان الشرائح في محلول مائي 1٪ من الحمض الدوري لمدة 5 دقائق. تلطخ الشرائح ب Schiff لمدة 20 دقيقة.
- احتضان الشرائح مع الهيماتوكسيلين لمدة 2 دقيقة لتلطيخ النوى. أضف محلول التمايز الحمضي (المرفق مع مجموعة HID) لمدة 5 ثوان. ضع محلول سكوت الأزرق لمدة 3 دقائق لتلوين الشرائح باللون الأزرق. جفف الشرائح وأغلقها كما هو موضح أعلاه في الخطوة 2.6.
ملاحظة: يجب حماية عملية التلوين من الضوء. يجب أن تبقى درجة الحرارة أقل من 22 درجة مئوية عند استخدام محلول مائي 1٪ من الحمض الدوري. يجب تجفيف الشرائح وإغلاقها كما هو موضح في الخطوة 2.6. - افحص الشرائح الملطخة تحت المجهر البصري بتكبير 10x و 20x.
3. الكيمياء المناعية
- استخدم الشرائح التي تم الحصول عليها في الخطوة 2.4. ضعي الشرائح في محلول 0.01 M من سترات الصوديوم وسخنيها لمدة 10 دقائق لإجراء استرجاع المستضد.
- أضف 3٪ بيروكسيد الهيدروجين لمدة 30 دقيقة لإخماد البيروكسيديز والبيوتين الداخلي. امنع الشرائح بمصل الماعز لمدة 30 دقيقة.
- احتضان الشرائح بالأجسام المضادة الأولية المخففة ضد sirt3 (1: 200) و foxo3a (1: 100) و parkin (1: 200) طوال الليل عند 4 درجات مئوية. استبدل الأجسام المضادة الأولية ب PBS للتحكم السلبي.
- اشطف الشرائح 3 مرات لمدة 5 دقائق لكل شطف باستخدام PBS. احتضان الشرائح بالجسم المضاد الثانوي المقابل في درجة حرارة الغرفة لمدة 1 ساعة.
- أضف 20 ميكرولتر من 3,3'-ديامينوبنزيدين (DAB) لمدة 3 دقائق. جفف الشرائح وأغلقها كما هو موضح أعلاه في الخطوة 2.6.
- صور جميع الشرائح بتكبير 40x تحت المجهر البصري. استخدم برنامج Image-Pro Plus 6.0 لإجراء تحليل كمي للصور.
4. التألق المناعي
- استخدم الشرائح التي تم الحصول عليها في الخطوة 3.1. كرر الخطوة 3.3.
- احتضان الشرائح بالأجسام المضادة الأولية المخففة ضد COX IV (1: 500) و LC3 (1: 500) بين عشية وضحاها عند 4 درجات مئوية. اشطف الشرائح 3 مرات لمدة 5 دقائق لكل شطف باستخدام PBS.
- احتضان الشرائح باستخدام الماعز المضاد للأرانب IgG (1: 1000) والماعز المضاد للفأر IgG (1: 1000) في درجة حرارة الغرفة لمدة 1.5 ساعة. اشطف الشرائح 3 مرات لمدة 5 دقائق لكل شطف باستخدام PBS.
- أضف محلول تلطيخ DAPI واحتضنه في درجة حرارة الغرفة لمدة 10 دقائق في الظلام. اشطف الشرائح 3 مرات لمدة 5 دقائق لكل شطف باستخدام PBS.
- أضف محلول تلطيخ DAPI المتساقط واحتضنه في درجة حرارة الغرفة لمدة 10 دقائق في الظلام. قم بتركيب الشرائح بوسيط تركيب مضان مضاد للبهتان.
- تصور وتصوير الشرائح تحت المجهر الفلوري (انظر جدول المواد) بتكبير 40x.
5. تحليل اللطخة الغربية
- تزن 100 مجم من أنسجة المعدة بدقة. أضف 1 مل من محلول RIPA المؤقت (انظر جدول المواد). طحن الأنسجة جيدا باستخدام الخالط (10,000 × جم ، 15 ثانية في كل مرة لمدة 3 أضعاف).
- ضع الأنسجة متجانسة على الجليد لمدة 30 دقيقة. جهاز طرد مركزي عند 12,000 × جم لمدة 20 دقيقة عند 4 درجات مئوية ، ثم جمع المادة الطافية.
- حدد تركيز البروتين باستخدام مجموعة أدوات تحديد تركيز بروتين حمض البيسنشونينيك (BCA) (انظر جدول المواد). اضبط تركيز البروتين للطافي الذي تم الحصول عليه ليكون متسقا داخل العينات.
- قم بإعداد جل SDS-PAGE الذي يتكون من جل فصل بنسبة 10٪ وجل تكديس بنسبة 5٪. صب جل الفصل بنسبة 10٪ في الصفيحة الزجاجية إلى 2/3 من الارتفاع الإجمالي. أضف الماء منزوع الأيونات فوق الجل حتى يتجمد الجل. صب جل التكديس بنسبة 5٪ لملء اللوحة الزجاجية. أدخل مشط الرحلان الكهربائي.
ملاحظة: يجب توخي الحذر للتأكد من عدم وجود فقاعات في الجل. - امزج المادة الطافية للبروتين مع مخزن مؤقت للتحميل 5x بنسبة 1: 4. ضعه في الماء المغلي لمدة 5 دقائق حتى يفسدها. قم بتخزينه في -20 درجة مئوية.
- قم بتجميع جل SDS-PAGE المحضر في نظام الرحلان الكهربائي الغربي. أضف محلول الرحلان الكهربائي الجديد (انظر جدول المواد). قم بتحميل 20 ميكرولتر من العينة لكل بئر على الجل. ابدأ الرحلان الكهربائي عند 80 فولت لمدة 40 دقيقة ثم قم بالتبديل إلى 120 فولت.
- اجمع الجل وقم بإنشاء شطيرة نقل على النحو التالي: طبقتان من الوسادة الإسفنجية ، طبقتان من ورق الترشيح ، الجل ، غشاء فلوريد البولي فينيلدين (PVDF) (انظر جدول المواد) ، طبقتان من ورق الترشيح ، طبقتان من وسادة الإسفنج (من القطب السالب إلى القطب الموجب). أضف مخزن مؤقت للنقل المبرد مسبقا. قم بإجراء النقل الرطب عند 350 مللي أمبير لمدة 2 ساعة.
ملاحظة: قبل تجميع شطيرة النقل ، يجب معالجة غشاء PVDF مسبقا بالميثانول. بالإضافة إلى ذلك ، يجب غمر الإسفنج وورق الترشيح وغشاء PVDF المعالج مسبقا في مخزن النقل (انظر جدول المواد) مسبقا. - سد الغشاء بحليب خالي الدسم بنسبة 5٪ في محلول ملحي مخزن ثلاثي مع توين 20 (TBST) لمدة ساعتين على شاكر. احتضان الغشاء طوال الليل عند 4 درجات مئوية مع الأجسام المضادة الأولية المخففة التالية (Sirt3 = 1: 500 ، Foxo3a = 1: 1000 ، Parkin = 1: 2000 ، P62 = 1: 1000 ، LC3 = 1: 1000 ، Tomm20 = 1: 2000 ، β-actin = 1: 5000 ، GAPDH = 1: 5000).
ملاحظة: تم اختيار GAPDH كمرجع للكشف عن باركين نظرا لكون الوزن الجزيئي للباركين (50 كيلو دالتون) قريبا من الوزن الجزيئي β الأكتين (42 كيلو دالتون). - اغسل الغشاء 4 مرات باستخدام TBST لمدة 5 دقائق في كل مرة. احتضانه بالجسم المضاد الثانوي المخفف (1: 5000) في درجة حرارة الغرفة لمدة 1 ساعة.
- قم بإسقاط محلول عمل ECL على جانب البروتين من الأغشية لمدة 2 دقيقة. احصل على الصور من خلال نظام التصوير الكيميائي. استخدم برنامج ImageJ لقياس قيم التدرج الرمادي.
6. التحليل الكمي في الوقت الحقيقي PCR
- قم بتنظيف جميع الأجهزة التجريبية باستخدام بيروكربونات ثنائي إيثيل 0.1٪ (DEPC) ، ثم قم بتعقيمها في درجة حرارة عالية وضغط مرتفع مسبقا.
- تزن 50 مجم من أنسجة المعدة. أضف 1 مل من Redzol (انظر جدول المواد) وطحنها في الخالط. انقل الأنسجة المتجانسة إلى أنبوب طرد مركزي خال من RNase واتركه في درجة حرارة الغرفة لمدة 10 دقائق.
- أضف 0.2 مل من ثلاثي كلورو الميثان واخلطه جيدا. اتركه في درجة حرارة الغرفة لمدة 3 دقائق. أجهزة الطرد المركزي عند 4 درجات مئوية و 12,000 × جم لمدة 15 دقيقة.
- قم بإزالة المرحلة المائية العلوية بعناية واخلطها مع 0.5 مل من الأيزوبروبانول لمدة 10 دقائق. جهاز طرد مركزي 12,000 × جم لمدة 10 دقائق عند 4 درجات مئوية لترسيب الحمض النووي الريبي. تخلص من المادة الطافية ثم اغسل راسب الحمض النووي الريبي 3 مرات مع 75٪ من الإيثانول.
- جهاز طرد مركزي عند 7,500 × جم لمدة 5 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية ثم جفف الحمض النووي الريبي في طاولة عمل معقمة لمدة 10 دقائق. قم بإذابة الراسب في 50 ميكرولتر من DEPC.
- نسخ عكسي 1 ميكروغرام من الحمض النووي الريبي إلى الحمض النووي (cDNA). أضف 1 ميكرولتر من مزيج RTase 20x ، و 4 ميكرولتر من المخزن المؤقت للتفاعل 5x RT (انظر جدول المواد) وقم بتجديد DEPC إلى حجم إجمالي قدره 20 ميكرولتر. اضبط إجراء التفاعل على النحو التالي: 10 دقائق عند 25 درجة مئوية ، 40 دقيقة عند 42 درجة مئوية ، 10 دقائق عند 85 درجة مئوية ، ثم استمر في 4 درجات مئوية.
- تحضير خليط تفاعل التضخيم الذي يحتوي على 2 ميكرولتر من الحمض النووي (كدونا) ، و 2 ميكرولتر من التمهيدي الأمامي ، و 2 ميكرولتر من التمهيدي العكسي (الجدول 2) ، و 10 ميكرولتر من 2x SYBR premix (انظر جدول المواد) ، و 4 ميكرولتر من DEPC. اضبط إجراء التفاعل على النحو التالي: 95 درجة مئوية لمدة 15 ثانية ، و 60 درجة مئوية لمدة 10 ثوان ، و 72 درجة مئوية لمدة 30 ثانية (40 دورة).
- استخدم β-أكتين كمرجع داخلي. الحصول على قيم Ct. احسب التعبير النسبي للجينات المستهدفة باستخدام طريقة 2-ΔΔCt.
7. التحضير لتجارب الخلايا
- نموذج الخلية ل PLGC
- استزراع خلايا GES-1 في معهد روزويل بارك التذكاري (RPMI) 1640 وسط مع 10٪ مصل بقري جنيني (FBS) و 1٪ بنسلين ستربتومايسين. استزراع الخلايا في 2 × 105 خلايا لكل بئر في صفيحة مكونة من 6 آبار تحتوي على 1.5 مل من وسط RPMI 1640 بدون مصل ومضادات حيوية عند 37 درجة مئوية مع 5٪ ثاني أكسيدالكربون 2.
- تحفيز خلايا GES-1 باستخدام MNNG للتحول الخبيث. قم بتعيين ترتيب النمذجة كما هو موضح أدناه.
- في اليوم 0 ، قم بإنعاش خلايا GES-1 مسبقا ومرورها للحفاظ عليها في مرحلة النمو اللوغاريتمي. تلقيح خلايا GES-1 ذات المرحلة اللوغاريتمية في قوارير الاستزراع وزراعتها طوال الليل.
- في اليوم 1 واليوم 2، يستعاض عن الوسط المحتوي على MNNG (10 ميكرومتر/لتر). في اليوم 3 ، استبدل الوسط المحتوي على MNNG بوسط خال من الأدوية.
- في اليوم 4 واليوم 6 ، عالج الخلايا بوسط يحتوي على MNNG (5 ميكرومتر / لتر) لمدة 24 ساعة. في اليوم 7 ، استبدل الوسط المحتوي على MNNG بوسط خال من المخدرات. قم بإزالة العديد من الخلايا المحتضرة والمتساقطة واستمر في زراعة الخلايا.
- في اليوم 8 واليوم 10 ، عالج الخلايا بالوسط الذي يحتوي على MNNG (5 ميكرومتر / لتر) لمدة 24 ساعة. في اليوم 11 ، قم ببناء نموذج خلية PLGC (MC).
ملاحظة: خلال فترة النمذجة ، يجب مراقبة حالة الخلايا بانتظام. إذا أظهرت الخلايا حالة سيئة ، فمن المستحسن معالجتها باستخدام MNNG لفترات زمنية مختلفة ، ويفضل أن يكون ذلك بفاصل يومين. بدلا من ذلك ، يمكن معالجة الخلايا بجرعة منخفضة من MNNG (3 ميكرو مولار / لتر). يمكن الرجوع إلى معايير التشخيص المرضي لخلايا MC من الأبحاث السابقة لتقييم حالة الخلايا بدقة10،19،20،21.
- تحضير المصل المحتوي على الأدوية
- قم بإطعام 30 فأر SD (ذكر ، 220 جم) بنظام غذائي قياسي من حبيبات القوارض والماء حتى تزن جميع الفئران أكثر من 350 جم. قم بتعيين الفئران بشكل عشوائي لمجموعة المصل الإيجابية المحتوية على الأدوية (ن = 10) ، ومجموعة المصل المحتوية على HZJD (ن = 10) ، ومجموعة مصل الفئران الطبيعية (ن = 10).
- إجراء إعطاء الدواء في الفئران كما هو موضح في الخطوة 1.3.2. إدارة الفئران مرتين يوميا في الساعة 8:00 صباحا و 8:00 مساء.
- استلام عينات الدم خلال ساعة واحدة بعد آخر إعطاء في اليوم 8 (8:00 صباحا). ضع العينات في أنابيب مضادة للتخثر عند 4 درجات مئوية لمدة 1 ساعة. جهاز طرد مركزي عند 3,000 × جم لمدة 15 دقيقة عند 4 درجات مئوية ثم جمع المادة الطافية.
- طرق التجميع والتدخل لتجارب الخلايا
- قسم تجارب الخلايا على النحو التالي: مجموعة GES-1 (GES-1) ، مجموعة MC (MC) ، مجموعة الأدوية الإيجابية (الدواء الإيجابي) ، مجموعة مغلي HZJD (HZJD) ، مجموعة إسكات Sirt3 (si-Sirt3) ، مجموعة التحكم السلبية (si-NC) وإسكات Sirt3 جنبا إلى جنب مع مجموعة مغلي HZJD (si-Sirt3 + HZJD).
- عالج الخلايا في مجموعة الأدوية الإيجابية ومجموعة HZJD بمصل يحتوي على فيتامين ب 10٪ ومصل يحتوي على 10٪ HZJD ، على التوالي. إدارة مجموعات أخرى مع مصل الفئران العادي بنسبة 10٪.
ملاحظة: بناء على الأبحاث السابقة، تم اختيار 10٪ مصل يحتوي على دواء لعلاج الخلايا. - قم بإجراء تعداء Sirt3 si-RNA (انظر جدول المواد) للخلايا في مجموعة si-Sirt3 ومجموعة si-Sirt3 + HZJD. قم بإعداد مجموعة تحكم سلبية تتلقى متجه فارغا ، وهو si-NC.
- قم بإذابة طاقة siRNA 2.5 نانومتر في 125 ميكرولتر من DEPC لتحضير محلول siRNA. خفف 5 ميكرولتر من محلول siRNA مع 250 ميكرولتر من الحد الأدنى من الوسط الأساسي وتخفيف 5 ميكرولتر من الليبوفيكتامين 2000 مع 250 ميكرولتر من الحد الأدنى من الوسط الأساسي. امزجهم معا بالتساوي.
- أضف الخليط إلى RPMI 1640 متوسط (1.5 مل / لكل بئر) في طبق 6 آبار. احتضان عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2. قم بإجراء تحليل اللطخة الغربية للكشف عن مستوى التعبير عن البروتين ل Sirt3 بعد 48 ساعة من التعدين.
8. اختبار CCK-8
- جهز الخلايا في تعليق الخلية عندما تغطي الخلايا 70٪ من قاع الزجاجة. استخدم عداد الخلايا لحساب عدد الخلايا في التعليق. اضبط التركيز لضمان 2,000 خلية / بئر ، ويحتوي كل بئر على 100 ميكرولتر من وسط RPMI 1640. قم بزرع الخلايا في ألواح 96 بئرا وحافظ عليها عند 37 درجة مئوية في حاضنة مع 5٪ ثاني أكسيد الكربون2 لمدة 24 ساعة. قم بإعداد 6 آبار مكررة لكل مجموعة.
ملاحظة: تمتلئ الآبار الطرفية للألواح المكونة من 96 بئرا التي لا يتم استخدامها ب 200 ميكرولتر من PBS من أجل تقليل التبخر خلال فترة الحضانة. - بعد زراعة الخلايا لمدة 24 ساعة ، استبدل وسط المزرعة بوسط ثقافة مختلف يحتوي على الأدوية. استزراع الخلايا لمدة 48 ساعة باستخدام وسط مزرعة إيجابي يحتوي على الدواء ووسط مزرعة يحتوي على HZJD.
ملاحظة: وسط الثقافة واضح. عند مراقبة الجزء السفلي من زجاجة الثقافة بالضوء ، يمكن ملاحظة أن الخلايا متصلة بأوراق. يمكن أن تثبت هذه الظاهرة أن الخلايا قد التصقت بالحائط. عند ملاحظتها تحت المجهر ، تمتد الخلايا الملتصقة إلى مكوكات في قاع الزجاجة وعند هز وسط الثقافة ، لا تتحرك الخلايا. عادة ما تلتصق الخلايا بالحائط بعد 24 ساعة من الزراعة. - استبدل وسط الاستزراع المحتوي على الدواء بوسط استزراع طازج. أضف 10 ميكرولتر من محلول CCK-8 (انظر جدول المواد) إلى كل بئر واحتضانه عند 37 درجة مئوية لمدة 1 ساعة. لتجنب تكوين فقاعات الهواء ، أضف محلول CCK-8 بشكل غير مباشر إلى جدار لوحة الثقافة.
- اكتشف قيمة OD لكل بئر باستخدام قارئ صفيحة دقيقة بطول موجي 450 نانومتر.
9. مقايسة تكاثر خلايا EdU
- قم بزرع الخلايا في 96 لوحة بئر كما هو موضح في الخطوة 7.1. استبدل وسط الاستزراع بوسط استزراع مختلف يحتوي على المخدرات لمدة 48 ساعة.
ملاحظة: تم تأكيد وقت العلاج الأمثل هو 48 ساعة من خلال التجارب الأولية. - قم بإزالة الوسيط وغسل الخلايا باستخدام PBS. أضف 100 ميكرولتر من وسط المزرعة لكل بئر. قم بإعداد محلول 2x EdU (انظر جدول المواد ، 20 ميكرومتر). أضف 6 ميكرولتر من محلول مخزون EdU إلى 3 مل من وسط الاستزراع. أضف 100 ميكرولتر من محلول 2x EdU (37 درجة مئوية مسخن مسبقا) لكل بئر ثم احتضانه لمدة 2.5 ساعة.
ملاحظة: تم تخفيف محلول مخزون EdU بنسبة 1: 500 للحصول على حل 2x EdU. كان الحجم الفعلي لمحلول 2x EdU 2.4 مل ل 24 بئرا. - قم بإزالة الوسيط المحتوي على EdU. أضف 200 ميكرولتر من 4٪ بارافورمالدهيد لكل بئر في درجة حرارة الغرفة لمدة 15 دقيقة. اشطف الخلايا بمحلول الغسيل (3٪ ألبومين مصل بقري [BSA] في PBS) 3x لمدة 5 دقائق لكل منهما.
- قم بإزالة محلول الغسيل. أضف 200 ميكرولتر من محلول النفاذية (0.3٪ Triton-X 100 في PBS) لكل بئر في درجة حرارة الغرفة لمدة 20 دقيقة. قم بإزالة محلول النفاذية. اشطف الخلايا بمحلول الغسيل (3٪ BSA في PBS) 2x لمدة 5 دقائق لكل منهما.
- قم بإذابة المادة المضافة ب 1.3 مل من الماء منزوع الأيونات لإكمال المحلول. تحضير محلول التفاعل الذي يحتوي على 1.72 مل من محلول التفاعل ، و 4 ميكرولتر من الأزيد 488 ، و 80 ميكرولتر من CuSO4 و 200 ميكرولتر من المحلول المضاف.
- أضف 50 ميكرولتر من محلول التفاعل لكل بئر. احتضان العينات في درجة حرارة الغرفة لمدة 30 دقيقة في الظلام. اشطف الخلايا بمحلول الغسيل 3 مرات لمدة 5 دقائق لكل منها.
- قم بإزالة محلول الغسيل. أضف 200 ميكرولتر من محلول 1x Hoechst 33342 واحتضان العينات في درجة حرارة الغرفة لمدة 10 دقائق في الظلام.
- احصل على الصور باستخدام المجهر الفلوري. استخدم برنامج Image-Pro plus 6.0 لإجراء تحليل كمي للصور.
ملاحظة: يبلغ الحد الأقصى للأطوال الموجية للإثارة والانبعاث ل Azide 488 495 نانومتر و 519 نانومتر على التوالي. الأطوال الموجية القصوى للإثارة والانبعاث ل Hoechst 33342 هي 346 نانومتر و 460 نانومتر على التوالي.
10. الكشف عن انقسام البكتيريا في الخلايا الحية
- قم بزرع الخلايا في 2 × 104 خلايا لكل بئر في صفيحة زجاجية ذات 24 بئر. زراعة الخلايا بين عشية وضحاها بوسط RPMI 1640 بدون مضادات حيوية عند 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2.
- قم بإعداد محلول عمل صبغة mtphagy ومحلول عمل صبغة lyso (انظر جدول المواد). قم بتخفيف محلول صبغة mtphagy باستخدام محلول Hanks 'HEPES بتركيز 100 نانومتر / لتر. قم بتخفيف محلول صبغة الليزو باستخدام محلول HEPES الخاص ب Hanks بتركيز 100 ميكرومتر / لتر.
- قم بإزالة وسط المزرعة واشطف الخلايا باستخدام Hanks 'HEPES buffer 2x. أضف 500 ميكرولتر من محلول عمل صبغة mtphagy (100 نانومتر / لتر) ثم احتضانه عند 37 درجة مئوية لمدة 30 دقيقة.
- اشطف الخلايا باستخدام Hanks 'HEPES Buffer 2x. أضف 500 ميكرولتر من محلول عمل صبغة الليزو (100 ميكرومتر / لتر) ثم احتضانه عند 37 درجة مئوية لمدة 30 دقيقة.
- اشطف الخلايا باستخدام Hanks 'HEPES Buffer 2x. تحديد مستوى الانقسام عن طريق المجهر الفلوري متحد البؤر.
ملاحظة: تم تصوير الخلايا دون أي تثبيت قبل أو بعد التلوين. تم إجراء عملية التصوير في أسرع وقت ممكن لتقليل أي تغييرات أو تغييرات محتملة في الحالة الخلوية.
11. التحليلات الإحصائية
- استخدام البرامج التجارية لإجراء التحليلات الإحصائية. قارن الاختلافات بين المجموعات المختلفة باستخدام ANOVA أحادي الاتجاه متبوعا باختبار LSD اللاحق. اعرض البيانات كمتوسط ± الانحراف المعياري (SD). قم بتعيين الدلالة الإحصائية على P<0.05.
النتائج
يحفز MNNG تقدم PLGC في النموذج الحيواني ويعزز التحول المورفولوجي لخلايا GES-1
عند الملاحظة العيانية ، ظهر الغشاء المخاطي في المعدة للفئران في المجموعة الضابطة باللون الأحمر الفاتح بشكل موحد ، ناعم ، وناعم ، مع ترتيب الطيات المخاطية في نمط خطي. على عكس ?...
Discussion
يعمل PLGC كعملية رئيسية في التقدم من التهاب المعدة المزمن إلى GC. ثبت أن الطب الصيني التقليدي هو علاج وتدخل واعد ل PLGC في السنوات الأخيرة24،25. في السنوات الأخيرة ، برزت الطب الصيني التقليدي كنهج واعد لعلاج وتدخل PLGC. هذا يتوافق مع الأبحاث السابق?...
Disclosures
يعلن جميع المؤلفين أنه ليس لديهم تضارب في المصالح.
Acknowledgements
تم تمويل هذا المشروع من قبل مؤسسة العلوم الطبيعية في مقاطعة خبي الصينية (H2020423207).
Materials
| Name | Company | Catalog Number | Comments |
| 1-Methyl-3-nitro-1-nitrosoguanidine | Shanghai McLean Biochemical Technology Co., Ltd., Shanghai, CHN | R030453 | |
| 3,3’-diaminobenzidine | Beijing Zhong Shan-Golden Bridge Biological Technology Co., Ltd., Beijing, CHN | ZLI0919 | |
| Alcian blue periodic acid schiff staining reagent kit | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | G1285 | |
| Anti-fade fluorescence mounting medium | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | S2110 | |
| Bicinchoninic acid protein concentration determination kit | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G2026-1000T | |
| CCK-8 reagent kit | Boster Biological Engineering co., Ltd., Wuhan, CHN | AR1160 | |
| Confocal fluorescence microscopy | Leica Instruments Co., Ltd., Weztlar, GER | TCS-SP8SR | |
COX 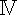 antibody antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab202554 | |
| DAPI staining solution | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | C0065 | |
| DEPC | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G3004 | |
| EdU cell proliferation kit | Beyotime Biotechnology Co., Ltd., Shanghai, CHN | C0071S | |
| Electrophoresis solution | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0139 | |
| Ethanol | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 64-17-5 | |
| FBS | Gibco Corporation, Gaithersburg, USA | 16000044 | |
| Fluorescence microscope | Olympus Corporation, Tokyo, JPN | BH2-RFCA | |
| Foxo3a antibody | Abcam Trading Co., Ltd., Shanghai, CHN | 23683 | |
| GAPDH antibody | Wuhan Sanying Biology Technology Co., Ltd., Wuhan, CHN | 10494-1-AP | |
| Gel preparation kit | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0138 | |
| GES-1 cell | Procell Life Science&Technology Co., Ltd., Wuhan, CHN | CL-0563 | |
| Goat-anti-mouse IgG | CST Biological Reagents Co., Ltd., Shanghai, CHN | 4409 | |
| Goat-anti-rabbit IgG | Abcam Trading Co., Ltd., Shanghai, CHN | ab150077 | |
| Hematoxylin-eosin staining solution | Zhuhai Beso Biotechnology Co., Ltd., Shenzhen, CHN | BA4027 | |
| High iron diamine/alcian blue staining reagent kit | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | G2070 | |
| ImageJ | National Institutes of Health, Bethesda, USA | ||
| Image-Pro Plus 6.0 software | Media Cybernetics Inc., Maryland, USA | ||
| Isopropanol | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 67-63-0 | |
| LC3 antibody | CST Biological Reagents Co., Ltd., Shanghai, CHN | 83506 | |
| Loading buffer | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0198 | |
| Microplate reader | Rayto Life and Analytical Sciences Co., Ltd., Shenzhen, CHN | RT6100 | |
| Microtome | Leica Instruments Co., Ltd., Weztlar, GER | RM2245 | |
| Mitophagy kit | Dojindo Laboratories, Kyushu Island, JPN | MD01-10 | |
| Neutral balsam | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | WG10004160 | |
| Optical microscope | Olympus Corporation, Tokyo, JPN | BH2-RFCA | |
| P62 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab91526 | |
| Paraformaldehyde | Biosharp Life Sciences, Anhui, CHN | BL539A | |
| Parkin antibody | CST Biological Reagents Co., Ltd., Shanghai, CHN | 32833 | |
| Penicillin–streptomycin | Gibco Corporation, Gaithersburg, USA | 15140122 | |
| phosphate-buffered saline | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G0002-15 | |
| PVDF membrane | Millipore Corporation, Michigan, USA | IPVH00010 | |
| Redzol | SBS Genetech Co., Ltd., Beijing, CHN | FTR-50 | |
| Reverse transcription reagent kit | Igene Biotechnology Co., Ltd., Guangzhou, CHN | QP057 | |
| RIPA Buffer solution | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | R002 | |
| Roswell Park Memorial Institute | Gibco Corporation, Gaithersburg, USA | 11875093 | |
| Silicone needle | Zhongke Life Biotechnology Co., Ltd., Beijing, CHN | TFEP-2 | |
| siRNA | Wuhan Genecreate Biological Engineering Co., Ltd. ,Wuhan,CHN | ||
| Sirt3 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | 189860 | |
| Sodium salicylate | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, CHN | S104176 | |
| Sprague-Dawley rat | Beijing Huafukang Biotechnology Co., Ltd., Beijing, CHN | 110322210102553975 | |
| SYBR quantitative PCR kit | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G3320-15 | |
| Tomm20 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab186735 | |
| Transferring buffer | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0141 | |
| Trichloromethane | Shanghai McLean Biochemical Technology Co., Ltd., Shanghai, CHN | 821112 | |
| Tris-buffered saline with Tween 20 | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G0004 | |
| VDAC1 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab15895 | |
| Xylene | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 1330-20-7 | |
| β-actin antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab8226 |
References
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- He, J., et al. Helicobacter pylori infection induces stem cell-like properties in Correa cascade of gastric cancer. Cancer Letters. 542, 215764 (2022).
- Xu, W., Li, B., Xu, M., Yang, T., Hao, X. Traditional Chinese medicine for precancerous lesions of gastric cancer: A review. Biomedicine & Pharmacotherapy. 146, 112542 (2022).
- Yang, L., et al. A Systematic Review of the Mechanisms Underlying Treatment of Gastric Precancerous Lesions by Traditional Chinese Medicine. Evidence-Based Complementary and Alternative Medicine. 2020, 9154738 (2020).
- Ping, Z., Yan, W., Jing, L., Qian, J., Xin, H. The Effect of Huazhuo Jiedu recipe on Epithelial -Mesenchymal-Transition in Chronic Erosive Gastritis Patients with Zhuoduneiyun syndrome. Pharmacology and Clinics of Chinese Materia Medica. 35 (6), 154-158 (2019).
- Yan, W., Jing, L., Pan, Z. The effect of Huazhuojiedu formula on HGF/c-Met signal pathway in patients with chronic erosive gastritis. Pharmacology and Clinics of Chinese Materia Medica. 33 (02), 186-189 (2017).
- Hao, X., et al. Integrating Network Pharmacology and Experimental Validation to Investigate the Mechanisms of Huazhuojiedu Decoction to Treat Chronic Atrophic Gastritis. Evidence-Based Complementary and Alternative Medicine. 2020, 2638362 (2020).
- Zhou, P., et al. 16S rRNA sequencing-based evaluation of the protective effects of Hua-Zhuo-Jie-Du on rats with chronic atrophic gastritis. BMC Complementary Medicine and Therapies. 22 (1), 71 (2022).
- Zhou, P., et al. Determination of the protective effects of Hua-Zhuo-Jie-Du in chronic atrophic gastritis by regulating intestinal microbiota and metabolites: combination of liquid chromatograph mass spectrometer metabolic profiling and 16S rRNA gene sequencing. Chinese Medicine. 16 (1), 37 (2021).
- Hao, X., Zhou, P., Yang, Z., Yang, T., Wang, Y. The therapeutic effect of Huazhuojiedu decoction on precancerous lesions in a gastric cancer model via the regulation of lnc 517368. Journal of Ethnopharmacology. 283, 114635 (2022).
- Palikaras, K., Lionaki, E., Tavernarakis, N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology. Nature Cell Biology. 20 (9), 1013-1022 (2018).
- Zhang, C., et al. Parkin, a p53 target gene, mediates the role of p53 in glucose metabolism and the Warburg effect. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16259-16264 (2011).
- Cai, T., et al. Protective effects of Weipixiao decoction against MNNG-induced gastric precancerous lesions in rats. Biomedicine & Pharmacotherapy. 120, 109427 (2019).
- Shah, S. C., Piazuelo, M. B., Kuipers, E. J., Li, D. AGA Clinical Practice Update on the Diagnosis and Management of Atrophic Gastritis: Expert Review. Gastroenterology. 161 (4), 1325-1332 (2021).
- Pimentel-Nunes, P., et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 51 (4), 365-388 (2019).
- Nagtegaal, I. D., et al. The 2019 WHO classification of tumours of the digestive system. Histopathology. 76 (2), 182-188 (2020).
- Kushima, R. The updated WHO classification of digestive system tumours-gastric adenocarcinoma and dysplasia. Der Pathologe. 43 (1), 8-15 (2022).
- Yang, P., et al. Weipiling decoction alleviates N-methyl-N-nitro-N'-nitrosoguanidine-induced gastric precancerous lesions via NF-κB signalling pathway inhibition. Chinese Medicine. 17 (1), 104 (2022).
- Xu, J., et al. Xiao Tan He Wei Decoction reverses MNNG-induced precancerous lesions of gastric carcinoma in vivo and vitro: Regulation of apoptosis through NF-κB pathway. Biomedicine & Pharmacotherapy. 108, 95-102 (2018).
- Li, S. Study on the mechanism of regulating NF-kB activity and inhibiting the migration of gastric "inflammation-cancer" transformed cells by invigorating spleen, removing blood stasis and detoxifying. Guangzhou University of Chinese Medicine. , 17-19 (2021).
- Liu, H. Research Progress of Cell Models of Gastric Cancer Precancerous Lesions. Traditional Chinese Drug Research and Clinical Pharmacology. 27 (4), 592-596 (2016).
- Zheng, J., et al. Chronic stress accelerates the process of gastric precancerous lesions in rats. Journal of Cancer. 12 (14), 4121-4133 (2021).
- Yu, W., et al. Sirt3 deficiency exacerbates diabetic cardiac dysfunction: Role of Foxo3A-Parkin-mediated mitophagy. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (8), 1973-1983 (2017).
- Cao, Y., et al. Efficacy of Banxia Xiexin decoction for chronic atrophic gastritis: A systematic review and meta-analysis. PLoS One. 15 (10), e0241202 (2020).
- Yin, J., et al. Weiqi Decoction Attenuated Chronic Atrophic Gastritis with Precancerous Lesion through Regulating Microcirculation Disturbance and HIF-1α Signaling Pathway. Evidence-Based Complementary and Alternative Medicine. 2019, 2651037 (2019).
- Zhang, J., Wang, X., Wang, F., Tang, X. Xiangsha Liujunzi Decoction improves gastrointestinal motility in functional dyspepsia with spleen deficiency syndrome by restoring mitochondrial quality control homeostasis. Phytomedicine. 105, 154374 (2022).
- Shida, M., et al. Impaired mitophagy activates mtROS/HIF-1α interplay and increases cancer aggressiveness in gastric cancer cells under hypoxia. International Journal of Oncology. 48 (4), 1379-1390 (2016).
- Zhou, X. Y., et al. Inhibition of autophagy blocks cathepsins-tBid-mitochondrial apoptotic signaling pathway via stabilization of lysosomal membrane in ischemic astrocytes. Cell Death & Disease. 8 (2), e2618 (2017).
- He, R., Peng, J., Yuan, P., Xu, F., Wei, W. Divergent roles of BECN1 in LC3 lipidation and autophagosomal function. Autophagy. 11 (5), 740-747 (2015).
- Fernández-Coto, D. L., et al. Quantitative proteomics reveals proteins involved in the progression from non-cancerous lesions to gastric cancer. Journal of Proteomics. 186, 15-27 (2018).
- Ding, D., et al. Post-translational modification of Parkin and its research progress in cancer. Cancer Communications. 39 (1), 77 (2019).
- Wang, Y., et al. The Role of Mitochondrial Dynamics and Mitophagy in Carcinogenesis, Metastasis and Therapy. Frontiers in Cell and Developmental Biology. 8, 413 (2020).
- Gehrke, S., et al. PINK1 and Parkin control localized translation of respiratory chain component mRNAs on mitochondria outer membrane. Cell Metabolism. 21 (1), 95-108 (2015).
- Fu, Z. J., et al. HIF-1α-BNIP3-mediated mitophagy in tubular cells protects against renal ischemia/reperfusion injury. Redox Biology. 36, 101671 (2020).
- Jia, Q., et al. Hesperidin promotes gastric motility in rats with functional dyspepsia by regulating Drp1-mediated ICC mitophagy. Frontiers in Pharmacology. 13, 945624 (2022).
- Chen, Y. The N-alkylamides induces MGMT gene hypomethylation in gastric epithelium cells malignant transformation. Zhejiang University. , 33-35 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved