Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Effets thérapeutiques de la décoction de Huazhuojiedu sur les lésions précancéreuses du cancer gastrique en régulant la mitophagie
Dans cet article
Résumé
Ici, nous présentons un protocole qui démontre l’efficacité thérapeutique de la décoction de Huazhuojiedu (HZJD) dans le soulagement des lésions précancéreuses du cancer gastrique en utilisant la régulation de la mitohagie.
Résumé
Cette recherche vise à explorer l’effet thérapeutique et les mécanismes potentiels de la décoction de Huazhuojiedu (HZJD) pour soulager les lésions précancéreuses du cancer gastrique (PLGC) à la fois in vivo et in vitro. HZJD est une formule traditionnelle chinoise à base de plantes composée de 11 herbes. Les rats Sprague-Dawley (SD) ont été divisés au hasard en quatre sous-groupes : groupe témoin, groupe modèle, groupe de médicament positif et groupe HZJD. La coloration à l’hématoxyline-éosine (H&E), la coloration à haute teneur en diamine-bleu d’alcian (HID-AB), la coloration au bleu d’alcian-acide périodique de Schiff (AB-PAS), l’immunohistochimie, l’immunofluorescence, la RT-qPCR et le Western blot ont été effectués après 10 semaines de traitement par HZJD. In vitro, les dosages de comptage cellulaire kit-8 (CCK-8) et de 5-éthynyl-2'-désoxyuridine (EdU) ont été utilisés pour détecter la prolifération cellulaire. Des tests RT-qPCR et Western blot ont été effectués pour évaluer les taux de mitophagie. Les résultats ont indiqué que HZJD pouvait retarder la progression pathologique chez les rats PLGC et réduire la prolifération cellulaire PLGC. Le traitement par HZJD a significativement augmenté les niveaux d’expression de l’ARNm et des protéines de Sirt3, Foxo3a, Parkin et LC3 II/I, tout en diminuant les niveaux d’expression de l’ARNm et des protéines de p62 et Tomm20. Il s’est avéré que HZJD avait la capacité d’inverser le déclin de l’activité de la mitophagie in vivo et in vitro. En conclusion, l’étude a évalué l’impact de HZJD et a fourni des preuves concernant son mécanisme moléculaire potentiel.
Introduction
Le cancer gastrique (GC) reste l’une des maladies malignes les plus courantes affectant le système digestif dans le monde. On estime que le GC représente environ 6 % de tous les cancers dans le monde, se classant au 5e rang des cancers les plus fréquemment diagnostiqués et au 3e rang des décès liés au cancer1. La CG est largement reconnue comme un processus biologique progressif en plusieurs étapes. Avant l’apparition de la GC, la muqueuse gastrique subit souvent plusieurs années de lésions précancéreuses, appelées lésions précancéreuses du cancer gastrique (PLGC). La théorie de la cascade de Correa est largement acceptée et fournit une explication de la progression séquentielle de la muqueuse normale à la gastrite chronique non atrophique, à la gastrite atrophique, à la métaplasie intestinale (MI), à la dysplasie (Dys) et finalement au carcinome2. La PLGC représente une étape cruciale dans le développement de la GC, et une intervention et une surveillance rapides de la PLGC sont essentielles pour la prévention précoce de la GC.
Des évaluations cliniques récentes et des recherches expérimentales ont confirmé que la médecine traditionnelle chinoise (MTC) est en train de devenir l’une des thérapies les plus efficaces pour traiter le PLGC 3,4. La décoction HZJD est une formule de MTC développée sur la base de l’expérience clinique et enracinée dans la théorie de la MTC sur l’élimination de la chaleur et de l’humidité. Des études antérieures ont démontré les effets bénéfiques de la décoction de HZJD dans le traitement de la PLGC, en particulier dans le soulagement des symptômes cliniques et des manifestations pathologiques 5,6. Grâce à des études pharmacologiques en réseau, nous avons identifié les composants actifs de la décoction de HZJD ainsi que leurs cibles potentielles pour PLGC7. Les résultats d’une étude précédente indiquaient que la décoction de HZJD avait la capacité d’améliorer la diversité, d’optimiser la structure de la communauté et d’augmenter l’abondance relative de la flore intestinale chez les rats PLGC8. De plus, il a été vérifié que la décoction de HZJD pouvait améliorer le PLGC en régulant le microbiote intestinal et ses métabolites9. Dans des travaux récents, nous avons démontré que la décoction de HZJD pouvait réguler l’équilibre dynamique de la prolifération cellulaire et de l’apoptose dans les cellules PLGC en régulant à la baisse l’expression de lnc 51736810.
De plus en plus d’études ont confirmé que la mitophagie joue un rôle important dans divers cancers. La mitophagie élimine sélectivement les mitochondries endommagées et dépolarisées et empêche en outre l’accumulation excessive d’espèces réactives de l’oxygène (ROS) cytotoxiques de la mitochondrie dysfonctionnelle, ce qui inhibe à son tour la tumorigenèse11. La mitophagie, la dégradation sélective des mitochondries endommagées ou dysfonctionnelles, est intimement liée à la phosphorylation oxydative mitochondriale (OXPHOS). L’altération ou l’absence de mitophagie peut entraîner un changement du métabolisme énergétique cellulaire vers la glycolyse aérobie, un phénomène communément appelé effet Warburg. L’augmentation de la production de lactate et de corps cétoniques, résultant de l’effet Warburg, contribue à la construction d’un microenvironnement tumoral propice à la prolifération cellulaire12.
Cette étude présente un protocole complet pour l’utilisation de la décoction de HZJD comme approche thérapeutique pour atténuer la progression de la PLGC. Grâce à notre évaluation, nous avons observé un effet positif significatif de la décoction de HZJD, notamment dans sa capacité à réguler la mitophagie. L’étude fournit des informations précieuses sur les mécanismes moléculaires potentiels de la décoction de HZJD dans le traitement de la PLGC.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les procédures expérimentales et les soins aux animaux ont été approuvés par les directives du comité institutionnel de soin et d’utilisation des animaux de l’Université de médecine traditionnelle chinoise du Hebei (numéro d’approbation : DWLL2019031) et ont été effectués conformément aux directives éthiques. Au total, 90 rats Sprague-Dawley mâles (SD) exempts d’agents pathogènes spécifiques (âge = 6 semaines ; poids = 150-180 g ; voir le tableau des matériaux) ont été élevés à une température constante (24 °C ± 4 °C) et à une humidité (50 %-60 %) sous un cycle contrôlé d’obscurité/lumière de 12 h. Les rats ont été acclimatés au nouvel environnement pendant 1 semaine avant de commencer les expériences.
1. Préparation à l’expérimentation animale
- Modèle de rat de PLGC
- Répartissez au hasard les rats à un groupe témoin (n = 20) et à un groupe modèle PLGC (n = 70). Fournissez aux rats du groupe témoin un régime standard composé de granulés de rongeurs et de l’eau à volonté. Nourrissez les rats du groupe modèle PLGC avec un régime irrégulier (1 jour de jeûne, 1 jour d’alimentation).
- Hébergez les rats par groupes de cinq par cage. Fournir au groupe témoin 150 g/jour de nourriture par cage. Laisser le groupe modèle PLGC accéder librement à la nourriture pendant 23 h (150 g/jour/par cage). Après 23 h, retirez le reste de la nourriture.
- Fournir aux rats du groupe modèle PLGC une solution de 1-méthyl-3-nitro-1-nitrosoguanidine (MNNG) (200 μg/mL) à boire gratuitement10,13. Fournir aux rats du groupe modèle PLGC 200 mL de solution de MNNG par cage. Placez la solution MNNG dans des bouteilles opaques et remplacez-la quotidiennement.
- Gavage des rats du groupe modèle PLGC avec 2 % de salicylate de sodium après 24 h de jeûne (une fois tous les 2 jours par gavage). Pour le gavage, utilisez une aiguille en silicone (voir tableau des matériaux) d’une profondeur minimale de l’aiguille égale à 6 cm. Effectuez le gavage régulièrement à la même heure le matin entre 8 h 30 et 9 h 30.
- Sélectionner au hasard deux rats du groupe modèle PLGC pour un examen pathologique aux semaines 12, 16, 20 et 24 afin d’évaluer l’établissement du modèle PLGC. Considérez que le modèle a réussi lorsque les deux rats sont diagnostiqués avec PLGC par une évaluation pathologique comme décrit en9.
- Ce processus de modelage dure environ 24 semaines. Permettre à l’évaluation pathologique d’être effectuée indépendamment par deux pathologistes seniors. Déterminer le diagnostic pathologique de la PLGC chez le rat grâce à l’évaluation collaborative de deux pathologistes. Tenez compte de leurs avis diagnostiques et utilisez les directives précédentes comme référence lors du processus d’évaluation 14,15,16,17.
- Préparation de la décoction de HZJD
- Préparez la décoction de HZJD selon la méthode décrite aupoint 7.
REMARQUE : Les herbes en décoction HZJD ont été achetées et authentifiées par l’hôpital de médecine traditionnelle chinoise du Hebei.
- Préparez la décoction de HZJD selon la méthode décrite aupoint 7.
- Groupement et intervention médicamenteuse
- Divisez au hasard le groupe modèle PLGC en trois sous-groupes : le groupe modèle (n = 20), le groupe de médicament positif (n = 20) et le groupe de décoction de Huazhuojiedu (HZJD, n = 20, tableau 1).
- Gavage chez les rats du groupe médicament positif avec 0,7 mg/kg/jour de vitamine B12 par gavage18. Traiter les rats du groupe HZJD avec une décoction de HZJD à 14,81 g/kg/jour8. Administrer aux rats du groupe témoin et du groupe modèle de l’eau distillée (10 mL/kg). Les quatre groupes reçoivent l’administration intragastrique une fois par jour pendant 10 semaines.
REMARQUE : La dose quotidienne recommandée de décoction de HZJD pour l’homme est de 142 g / jour10. En utilisant la méthode de calcul de la surface corporelle, il est déterminé que la dose recommandée pour les rats est 6,25 fois celle des humains. Par conséquent, la dose quotidienne de décoction de HZJD pour le rat est de 14,81 g/kg. La posologie a été ajustée chaque semaine en fonction du poids des rats. Le volume maximal du gavage n’a pas dépassé 3 mL.
- Prélèvement d’échantillons
- Sacrifiez tous les rats après 24 h de jeûne (avec accès gratuit à l’eau) à la semaine 35. Anesthésier tous les rats avec de l’isoflurane (5 % d’induction, 2 % pour l’entretien, débit de 1L/min).
- Rasez la région abdominale et stérilisez la peau avec de l’éthanol et de l’iode après avoir confirmé la perte de stimulation de la douleur. Coupez la peau abdominale du cartilage xiphoïde le long de la ligne médiane de l’abdomen avec un scalpel.
- Blunt sépare le tissu sous-cutané à l’aide d’une pince et d’un scalpel jusqu’à ce qu’il expose l’estomac. Disséquez l’estomac le long de la plus grande courbure avec des ciseaux et rincez-le immédiatement avec une solution saline tamponnée au phosphate (PBS).
- Dépliez les tissus de l’estomac sur une plaque de glace. Prélever des échantillons gastriques (2 mm x 2 mm) de l’antre, du corps et de la moindre courbure de la région angulaire. S’il y a des lésions visibles sur l’estomac, prélevez et traitez ces portions spécifiques comme des échantillons.
- Fixer les échantillons gastriques dans du paraformaldéhyde à 4 % pendant 24 h. Placez les tissus gastriques restants dans des cryotubes. Congelez-les dans de l’azote liquide, puis conservez-les à -80 °C.
- Euthanasier les rats par inhalation de dioxyde de carbone. Placez les carcasses de rats dans des sacs scellés, puis mettez-les dans l’armoire de stockage des carcasses d’animaux.
2. Examen pathologique
- Coupez et lissez les tissus gastriques fixes avec des ciseaux. Déshydrater les tissus avec une série d’alcool à gradient, c’est-à-dire 75 % d’éthanol pendant 30 min, 85 % d’éthanol pendant 30 min, 95 % d’éthanol pendant 30 min et 2x dans de l’éthanol anhydre pendant 30 min chacun. Immerger les tissus dans une solution de xylène/éthanol (1:1) pendant 1 h, et 2x dans du xylène à 100 % pendant 30 min chacun.
- Versez la moitié de la cire fondue dans le moule, puis mettez rapidement les tissus perméabilisés dans le moule. Placez les mouchoirs dans l’autre moitié de la cire fondue. Marquez la boîte incrustée et laissez la cire se solidifier complètement.
- À l’aide d’un microtome, couper en tranches d’une épaisseur de 4 μm. Placez les tranches sur les lames.
- Placez les tranches 2x dans du xylène à 100 % pendant 10 min chacune, puis dans une solution de xylène/éthanol (1:1) pendant 10 min, 2x à nouveau dans de l’éthanol anhydre pendant 5 min, puis dans de l’éthanol à 95 % pendant 5 min, puis de l’éthanol à 85 % pendant 5 min, et enfin dans de l’éthanol à 70 % pendant 5 min. Rincez les tranches à l’eau courante.
- Teintez les tranches d’hématoxyline pendant 5 min. Différencier en trempant dans de l’acide chlorhydrique-éthanol à 0,5 % pendant 10 s. Teintez les tranches avec de l’éosine pendant 2 min.
- Rincez les tranches à l’eau distillée. Déshydrater les tranches avec une série d’alcool à gradient, c’est-à-dire 70 % d’éthanol pendant 30 s, 80 % d’éthanol pendant 30 s, 95 % d’éthanol pendant 30 s, éthanol anhydre pendant 30 s. Perméabiliser les tranches avec 100 % de xylène 2x. Scellez les tranches avec du baume neutre.
- Mélanger la solution HID A et la solution HID B dans un rapport de 50:3 pour préparer la solution de travail HID. Teindre les tranches avec la solution de travail HID pendant 24 h.
- Rincer à l’eau courante puis teindre les tranches avec de l’alcian pendant 20 min. Contre-colorez les tranches avec la solution rouge nucléaire rapide pendant 10 min. Déshydratez et scellez les tranches comme décrit à l’étape 2.6.
- Teintez les tranches d’alcian pendant 20 min. Incuber les tranches dans une solution aqueuse à 1 % d’acide périodique pendant 5 min. Techez les tranches de Schiff pendant 20 min.
- Incuber les lames avec de l’hématoxyline pendant 2 min pour colorer les noyaux. Ajouter la solution de différenciation acide (fournie avec le kit HID) pendant 5 s. Appliquez la solution de bleu Scott pendant 3 min pour colorer les lames en bleu. Déshydratez et scellez les tranches comme décrit ci-dessus à l’étape 2.6.
REMARQUE : Le processus de coloration doit être protégé de la lumière. La température doit être maintenue en dessous de 22 °C lors de l’utilisation d’une solution aqueuse à 1 % d’acide périodique. Les tranches doivent être déshydratées et scellées comme décrit à l’étape 2.6. - Examinez les tranches colorées au microscope optique à un grossissement de 10x et 20x.
3. Immunohistochimie
- Utilisez les tranches obtenues à l’étape 2.4. Mettez les tranches dans un tampon de citrate de sodium 0,01 M et chauffez pendant 10 min pour effectuer la récupération de l’antigène.
- Ajoutez du peroxyde d’hydrogène à 3 % pendant 30 minutes pour éteindre la peroxydase endogène et la biotine. Bloquez les tranches avec du sérum de chèvre pendant 30 min.
- Incuber les tranches avec les anticorps primaires dilués contre sirt3 (1:200), foxo3a (1:100) et parkine (1:200) pendant une nuit à 4 °C. Remplacez les anticorps primaires par du PBS pour le contrôle négatif.
- Rincez les tranches 3x pendant 5 minutes par rinçage avec du PBS. Incuber les tranches avec l’anticorps secondaire correspondant à température ambiante pendant 1 h.
- Ajouter 20 μL de 3,3'-diaminobenzidine (DAB) pendant 3 min. Déshydratez et scellez les tranches comme décrit ci-dessus à l’étape 2.6.
- Imagez toutes les coupes à un grossissement de 40x au microscope optique. Utilisez le logiciel Image-Pro Plus 6.0 pour effectuer une analyse quantitative des images.
4. Immunofluorescence
- Utilisez les tranches obtenues à l’étape 3.1. Répétez l’étape 3.3.
- Incuber les tranches avec les anticorps primaires dilués contre la COX IV (1:500) et la LC3 (1:500) pendant la nuit à 4 °C. Rincez les tranches 3x pendant 5 minutes par rinçage avec du PBS.
- Incuber les tranches avec les IgG anti-lapin de chèvre (1:1000) et les IgG anti-souris de chèvre (1:1000) à température ambiante pendant 1,5 h. Rincez les tranches 3x pendant 5 minutes par rinçage avec du PBS.
- Ajouter la solution de coloration DAPI et incuber à température ambiante pendant 10 min dans l’obscurité. Rincez les tranches 3x pendant 5 minutes par rinçage avec du PBS.
- Ajouter une solution de coloration DAPI goutte à goutte et incuber à température ambiante pendant 10 min dans l’obscurité. Montez les tranches avec un support de montage à fluorescence anti-décoloration.
- Visualisez et photographiez les coupes au microscope à fluorescence (voir le tableau des matériaux) à un grossissement de 40x.
5. Analyse par transfert Western
- Peser précisément 100 mg de tissus gastriques. Ajouter 1 mL de solution tampon RIPA (voir le tableau des matériaux). Broyez soigneusement les tissus à l’aide d’un homogénéisateur (10 000 x g, 15 s à chaque fois pendant 3 fois).
- Placez l’homogénat de tissu sur de la glace pendant 30 min. Centrifuger à 12 000 x g pendant 20 min à 4 °C, puis recueillir le surnageant.
- Quantifiez la concentration en protéines à l’aide du kit de détermination de la concentration en protéines de l’acide bicinchoninique (BCA) (voir la table des matériaux). Ajuster la concentration en protéines du surnageant obtenu pour qu’elle soit cohérente dans les échantillons.
- Préparez le gel SDS-PAGE composé d’un gel séparateur à 10 % et d’un gel à empiler à 5 %. Versez le gel de séparation à 10 % dans la plaque de verre aux 2/3 de la hauteur totale. Ajoutez de l’eau déminéralisée sur le gel jusqu’à ce que le gel se solidifie. Versez le gel d’empilage à 5 % pour remplir la plaque de verre. Insérez le peigne d’électrophorèse.
REMARQUE : Des précautions doivent être prises pour s’assurer qu’il n’y a pas de bulles dans le gel. - Mélangez le surnageant protéique avec un tampon de charge 5x dans un rapport de 1:4. Mettez-le dans de l’eau bouillante pendant 5 min pour le dénaturer. Conservez-le à -20 °C.
- Assemblez le gel SDS-PAGE préparé dans le système d’électrophorèse par transfert Western. Ajouter une solution d’électrophorèse fraîche (voir le tableau des matériaux). Chargez 20 μL d’échantillon par puits sur le gel. Démarrez l’électrophorèse à 80 V pendant 40 min puis passez à 120 V.
- Prélevez le gel et créez un sandwich de transfert comme suit : deux couches de tampon éponge, deux couches de papier filtre, du gel, une membrane de fluorure de polyvinylidène (PVDF) (voir le tableau des matériaux), deux couches de papier filtre, deux couches de tampon éponge (du pôle négatif au pôle positif). Ajoutez un tampon de transfert pré-refroidi. Effectuez un transfert humide à 350 mA pendant 2 h.
REMARQUE : Avant d’assembler le sandwich de transfert, la membrane PVDF doit être prétraitée avec du méthanol. De plus, l’éponge, le papier filtre et la membrane PVDF prétraitée doivent être immergés au préalable dans le tampon de transfert (voir tableau des matériaux). - Bloquer la membrane avec du lait écrémé à 5 % dans une solution saline tris-tamponnée avec tween 20 (TBST) pendant 2 h sur un agitateur. Incuber la membrane pendant la nuit à 4 °C avec les anticorps primaires dilués suivants (Sirt3 = 1:500, Foxo3a = 1:1000, Parkin = 1:2000, P62 = 1:1000, LC3 = 1:1000, Tomm20 = 1:2000, β-actine = 1:5000, GAPDH = 1:5000).
REMARQUE : La GAPDH a été choisie comme référence pour la détection de la parkine en raison de la masse moléculaire de la parkine (50 kDa) proche de celle de la β-actine (42 kDa). - Lavez la membrane 4 fois avec du TBST pendant 5 minutes à chaque fois. Incuber avec l’anticorps secondaire dilué (1:5000) à température ambiante pendant 1 h.
- Déposer la solution de travail ECL du côté protéique des membranes pendant 2 min. Acquérez les images grâce au système d’imagerie par chimiluminescence. Utilisez le logiciel ImageJ pour mesurer les valeurs en niveaux de gris.
6. Analyse PCR quantitative en temps réel
- Nettoyez tous les dispositifs expérimentaux avec du pyrocarbonate de diéthyle à 0,1 % (DEPC), puis stérilisez-les à haute température et à haute pression à l’avance.
- Peser 50 mg de tissus gastriques. Ajouter 1 mL de Redzol (voir le tableau des matériaux) et broyer dans un homogénéisateur. Transférez l’homogénat de tissu dans un tube à centrifuger sans RNase et laissez-le reposer à température ambiante pendant 10 min.
- Ajouter 0,2 mL de trichlorométhane et bien mélanger. Laissez reposer à température ambiante pendant 3 min. Centrifugeuse à 4 °C et 12 000 x g pendant 15 min.
- Retirez soigneusement la phase aqueuse supérieure et mélangez-la avec 0,5 mL d’isopropanol pendant 10 min. Centrifuger 12 000 x g pendant 10 min à 4 °C pour précipiter l’ARN. Jetez le surnageant, puis lavez le précipité d’ARN 3 fois avec de l’éthanol à 75 %.
- Centrifugeuse à 7 500 x g pendant 5 min à 4 °C. Jeter le surnageant puis le précipité d’ARN sec dans un établi stérile pendant 10 min. Dissoudre le précipité dans 50 μL de DEPC.
- Transcrire inversement 1 μg d’ARN en ADNc. Ajouter 1 μL de mélange 20x RTase, 4 μL de tampon réactionnel 5x RT (voir le tableau des matériaux) et réapprovisionner le DEPC jusqu’à un volume total de 20 μL. Régler la procédure de réaction comme suit : 10 min à 25 °C, 40 min à 42 °C, 10 min à 85 °C, puis maintenir à 4 °C.
- Préparez un mélange de réaction d’amplification contenant 2 μL d’ADNc, 2 μL d’amorce directe, 2 μL d’amorce inverse (Tableau 2), 10 μL de 2 prémélanges SYBR (voir le Tableau des matériaux) et 4 μL de DEPC. Réglez la procédure de réaction comme suit : 95 °C pendant 15 s, 60 °C pendant 10 s et 72 °C pendant 30 s (40 cycles).
- Utiliser la β-actine comme référence endogène. Obtenez les valeurs Ct. Calculez l’expression relative des gènes cibles à l’aide de la méthode 2-ΔΔCt.
7. Préparation aux expériences cellulaires
- Modèle cellulaire de PLGC
- Cultivez les cellules GES-1 dans le milieu 1640 du Roswell Park Memorial Institute (RPMI) avec 10 % de sérum de veau fœtal (FBS) et 1 % de pénicilline-streptomycine. Cultivez les cellules à raison de 2 x 105 cellules par puits dans une plaque de 6 puits contenant 1,5 ml de milieu RPMI 1640 sans sérum et des antibiotiques à 37 °C avec 5 % de CO2.
- Induire les cellules GES-1 avec du MNNG pour la transformation maligne. Définissez la disposition de modélisation comme décrit ci-dessous.
- Au jour 0, pré-réanimez et passez les cellules GES-1 pour les maintenir dans la phase de croissance logarithmique. Inoculez les cellules GES-1 en phase logarithmique dans des flacons de culture et cultivez-les pendant la nuit.
- Le jour 1 et le jour 2, remplacez le milieu contenant du MNNG (10 μM/L). Le jour 3, remplacez le milieu contenant du MNNG par un milieu sans médicament.
- Le jour 4 et le jour 6, traiter les cellules avec un milieu contenant du MNNG (5 μM/L) pendant 24 h. Le jour 7, remplacez le milieu contenant du MNNG par un milieu sans médicament. Retirez les nombreuses cellules mourantes et en perte et poursuivez la culture cellulaire.
- Le jour 8 et le jour 10, traiter les cellules avec le milieu contenant du MNNG (5 μM/L) pendant 24 h. Le jour 11, construisez le modèle cellulaire de PLGC (MC).
REMARQUE : Pendant la période de modélisation, l’état des cellules doit être observé régulièrement. Si les cellules présentent un mauvais état, il est recommandé de les traiter avec du MNNG pendant différents intervalles de temps, de préférence avec un intervalle de 2 jours. Alternativement, les cellules peuvent être traitées avec une faible dose de MNNG (3 μM/L). Les critères de diagnostic pathologique des cellules MC peuvent être référencés à partir de recherches antérieures pour évaluer avec précision l’état des cellules 10,19,20,21.
- Préparation d’un sérum contenant un médicament
- Nourrir 30 rats SD (mâles, 220 g) avec un régime standard en granulés pour rongeurs et de l’eau à volonté jusqu’à ce que tous les rats pèsent plus de 350 g. Répartissez au hasard les rats dans le groupe sérique contenant le médicament positif (n = 10), le groupe sérique contenant le HZJD (n = 10) et le groupe sérique normal du rat (n = 10).
- Effectuer l’administration du médicament chez le rat comme décrit à l’étape 1.3.2. Administrez les rats 2 fois par jour à 8h00 et 20h00. Continuez l’intervention médicamenteuse pendant 7 jours.
- Prélever les échantillons de sang dans l’heure suivant la dernière administration le jour 8 (8h00). Placer les échantillons dans des tubes anticoagulants à 4 °C pendant 1 h. Centrifuger à 3 000 x g pendant 15 min à 4 °C, puis prélever le surnageant.
- Méthodes de regroupement et d’intervention des expériences cellulaires
- Divisez les expériences cellulaires comme suit : groupe GES-1 (GES-1), groupe MC (MC), groupe de drogue positif (drogue positive), groupe de décoction HZJD (HZJD), groupe de silençage de Sirt3 (si-Sirt3), groupe de contrôle négatif (si-NC) et silençage de Sirt3 combiné avec le groupe de décoction HZJD (si-Sirt3+HZJD).
- Traitez les cellules du groupe de médicament positif et du groupe HZJD avec 10 % de sérum contenant de la vitamine B12 et 10 % de sérum contenant HZJD, respectivement. Administrer aux autres groupes avec 10 % de sérum de rat normal.
REMARQUE : Sur la base de recherches antérieures,10,10 % de sérum contenant du médicament a été sélectionné pour le traitement cellulaire. - Effectuer la transfection de Sirt3 si-RNA (voir Tableau des matériaux) pour les cellules du groupe si-Sirt3 et du groupe si-Sirt3+HZJD. Établissez un groupe témoin négatif recevant un vecteur vide, à savoir si-NC.
- Dissoudre une puissance de 2,5 nM dans 125 μL de DEPC pour préparer une solution de siRNA. Diluer 5 μL de solution de siRNA avec 250 μL de milieu essentiel minimum et diluer 5 μL de lipofectamine 2000 avec 250 μL de milieu essentiel minimum. Mélangez-les uniformément.
- Ajouter le mélange au RPMI 1640 moyen (1,5 ml/par puits) dans une assiette à 6 puits. Incuber à 37 °C avec 5 % de CO2. Effectuer une analyse par transfert Western pour détecter le niveau d’expression protéique de Sirt3 48 h après la transfection.
8. Dosage CCK-8
- Préparez les cellules en suspension cellulaire lorsque les cellules couvrent 70 % du fond de la bouteille. Utilisez le compteur de cellules pour compter le nombre de cellules dans la suspension. Ajustez la concentration pour vous assurer qu’il y a 2 000 cellules/puits, et que chaque puits contient 100 μL de milieu RPMI 1640. Ensemencez les cellules dans des plaques à 96 puits et maintenez-les à 37 °C dans un incubateur avec 5 % de CO2 pendant 24 h. Installez 6 puits répliqués pour chaque groupe.
REMARQUE : Les puits périphériques des plaques de 96 puits qui ne sont pas utilisés sont remplis de 200 μL de PBS afin de réduire l’évaporation pendant la période d’incubation. - Après avoir cultivé les cellules pendant 24 h, remplacez le milieu de culture par un autre milieu de culture contenant du médicament. Cultivez les cellules pendant 48 h avec un milieu de culture contenant du médicament positif et un milieu de culture contenant du HZJD.
REMARQUE : Le milieu de culture est clair. En observant le fond de la bouteille de culture avec de la lumière, on peut voir que les cellules sont reliées en feuilles. Ce phénomène peut prouver que les cellules ont adhéré à la paroi. Lorsqu’elles sont observées au microscope, les cellules adhérentes se déploient en navettes au fond de la bouteille et lorsqu’elles agitent le milieu de culture, les cellules ne bougent pas. Les cellules adhèrent généralement à la paroi après 24 h de culture. - Remplacez le milieu de culture contenant le médicament par un milieu de culture frais. Ajouter 10 μL de solution de CCK-8 (voir le tableau des matériaux) dans chaque puits et incuber à 37 °C pendant 1 h. Pour éviter la formation de bulles d’air, ajoutez la solution CCK-8 obliquement à la paroi de la plaque de culture.
- Détectez la valeur OD de chaque puits à l’aide d’un lecteur de microplaques à une longueur d’onde de 450 nm.
9. Essai de prolifération cellulaire EdU
- Ensemencez les cellules dans des plaques à 96 puits comme décrit à l’étape 7.1. Remplacer le milieu de culture par un autre milieu de culture contenant du médicament pendant 48 h.
REMARQUE : La durée optimale du traitement a été confirmée à 48 h par des expériences préliminaires. - Retirez le milieu et lavez les cellules avec du PBS. Ajouter 100 μL de milieu de culture par puits. Préparez la solution 2x EdU (voir Tableau des matériaux, 20 μM). Ajouter 6 μL de la solution mère EdU à 3 mL de milieu de culture. Ajouter 100 μL de la solution 2x EdU (37 °C préchauffé) par puits, puis incuber pendant 2,5 h.
REMARQUE : La solution mère d’EdU a été diluée dans un rapport de 1:500 pour obtenir la solution EdU 2x. Le volume réel de la solution 2x EdU était de 2,4 mL pour 24 puits. - Retirez le milieu contenant de l’EdU. Ajouter 200 μL de paraformaldéhyde à 4 % par puits à température ambiante pendant 15 min. Retirer le paraformaldéhyde. Rincer les cellules avec une solution de lavage (albumine sérique bovine à 3 % [BSA] dans PBS) 3 fois pendant 5 minutes chacune.
- Retirez la solution de lavage. Ajouter 200 μL de solution de perméabilisation (0,3 % de Triton-X 100 dans du PBS) par puits à température ambiante pendant 20 min. Retirez la solution de perméabilisation. Rincez les cellules avec une solution de lavage (3 % BSA dans PBS) 2 fois pendant 5 minutes chacune.
- Dissoudre l’additif avec 1,3 mL d’eau déminéralisée pour compléter la solution. Préparez la solution réactionnelle contenant 1,72 mL de tampon réactionnel, 4 μL d’azoture 488, 80 μL de CuSO4 et 200 μL de solution additive.
- Ajouter 50 μL de solution réactionnelle par puits. Incuber les échantillons à température ambiante pendant 30 minutes dans l’obscurité. Rincez les cellules avec une solution de lavage 3 fois pendant 5 minutes chacune.
- Retirez la solution de lavage. Ajouter 200 μL de 1x solution Hoechst 33342 et incuber les échantillons à température ambiante pendant 10 min dans l’obscurité.
- Acquérir des images à l’aide du microscope à fluorescence. Utilisez le logiciel Image-Pro plus 6.0 pour effectuer une analyse quantitative des images.
REMARQUE : Les longueurs d’onde maximales d’excitation et d’émission de l’Azide 488 sont respectivement de 495 nm et 519 nm. Les longueurs d’onde maximales d’excitation et d’émission de Hoechst 33342 sont respectivement de 346 nm et 460 nm.
10. Détection de mitophagie dans les cellules vivantes
- Ensemencez les cellules à raison de 2 x 104 cellules par puits dans une plaque à fond de verre à 24 puits. Cultivez des cellules pendant la nuit avec un milieu RPMI 1640 sans antibiotiques à 37 °C avec 5 % de CO2.
- Préparez la solution de travail du colorant mtphagy et la solution de travail du colorant lyso (voir le tableau des matériaux). Diluer la solution de colorant mtphagy avec le tampon HEPES de Hanks à une concentration de 100 nM/L. Diluer la solution de colorant lyso avec le tampon HEPES de Hanks à une concentration de 100 μM/L.
- Retirez le milieu de culture et rincez les cellules avec le tampon HEPES 2x de Hanks. Ajouter 500 μL de solution de travail du colorant mmphagique (100 nM/L), puis incuber à 37 °C pendant 30 min.
- Rincez les cellules avec le tampon HEPES de Hanks 2x. Ajouter 500 μL de solution de travail du lyso (100 μM/L), puis incuber à 37 °C pendant 30 min.
- Rincez les cellules avec le tampon HEPES de Hanks 2x. Déterminer le niveau de mitophagie par microscopie confocale à fluorescence.
REMARQUE : Les cellules ont été imagées sans aucune fixation avant ou après la coloration. Le processus d’imagerie a été effectué aussi rapidement que possible afin de minimiser tout changement ou altération potentiel de l’état cellulaire.
11. Analyses statistiques
- Utiliser un logiciel commercial pour effectuer des analyses statistiques. Comparez les différences entre les différents groupes avec l’ANOVA à un facteur suivie du test LSD post hoc. Présentez les données sous forme de moyenne ± d’écart-type (ET). Définissez la signification statistique sur P<0,05.
Access restricted. Please log in or start a trial to view this content.
Résultats
Le MNNG induit la progression du PLGC dans le modèle animal et favorise la transformation morphologique des cellules GES-1
Lors de l’observation macroscopique, la muqueuse gastrique des rats du groupe témoin est apparue uniformément rouge vif, lisse et molle, avec les plis muqueux disposés selon un motif linéaire. Contrairement aux rats du groupe témoin, la muqueuse gastrique des rats du groupe modèle présentait une pâleur et une ru...
Access restricted. Please log in or start a trial to view this content.
Discussion
La PLGC joue un rôle clé dans la progression de la gastrite chronique vers la GC. La MTC s’est avérée être un traitement et une intervention prometteurs pour la PLGC au cours des dernières années24,25. Ces dernières années, la MTC est apparue comme une approche prometteuse pour le traitement et l’intervention du PLGC. Cela est cohérent avec les recherches précédentes10. Les résultats de l?...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Tous les auteurs déclarent qu’ils n’ont aucun conflit d’intérêts.
Remerciements
Ce projet a été financé par la Fondation des sciences naturelles de la province du Hebei en Chine (H2020423207).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1-Methyl-3-nitro-1-nitrosoguanidine | Shanghai McLean Biochemical Technology Co., Ltd., Shanghai, CHN | R030453 | |
| 3,3’-diaminobenzidine | Beijing Zhong Shan-Golden Bridge Biological Technology Co., Ltd., Beijing, CHN | ZLI0919 | |
| Alcian blue periodic acid schiff staining reagent kit | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | G1285 | |
| Anti-fade fluorescence mounting medium | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | S2110 | |
| Bicinchoninic acid protein concentration determination kit | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G2026-1000T | |
| CCK-8 reagent kit | Boster Biological Engineering co., Ltd., Wuhan, CHN | AR1160 | |
| Confocal fluorescence microscopy | Leica Instruments Co., Ltd., Weztlar, GER | TCS-SP8SR | |
COX 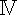 antibody antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab202554 | |
| DAPI staining solution | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | C0065 | |
| DEPC | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G3004 | |
| EdU cell proliferation kit | Beyotime Biotechnology Co., Ltd., Shanghai, CHN | C0071S | |
| Electrophoresis solution | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0139 | |
| Ethanol | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 64-17-5 | |
| FBS | Gibco Corporation, Gaithersburg, USA | 16000044 | |
| Fluorescence microscope | Olympus Corporation, Tokyo, JPN | BH2-RFCA | |
| Foxo3a antibody | Abcam Trading Co., Ltd., Shanghai, CHN | 23683 | |
| GAPDH antibody | Wuhan Sanying Biology Technology Co., Ltd., Wuhan, CHN | 10494-1-AP | |
| Gel preparation kit | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0138 | |
| GES-1 cell | Procell Life Science&Technology Co., Ltd., Wuhan, CHN | CL-0563 | |
| Goat-anti-mouse IgG | CST Biological Reagents Co., Ltd., Shanghai, CHN | 4409 | |
| Goat-anti-rabbit IgG | Abcam Trading Co., Ltd., Shanghai, CHN | ab150077 | |
| Hematoxylin-eosin staining solution | Zhuhai Beso Biotechnology Co., Ltd., Shenzhen, CHN | BA4027 | |
| High iron diamine/alcian blue staining reagent kit | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | G2070 | |
| ImageJ | National Institutes of Health, Bethesda, USA | ||
| Image-Pro Plus 6.0 software | Media Cybernetics Inc., Maryland, USA | ||
| Isopropanol | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 67-63-0 | |
| LC3 antibody | CST Biological Reagents Co., Ltd., Shanghai, CHN | 83506 | |
| Loading buffer | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0198 | |
| Microplate reader | Rayto Life and Analytical Sciences Co., Ltd., Shenzhen, CHN | RT6100 | |
| Microtome | Leica Instruments Co., Ltd., Weztlar, GER | RM2245 | |
| Mitophagy kit | Dojindo Laboratories, Kyushu Island, JPN | MD01-10 | |
| Neutral balsam | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | WG10004160 | |
| Optical microscope | Olympus Corporation, Tokyo, JPN | BH2-RFCA | |
| P62 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab91526 | |
| Paraformaldehyde | Biosharp Life Sciences, Anhui, CHN | BL539A | |
| Parkin antibody | CST Biological Reagents Co., Ltd., Shanghai, CHN | 32833 | |
| Penicillin–streptomycin | Gibco Corporation, Gaithersburg, USA | 15140122 | |
| phosphate-buffered saline | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G0002-15 | |
| PVDF membrane | Millipore Corporation, Michigan, USA | IPVH00010 | |
| Redzol | SBS Genetech Co., Ltd., Beijing, CHN | FTR-50 | |
| Reverse transcription reagent kit | Igene Biotechnology Co., Ltd., Guangzhou, CHN | QP057 | |
| RIPA Buffer solution | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | R002 | |
| Roswell Park Memorial Institute | Gibco Corporation, Gaithersburg, USA | 11875093 | |
| Silicone needle | Zhongke Life Biotechnology Co., Ltd., Beijing, CHN | TFEP-2 | |
| siRNA | Wuhan Genecreate Biological Engineering Co., Ltd. ,Wuhan,CHN | ||
| Sirt3 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | 189860 | |
| Sodium salicylate | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, CHN | S104176 | |
| Sprague-Dawley rat | Beijing Huafukang Biotechnology Co., Ltd., Beijing, CHN | 110322210102553975 | |
| SYBR quantitative PCR kit | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G3320-15 | |
| Tomm20 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab186735 | |
| Transferring buffer | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0141 | |
| Trichloromethane | Shanghai McLean Biochemical Technology Co., Ltd., Shanghai, CHN | 821112 | |
| Tris-buffered saline with Tween 20 | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G0004 | |
| VDAC1 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab15895 | |
| Xylene | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 1330-20-7 | |
| β-actin antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab8226 |
Références
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- He, J., et al. Helicobacter pylori infection induces stem cell-like properties in Correa cascade of gastric cancer. Cancer Letters. 542, 215764(2022).
- Xu, W., Li, B., Xu, M., Yang, T., Hao, X. Traditional Chinese medicine for precancerous lesions of gastric cancer: A review. Biomedicine & Pharmacotherapy. 146, 112542(2022).
- Yang, L., et al. A Systematic Review of the Mechanisms Underlying Treatment of Gastric Precancerous Lesions by Traditional Chinese Medicine. Evidence-Based Complementary and Alternative Medicine. 2020, 9154738(2020).
- Ping, Z., Yan, W., Jing, L., Qian, J., Xin, H. The Effect of Huazhuo Jiedu recipe on Epithelial -Mesenchymal-Transition in Chronic Erosive Gastritis Patients with Zhuoduneiyun syndrome. Pharmacology and Clinics of Chinese Materia Medica. 35 (6), 154-158 (2019).
- Yan, W., Jing, L., Pan, Z. The effect of Huazhuojiedu formula on HGF/c-Met signal pathway in patients with chronic erosive gastritis. Pharmacology and Clinics of Chinese Materia Medica. 33 (02), 186-189 (2017).
- Hao, X., et al. Integrating Network Pharmacology and Experimental Validation to Investigate the Mechanisms of Huazhuojiedu Decoction to Treat Chronic Atrophic Gastritis. Evidence-Based Complementary and Alternative Medicine. 2020, 2638362(2020).
- Zhou, P., et al. 16S rRNA sequencing-based evaluation of the protective effects of Hua-Zhuo-Jie-Du on rats with chronic atrophic gastritis. BMC Complementary Medicine and Therapies. 22 (1), 71(2022).
- Zhou, P., et al. Determination of the protective effects of Hua-Zhuo-Jie-Du in chronic atrophic gastritis by regulating intestinal microbiota and metabolites: combination of liquid chromatograph mass spectrometer metabolic profiling and 16S rRNA gene sequencing. Chinese Medicine. 16 (1), 37(2021).
- Hao, X., Zhou, P., Yang, Z., Yang, T., Wang, Y. The therapeutic effect of Huazhuojiedu decoction on precancerous lesions in a gastric cancer model via the regulation of lnc 517368. Journal of Ethnopharmacology. 283, 114635(2022).
- Palikaras, K., Lionaki, E., Tavernarakis, N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology. Nature Cell Biology. 20 (9), 1013-1022 (2018).
- Zhang, C., et al. Parkin, a p53 target gene, mediates the role of p53 in glucose metabolism and the Warburg effect. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16259-16264 (2011).
- Cai, T., et al. Protective effects of Weipixiao decoction against MNNG-induced gastric precancerous lesions in rats. Biomedicine & Pharmacotherapy. 120, 109427(2019).
- Shah, S. C., Piazuelo, M. B., Kuipers, E. J., Li, D. AGA Clinical Practice Update on the Diagnosis and Management of Atrophic Gastritis: Expert Review. Gastroenterology. 161 (4), 1325-1332 (2021).
- Pimentel-Nunes, P., et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 51 (4), 365-388 (2019).
- Nagtegaal, I. D., et al. The 2019 WHO classification of tumours of the digestive system. Histopathology. 76 (2), 182-188 (2020).
- Kushima, R. The updated WHO classification of digestive system tumours-gastric adenocarcinoma and dysplasia. Der Pathologe. 43 (1), 8-15 (2022).
- Yang, P., et al. Weipiling decoction alleviates N-methyl-N-nitro-N'-nitrosoguanidine-induced gastric precancerous lesions via NF-κB signalling pathway inhibition. Chinese Medicine. 17 (1), 104(2022).
- Xu, J., et al. Xiao Tan He Wei Decoction reverses MNNG-induced precancerous lesions of gastric carcinoma in vivo and vitro: Regulation of apoptosis through NF-κB pathway. Biomedicine & Pharmacotherapy. 108, 95-102 (2018).
- Li, S. Study on the mechanism of regulating NF-kB activity and inhibiting the migration of gastric "inflammation-cancer" transformed cells by invigorating spleen, removing blood stasis and detoxifying. Guangzhou University of Chinese Medicine. , 17-19 (2021).
- Liu, H. Research Progress of Cell Models of Gastric Cancer Precancerous Lesions. Traditional Chinese Drug Research and Clinical Pharmacology. 27 (4), 592-596 (2016).
- Zheng, J., et al. Chronic stress accelerates the process of gastric precancerous lesions in rats. Journal of Cancer. 12 (14), 4121-4133 (2021).
- Yu, W., et al. Sirt3 deficiency exacerbates diabetic cardiac dysfunction: Role of Foxo3A-Parkin-mediated mitophagy. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (8), 1973-1983 (2017).
- Cao, Y., et al. Efficacy of Banxia Xiexin decoction for chronic atrophic gastritis: A systematic review and meta-analysis. PLoS One. 15 (10), e0241202(2020).
- Yin, J., et al. Weiqi Decoction Attenuated Chronic Atrophic Gastritis with Precancerous Lesion through Regulating Microcirculation Disturbance and HIF-1α Signaling Pathway. Evidence-Based Complementary and Alternative Medicine. 2019, 2651037(2019).
- Zhang, J., Wang, X., Wang, F., Tang, X. Xiangsha Liujunzi Decoction improves gastrointestinal motility in functional dyspepsia with spleen deficiency syndrome by restoring mitochondrial quality control homeostasis. Phytomedicine. 105, 154374(2022).
- Shida, M., et al. Impaired mitophagy activates mtROS/HIF-1α interplay and increases cancer aggressiveness in gastric cancer cells under hypoxia. International Journal of Oncology. 48 (4), 1379-1390 (2016).
- Zhou, X. Y., et al. Inhibition of autophagy blocks cathepsins-tBid-mitochondrial apoptotic signaling pathway via stabilization of lysosomal membrane in ischemic astrocytes. Cell Death & Disease. 8 (2), e2618(2017).
- He, R., Peng, J., Yuan, P., Xu, F., Wei, W. Divergent roles of BECN1 in LC3 lipidation and autophagosomal function. Autophagy. 11 (5), 740-747 (2015).
- Fernández-Coto, D. L., et al. Quantitative proteomics reveals proteins involved in the progression from non-cancerous lesions to gastric cancer. Journal of Proteomics. 186, 15-27 (2018).
- Ding, D., et al. Post-translational modification of Parkin and its research progress in cancer. Cancer Communications. 39 (1), 77(2019).
- Wang, Y., et al. The Role of Mitochondrial Dynamics and Mitophagy in Carcinogenesis, Metastasis and Therapy. Frontiers in Cell and Developmental Biology. 8, 413(2020).
- Gehrke, S., et al. PINK1 and Parkin control localized translation of respiratory chain component mRNAs on mitochondria outer membrane. Cell Metabolism. 21 (1), 95-108 (2015).
- Fu, Z. J., et al. HIF-1α-BNIP3-mediated mitophagy in tubular cells protects against renal ischemia/reperfusion injury. Redox Biology. 36, 101671(2020).
- Jia, Q., et al. Hesperidin promotes gastric motility in rats with functional dyspepsia by regulating Drp1-mediated ICC mitophagy. Frontiers in Pharmacology. 13, 945624(2022).
- Chen, Y. The N-alkylamides induces MGMT gene hypomethylation in gastric epithelium cells malignant transformation. Zhejiang University. , 33-35 (2015).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon