É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Efeitos terapêuticos da decocção de Huazhuojiedu em lesões pré-cancerosas de câncer gástrico, regulando a mitofagia
Neste Artigo
Resumo
Aqui, apresentamos um protocolo que demonstra a eficácia terapêutica da decocção de Huazhuojiedu (HZJD) no alívio de lesões pré-cancerosas de câncer gástrico usando a regulação da mitofagia.
Resumo
Esta pesquisa tem como objetivo explorar o efeito terapêutico e os mecanismos potenciais da decocção de Huazhuojiedu (HZJD) para aliviar lesões pré-cancerosas do câncer gástrico (PLGC) tanto in vivo quanto in vitro. HZJD é uma fórmula tradicional chinesa de ervas composta por 11 ervas. Os ratos Sprague-Dawley (SD) foram divididos aleatoriamente em quatro subgrupos: grupo controle, grupo modelo, grupo droga positiva e grupo HZJD. Coloração de hematoxilina-eosina (H & E), coloração de alto teor de diamina-azul de alcian (HID-AB), coloração de ácido periódico de ácido de Alcian (AB-PAS), imuno-histoquímica, imunofluorescência, RT-qPCR e ensaios de Western blot foram realizados após 10 semanas de tratamento com HZJD. In vitro, os ensaios de contagem de células kit-8 (CCK-8) e 5-etinil-2'-desoxiuridina (EdU) foram usados para detectar a proliferação celular. Ensaios de RT-qPCR e Western blot foram realizados para avaliar os níveis de mitofagia. Os resultados indicaram que o HZJD pode retardar a progressão patológica em ratos com PLGC e reduzir a proliferação de células com PLGC. O tratamento com HZJD aumentou significativamente os níveis de expressão de mRNA e proteína de Sirt3, Foxo3a, Parkin e LC3 II/I, enquanto diminuiu os níveis de expressão de mRNA e proteína de p62 e Tomm20. Descobriu-se que o HZJD tem a capacidade de reverter o declínio na atividade mitofagia tanto in vivo quanto in vitro. Em conclusão, o estudo avaliou o impacto do HZJD e forneceu evidências sobre seu potencial mecanismo molecular.
Introdução
O câncer gástrico (CG) continua sendo uma das doenças malignas mais comuns que afetam o sistema digestivo em todo o mundo. Estima-se que o GC seja responsável por aproximadamente 6% de todos os cânceres em todo o mundo, ocupando o5º lugar entre os cânceres mais frequentemente diagnosticados e o3º entre as mortes relacionadas ao câncer1. O GC é amplamente reconhecido como um processo biológico progressivo de várias etapas. Antes do início do GC, a mucosa gástrica geralmente passa por vários anos de lesões pré-cancerosas, chamadas de lesões pré-cancerosas dos estágios de câncer gástrico (PLGC). A teoria da cascata de Correa é amplamente aceita e fornece uma explicação para a progressão sequencial da mucosa normal para gastrite crônica não atrófica, gastrite atrófica, metaplasia intestinal (MI), displasia (Dys) e, eventualmente, carcinoma2. O PLGC representa um estágio crucial no desenvolvimento do GC, e a intervenção e o monitoramento oportunos do PLGC são vitais para a prevenção precoce do GC.
Avaliações clínicas recentes e pesquisas experimentais confirmaram que a medicina tradicional chinesa (MTC) está emergindo como uma das terapias mais eficazes para o tratamento de PLGC 3,4. A decocção HZJD é uma fórmula da MTC desenvolvida com base na experiência clínica e enraizada na teoria da MTC de remoção de calor e umidade. Estudos anteriores demonstraram os efeitos benéficos da decocção de HZJD no tratamento da PLGC, particularmente no alívio dos sintomas clínicos e manifestações patológicas 5,6. Por meio de estudos relacionados à farmacologia em rede, identificamos os componentes ativos da decocção de HZJD, bem como seus alvos potenciais para o PLGC7. Os resultados de um estudo anterior indicaram que a decocção de HZJD tinha a capacidade de aumentar a diversidade, otimizar a estrutura da comunidade e aumentar a abundância relativa da flora intestinal em ratos PLGC8. Além disso, verificou-se que a decocção de HZJD poderia melhorar o PLGC regulando a microbiota intestinal e seus metabólitos9. Em trabalhos recentes, demonstramos que a decocção de HZJD pode regular o equilíbrio dinâmico da proliferação celular e apoptose em células PLGC, regulando negativamente a expressão de lnc 51736810.
Um número crescente de estudos confirmou que a mitofagia desempenha um papel importante em vários tipos de câncer. A mitofagia elimina seletivamente a mitocôndria danificada e despolarizada e evita ainda o acúmulo excessivo de espécies reativas citotóxicas de oxigênio (ROS) da mitocôndria disfuncional, que por sua vez inibe a tumorigênese11. A mitofagia, a degradação seletiva de mitocôndrias danificadas ou disfuncionais, está intrinsecamente ligada à fosforilação oxidativa mitocondrial (OXPHOS). O comprometimento ou ausência de mitofagia pode levar a uma mudança no metabolismo energético celular em direção à glicólise aeróbica, um fenômeno comumente conhecido como efeito Warburg. O aumento da produção de lactato e corpos cetônicos, resultante do efeito Warburg, contribui para a construção de um microambiente tumoral propício à proliferação celular12.
Este estudo apresenta um protocolo abrangente para a utilização da decocção de HZJD como uma abordagem terapêutica para mitigar a progressão do PLGC. Por meio de nossa avaliação, observamos um efeito positivo significativo da decocção de HZJD, particularmente em sua capacidade de regular a mitofagia. O estudo fornece informações valiosas sobre os potenciais mecanismos moleculares da decocção de HZJD no tratamento de PLGC.
Protocolo
Todos os procedimentos experimentais e cuidados com os animais foram aprovados pelas Diretrizes do Comitê Institucional de Cuidados e Uso de Animais da Universidade de Medicina Tradicional Chinesa de Hebei (número de aprovação: DWLL2019031) e foram realizados de acordo com as diretrizes éticas. Um total de 90 ratos Sprague-Dawley (SD) machos livres de patógenos específicos (idade = 6 semanas; peso = 150-180 g; ver Tabela de Materiais) foram criados em temperatura constante (24 ° C ± 4 ° C) e umidade (50% -60%) sob ciclo escuro / claro controlado de 12 h. Os ratos foram aclimatados ao novo ambiente por 1 semana antes de iniciar os experimentos.
1. Preparação para experimentação animal
- Modelo de rato de PLGC
- Atribua aleatoriamente os ratos a um grupo de controle (n = 20) e um grupo de modelo PLGC (n = 70). Forneça aos ratos do grupo controle uma dieta padrão de pellets para roedores e água ad libitum. Alimente os ratos no grupo modelo PLGC com uma dieta irregular (jejum de 1 dia, alimentação de 1 dia).
- Alojar os ratos em grupos de cinco por gaiola. Fornecer ao grupo de controle 150 g/dia de ração por gaiola. Permitir que o grupo de modelos PLGC tenha livre acesso aos alimentos por 23 h (150 g/dia/por gaiola). Após 23 h, remova o alimento restante.
- Fornecer aos ratos do grupo modelo PLGC uma solução de 1-metil-3-nitro-1-nitrosoguanidina (MNNG) (200 μg/ml) para consumo livre10,13. Forneça aos ratos do grupo modelo PLGC 200 mL de solução de GNM por gaiola. Coloque a solução MNNG em garrafas opacas e substitua diariamente.
- Gavagem os ratos do grupo modelo PLGC com salicilato de sódio a 2% após 24 h de jejum (uma vez a cada 2 dias por gavagem). Para a sonda gástrica, utilizar uma agulha de silicone (ver Tabela de Materiais) com uma profundidade mínima da agulha igual a 6 cm. Realize a gavagem de forma consistente no mesmo horário pela manhã, entre 8h30 e 9h30.
- Selecione aleatoriamente dois ratos do grupo modelo PLGC para exame patológico nas semanas 12, 16, 20 e 24, a fim de avaliar o estabelecimento do modelo PLGC. Considere o modelo bem-sucedido quando ambos os ratos forem diagnosticados com PLGC por avaliação patológica, conforme descrito em9.
- Este processo de modelagem dura cerca de 24 semanas. Permitir que a avaliação patológica seja realizada de forma independente por dois patologistas seniores. Determinar o diagnóstico patológico de PLGC em ratos por meio da avaliação colaborativa de dois patologistas. Levar em consideração suas opiniões diagnósticas e usar as diretrizes anteriores como referência durante o processo de avaliação 14,15,16,17.
- Preparação da decocção HZJD
- Prepare a decocção de HZJD de acordo com o método descrito em7.
NOTA: As ervas na decocção HZJD foram compradas e autenticadas pelo Hospital de Medicina Tradicional Chinesa de Hebei.
- Prepare a decocção de HZJD de acordo com o método descrito em7.
- Agrupamento e intervenção medicamentosa
- Divida aleatoriamente o grupo modelo PLGC em três subgrupos: grupo modelo (n = 20), grupo de drogas positivas (n = 20) e grupo de decocção Huazhuojiedu (HZJD, n = 20, Tabela 1).
- Gavagem os ratos do grupo de drogas positivas com 0,7 mg/kg/dia de vitamina B12 por gavagem18. Trate os ratos do grupo HZJD com decocção de HZJD a 14,81 g / kg / dia8. Administrar os ratos do grupo controle e do grupo modelo com água destilada (10 mL/kg). Todos os quatro grupos recebem a administração intragástrica uma vez ao dia por 10 semanas.
NOTA: A dose diária recomendada de decocção de HZJD para humanos é de 142 g / dia10. Usando o método de cálculo da área da superfície corporal, determina-se que a dosagem recomendada para ratos é 6,25x a dos humanos. Portanto, a dose diária de decocção de HZJD para ratos é de 14,81 g / kg. A dosagem foi ajustada semanalmente de acordo com o peso dos ratos. O volume máximo de gavagem não excedeu 3 mL.
- Coleta de amostras
- Sacrifique todos os ratos após 24 h de jejum (com livre acesso à água) na semana 35. Anestesiar todos os ratos com isoflurano (indução a 5%, 2% para manutenção, vazão de 1L/min).
- Depile a área abdominal e esterilize a pele com etanol e iodo após confirmar a perda de estimulação da dor. Corte a pele abdominal da cartilagem xifóide ao longo da linha média do abdômen com um bisturi.
- Sem corte, separe o tecido subcutâneo com uma pinça e um bisturi até expor o estômago. Disseque o estômago ao longo da curvatura maior com uma tesoura e enxágue imediatamente com solução salina tamponada com fosfato (PBS).
- Desdobre os tecidos do estômago em uma placa de gelo. Coletar amostras gástricas (2 mm x 2 mm) do antro, do corpo e da curvatura menor da região angular. Se houver lesões visíveis no estômago, colete e processe essas porções específicas como amostras.
- Fixe as amostras gástricas em paraformaldeído a 4% por 24 h. Coloque os tecidos gástricos restantes em criotubos. Congele-os em nitrogênio líquido e armazene-os a -80 °C.
- Eutanásia dos ratos por inalação de dióxido de carbono. Coloque as carcaças de ratos em sacos lacrados e, em seguida, coloque os sacos no armário de armazenamento de carcaças de animais.
2. Exame patológico
- Apare e alise os tecidos gástricos fixos com uma tesoura. Desidratar os tecidos com uma série de gradiente de álcool, ou seja, etanol 75% por 30 min, etanol 85% por 30 min, etanol 95% por 30 min e 2x em etanol anidro por 30 min cada. Mergulhe os tecidos em solução de xileno/etanol (1:1) por 1 h e 2x em xileno 100% por 30 min cada.
- Despeje metade da cera derretida no molde e, em seguida, coloque os tecidos permeabilizados no molde rapidamente. Coloque os lenços na outra metade da cera derretida. Marque a caixa embutida e deixe a cera solidificar completamente.
- Use micrótomo para cortar em fatias com espessura de 4 μm. Coloque as fatias nas lâminas.
- Coloque as fatias 2x em xileno 100% por 10 min cada, depois em solução de xileno/etanol (1:1) por 10 min, 2x novamente em etanol anidro por 5 min, depois em etanol 95% por 5 min, seguido de etanol 85% por 5 min e, finalmente, em etanol 70% por 5 min. Lave as fatias com água corrente.
- Manchar as fatias com hematoxilina por 5 min. Diferencie-se mergulhando em ácido clorídrico-etanol a 0,5% por 10 s. Pinte as fatias com eosina por 2 min.
- Lave as fatias com água destilada. Desidrate as fatias com uma série de álcool gradiente, ou seja, etanol 70% por 30 s, etanol 80% por 30 s, etanol 95% por 30 s, etanol anidro por 30 s. Permeabilize as fatias com 100% xileno 2x. Sele as fatias com bálsamo neutro.
- Misture a solução HID A e a solução HID B na proporção de 50:3 para preparar a solução de trabalho HID. Manchar as fatias com a solução de trabalho HID durante 24 h.
- Enxágüe em água corrente e manche as fatias com alcian por 20 min. Contra-corar as fatias com a solução vermelha nuclear rápida por 10 min. Desidrate e sele as fatias conforme descrito na etapa 2.6.
- Manchar as fatias com alcian durante 20 min. Incube as fatias em solução aquosa de ácido periódico a 1% por 5 min. Manchar as fatias com Schiff por 20 min.
- Incube as lâminas com hematoxilina por 2 min para corar os núcleos. Adicionar a solução de diferenciação ácida (fornecida com o kit HID) durante 5 s. Aplique a solução azul Scott por 3 min para colorir os slides de azul. Desidrate e sele as fatias conforme descrito acima na etapa 2.6.
NOTA: O processo de coloração deve ser protegido da luz. A temperatura deve ser mantida abaixo de 22 °C quando se utiliza uma solução aquosa a 1% de ácido periódico. As fatias devem ser desidratadas e seladas conforme descrito na etapa 2.6. - Examine as fatias coradas sob um microscópio óptico com ampliação de 10x e 20x.
3. Imuno-histoquímica
- Use as fatias obtidas na etapa 2.4. Coloque as fatias em tampão citrato de sódio 0,01 M e aqueça por 10 min para realizar a recuperação do antígeno.
- Adicione 3% de peróxido de hidrogênio por 30 min para extinguir a peroxidase endógena e a biotina. Bloqueie as fatias com soro de cabra por 30 min.
- Incubar as fatias com os anticorpos primários diluídos contra sirt3 (1:200), foxo3a (1:100) e parkin (1:200) durante a noite a 4 °C. Substitua os anticorpos primários por PBS para o controle negativo.
- Enxágue as fatias 3x por 5 min por enxágue com PBS. Incubar as fatias com o anticorpo secundário correspondente à temperatura ambiente durante 1 h.
- Adicionar 20 μL de 3,3'-diaminobenzidina (DAB) durante 3 min. Desidrate e sele as fatias conforme descrito acima na etapa 2.6.
- Visualize todas as fatias com ampliação de 40x sob o microscópio óptico. Use o software Image-Pro Plus 6.0 para realizar análises quantitativas de imagens.
4. Imunofluorescência
- Use as fatias obtidas na etapa 3.1. Repita a etapa 3.3.
- Incubar as fatias com os anticorpos primários diluídos contra COX IV (1:500) e CL3 (1:500) durante a noite a 4 °C. Enxágue as fatias 3x por 5 min por enxágue com PBS.
- Incube as fatias com o IgG anti-coelho de cabra (1:1000) e IgG anti-rato de cabra (1:1000) em temperatura ambiente por 1,5 h. Enxágue as fatias 3x por 5 min por enxágue com PBS.
- Adicione a solução de coloração DAPI e incube em temperatura ambiente por 10 min no escuro. Enxágue as fatias 3x por 5 min por enxágue com PBS.
- Adicione a solução de coloração DAPI gota a gota e incube em temperatura ambiente por 10 min no escuro. Monte as fatias com meio de montagem de fluorescência anti-desbotamento.
- Visualize e fotografe as fatias sob um microscópio de fluorescência (consulte a Tabela de Materiais) com ampliação de 40x.
5. Análise de Western blot
- Pese 100 mg de tecidos gástricos com precisão. Adicione 1 mL de solução tampão RIPA (consulte a Tabela de Materiais). Triture bem os tecidos usando um homogeneizador (10.000 x g, 15 s de cada vez por 3x).
- Coloque o homogeneizado de tecido no gelo por 30 min. Centrifugue a 12.000 x g por 20 min a 4 °C e, em seguida, colete o sobrenadante.
- Quantifique a concentração de proteína usando o kit de determinação da concentração de proteína de ácido bicinconínico (BCA) (consulte a Tabela de Materiais). Ajustar a concentração de proteínas do sobrenadante obtido de modo a ser coerente nas amostras.
- Prepare o gel SDS-PAGE consistindo em um gel de separação de 10% e um gel de empilhamento de 5%. Despeje o gel de separação a 10% na placa de vidro até 2/3 da altura total. Adicione água deionizada sobre o gel até que o gel solidifique. Despeje o gel de empilhamento a 5% para encher a placa de vidro. Insira o pente de eletroforese.
NOTA: Deve-se tomar cuidado para garantir que não haja bolhas no gel. - Misture o sobrenadante de proteína com tampão de carga 5x na proporção de 1:4. Coloque em água fervente por 5 min para desnaturar. Armazene-o a -20 °C.
- Monte o gel SDS-PAGE preparado no sistema de eletroforese Western blotting. Adicionar solução de eletroforese nova (ver Tabela de Materiais). Carregue 20 μL de amostra por poço no gel. Inicie a eletroforese a 80 V por 40 min e depois mude para 120 V.
- Recolha o gel e crie uma sanduíche de transferência da seguinte forma: duas camadas de esponja, duas camadas de papel de filtro, gel, membrana de fluoreto de polivinilideno (PVDF) (ver Tabela de Materiais), duas camadas de papel de filtro, duas camadas de esponja (do pólo negativo ao pólo positivo). Adicione tampão de transferência pré-resfriado. Execute a transferência úmida a 350 mA por 2 h.
NOTA: Antes de montar o sanduíche de transferência, a membrana de PVDF deve ser pré-tratada com metanol. Além disso, a esponja, o papel de filtro e a membrana de PVDF pré-tratada devem ser imersos no tampão de transferência (consulte a Tabela de Materiais) com antecedência. - Bloqueie a membrana com 5% de leite desnatado em solução salina tamponada com tris com tween 20 (TBST) por 2 h em um shaker. Incubar a membrana durante a noite a 4 °C com os seguintes anticorpos primários diluídos (Sirt3 = 1:500, Foxo3a = 1:1000, Parkin = 1:2000, P62 = 1:1000, LC3 = 1:1000, Tomm20 = 1:2000, β-actina = 1:5000, GAPDH = 1:5000).
NOTA: O GAPDH foi selecionado como referência para a detecção de Parkin devido ao peso molecular da Parkin (50 kDa) ser próximo ao da β-actina (42 kDa). - Lave a membrana 4x com TBST por 5 min de cada vez. Incube-o com o anticorpo secundário diluído (1:5000) à temperatura ambiente por 1 h.
- Solte a solução de trabalho ECL no lado proteico das membranas por 2 min. Adquira as imagens através do sistema de imagem por quimioluminescência. Use o software ImageJ para medir os valores da escala de cinza.
6. Análise quantitativa de PCR em tempo real
- Limpe todos os dispositivos experimentais com 0,1% de dietilpirocarbonato (DEPC) e, em seguida, esterilize-os em alta temperatura e alta pressão com antecedência.
- Pesar 50 mg de tecidos gástricos. Adicione 1 mL de Redzol (consulte a Tabela de Materiais) e triture em um homogeneizador. Transfira o homogeneizado de tecido para um tubo de centrífuga sem RNase e deixe-o repousar em temperatura ambiente por 10 min.
- Adicione 0,2 mL de triclorometano e misture bem. Deixe repousar em temperatura ambiente por 3 min. Centrifugue a 4 °C e 12.000 x g por 15 min.
- Remova a fase aquosa superior com cuidado e misture com 0,5 mL de isopropanol por 10 min. Centrifugue 12.000 x g por 10 min a 4 ° C para precipitar o RNA. Descarte o sobrenadante e lave o precipitado de RNA 3x com etanol a 75%.
- Centrifugue a 7.500 x g por 5 min a 4 °C. Descarte o sobrenadante e depois o precipitado de RNA seco em uma bancada estéril por 10 min. Dissolver o precipitado em 50 μl de DEPC.
- Transcreva reversamente 1 μg de RNA em cDNA. Adicione 1 μL de mistura 20x RTase, 4 μL de tampão de reação 5x RT (consulte a Tabela de Materiais) e reabasteça o DEPC até um volume total de 20 μL. Defina o procedimento de reação da seguinte forma: 10 min a 25 °C, 40 min a 42 °C, 10 min a 85 °C e, em seguida, mantenha a 4 °C.
- Prepare a mistura de reação de amplificação contendo 2 μL de cDNA, 2 μL de primer direto, 2 μL de primer reverso (Tabela 2), 10 μL de pré-mistura 2x SYBR (consulte a Tabela de Materiais) e 4 μL de DEPC. Defina o procedimento de reação da seguinte forma: 95 °C por 15 s, 60 °C por 10 s e 72 °C por 30 s (40 ciclos).
- Use β-actina como referência endógena. Obtenha os valores de Ct. Calcule a expressão relativa dos genes-alvo usando o método 2-ΔΔCt.
7. Preparação para experimentos com células
- Modelo celular de PLGC
- Cultura das células GES-1 em meio Roswell Park Memorial Institute (RPMI) 1640 combinado com 10% de soro fetal bovino (FBS) e 1% de penicilina-estreptomicina. Cultive as células a 2 x 105 células por poço em uma placa de 6 poços contendo 1,5 mL de meio RPMI 1640 sem soro e antibióticos a 37 ° C com 5% de CO2.
- Induza as células GES-1 com MNNG para transformação maligna. Defina a organização de modelagem conforme descrito abaixo.
- No dia 0, pré-ressuscite e passe as células GES-1 para mantê-las na fase de crescimento logarítmico. Inocular as células GES-1 em fase logarísmica em frascos de cultura e cultivá-las durante a noite.
- No dia 1 e no dia 2, substitua o meio contendo MNNG (10 μM / L). No dia 3, substitua o meio contendo MNNG por meio livre de drogas.
- No dia 4 e no dia 6, trate as células com meio contendo MNNG (5 μM / L) por 24 h. No dia 7, substitua o meio contendo MNNG por meio livre de drogas. Remova as numerosas células que morrem e se desprendem e continue a cultura celular.
- No dia 8 e no dia 10, trate as células com o meio contendo MNNG (5 μM / L) por 24 h. No dia 11, construa o modelo celular de PLGC (MC).
NOTA: Durante o período de modelagem, o estado das células deve ser observado regularmente. Se as células apresentarem um estado ruim, recomenda-se tratá-las com MNNG por diferentes intervalos de tempo, de preferência com um intervalo de 2 dias. Alternativamente, as células podem ser tratadas com uma dose baixa de MNNG (3 μM / L). Os critérios de diagnóstico patológico das células MC podem ser referenciados a partir de pesquisas anteriores para avaliar o estado das células com precisão 10,19,20,21.
- Preparação de soro contendo medicamento
- Alimente 30 ratos SD (machos, 220 g) com uma dieta padrão de pellets para roedores e água ad libitum até que todos os ratos pesem mais de 350 g. Atribua os ratos aleatoriamente ao grupo de soro contendo medicamento positivo (n = 10), grupo de soro contendo HZJD (n = 10) e grupo de soro de rato normal (n = 10).
- Realize a administração de medicamentos em ratos conforme descrito na etapa 1.3.2. Administre os ratos 2x ao dia às 8:00 e 20:00. Continue a intervenção medicamentosa por 7 dias.
- Colete as amostras de sangue dentro de 1 h após a última administração no dia 8 (8:00 AM). Colocar as amostras em tubos anticoagulantes a 4 °C durante 1 h. Centrifugar a 3.000 x g durante 15 min a 4 °C e recolher o sobrenadante.
- Métodos de agrupamento e intervenção de experimentos celulares
- Divida os experimentos celulares da seguinte forma: grupo GES-1 (GES-1), grupo MC (MC), grupo droga positiva (droga positiva), grupo decocção HZJD (HZJD), grupo silenciador Sirt3 (si-Sirt3), grupo controle negativo (si-NC) e silenciamento Sirt3 combinado com grupo decocção HZJD (si-Sirt3+HZJD).
- Trate as células no grupo de drogas positivas e no grupo HZJD com soro contendo vitamina B12 a 10% e soro contendo HZJD a 10%, respectivamente. Administre outros grupos com 10% de soro normal de rato.
NOTA: Com base em pesquisas anteriores10, 10% de soro contendo drogas foi selecionado para tratamento celular. - Realize a transfecção de si-RNA Sirt3 (ver Tabela de Materiais) para as células do grupo si-Sirt3 e do grupo si-Sirt3+HZJD. Configure um grupo de controle negativo recebendo um vetor vazio, ou seja, si-NC.
- Dissolva a potência de siRNA de 2,5 nM em 125 μL de DEPC para preparar a solução de siRNA. Diluir 5 μL de solução de siRNA com 250 μL de meio essencial mínimo e diluir 5 μL de lipofectamina 2000 com 250 μL de meio essencial mínimo. Misture-os uniformemente.
- Adicione a mistura ao meio RPMI 1640 (1,5 mL / por poço) em uma placa de 6 poços. Incubar a 37 °C com 5% de CO2. Realize a análise de Western blot para detectar o nível de expressão proteica de Sirt3 48 h após a transfecção.
8. Ensaio CCK-8
- Prepare as células em suspensão celular quando as células cobrirem 70% do fundo do frasco. Use o contador de células para contar o número de células na suspensão. Ajuste a concentração para garantir 2.000 células/poço, e cada poço contém 100 μL de meio RPMI 1640. Semeie as células em placas de 96 poços e mantenha a 37 ° C em uma incubadora com 5% de CO2 por 24 h. Configure 6 poços de replicação para cada grupo.
NOTA: Os poços periféricos das placas de 96 poços que não estão sendo usados são preenchidos com 200 μL de PBS para reduzir a evaporação durante o período de incubação. - Depois de cultivar as células por 24 horas, substitua o meio de cultura por um meio de cultura contendo medicamento diferente. Cultivar as células durante 48 h com meio de cultura contendo fármaco positivo e meio de cultura contendo HZJD.
NOTA: O meio de cultura é claro. Observando o fundo do frasco de cultura com luz, pode-se ver que as células estão conectadas em folhas. Esse fenômeno pode provar que as células aderiram à parede. Quando observadas ao microscópio, as células aderentes se estendem em lançadeiras no fundo do frasco e, ao agitar o meio de cultura, as células não se movem. As células geralmente aderem à parede após 24 h de cultura. - Substitua o meio de cultura contendo o medicamento por meio de cultura fresco. Adicionar 10 μL de solução de CCK-8 (ver Tabela de Materiais) a cada alvéolo e incubar a 37 °C durante 1 h. Para evitar a formação de bolhas de ar, adicione a solução CCK-8 obliquamente à parede da placa de cultura.
- Detecte o valor OD de cada poço usando um leitor de microplacas no comprimento de onda de 450 nm.
9. Ensaio de proliferação de células EdU
- Semeie as células em placas de 96 poços, conforme descrito na etapa 7.1. Substitua o meio de cultura por outro meio de cultura contendo drogas por 48 h.
NOTA: O tempo ideal de tratamento foi confirmado em 48 h por meio de experimentos preliminares. - Remova o meio e lave as células com PBS. Adicione 100 μL de meio de cultura por alvéolo. Prepare a solução 2x EdU (ver Tabela de Materiais, 20 μM). Adicione 6 μL da solução-mãe EdU a 3 mL de meio de cultura. Adicione 100 μL da solução 2x EdU (37 °C pré-aquecida) por poço e depois incube por 2,5 h.
NOTA: A solução estoque de EdU foi diluída na proporção de 1:500 para obter a solução 2x EdU. O volume real da solução 2x EdU foi de 2,4 mL para 24 poços. - Remova o meio contendo EdU. Adicionar 200 μL de paraformaldeído a 4% por poço à temperatura ambiente durante 15 min. Enxágue as células com solução de lavagem (albumina de soro bovino a 3% [BSA] em PBS) 3x por 5 min cada.
- Remova a solução de lavagem. Adicione 200 μL de solução de permeabilização (0,3% Triton-X 100 em PBS) por poço em temperatura ambiente por 20 min. Remova a solução de permeabilização. Enxágue as células com solução de lavagem (3% BSA em PBS) 2x por 5 min cada.
- Dissolva o aditivo com 1,3 mL de água deionizada para completar a solução. Preparar a solução de reacção contendo 1,72 ml de tampão de reacção, 4 μL de azida 488, 80 μl de CuSO4 e 200 μl de solução aditiva.
- Adicione 50 μL de solução de reação por poço. Incubar as amostras à temperatura ambiente durante 30 min no escuro. Enxágue as células com solução de lavagem 3x por 5 min cada.
- Remova a solução de lavagem. Adicione 200 μL de 1x solução Hoechst 33342 e incube as amostras em temperatura ambiente por 10 min no escuro.
- Adquira imagens usando o microscópio de fluorescência. Use o software Image-Pro plus 6.0 para realizar análises quantitativas de imagens.
NOTA: Os comprimentos de onda máximos de excitação e emissão da azida 488 são 495 nm e 519 nm, respectivamente. Os comprimentos de onda máximos de excitação e emissão do Hoechst 33342 são 346 nm e 460 nm, respectivamente.
10. Detecção de mitofagia em células vivas
- Semeie as células em 2 x 104 células por poço em uma placa de 24 poços com fundo de vidro. Cultura de células durante a noite com meio RPMI 1640 sem antibióticos a 37 °C com 5% de CO2.
- Prepare a solução de trabalho de corante de mtagia e a solução de trabalho de corante de liso (consulte a Tabela de Materiais). Diluir a solução de corante de mtfagia com tampão HEPES de Hanks até uma concentração de 100 nM/L. Diluir a solução de corante liso com tampão HEPES de Hanks até uma concentração de 100 μM/L.
- Remova o meio de cultura e enxágue as células com o tampão HEPES de Hanks 2x. Adicione 500 μL de solução de trabalho de corante de mestagia (100 nM / L) e incube a 37 ° C por 30 min.
- Enxágue as células com o tampão HEPES de Hanks 2x. Adicione 500 μL de solução de trabalho de corante lisoso (100 μM/L) e incube a 37 °C por 30 min.
- Enxágue as células com o tampão HEPES de Hanks 2x. Determinar o nível de mitofagia por microscopia de fluorescência confocal.
NOTA: As células foram fotografadas sem qualquer fixação antes ou depois da coloração. O processo de imagem foi conduzido o mais rápido possível para minimizar possíveis alterações ou alterações no estado celular.
11. Análises estatísticas
- Use software comercial para realizar análises estatísticas. Compare as diferenças entre os diferentes grupos com ANOVA de uma via seguida pelo teste post hoc do LSD. Apresente os dados como média ± desvio padrão (DP). Defina a significância estatística como P<0,05.
Resultados
MNNG induz progressão de PLGC em modelo animal e promove transformação morfológica de células GES-1
Após observação macroscópica, a mucosa gástrica dos ratos do grupo controle parecia uniformemente vermelha brilhante, lisa e macia, com as dobras mucosas dispostas em um padrão linear. Em contraste com os ratos do grupo controle, a mucosa gástrica dos ratos do grupo modelo exibiu palidez e rugosidade, e as plicanas mucosas estavam pl...
Discussão
O PLGC serve como um processo-chave na progressão da gastrite crônica para o GC. A MTC tem se mostrado um tratamento e intervenção promissores para o PLGC nos últimos anos24,25. Nos últimos anos, a MTC emergiu como uma abordagem promissora para o tratamento e intervenção do PLGC. Isso é consistente com pesquisas anteriores10. Os resultados do exame patológico revelaram que a decocção de HZJD ob...
Divulgações
Todos os autores declaram não ter conflito de interesses.
Agradecimentos
Este projeto foi financiado pela Fundação de Ciências Naturais da Província de Hebei, na China (H2020423207).
Materiais
| Name | Company | Catalog Number | Comments |
| 1-Methyl-3-nitro-1-nitrosoguanidine | Shanghai McLean Biochemical Technology Co., Ltd., Shanghai, CHN | R030453 | |
| 3,3’-diaminobenzidine | Beijing Zhong Shan-Golden Bridge Biological Technology Co., Ltd., Beijing, CHN | ZLI0919 | |
| Alcian blue periodic acid schiff staining reagent kit | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | G1285 | |
| Anti-fade fluorescence mounting medium | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | S2110 | |
| Bicinchoninic acid protein concentration determination kit | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G2026-1000T | |
| CCK-8 reagent kit | Boster Biological Engineering co., Ltd., Wuhan, CHN | AR1160 | |
| Confocal fluorescence microscopy | Leica Instruments Co., Ltd., Weztlar, GER | TCS-SP8SR | |
COX 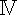 antibody antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab202554 | |
| DAPI staining solution | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | C0065 | |
| DEPC | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G3004 | |
| EdU cell proliferation kit | Beyotime Biotechnology Co., Ltd., Shanghai, CHN | C0071S | |
| Electrophoresis solution | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0139 | |
| Ethanol | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 64-17-5 | |
| FBS | Gibco Corporation, Gaithersburg, USA | 16000044 | |
| Fluorescence microscope | Olympus Corporation, Tokyo, JPN | BH2-RFCA | |
| Foxo3a antibody | Abcam Trading Co., Ltd., Shanghai, CHN | 23683 | |
| GAPDH antibody | Wuhan Sanying Biology Technology Co., Ltd., Wuhan, CHN | 10494-1-AP | |
| Gel preparation kit | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0138 | |
| GES-1 cell | Procell Life Science&Technology Co., Ltd., Wuhan, CHN | CL-0563 | |
| Goat-anti-mouse IgG | CST Biological Reagents Co., Ltd., Shanghai, CHN | 4409 | |
| Goat-anti-rabbit IgG | Abcam Trading Co., Ltd., Shanghai, CHN | ab150077 | |
| Hematoxylin-eosin staining solution | Zhuhai Beso Biotechnology Co., Ltd., Shenzhen, CHN | BA4027 | |
| High iron diamine/alcian blue staining reagent kit | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | G2070 | |
| ImageJ | National Institutes of Health, Bethesda, USA | ||
| Image-Pro Plus 6.0 software | Media Cybernetics Inc., Maryland, USA | ||
| Isopropanol | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 67-63-0 | |
| LC3 antibody | CST Biological Reagents Co., Ltd., Shanghai, CHN | 83506 | |
| Loading buffer | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0198 | |
| Microplate reader | Rayto Life and Analytical Sciences Co., Ltd., Shenzhen, CHN | RT6100 | |
| Microtome | Leica Instruments Co., Ltd., Weztlar, GER | RM2245 | |
| Mitophagy kit | Dojindo Laboratories, Kyushu Island, JPN | MD01-10 | |
| Neutral balsam | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | WG10004160 | |
| Optical microscope | Olympus Corporation, Tokyo, JPN | BH2-RFCA | |
| P62 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab91526 | |
| Paraformaldehyde | Biosharp Life Sciences, Anhui, CHN | BL539A | |
| Parkin antibody | CST Biological Reagents Co., Ltd., Shanghai, CHN | 32833 | |
| Penicillin–streptomycin | Gibco Corporation, Gaithersburg, USA | 15140122 | |
| phosphate-buffered saline | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G0002-15 | |
| PVDF membrane | Millipore Corporation, Michigan, USA | IPVH00010 | |
| Redzol | SBS Genetech Co., Ltd., Beijing, CHN | FTR-50 | |
| Reverse transcription reagent kit | Igene Biotechnology Co., Ltd., Guangzhou, CHN | QP057 | |
| RIPA Buffer solution | Beijing Solarbio Technology Co., Ltd., Beijing, CHN | R002 | |
| Roswell Park Memorial Institute | Gibco Corporation, Gaithersburg, USA | 11875093 | |
| Silicone needle | Zhongke Life Biotechnology Co., Ltd., Beijing, CHN | TFEP-2 | |
| siRNA | Wuhan Genecreate Biological Engineering Co., Ltd. ,Wuhan,CHN | ||
| Sirt3 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | 189860 | |
| Sodium salicylate | Shanghai Aladdin Biochemical Technology Co., Ltd., Shanghai, CHN | S104176 | |
| Sprague-Dawley rat | Beijing Huafukang Biotechnology Co., Ltd., Beijing, CHN | 110322210102553975 | |
| SYBR quantitative PCR kit | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G3320-15 | |
| Tomm20 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab186735 | |
| Transferring buffer | Boster Biological Technology co., Ltd., Wuhan, CHN | AR0141 | |
| Trichloromethane | Shanghai McLean Biochemical Technology Co., Ltd., Shanghai, CHN | 821112 | |
| Tris-buffered saline with Tween 20 | Wuhan Servicebio Technology Co., Ltd., Wuhan, CHN | G0004 | |
| VDAC1 antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab15895 | |
| Xylene | Tianjin Baishi Chemical Industry Co., Ltd., Tianjin, CHN | 1330-20-7 | |
| β-actin antibody | Abcam Trading Co., Ltd., Shanghai, CHN | ab8226 |
Referências
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- He, J., et al. Helicobacter pylori infection induces stem cell-like properties in Correa cascade of gastric cancer. Cancer Letters. 542, 215764 (2022).
- Xu, W., Li, B., Xu, M., Yang, T., Hao, X. Traditional Chinese medicine for precancerous lesions of gastric cancer: A review. Biomedicine & Pharmacotherapy. 146, 112542 (2022).
- Yang, L., et al. A Systematic Review of the Mechanisms Underlying Treatment of Gastric Precancerous Lesions by Traditional Chinese Medicine. Evidence-Based Complementary and Alternative Medicine. 2020, 9154738 (2020).
- Ping, Z., Yan, W., Jing, L., Qian, J., Xin, H. The Effect of Huazhuo Jiedu recipe on Epithelial -Mesenchymal-Transition in Chronic Erosive Gastritis Patients with Zhuoduneiyun syndrome. Pharmacology and Clinics of Chinese Materia Medica. 35 (6), 154-158 (2019).
- Yan, W., Jing, L., Pan, Z. The effect of Huazhuojiedu formula on HGF/c-Met signal pathway in patients with chronic erosive gastritis. Pharmacology and Clinics of Chinese Materia Medica. 33 (02), 186-189 (2017).
- Hao, X., et al. Integrating Network Pharmacology and Experimental Validation to Investigate the Mechanisms of Huazhuojiedu Decoction to Treat Chronic Atrophic Gastritis. Evidence-Based Complementary and Alternative Medicine. 2020, 2638362 (2020).
- Zhou, P., et al. 16S rRNA sequencing-based evaluation of the protective effects of Hua-Zhuo-Jie-Du on rats with chronic atrophic gastritis. BMC Complementary Medicine and Therapies. 22 (1), 71 (2022).
- Zhou, P., et al. Determination of the protective effects of Hua-Zhuo-Jie-Du in chronic atrophic gastritis by regulating intestinal microbiota and metabolites: combination of liquid chromatograph mass spectrometer metabolic profiling and 16S rRNA gene sequencing. Chinese Medicine. 16 (1), 37 (2021).
- Hao, X., Zhou, P., Yang, Z., Yang, T., Wang, Y. The therapeutic effect of Huazhuojiedu decoction on precancerous lesions in a gastric cancer model via the regulation of lnc 517368. Journal of Ethnopharmacology. 283, 114635 (2022).
- Palikaras, K., Lionaki, E., Tavernarakis, N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology. Nature Cell Biology. 20 (9), 1013-1022 (2018).
- Zhang, C., et al. Parkin, a p53 target gene, mediates the role of p53 in glucose metabolism and the Warburg effect. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16259-16264 (2011).
- Cai, T., et al. Protective effects of Weipixiao decoction against MNNG-induced gastric precancerous lesions in rats. Biomedicine & Pharmacotherapy. 120, 109427 (2019).
- Shah, S. C., Piazuelo, M. B., Kuipers, E. J., Li, D. AGA Clinical Practice Update on the Diagnosis and Management of Atrophic Gastritis: Expert Review. Gastroenterology. 161 (4), 1325-1332 (2021).
- Pimentel-Nunes, P., et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 51 (4), 365-388 (2019).
- Nagtegaal, I. D., et al. The 2019 WHO classification of tumours of the digestive system. Histopathology. 76 (2), 182-188 (2020).
- Kushima, R. The updated WHO classification of digestive system tumours-gastric adenocarcinoma and dysplasia. Der Pathologe. 43 (1), 8-15 (2022).
- Yang, P., et al. Weipiling decoction alleviates N-methyl-N-nitro-N'-nitrosoguanidine-induced gastric precancerous lesions via NF-κB signalling pathway inhibition. Chinese Medicine. 17 (1), 104 (2022).
- Xu, J., et al. Xiao Tan He Wei Decoction reverses MNNG-induced precancerous lesions of gastric carcinoma in vivo and vitro: Regulation of apoptosis through NF-κB pathway. Biomedicine & Pharmacotherapy. 108, 95-102 (2018).
- Li, S. Study on the mechanism of regulating NF-kB activity and inhibiting the migration of gastric "inflammation-cancer" transformed cells by invigorating spleen, removing blood stasis and detoxifying. Guangzhou University of Chinese Medicine. , 17-19 (2021).
- Liu, H. Research Progress of Cell Models of Gastric Cancer Precancerous Lesions. Traditional Chinese Drug Research and Clinical Pharmacology. 27 (4), 592-596 (2016).
- Zheng, J., et al. Chronic stress accelerates the process of gastric precancerous lesions in rats. Journal of Cancer. 12 (14), 4121-4133 (2021).
- Yu, W., et al. Sirt3 deficiency exacerbates diabetic cardiac dysfunction: Role of Foxo3A-Parkin-mediated mitophagy. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1863 (8), 1973-1983 (2017).
- Cao, Y., et al. Efficacy of Banxia Xiexin decoction for chronic atrophic gastritis: A systematic review and meta-analysis. PLoS One. 15 (10), e0241202 (2020).
- Yin, J., et al. Weiqi Decoction Attenuated Chronic Atrophic Gastritis with Precancerous Lesion through Regulating Microcirculation Disturbance and HIF-1α Signaling Pathway. Evidence-Based Complementary and Alternative Medicine. 2019, 2651037 (2019).
- Zhang, J., Wang, X., Wang, F., Tang, X. Xiangsha Liujunzi Decoction improves gastrointestinal motility in functional dyspepsia with spleen deficiency syndrome by restoring mitochondrial quality control homeostasis. Phytomedicine. 105, 154374 (2022).
- Shida, M., et al. Impaired mitophagy activates mtROS/HIF-1α interplay and increases cancer aggressiveness in gastric cancer cells under hypoxia. International Journal of Oncology. 48 (4), 1379-1390 (2016).
- Zhou, X. Y., et al. Inhibition of autophagy blocks cathepsins-tBid-mitochondrial apoptotic signaling pathway via stabilization of lysosomal membrane in ischemic astrocytes. Cell Death & Disease. 8 (2), e2618 (2017).
- He, R., Peng, J., Yuan, P., Xu, F., Wei, W. Divergent roles of BECN1 in LC3 lipidation and autophagosomal function. Autophagy. 11 (5), 740-747 (2015).
- Fernández-Coto, D. L., et al. Quantitative proteomics reveals proteins involved in the progression from non-cancerous lesions to gastric cancer. Journal of Proteomics. 186, 15-27 (2018).
- Ding, D., et al. Post-translational modification of Parkin and its research progress in cancer. Cancer Communications. 39 (1), 77 (2019).
- Wang, Y., et al. The Role of Mitochondrial Dynamics and Mitophagy in Carcinogenesis, Metastasis and Therapy. Frontiers in Cell and Developmental Biology. 8, 413 (2020).
- Gehrke, S., et al. PINK1 and Parkin control localized translation of respiratory chain component mRNAs on mitochondria outer membrane. Cell Metabolism. 21 (1), 95-108 (2015).
- Fu, Z. J., et al. HIF-1α-BNIP3-mediated mitophagy in tubular cells protects against renal ischemia/reperfusion injury. Redox Biology. 36, 101671 (2020).
- Jia, Q., et al. Hesperidin promotes gastric motility in rats with functional dyspepsia by regulating Drp1-mediated ICC mitophagy. Frontiers in Pharmacology. 13, 945624 (2022).
- Chen, Y. The N-alkylamides induces MGMT gene hypomethylation in gastric epithelium cells malignant transformation. Zhejiang University. , 33-35 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados