A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
بروتوكول فحص القص لتحديد خصائص المواد أحادية الخلية
* These authors contributed equally
In This Article
Summary
يحدد هذا البروتوكول القياس الكمي للخصائص الميكانيكية لخطوط الخلايا السرطانية وغير السرطانية في المختبر. يمكن أن تعمل الاختلافات المحفوظة في ميكانيكا الخلايا السرطانية والطبيعية كعلامة حيوية قد يكون لها آثار في التشخيص والتشخيص.
Abstract
الميكانيكا الحيوية غير المنتظمة هي السمة المميزة لبيولوجيا السرطان الخاضعة لدراسة مستفيضة. الخواص الميكانيكية للخلية مماثلة لتلك الخاصة بالمادة. مقاومة الخلية للإجهاد والإجهاد ، ووقت استرخاءها ، ومرونتها كلها خصائص يمكن اشتقاقها ومقارنتها بأنواع أخرى من الخلايا. يسمح تحديد الخواص الميكانيكية للخلايا السرطانية (الخبيثة) مقابل الخلايا الطبيعية (غير الخبيثة) للباحثين بالكشف عن الأساسيات الفيزيائية الحيوية لهذا المرض. في حين أنه من المعروف أن الخواص الميكانيكية للخلايا السرطانية تختلف باستمرار عن الخواص الميكانيكية للخلايا الطبيعية ، إلا أنه لا يوجد إجراء تجريبي قياسي لاستنتاج هذه الخصائص من الخلايا في الثقافة.
تحدد هذه الورقة إجراء لتحديد الخواص الميكانيكية للخلايا المفردة في المختبر باستخدام مقايسة قص السوائل. يتضمن المبدأ الكامن وراء هذا الفحص تطبيق إجهاد قص السوائل على خلية واحدة ومراقبة التشوه الخلوي الناتج بصريا بمرور الوقت. يتم بعد ذلك توصيف الخواص الميكانيكية للخلية باستخدام تحليل ارتباط الصورة الرقمية (DIC) وتركيب نموذج لزج مرن مناسب للبيانات التجريبية الناتجة عن تحليل DIC. بشكل عام ، يهدف البروتوكول الموضح هنا إلى توفير طريقة أكثر فعالية واستهدافا لتشخيص السرطانات التي يصعب علاجها.
Introduction
تتيح دراسة الاختلافات الفيزيائية الحيوية بين الخلايا السرطانية وغير السرطانية فرصا تشخيصية وعلاجية جديدة1. إن فهم كيفية مساهمة الاختلافات في الميكانيكا الحيوية / علم الأحياء الميكانيكي في تطور الورم ومقاومة العلاج سيكشف عن طرق جديدة للعلاج الموجه والتشخيص المبكر2.
في حين أنه من المعروف أن الخواص الميكانيكية للخلايا السرطانية تختلف عن الخلايا الطبيعية (على سبيل المثال ، مرونة اللزوجة في غشاء البلازما والغلاف النووي)3،4،5 ، إلا أن الطرق القوية والقابلة للتكرار لقياس هذه الخصائص في الخلايا الحية غير موجودة6. تستخدم طريقة مقايسة القص لتحديد الخواص الميكانيكية للخلايا عن طريق إخضاع الخلايا المفردة لإجهاد القص السائل وتحليل استجاباتها الفردية ومقاومتها للإجهاد المطبق3،4،5،7،8،9. على الرغم من استخدام العديد من الطرق والتقنيات لتوصيف الخواص الميكانيكية للخلايا المفردة ، إلا أنها تميل إلى التأثير على خصائص مادة الخلية عن طريق i) تثقيب / إتلاف غشاء الخلية بسبب عمق المسافة البادئة ، أو هندسة الطرف المعقدة ، أو تصلب الركيزة المرتبط بمجهر القوة الذرية (AFM) 10،11 ، ii) إحداث تلف ضوئي خلوي أثناء الاصطياد البصري12 ، 13 ، أو iii) إحداث حالات إجهاد معقدة مرتبطة بشفط الماصةالدقيقة 14,15. ترتبط هذه التأثيرات الخارجية بشكوك كبيرة في دقة قياسات مرونة لزوجة الخلية6،16،17.
لمعالجة هذه القيود ، توفر طريقة فحص القص الموصوفة هنا نهجا بسيطا ويمكن التحكم فيه بدرجة كبيرة لمحاكاة التدفق الفسيولوجي في الجسم دون التأثير على خصائص المواد الخلوية في العملية. تمثل إجهادات قص السوائل في هذا الفحص ضغوطا ميكانيكية تعاني منها الخلايا في الجسم إما عن طريق السوائل داخل الخلالي للورم أو في الدم أثناء الدورة الدموية18،19،20. علاوة على ذلك ، تعزز ضغوط السوائل هذه السلوكيات الخبيثة المختلفة في الخلايا السرطانية ، بما في ذلك التقدم والهجرة وورم خبيث وموت الخلايا19،21،22،23 والتي تختلف بين الخلايا السرطانية وغير السرطانية. علاوة على ذلك ، فإن السمات الميكانيكية المتغيرة للخلايا السرطانية (أي أنها غالبا ما تكون "أكثر ليونة" من الخلايا الطبيعية الموجودة داخل نفس العضو) تسمح لها بالاستمرار في البيئات الدقيقة المعادية للورم ، وغزو الأنسجة الطبيعية المحيطة ، والانتقال إلى مواقع بعيدة24،25،26. من خلال خلق بيئة بيولوجية زائفة حيث تعاني الخلايا من مستويات فسيولوجية من إجهاد قص السوائل ، يتم تحقيق عملية ذات صلة من الناحية الفسيولوجية وليست مدمرة للخلية. تسمح لنا الاستجابات الخلوية لضغوط قص السوائل المطبقة هذه بتوصيف الخواص الميكانيكية للخلية.
يقدم هذا البحث بروتوكول مقايسة القص للدراسة المكثفة للخصائص الميكانيكية وسلوك الخلايا السرطانية وغير السرطانية تحت إجهاد القص المطبق. تستجيب الخلايا للقوى الخارجية بطريقة مرنة ولزجة وبالتالي يمكن أن تكون مثالية كمادة لزجةمرنة 3. يتم تصنيف هذه التقنية إلى: (i) زراعة الخلايا للخلايا المفردة المشتتة ، (ii) التطبيق المتحكم فيه لإجهاد قص السوائل ، (iii) التصوير في الموقع ومراقبة السلوك الخلوي (بما في ذلك مقاومة الإجهاد والتشوه) ، (iv) تحليل سلالة الخلايا لتحديد مدى التشوه ، و (v) توصيف الخصائص اللزجة المرنة للخلايا المفردة. من خلال استجواب هذه الخصائص والسلوكيات الميكانيكية ، يمكن تقطير البيولوجيا الميكانيكية الخلوية المعقدة إلى بيانات قابلة للقياس الكمي. يسمح البروتوكول الذي يحدد هذه الطريقة بفهرسة ومقارنة أنواع الخلايا الخبيثة وغير الخبيثة المختلفة. إن القياس الكمي لهذه الاختلافات لديه القدرة على إنشاء مؤشرات حيوية تشخيصية وعلاجية.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. التحضير لمقايسة القص أحادية الخلية
- زراعة الخلايا
- بذر ما يقرب من 50000 خلية مفردة معلقة في طبق بتري 35 مم × 10 مم يحتوي على 2 مل من وسائط الاستزراع.
ملاحظة: دوامة الخلايا العالقة قبل البذر لتفكيك مجاميع الخلايا. - احتضان الخلايا عند 37 درجة مئوية والسماح ما بين 10 إلى 48 ساعة لربط الخلية وتكوين البروتين الهيكلي الخلوي الكامل.
ملاحظة: ضع في اعتبارك مدة التعلق الخلوي ، بالإضافة إلى معدلات الانتشار والنمو ، لضمان نمو الخلايا وتعلقها بشكل كاف مع تجنب تراكم الخلايا. تختلف هذه المعلمات باختلاف نوع الخلية.
- بذر ما يقرب من 50000 خلية مفردة معلقة في طبق بتري 35 مم × 10 مم يحتوي على 2 مل من وسائط الاستزراع.
2. تجربة مقايسة القص
- تحضير وسائط التدفق اللزج لمقايسة القص
- لضمان وسائط تدفق لزجة قليلا (0.015-0.02 باسكال ثانية) ، قم بقياس وإضافة 0.05٪ بالوزن من ميثيل سلولوز غير سام وغير مسبب للحساسية (4 باسكال ثانية) إلى وسائط الاستزراع.
- لضمان مزيج متجانس ، سخن وسائط الاستزراع الأساسية لمدة ~ 10-20 دقيقة عند درجة حرارة ~ 60-70 °C باستخدام محرك مغناطيسي / لوح تسخين. أثناء تحريك الوسائط باستمرار ، أضف الميثيل سلولوز برفق بحيث يتشتت بسرعة ، لتجنب تخثر جزيئات ميثيل سلولوز. اسمح لهذه العملية بالاستمرار لمدة ~ 15-24 ساعة لضمان حل واضح للوسائط + السليلوز.
ملاحظة: تجنب التسخين المفرط للمحلول. - لقياس لزوجة وسائط التدفق ، اختبر ~ 0.5-1 مل من وسائط التدفق التمثيلية باستخدام مقياس ريومتر. من القراءة ، حدد لزوجة السائل واستخدم هذه القيمة لتمثيل لزوجة وسط مائع القص (μ) لحساب إجهاد القص باستخدام المعادلة (2).
- إعداد جهاز القص
- قم بإعداد نظام فحص القص للمحاقن المزدوجة (60 مل أو 100 مل) المتصل بمضخة حقنة قابلة للبرمجة لتسريب وسحب وسائط الثقافة اللزجة (الشكل 1).
- قم بتوصيل كلا المحقنتين بغرفة التدفق عبر موصلات أنابيب وأنابيب مقاس 1/16 بوصة.
- اربط حشية مطاطية لتوفير تدفق موحد متحكم فيه على خلايا مفردة على طول مسار التدفق (الشكل 1). تأتي الحشية المطاطية بأحجام مختلفة اعتمادا على ملف تعريف التدفق المراد تحقيقه (رقائقي أو مضطرب) ومنطقة المراقبة المرغوبة (على سبيل المثال ، طول 22.5 مم ، عرض 2.5 مم ، وارتفاع 0.254 مم) (الشكل 1).
- قم ببرمجة المضخة لضخ وسحب حجم معين من السوائل (على سبيل المثال ، 60 مل) بمعدل معين (على سبيل المثال ، 1 مل / دقيقة) وحدد المحاقن المقابلة (على سبيل المثال ، 60 مل).
ملاحظة: ضع في اعتبارك الحد الأقصى للإعدادات المسبقة لحجم التسريب والسحب لتجنب التشويش أو العطل. استخدم المعادلة (2) لحساب معدل قص المضخة المطلوب (بافتراض أن الإجهاد واللزوجة المطلوبين معروفان).
- إعداد ما قبل القص
- املأ المحقنة بوسائط التدفق اللزج المعدة.
- قم بتوصيل المحقنة المملوءة ب 60 أو 100 مل (أو حسب الحاجة) من وسائط التدفق اللزجة ، ومحقنة فارغة سعة 60 مل في مواقعها على مضخة المحقنة القابلة للبرمجة. عبر موصلات الأنابيب والأنابيب ، قم بتوصيل كلا المحاقن بغرفة التدفق.
- لضمان سهولة التعرف على الخلايا المفردة والاتصال المثبت بين غرفة التدفق وطبق بتري ، قم بتوصيل الحشية المطاطية بغرفة التدفق.
- نضح وسائط زراعة الخلايا من طبق بتري الذي يحتوي على الخلايا محل الاهتمام.
- اغسل الخلايا الميتة والخلايا المرتبطة بشكل فضفاض باستخدام محلول ملحي مخزن بالفوسفات (PBS).
- نضح برنامج تلفزيوني.
- أدخل وثبت غرفة التدفق والحشية المطاطية (~ 34 مم × 9 مم) على طبق بتري (35 مم × 10 مم) الذي يحتوي على الخلايا المرفقة.
- ضع غرفة تدفق الموائع الدقيقة المجهزة + الخلايا على طبق مثقف على مجهر مقلوب ، مع هدف مجهر مرتفع بما يكفي للحصول على صور عالية الجودة بقيم بكسل عالية (عادة بين 40x و 63x تكبير) وشاشة عرض.
- حدد خيار الصورة الحية (الفاصل الزمني في بعض البرامج) من برنامج المجهر على شاشة العرض. تأكد من أن برنامج المجهر على جهاز الكمبيوتر لديه وظيفة t (الفاصل الزمني) أو يمكنه التقاط تسجيلات الفيديو.
- ركز هدف المجهر ، مما يضمن التباين الكافي وحواف الخلايا المميزة. هذا ضروري لتحليل الصورة بعد القص. حرك مرحلة المجهر للتأكد من أن الخلايا مرئية بوضوح على شاشة العرض وأنها صور حية.
- حدد خلية أو عدة خلايا مميزة داخل مسار التصوير / التدفق لغرفة التدفق المجهزة + طبق بتري (المنطقة / المسار الذي تم إنشاؤه بواسطة تركيب الحشية في غرفة التدفق).
- القص والتصوير
- للحفاظ على تدفق موحد مستمر ، حدد معدلات ضخ وسحب مماثلة وتأكد من التدفق الصفحي للسائل ، عادة بين 1 مل / دقيقة و 5 مل / دقيقة. بالنسبة لأنظمة التدفق الصفحي المنخفض ، تأكد من أن عدد Re < 100 في Re من رينولد.
- انقر فوق تشغيل على مضخة القص لحقن وسحب سائل القص (الوسائط اللزجة المحضرة) بمعدل مستمر. تأكد من عدم وجود فقاعات أثناء ضخ السوائل ، لأن هذا قد يؤدي إلى ضغط خارجي غير محسوب على الخلايا.
- ابدأ في تسجيل مقطع فيديو بالنقر فوق تسجيل على برنامج المجهر قبل أن يتلامس سائل القص المشبع مع الخلية (الخلايا) ذات الأهمية تحت المجهر.
- استمر في التسجيل لمدة 7 دقائق ، أو طوال المدة المطلوبة للتعرض للإجهاد ، أو حتى تنفصل الخلية (الخلايا) ذات الأهمية عن قاع الطبق. انقر فوق إيقاف التسجيل على برنامج المجهر عند اكتمال التشغيل حسب الرغبة.
- احفظ التسجيل واستخرجه كملفات .tiff. على نحو مفضل ، استخراج الصور بمعدل 1 إطار في الثانية للتحليل السهل.
3. معالجة البيانات
- إجراء ارتباط الصورة الرقمية (تحليل الصورة)
- إذا تم استخراج التسجيل من المجهر كملف فيديو ، فقم بتحويله إلى إطارات صور (يفضل .tiff تنسيق الملف).
- قم باستيراد الصور المشتقة من تسجيل مقايسة القص إلى برنامج Davis 10.1.2 (برنامج DIC) لتتبع حركة الهياكل المنقوشة بشكل طبيعي للخلية عن طريق تحديد موقع كل كتلة بكسل (مجموعة فرعية) من الصورة المرجعية في الصور الجديدة المعنية (الصور المشوهة) (الشكل 2).
- للحصول على ارتباط محسن ، استخدم حجم مجموعة فرعية يبلغ 31 × 31 بكسل ، وحجم خطوة (مسافة تشوه كل مجموعة فرعية) يبلغ 20 بكسل ، ومجموع خيار المسار التفاضلي ، الذي يتتبع تشوه صورة جديدة فيما يتعلق بالصورة الأخيرة. نتيجة هذا الارتباط هي مخطط وقت الإجهاد (الشكل 3) الذي يمكن تصديره كملف .csv لمزيد من التحليل في MATLAB.
- حدد منطقة الاهتمام لخلية مفردة مختارة. حدد النقاط العشوائية داخل الخلية المعينة لتعقب التشوه. بالنسبة لشكل غير منتظم، مثل الخلية، استخدم قناع مضلع لرسم خريطة هندسية للخلية.
- بعد التعيين ، اختر نقاطا محددة على الخلية (النواة أو السيتوبلازم) ليتم تحليلها بالنقر فوق إضافة مقياس إجهاد ورسم مقاييس إجهاد فردية في نقاط داخل الحدود الخلوية المحددة.
- انقر فوق تشغيل لبدء معالجة الإجهاد والحصول على بيانات الإجهاد مقابل الوقت.
- انقر نقرا مزدوجا (أو انقر بزر الماوس الأيمن) على مخطط وقت الإجهاد الذي تم إنشاؤه وحدد تصدير البيانات كجدول بيانات.
4. توصيف الخواص الميكانيكية
- توصيف خاصية اللزوجة المرنة
- احفظ ملف .csv الذي يحتوي على بيانات وقت الإجهاد من برنامج DIC في مجلد منفصل لسهولة القراءة بواسطة MATLAB.
- قم بتشغيل MATLAB وانقر فوق علامة تبويب المحرر لفتح صفحة محرر لكتابة رمز يقرأ جدول البيانات ، خلية تلو الأخرى.
- قم بتغيير مسار MATLAB (مسار المجلد الذي يصل إلى ملف الاهتمام) للوصول إلى المجلد الذي يحتوي على البيانات المراد تحليلها ، على سبيل المثال ، المستخدمون / اسم المستخدم / سطح المكتب / البيانات.
- في صفحة محرر MATLAB ، قم بالوصول إلى بيانات جدول البيانات باستخدام الرمز المخصص. على سبيل المثال: a1 = xlsread ('data'، 'run1'، 'A4: A183')، حيث يمثل a1 المعرف، xlsread هي دالة MATLAB التي تقرأ ملف .csv (في هذه الحالة، كجدول بيانات)، والبيانات هي اسم الملف، وrun1 هو اسم الورقة، وA4: A183 هو نطاق البيانات ذات الأهمية في الخلية A لبيانات جدول البيانات المراد تحليلها. للحصول على ملاءمة كاملة ، قم بتحليل x و y (الوقت والإجهاد ، على التوالي). على سبيل المثال:
a1 = xlsread ('data','run1','A4:A183');
b1 = xlsread ('data','run1','B4:B183');
A1 = x (الوقت) ، و B1 = Y (سلالة). - في MATLAB ، انقر فوق التطبيقات | مجرب المنحنى | معادلة مخصصة. امسح المعادلة المخصصة التمثيلية وأدخل معادلة النموذج اللزج المرن [المعادلة (1)] ، حيث يمثل ε المتغير x ويمثل t المتغير y.
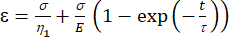 (1)
(1)
هنا ، يمثل ε الإجهاد ، σ يمثل إجهاد القص ، η1 يمثل اللزوجة ، E يمثل المرونة ، t يمثل الوقت ، و τ يمثل وقت الاسترخاء ، والذي يميز الحد الأقصى للوقت اللازم للخلية للعودة إلى شكلها الأصلي بعد التشوه الأولي. يتم التعبير عنها ك τ =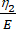 ، حيث η2 هو مصطلح اللزوجة الثانوية ل dashpot الثاني (الشكل 4).
، حيث η2 هو مصطلح اللزوجة الثانوية ل dashpot الثاني (الشكل 4). - إعادة تعيين متغيرات جديدة للمعلمات اللزجة المرنة داخل واجهة المعادلة المخصصة. (ε ، η1 ، E ، σ ، t ، و τ =
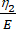 ) سيمثل (x و a و b و K و y و c) على التوالي. هنا ، x و y هما المتغيران المستقل والتابع ، على التوالي. يمكن تحديد إجهاد القص (σ) باستخدام المعادلة (2):
) سيمثل (x و a و b و K و y و c) على التوالي. هنا ، x و y هما المتغيران المستقل والتابع ، على التوالي. يمكن تحديد إجهاد القص (σ) باستخدام المعادلة (2):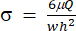 (2)
(2)
هنا ، يمثل μ لزوجة وسط مائع القص ، و Q هو معدل تدفق المضخة ، و w و h هما عرض وارتفاع قناة التدفق الموضحة في الشكل 1C ، على التوالي. - انقر فوق تحديد البيانات لتحديد الوقت (a1) والإجهاد (b1) لكل مجموعة من البيانات.
- تأكد من تحديد خيار مربع الاحتواء التلقائي . يؤدي هذا إلى تشغيل الملاءمة تلقائيا عند تحديد البيانات (x و y).
- حدد طرق التركيب لتشديد شروط الحدود. انقر فوق خيارات متقدمة ضمن فئة الطرق وحدد المربعات الصغرى غير الخطية. ضمن قوي، حدد إيقاف، وضمن خوارزمية، حدد منطقة الثقة. اترك كل معلمة أخرى كما هي.
- تمثل المتغيرات الجديدة بعد التركيب (a و b و c) الخصائص اللزجة المرنة واللزوجة والمرونة ووقت الاسترخاء (η1 ، E ، EQUAT) ، للخلية ، على التوالي (الشكل 5).
- ابحث عن قيمة مربع R عالية للملاءمة (R2 > 80٪) للتأكد من أن إخراج البيانات يمكن اعتباره مناسبا حقيقيا للنموذج اللزج المرن (الشكل 3)
Access restricted. Please log in or start a trial to view this content.
النتائج
بروتوكول مقايسة القص المقترن بتحليل التشوه باستخدام DIC ونموذج المرونة اللزجة ناجح في تحديد الخواص الميكانيكية لخلية واحدة في المختبر. تم اختبار هذه الطريقة على خطوط خلايا الإنسان والفئران ، بما في ذلك خلايا الثدي البشرية الطبيعية (MCF-10A) 3،4،9 ، وخلايا سرطان ا?...
Access restricted. Please log in or start a trial to view this content.
Discussion
أنتجت طريقة فحص القص ، والتي تتضمن إنشاء بيئة ميكانيكية بيولوجية زائفة لمحاكاة تفاعل الخلايا مع البيئة الدقيقة الميكانيكية المحيطة واستجاباتها للضغوط الميكانيكية ، كتالوجا للخصائص الميكانيكية الخلوية ، التي تظهر أنماطها اللانمطية الفيزيائية المحفوظة بين خطوط الخلايا السرطانية
Access restricted. Please log in or start a trial to view this content.
Disclosures
وليس للمؤلفين مصالح مالية متنافسة يكشفون عنها.
Acknowledgements
يشكر المؤلفون الباحثين السابقين من مجموعة Soboyejo في معهد Worcester Polytechnic الذين كانوا رائدين في هذه التقنية لأول مرة: Drs. Yifang Cao و Jingjie Hu و Vanessa Uzonwanne. تم دعم هذا العمل من قبل المعهد الوطني للسرطان (NIH / NCI K22 CA258410 إلى MD.). تم إنشاء الأرقام مع BioRender.com.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| CELL CULTURE | |||
| .25% Trypsin, 2.21 mM EDTA, 1x[-] sodium bicarbonate | Corning | 25-053-ci | For cellular detachment from substrate in cell culture |
| 15 mL Centrifuge tubes | Falcon by Corning | 05-527-90 | |
| 35 mm Petri dishes | Corning | 430165 | |
| 50 mL Centrifuge tubes | Falcon by Corning | 14-432-22 | |
| Centrifuge | any | For sterile cell culture | |
| Dulbecco's Modification of Eagle's Medium (DMEM) 1x | Corning | 10-013-cv | Or any other media for culturing cells. DMEM was used for culturing U87 cells |
| Gloves | any | For sterile cell culture | |
| Heracell Vios 160i CO2 Incubator | Thermo Scientific | 51033770 | For Incubation during cell culture |
| Hood | any | For sterile cell culture | |
| Micropipette | any | For sterile cell culture | |
| Micropipette tips | any | For sterile cell culture | |
| Microscope | Leica/any | For sterile cell culture | |
| Phosphate Buffered Saline without calcium and magnesium PBS, 1x | Corning | 21-040-CM | |
| Pipetman | any | For sterile cell culture | |
| Pipette tips | any | For sterile cell culture | |
| Precision GP 10 liquid incubator | Thermo Scientific | TSGP02 | |
| T25 Flask | Corning | 430639 | |
| T75 Flask | Corning | 430641U | |
| SHEAR ASSAY | |||
| 100 mL beaker | any | For creating DMEM + methyl cellulose viscous shear media | |
| DMEM | Corning | ||
| Flow chamber + rubber gasket | Glycotech | 31-001 | Circular Flow chamber Kit ( for 35 mm tissue culture dishes) |
| Hybrid Rheometer | HR-2 Discovery Hybrid Rheometer | For determination of shear fluid viscosity | |
| Magnetic stir bar | any | For creating DMEM + methyl cellulose viscous shear media | |
| Magnetic stir plate | any | For creating DMEM + methyl cellulose viscous shear media | |
| Methyl cellulose | any | To increase viscosity of DMEM in flow media | |
| Syringe Pump | KD Scientific Geminin 88 plus | 788088 | For programming fluid infusion and withdrawal |
| Syringes, tubing, and connectors | For shear apparatus setup | ||
| SOFTWARE | |||
| ABAQUS software | Simulia | ||
| Digitial Image Correlation software | LaVision, Germany | DAVIS 10.1.2 | |
| Imaging software | Leica/any microscope software | ||
| MATLAB | MATLAB | MATLAB_R2020B |
References
- Sethi, S., Ali, S., Philip, P. A., Sarkar, F. H. Clinical advances in molecular biomarkers for cancer diagnosis and therapy. International Journal of Molecular Sciences. 14 (7), 14771-14784 (2013).
- Runel, G., Lopez-Ramirez, N., Chlasta, J., Masse, I. Biomechanical properties of cancer cells. Cells. 10 (4), 887(2021).
- Hu, J., Zhou, Y., Obayemi, J. D., Du, J., Soboyejo, W. O. An investigation of the viscoelastic properties and the actin cytoskeletal structure of triple negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 86, 1-13 (2018).
- Onwudiwe, K., et al. Investigation of creep properties and the cytoskeletal structures of non-tumorigenic breast cells and triple-negative breast cancer cells. Journal of Biomedical Materials Research. Part A. 110 (5), 1004-1020 (2022).
- Ani, C. J., et al. A shear assay study of single normal/breast cancer cell deformation and detachment from poly-di-methyl-siloxane (PDMS) surfaces. Journal of the Mechanical Behavior of Biomedical Materials. 91, 76-90 (2019).
- Suresh, S. Biomechanics and biophysics of cancer cells. Acta Biomaterialia. 3 (4), 413-438 (2007).
- Cao, Y., et al. Investigation of the viscoelasticity of human osteosarcoma cells using a shear assay method. Journal of Materials Research. 21 (8), 1922-1930 (2006).
- Cao, Y. On the measurement of human osteosarcoma cell elastic modulus using shear assay experiments. Journal of Materials Science. Materials in Medicine. 18 (1), 103-109 (2007).
- Onwudiwe, K., et al. Actin cytoskeletal structure and the statistical variations of the mechanical properties of non-tumorigenic breast and triple-negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 119, 104505(2021).
- Kirmizis, D., Logothetidis, S. Atomic force microscopy probing in the measurement of cell mechanics. International Journal of Nanomedicine. 5, 137-145 (2010).
- Haase, K., Pelling, A. E. Investigating cell mechanics with atomic force microscopy. Journal of the Royal Society. Interface. 12 (104), 20140970(2015).
- Zhang, H., Liu, K. K. Optical tweezers for single cells. Journal of the Royal Society. Interface. 5 (24), 671-690 (2008).
- Peterman, E. J. G., Gittes, F., Schmidt, C. F. Laser-induced heating in optical traps. Biophysical Journal. 84, 1308-1316 (2003).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Evans, E., Yeung, A. Apparent viscosity and corticcal tension of blood granulocytes determined by micropipet aspiration. Biophysical Journal. 56 (1), 151-160 (1989).
- Van Vliet, K. J., Bao, G., Suresh, S. The biomechanics toolbox: experimental approaches for living cells and biomolecules. Acta Materialia. 51 (19), 5881-5905 (2003).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews. Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Choi, H. Y., et al. Hydrodynamic shear stress promotes epithelial-mesenchymal transition by downregulating ERK and GSK3beta activities. Breast Cancer Research. 21 (1), 6(2019).
- Northcott, J. M., Dean, I. S., Mouw, J. K., Weaver, V. M. Feeling stress: The mechanics of cancer progression and aggression. Frontiers in Cell and Developmental Biology. 6, 17(2018).
- Onwudiwe, K., Najera, J., Siri, S., Datta, M. Do tumor mechanical stresses promote cancer immune escape. Cells. 11 (23), 3840(2022).
- Heldin, C. H., Rubin, K., Pietras, K., Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nature Reviews. Cancer. 4 (10), 806-813 (2004).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Mao, B. H., Nguyen Thi, K. M., Tang, M. J., Kamm, R. D., Tu, T. Y. The interface stiffness and topographic feature dictate interfacial invasiveness of cancer spheroids. Biofabrication. 15 (1), (2023).
- Kashani, A. S., Packirisamy, M. Cancer cells optimize elasticity for efficient migration. Royal Society Open Science. 7 (10), 200747(2020).
- Riehl, B. D., Kim, E., Bouzid, T., Lim, J. Y. The role of microenvironmental cues and mechanical loading milieus in breast cancer cell progression and metastasis. Frontiers in Bioengineering and Biotechnology. 8, 608526(2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved