A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פרוטוקול בדיקת גזירה לקביעת תכונות חומר חד-תאי
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר את כימות התכונות המכניות של קווי תאים סרטניים ולא סרטניים במבחנה. הבדלים שמורים במכניקה של תאים סרטניים ונורמליים יכולים לשמש כסמן ביולוגי שעשוי להיות בעל השלכות על הפרוגנוזה והאבחנה.
Abstract
ביומכניקה לא סדירה היא סימן ההיכר של ביולוגיה של סרטן הנתונה למחקר מקיף. התכונות המכניות של תא דומות לאלה של חומר. עמידותו של התא בפני לחץ ומתח, זמן ההרפיה שלו וגמישותו הם כולם תכונות שניתן להפיק ולהשוות לסוגים אחרים של תאים. כימות התכונות המכניות של תאים סרטניים (ממאירים) לעומת תאים נורמליים (לא ממאירים) מאפשר לחוקרים להמשיך ולחשוף את היסודות הביופיזיקליים של מחלה זו. בעוד התכונות המכניות של תאים סרטניים ידועות כשונות באופן עקבי מהתכונות המכניות של תאים נורמליים, הליך ניסיוני סטנדרטי כדי להסיק תכונות אלה מתאים בתרבית לוקה בחסר.
מאמר זה מתאר הליך לכימות התכונות המכניות של תאים בודדים במבחנה באמצעות בדיקת גזירה נוזלית. העיקרון מאחורי בדיקה זו כרוך בהפעלת לחץ גזירה נוזלי על תא בודד וניטור אופטי של העיוות התאי שנוצר לאורך זמן. תכונות מכניות של תאים מאופיינות לאחר מכן באמצעות ניתוח מתאם תמונה דיגיטלית (DIC) והתאמת מודל ויסקו-אלסטי מתאים לנתונים הניסיוניים המופקים מניתוח DIC. בסך הכל, הפרוטוקול המתואר כאן נועד לספק שיטה יעילה וממוקדת יותר לאבחון של סוגי סרטן קשים לטיפול.
Introduction
חקר ההבדלים הביופיזיים בין תאים סרטניים ולא-סרטניים מאפשר הזדמנויות אבחוניות וטיפוליות חדשות1. הבנת האופן שבו הבדלים בביומכניקה/מכנוביולוגיה תורמים להתקדמות הגידול ולעמידות לטיפול תחשוף דרכים חדשות לטיפול ממוקד ואבחון מוקדם2.
בעוד שידוע כי תכונות מכניות של תאים סרטניים שונות מתאים נורמליים (למשל, צמיגות קרום הפלזמה והמעטפת הגרעינית)3,4,5, חסרות שיטות חזקות וניתנות לשחזור למדידת תכונות אלה בתאים חיים6. שיטת בדיקת הגזירה משמשת לכימות התכונות המכניות של תאים על ידי חשיפת תאים בודדים ללחץ גזירה נוזלי וניתוח תגובותיהם האישיות והתנגדותם ללחץ המופעל 3,4,5,7,8,9. למרות שמספר שיטות וטכניקות שימשו לאפיון התכונות המכניות של תאים בודדים, אלה נוטות להשפיע על תכונות חומר התא על ידי i) ניקוב/פגיעה בקרום התא עקב עומק הכניסה, גיאומטריות קצה מורכבות, או הקשחת מצע הקשורים למיקרוסקופ כוח אטומי (AFM)10,11, ii) גרימת נזק לאור תאי במהלך לכידה אופטית 12, 13, או iii) גרימת מצבי לחץ מורכבים הקשורים לשאיפת מיקרופיפטה14,15. השפעות חיצוניות אלה קשורות לאי-ודאות משמעותית בדיוק מדידות צמיגות התא 6,16,17.
כדי להתמודד עם מגבלות אלה, שיטת בדיקת הגזירה המתוארת כאן מספקת גישה מאוד נשלטת ופשוטה להדמיית זרימה פיזיולוגית בגוף מבלי להשפיע על תכונות החומר התאי בתהליך. לחצים לגזירת נוזלים בבדיקה זו מייצגים לחצים מכניים שחווים תאים בגוף או על ידי נוזלים בתוך אינטרסטיציום הגידול או בדם במהלך מחזורהדם 18,19,20. יתר על כן, לחצים נוזליים אלה מקדמים התנהגויות ממאירות שונות בתאים סרטניים, כולל התקדמות, נדידה, גרורות ומוות תאי 19,21,22,23 המשתנים בין תאים גידוליים ולא גידוליים. יתר על כן, התכונות המכניות המשתנות של תאים סרטניים (כלומר, הם לעתים קרובות "רכים" יותר מתאים נורמליים הנמצאים באותו איבר) מאפשרות להם להתמיד במיקרו-סביבות גידול עוינות, לפלוש לרקמות נורמליות הסובבות אותם, ולשלוח גרורות לאתרים מרוחקים24,25,26. על ידי יצירת סביבה פסאודו-ביולוגית שבה תאים חווים רמות פיזיולוגיות של עקה גזירה נוזלית, מושג תהליך שהוא רלוונטי פיזיולוגית ולא הרסני לתא. התגובות התאיות ללחצים אלה של גזירת נוזלים מאפשרות לנו לאפיין תכונות מכניות של תאים.
מאמר זה מספק פרוטוקול בדיקת גזירה למחקר מקיף של התכונות המכניות וההתנהגות של תאים סרטניים ולא סרטניים תחת לחץ גזירה מופעל. תאים מגיבים לכוחות חיצוניים בצורה אלסטית וצמיגית ולכן ניתן להפוך אותם לחומר ויסקו-אלסטי3. טכניקה זו מסווגת ל: (i) תרבית תאים של תאים בודדים מפוזרים, (ii) יישום מבוקר של לחץ גזירה נוזלי, (iii) הדמיה באתרו ותצפית על התנהגות התא (כולל עמידות ללחץ ועיוות), (iv) ניתוח מאמץ של תאים כדי לקבוע את מידת העיוות, ו (v) אפיון התכונות הוויסקו-אלסטיות של תאים בודדים. על ידי חקירת התכונות וההתנהגויות המכניות האלה, ניתן לזקק מכנוביולוגיה תאית מורכבת לנתונים הניתנים לכימות. פרוטוקול המתווה שיטה זו מאפשר קיטלוג והשוואה בין סוגי תאים ממאירים ולא ממאירים שונים. לכימות הבדלים אלה יש פוטנציאל לבסס סמנים ביולוגיים אבחוניים וטיפוליים.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הכנה לבדיקת הגזירה החד-תאית
- תרבית תאים
- זרעו כ-50,000 תאים בודדים מרחפים בצלוחית פטרי בגודל 35 מ"מ על 10 מ"מ המכילה 2 מ"ל של תרבית.
הערה: מערבל את התאים המרחפים לפני הזריעה כדי לפרק את צברי התאים. - לדגור על התאים ב 37 ° C ולאפשר בין 10 ל 48 שעות עבור חיבור תאים והיווצרות מלאה של חלבון השלד והשלד.
הערה: יש לקחת בחשבון את משך ההתקשרות התאית, כמו גם את קצב ההתרבות והגדילה, כדי להבטיח גדילה והתקשרות תאים נאותים תוך הימנעות מצבירת תאים. פרמטרים אלה משתנים בהתאם לסוג התא.
- זרעו כ-50,000 תאים בודדים מרחפים בצלוחית פטרי בגודל 35 מ"מ על 10 מ"מ המכילה 2 מ"ל של תרבית.
2. ניסוי מבחן גזירה
- הכנת מדיית זרימה צמיגה של בדיקת גזירה
- כדי להבטיח מדיית זרימה צמיגה מעט (0.015-0.02 Pa·s), מדדו והוסיפו 0.05 wt% של מתילצלולוז לא רעיל ולא אלרגני (4 Pa·s) למדיית התרבית.
- כדי להבטיח תערובת הומוגנית, חממו מראש את מצע תרבית הבסיס למשך ~10-20 דקות בטמפרטורה של ~60-70 מעלות צלזיוס עם מערבל מגנטי/פלטה חשמלית. תוך ערבוב מתמשך של התקשורת, להוסיף בעדינות את מתילצלולוז כך שהוא מתפזר במהירות, כדי למנוע קרישה של חלקיקי מתילצלולוז. אפשר לתהליך זה להימשך ~ 15-24 שעות כדי להבטיח תמיסה ברורה של מדיה + תאית.
הערה: הימנע מחימום מוגזם של התמיסה. - כדי למדוד את צמיגות מדיית הזרימה, בדוק ~ 0.5-1 מ"ל של מדיית הזרימה המייצגת באמצעות ראומטר. מתוך הקריאה, קבע את צמיגות הנוזל והשתמש בערך זה כדי לייצג את צמיגות תווך נוזל הגזירה (μ) כדי לחשב מתח גזירה באמצעות משוואה (2).
- הגדרת מנגנון גזירה
- הגדירו את מערכת בדיקת הגזירה של מזרקים כפולים (60 מ"ל או 100 מ"ל) המחוברים למשאבת מזרקים ניתנת לתכנות לצורך עירוי ונסיגה של מצע התרבית הצמיגי (איור 1).
- חבר את שני המזרקים לתא הזרימה באמצעות צינורות ומחברי צינורות בגודל 1/16 אינץ'.
- הדקו אטם גומי כדי לספק זרימה מבוקרת ואחידה על תאים בודדים לאורך נתיב הזרימה (איור 1). אטם הגומי מגיע בגדלים שונים בהתאם לפרופיל הזרימה שיש להשיג (למינרי או טורבולנטי) ולאזור התצפית הרצוי (למשל, אורך של 22.5 מ"מ, רוחב של 2.5 מ"מ וגובה של 0.254 מ"מ) (איור 1).
- תכנת את המשאבה להחדיר ולמשוך נפח מסוים של נוזל (למשל, 60 מ"ל) בקצב מוגדר (למשל, 1 מ"ל/דקה) ובחר את המזרקים המתאימים (למשל, 60 מ"ל).
הערה: קח בחשבון את הגדרות הנפח המרביות המוגדרות מראש של עירוי ומשיכה כדי למנוע חסימה או תקלה. השתמש במשוואה (2) לחישוב קצב הגזירה הנדרש של המשאבה (בהנחה שהלחץ והצמיגות הנדרשים ידועים).
- הגדרת טרום גזירה
- ממלאים את המזרק באמצעי הזרימה הצמיגי המוכן.
- חבר את המזרק, מלא 60 או 100 מ"ל (או לפי הצורך) של מדיה זרימה צמיגה, מזרק ריק 60 מ"ל למיקומם בהתאמה על משאבת מזרק לתכנות. באמצעות מחברי צינורות וצינורות, חבר את שני המזרקים לתא הזרימה.
- כדי להבטיח זיהוי קל של תאים בודדים וחיבור מהודק בין תא הזרימה לצלחת הפטרי, חברו את אטם הגומי לתא הזרימה.
- שאפו את תרבית התאים מצלוחית הפטרי המכילה את התאים המעניינים.
- שטפו תאים מתים ותאים המחוברים באופן רופף באמצעות מלח חוצץ פוספט (PBS).
- שאפו את PBS.
- הכנס וקבע את תא הזרימה ואטם הגומי (~ 34 מ"מ x 9 מ"מ) על צלחת הפטרי (35 מ"מ x 10 מ"מ) המכילה את התאים המחוברים.
- הניחו את תא הזרימה + התאים המיקרופלואידים המותאמים על צלחת מתורבתת על גבי מיקרוסקופ הפוך, עם מטרת מיקרוסקופ גבוהה מספיק כדי לקבל תמונות באיכות גבוהה עם ערכי פיקסלים גבוהים (בדרך כלל בין 40x להגדלה של 63x ) וצג תצוגה.
- בחר באפשרות Live Image (קיטועי זמן בתוכנות מסוימות) מתוכנת המיקרוסקופ בצג התצוגה. ודא שלתוכנת המיקרוסקופ במחשב יש פונקציונליות t (קיטועי זמן) או שהיא יכולה לצלם הקלטות וידאו.
- מקדו את מטרת המיקרוסקופ, תוך הבטחת ניגודיות מספקת וקצוות תאים ברורים. זה הכרחי עבור ניתוח התמונה לאחר גזירה. הזז את שלב המיקרוסקופ כדי לוודא שהתאים נראים בבירור על צג התצוגה והם תמונות חיות.
- בחר תא או תאים נפרדים מרובים בתוך נתיב ההדמיה/זרימה של תא הזרימה המותאם + צלחת פטרי (האזור/נתיב שנוצר על ידי התאמת האטם לתא הזרימה).
- גזירה והדמיה
- כדי לשמור על זרימה רציפה ואחידה, בחר קצבי עירוי ונסיגה דומים וודא זרימה למינרית של הנוזל, בדרך כלל בין 1 מ"ל / דקה ל -5 מ"ל / דקה. עבור משטרי זרימה למינרית נמוכה, ודא מספר Re < 100 של ריינולד.
- לחץ על הפעל על משאבת הגזירה כדי להזריק ולמשוך את נוזל הגזירה (מדיה צמיגה מוכנה) בקצב רציף. ודא כי אין בועות במהלך עירוי נוזלים, כמו זה עלול לגרום לחץ חיצוני unaccount על התאים.
- התחל להקליט וידאו על ידי לחיצה על הקלט בתוכנת המיקרוסקופ לפני שנוזל הגזירה המוחדר יוצר מגע עם התא(ים) המעניינים מתחת למיקרוסקופ.
- המשיכו להקליט במשך 7 דקות, או למשך הזמן הרצוי של חשיפה ללחץ, או עד שהתאים המעניינים חותכים מתחתית המנה. לחץ על הפסק הקלטה בתוכנת המיקרוסקופ כאשר הריצה תושלם כרצונך.
- שמור את ההקלטה וחלץ כקבצי .tiff. רצוי, לחלץ תמונות ב 1 מסגרת לשנייה לניתוח facile.
3. עיבוד נתונים
- הליך מתאם תמונה דיגיטלי (ניתוח תמונה)
- אם ההקלטה מהמיקרוסקופ חולצה כקובץ וידאו, המירו אותה למסגרות תמונה (רצוי .tiff פורמט קובץ).
- ייבא את התמונות הנגזרות מהקלטת בדיקת הגזירה לתוכנת Davis 10.1.2 (תוכנת DIC) כדי לעקוב אחר התנועה של המבנים בעלי התבנית הטבעית של התא על-ידי איתור כל גוש פיקסל (תת-קבוצה) של תמונת הייחוס בתמונות החדשות המתאימות (תמונות מעוותות) (איור 2).
- למתאם ממוטב, השתמשו בגודל תת-ערכה של 31 x 31 פיקסלים, בגודל צעד (מרחק עיוות של כל תת-ערכה) של 20 פיקסלים ובאפשרות 'סכום המסלול הדיפרנציאלי', העוקבת אחר עיוות של תמונה חדשה ביחס לתמונה האחרונה. התוצאה של מתאם זה היא תרשים זמן-מתח (איור 3) שניתן לייצא כקובץ .csv לניתוח נוסף ב-MATLAB.
- מפה את אזור העניין עבור תא בודד שנבחר. בחר נקודות שרירותיות בתוך התא הממופה כדי לעקוב אחר דפורמציה. עבור צורה לא סדירה, כגון התא, השתמש במסיכת מצולע כדי למפות את הגיאומטריה של התא.
- לאחר המיפוי, בחר נקודות ספציפיות בתא (גרעין או ציטופלסמה) לניתוח על ידי לחיצה על הוסף מד מאמץ ושרטוט מדי מאמץ בודדים בנקודות בתוך הגבול התאי שהוגדר.
- לחץ על הפעל כדי להתחיל את עיבוד המאמץ ולקבל נתוני מאמץ לעומת זמן.
- לחץ פעמיים (או לחץ באמצעות לחצן העכבר הימני) על התוויית זמן המתח שנוצרה ובחר ייצוא נתונים כגיליון אלקטרוני.
4. אפיון תכונות מכניות
- אפיון תכונות ויסקו-אלסטיות
- שמרו את קובץ .csv המכיל את נתוני זמן המאמץ מתוכנת DIC בתיקייה נפרדת לקריאה קלה על ידי MATLAB.
- הפעל את MATLAB ולחץ על כרטיסיית העורך כדי לפתוח דף עורך לכתיבת קוד שקורא את הגיליון האלקטרוני, תא אחר תא.
- שנו את נתיב MATLAB (נתיב התיקיה שניגש לקובץ העניין) כדי לגשת לתיקייה המכילה את הנתונים לניתוח, לדוגמה, משתמשים/שם משתמש/שולחן עבודה/נתונים.
- בדף עורך MATLAB, גשו לנתוני הגיליון האלקטרוני באמצעות הקוד המותאם אישית. לדוגמה: a1= xlsread('data','run1','A4:A183'), כאשר a1 מייצג את המזהה, xlsread היא הפונקציה MATLAB הקוראת את קובץ .csv (במקרה זה, כגיליון אלקטרוני), data הוא שם הקובץ, run1 הוא שם הגיליון ו- A4:A183 הוא טווח הנתונים המעניינים בתא A של נתוני הגיליון האלקטרוני שיש לנתח. לקבלת התאמה מלאה, לנתח x ו- y (זמן ומתח, בהתאמה). לדוגמה:
a1=xlsread('data','run1','A4:A183');
b1=xlsread('data','run1','B4:B183');
A1 = X (זמן), ו- B1 = Y (מתח). - ב-MATLAB, לחצו על ' יישומים' | Curve Fitter | משוואה מותאמת אישית. נקה את המשוואה המותאמת אישית המייצגת והזן את משוואת המודל הוויסקו-אלסטי [משוואה (1)], כאשר ε מייצג את משתנה x ו- t מייצג את המשתנה y.
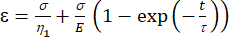 (1)
(1)
כאן, ε מייצג את המתח, σ מייצג את מתח הגזירה, η1 מייצג את הצמיגות, E מייצג את הגמישות, t מייצג את הזמן, ו-τ מייצג את זמן ההרפיה, המאפיין את הזמן המרבי הדרוש לתא לחזור לצורתו המקורית לאחר עיוות ראשוני. הוא מבוטא כ-τ =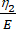 , כאשר η2 הוא מונח הצמיגות המשנית עבור הדשבורד השני (איור 4).
, כאשר η2 הוא מונח הצמיגות המשנית עבור הדשבורד השני (איור 4). - הקצה מחדש משתנים חדשים לפרמטרים הוויסקו-אלסטיים בממשק המשוואה המותאם אישית. (ε, η1, E, σ, t ו-τ =
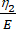 ) ייצג (x, a, b, K, y ו- c), בהתאמה. כאן, x ו- y הם המשתנים הבלתי תלויים והתלויים, בהתאמה. ניתן לקבוע מתח גזירה (σ) באמצעות משוואה (2):
) ייצג (x, a, b, K, y ו- c), בהתאמה. כאן, x ו- y הם המשתנים הבלתי תלויים והתלויים, בהתאמה. ניתן לקבוע מתח גזירה (σ) באמצעות משוואה (2):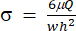 (2)
(2)
כאן, μ מייצג את צמיגות תווך נוזל הגזירה, Q הוא קצב זרימת המשאבה, ו-w ו-h הם הרוחב והגובה של ערוץ הזרימה שמוצגים באיור 1C, בהתאמה. - לחץ על בחר נתונים כדי לבחור את השעה (a1) ואת המתח (b1) עבור כל ערכת נתונים.
- ודא שהאפשרות התאמה אוטומטית מסומנת. פעולה זו מפעילה את ההתאמה באופן אוטומטי כאשר נתונים (x ו- y) נבחרים.
- בחר בשיטות ההתאמה כדי להדק את תנאי הגבול. לחץ על אפשרויות מתקדמות תחת הקטגוריה שיטות ובחר ריבועים לפחות לא ליניאריים. תחת חזק, בחר כבוי, ותחת אלגוריתם, בחר אזור אמון. השאר כל פרמטר אחר כפי שהוא.
- המשתנים החדשים לאחר ההתאמה (a, b ו-c) מייצגים את התכונות הוויסקו-אלסטיות, הצמיגות, האלסטיות וזמן ההרפיה (η1, E, EQUAT) של התא, בהתאמה (איור 5).
- חפש ערך R ריבועי גבוה של ההתאמה (R2 > 80%) כדי להבטיח שפלט הנתונים יכול להיחשב כהתאמה אמיתית של המודל הוויסקו-אלסטי (איור 3)
Access restricted. Please log in or start a trial to view this content.
תוצאות
פרוטוקול בדיקת הגזירה יחד עם ניתוח דפורמציה באמצעות DIC ומודל ויסקו-אלסטי מצליח לכמת את התכונות המכניות של תא בודד במבחנה. שיטה זו נבדקה על קווי תאים אנושיים ומורין, כולל תאי שד אנושיים רגילים (MCF-10A)3,4,9, תאי סרטן שד טריפל נגטיב גרורתיים פחות (MDA-MB-468)3, תאי סרטן שד טריפל נגטיב (MD...
Access restricted. Please log in or start a trial to view this content.
Discussion
שיטת בדיקת הגזירה, הכוללת הקמת סביבה פסאודו-מכנוביולוגית המדמה את האינטראקציה של תאים עם המיקרו-סביבה המכנית הסובבת אותם ואת תגובותיהם לעקות מכניות, יצרה קטלוג של תכונות מכניות תאיות, שדפוסיהן מראים אטיפיה פיזית שמורה בין שורות תאים סרטניים 3,4,5,7,8
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין אינטרסים כלכליים מתחרים לחשוף.
Acknowledgements
המחברים מודים לחוקרים קודמים מקבוצת סובוייג'ו במכון הפוליטכני של וורצ'סטר שהיו החלוצים הראשונים בטכניקה זו: ד"ר ייפאנג קאו, ג'ינגג'יה הו וונסה אוזונוואן. עבודה זו נתמכה על ידי המכון הלאומי לסרטן (NIH/NCI K22 CA258410 ל-M.D). דמויות נוצרו עם BioRender.com.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| CELL CULTURE | |||
| .25% Trypsin, 2.21 mM EDTA, 1x[-] sodium bicarbonate | Corning | 25-053-ci | For cellular detachment from substrate in cell culture |
| 15 mL Centrifuge tubes | Falcon by Corning | 05-527-90 | |
| 35 mm Petri dishes | Corning | 430165 | |
| 50 mL Centrifuge tubes | Falcon by Corning | 14-432-22 | |
| Centrifuge | any | For sterile cell culture | |
| Dulbecco's Modification of Eagle's Medium (DMEM) 1x | Corning | 10-013-cv | Or any other media for culturing cells. DMEM was used for culturing U87 cells |
| Gloves | any | For sterile cell culture | |
| Heracell Vios 160i CO2 Incubator | Thermo Scientific | 51033770 | For Incubation during cell culture |
| Hood | any | For sterile cell culture | |
| Micropipette | any | For sterile cell culture | |
| Micropipette tips | any | For sterile cell culture | |
| Microscope | Leica/any | For sterile cell culture | |
| Phosphate Buffered Saline without calcium and magnesium PBS, 1x | Corning | 21-040-CM | |
| Pipetman | any | For sterile cell culture | |
| Pipette tips | any | For sterile cell culture | |
| Precision GP 10 liquid incubator | Thermo Scientific | TSGP02 | |
| T25 Flask | Corning | 430639 | |
| T75 Flask | Corning | 430641U | |
| SHEAR ASSAY | |||
| 100 mL beaker | any | For creating DMEM + methyl cellulose viscous shear media | |
| DMEM | Corning | ||
| Flow chamber + rubber gasket | Glycotech | 31-001 | Circular Flow chamber Kit ( for 35 mm tissue culture dishes) |
| Hybrid Rheometer | HR-2 Discovery Hybrid Rheometer | For determination of shear fluid viscosity | |
| Magnetic stir bar | any | For creating DMEM + methyl cellulose viscous shear media | |
| Magnetic stir plate | any | For creating DMEM + methyl cellulose viscous shear media | |
| Methyl cellulose | any | To increase viscosity of DMEM in flow media | |
| Syringe Pump | KD Scientific Geminin 88 plus | 788088 | For programming fluid infusion and withdrawal |
| Syringes, tubing, and connectors | For shear apparatus setup | ||
| SOFTWARE | |||
| ABAQUS software | Simulia | ||
| Digitial Image Correlation software | LaVision, Germany | DAVIS 10.1.2 | |
| Imaging software | Leica/any microscope software | ||
| MATLAB | MATLAB | MATLAB_R2020B |
References
- Sethi, S., Ali, S., Philip, P. A., Sarkar, F. H. Clinical advances in molecular biomarkers for cancer diagnosis and therapy. International Journal of Molecular Sciences. 14 (7), 14771-14784 (2013).
- Runel, G., Lopez-Ramirez, N., Chlasta, J., Masse, I. Biomechanical properties of cancer cells. Cells. 10 (4), 887(2021).
- Hu, J., Zhou, Y., Obayemi, J. D., Du, J., Soboyejo, W. O. An investigation of the viscoelastic properties and the actin cytoskeletal structure of triple negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 86, 1-13 (2018).
- Onwudiwe, K., et al. Investigation of creep properties and the cytoskeletal structures of non-tumorigenic breast cells and triple-negative breast cancer cells. Journal of Biomedical Materials Research. Part A. 110 (5), 1004-1020 (2022).
- Ani, C. J., et al. A shear assay study of single normal/breast cancer cell deformation and detachment from poly-di-methyl-siloxane (PDMS) surfaces. Journal of the Mechanical Behavior of Biomedical Materials. 91, 76-90 (2019).
- Suresh, S. Biomechanics and biophysics of cancer cells. Acta Biomaterialia. 3 (4), 413-438 (2007).
- Cao, Y., et al. Investigation of the viscoelasticity of human osteosarcoma cells using a shear assay method. Journal of Materials Research. 21 (8), 1922-1930 (2006).
- Cao, Y. On the measurement of human osteosarcoma cell elastic modulus using shear assay experiments. Journal of Materials Science. Materials in Medicine. 18 (1), 103-109 (2007).
- Onwudiwe, K., et al. Actin cytoskeletal structure and the statistical variations of the mechanical properties of non-tumorigenic breast and triple-negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 119, 104505(2021).
- Kirmizis, D., Logothetidis, S. Atomic force microscopy probing in the measurement of cell mechanics. International Journal of Nanomedicine. 5, 137-145 (2010).
- Haase, K., Pelling, A. E. Investigating cell mechanics with atomic force microscopy. Journal of the Royal Society. Interface. 12 (104), 20140970(2015).
- Zhang, H., Liu, K. K. Optical tweezers for single cells. Journal of the Royal Society. Interface. 5 (24), 671-690 (2008).
- Peterman, E. J. G., Gittes, F., Schmidt, C. F. Laser-induced heating in optical traps. Biophysical Journal. 84, 1308-1316 (2003).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Evans, E., Yeung, A. Apparent viscosity and corticcal tension of blood granulocytes determined by micropipet aspiration. Biophysical Journal. 56 (1), 151-160 (1989).
- Van Vliet, K. J., Bao, G., Suresh, S. The biomechanics toolbox: experimental approaches for living cells and biomolecules. Acta Materialia. 51 (19), 5881-5905 (2003).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews. Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Choi, H. Y., et al. Hydrodynamic shear stress promotes epithelial-mesenchymal transition by downregulating ERK and GSK3beta activities. Breast Cancer Research. 21 (1), 6(2019).
- Northcott, J. M., Dean, I. S., Mouw, J. K., Weaver, V. M. Feeling stress: The mechanics of cancer progression and aggression. Frontiers in Cell and Developmental Biology. 6, 17(2018).
- Onwudiwe, K., Najera, J., Siri, S., Datta, M. Do tumor mechanical stresses promote cancer immune escape. Cells. 11 (23), 3840(2022).
- Heldin, C. H., Rubin, K., Pietras, K., Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nature Reviews. Cancer. 4 (10), 806-813 (2004).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Mao, B. H., Nguyen Thi, K. M., Tang, M. J., Kamm, R. D., Tu, T. Y. The interface stiffness and topographic feature dictate interfacial invasiveness of cancer spheroids. Biofabrication. 15 (1), (2023).
- Kashani, A. S., Packirisamy, M. Cancer cells optimize elasticity for efficient migration. Royal Society Open Science. 7 (10), 200747(2020).
- Riehl, B. D., Kim, E., Bouzid, T., Lim, J. Y. The role of microenvironmental cues and mechanical loading milieus in breast cancer cell progression and metastasis. Frontiers in Bioengineering and Biotechnology. 8, 608526(2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved