Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Протокол сдвигового анализа для определения свойств одноячеистого материала
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом протоколе описывается количественная оценка механических свойств раковых и нераковых клеточных линий in vitro. Консервативные различия в механике раковых и нормальных клеток могут выступать в качестве биомаркера, который может иметь значение для прогноза и диагностики.
Аннотация
Нерегулярная биомеханика является отличительной чертой биологии рака, подлежащей обширному изучению. Механические свойства ячейки аналогичны свойствам материала. Устойчивость клетки к стрессу и напряжению, время ее релаксации и ее эластичность — все это свойства, которые можно вывести и сравнить с другими типами клеток. Количественная оценка механических свойств раковых (злокачественных) и нормальных (незлокачественных) клеток позволяет исследователям глубже раскрыть биофизические основы этого заболевания. Хотя известно, что механические свойства раковых клеток постоянно отличаются от механических свойств нормальных клеток, стандартная экспериментальная процедура для определения этих свойств из клеток в культуре отсутствует.
В этой статье описывается процедура количественной оценки механических свойств отдельных клеток in vitro с использованием анализа сдвига жидкости. Принцип, лежащий в основе этого анализа, заключается в приложении напряжения сдвига жидкости к одной ячейке и оптическом мониторинге результирующей клеточной деформации с течением времени. Механические свойства ячеек впоследствии характеризуются с помощью анализа цифровой корреляции изображений (DIC) и подгонки соответствующей вязкоупругой модели к экспериментальным данным, полученным в результате ДВС-анализа. В целом, протокол, изложенный здесь, направлен на обеспечение более эффективного и целенаправленного метода диагностики трудно поддающихся лечению видов рака.
Введение
Изучение биофизических различий между раковыми и нераковыми клетками открывает новые диагностические и терапевтические возможности1. Понимание того, как различия в биомеханике/механобиологии способствуют прогрессированию опухоли и резистентности к лечению, откроет новые возможности для таргетной терапии и ранней диагностики2.
Хотя известно, что механические свойства раковых клеток отличаются от нормальных клеток (например, вязкоупругость плазматической мембраны и ядерной оболочки)3,4,5, надежные и воспроизводимые методы измерения этих свойств в живых клеткахотсутствуют6. Метод сдвигового анализа используется для количественной оценки механических свойств клеток путем воздействия на отдельные клетки напряжения сдвига жидкости и анализа их индивидуальных реакций и сопротивления приложенному напряжению 3,4,5,7,8,9. Хотя для характеристики механических свойств отдельных клеток использовалось несколько методов и приемов, они, как правило, влияют на свойства клеточного материала путем i) перфорации/повреждения клеточной мембраны из-за глубины вдавливания, сложной геометрии наконечника или жесткости подложки, связанной с атомно-силовой микроскопией (АСМ)10,11, ii) индуцирования клеточного фотоповреждения во время оптического захвата 12, 13, или iii) индуцирование сложных стрессовых состояний, связанных с аспирацией микропипеток14,15. Эти внешние эффекты связаны со значительными неопределенностями в точности измерений вязкоупругости клеток 6,16,17.
Чтобы устранить эти ограничения, описанный здесь метод анализа сдвига обеспечивает высококонтролируемый и простой подход к моделированию физиологического потока в организме без влияния на свойства клеточного материала в процессе. Напряжения сдвига жидкости в этом анализе представляют собой механические напряжения, испытываемые клетками организма либо жидкостями внутри опухолевого интерстиция, либо в крови во время циркуляции18,19,20. Кроме того, эти жидкостные стрессы способствуют различному злокачественному поведению раковых клеток, включая прогрессирование, миграцию, метастазирование и гибель клеток 19,21,22,23, которые варьируются между онкогенными и неопухолевыми клетками. Более того, измененные механические особенности раковых клеток (т.е. они часто «мягче», чем нормальные клетки, обнаруженные в том же органе) позволяют им сохраняться во враждебном микроокружении опухоли, проникать в окружающие нормальные ткани и метастазировать в отдаленные участки24,25,26. Создавая псевдобиологическую среду, в которой клетки испытывают физиологические уровни напряжения сдвига жидкости, достигается процесс, который физиологически актуален и не разрушает клетку. Клеточные реакции на эти приложенные напряжения сдвига жидкости позволяют нам охарактеризовать механические свойства клеток.
В этой статье представлен протокол анализа сдвига для обширного изучения механических свойств и поведения раковых и нераковых клеток при приложенном напряжении сдвига. Клетки реагируют на внешние силы упругим и вязким образом и поэтому могут быть идеализированы как вязкоупругий материал3. Этот метод подразделяется на: (i) клеточную культуру дисперсных одиночных клеток, (ii) контролируемое применение напряжения сдвига жидкости, (iii) визуализацию in situ и наблюдение за клеточным поведением (включая устойчивость к стрессу и деформации), (iv) анализ деформации клеток для определения степени деформации и (v) характеристика вязкоупругих свойств отдельных клеток. Исследуя эти механические свойства и поведение, сложная клеточная механобиология может быть преобразована в количественные данные. Протокол, описывающий этот метод, позволяет каталогизировать и сравнивать различные злокачественные и незлокачественные типы клеток. Количественная оценка этих различий может привести к установлению диагностических и терапевтических биомаркеров.
протокол
1. Подготовка к одноклеточному сдвиговому анализу
- Клеточная культура
- Засейте около 50 000 суспендированных одиночных клеток в чашку Петри размером 35 мм x 10 мм, содержащую 2 мл питательной среды.
ПРИМЕЧАНИЕ: Перед посевом встряхните взвешенные ячейки, чтобы разбить агрегаты клеток. - Инкубируйте клетки при 37 ° C и подождите от 10 до 48 часов для прикрепления клеток и полного образования белка цитоскелета.
ПРИМЕЧАНИЕ: Учитывайте продолжительность клеточного прикрепления, а также скорость пролиферации и роста, чтобы обеспечить адекватный клеточный рост и прикрепление, избегая при этом клеточной агрегации. Эти параметры варьируются в зависимости от типа ячейки.
- Засейте около 50 000 суспендированных одиночных клеток в чашку Петри размером 35 мм x 10 мм, содержащую 2 мл питательной среды.
2. Эксперимент по анализу сдвига
- Подготовка вязких текучих сред для анализа сдвига
- Для обеспечения слегка вязкой текучести (0,015-0,02 Па·с) отмерьте и добавьте в питательную среду 0,05 мас.% нетоксичной и неаллергенной метилцеллюлозы (4 Па·с).
- Чтобы обеспечить однородную смесь, предварительно нагрейте основную питательную среду в течение ~10-20 мин при температуре ~60-70 °C с помощью магнитной мешалки/конфорки. Постоянно помешивая среду, осторожно добавьте метилцеллюлозу, чтобы она быстро рассеялась, чтобы избежать коагуляции частиц метилцеллюлозы. Дайте этому процессу продолжаться в течение ~ 15-24 часов, чтобы обеспечить прозрачный раствор среды + целлюлозы.
ПРИМЕЧАНИЕ: Избегайте чрезмерного нагрева раствора. - Чтобы измерить вязкость текучей среды, проверьте ~ 0,5-1 мл репрезентативной текучей среды с помощью реометра. Исходя из показаний, определите вязкость жидкости и используйте это значение для представления вязкости среды сдвиговой жидкости (μ) для расчета напряжения сдвига с использованием уравнения (2).
- Настройка ножниц
- Настройте систему анализа сдвига из двойных шприцев (60 мл или 100 мл), подключенных к программируемому шприц-насосу для инфузии и удаления вязких питательных сред (рис. 1).
- Прикрепите оба шприца к проточной камере с помощью трубки 1/16 дюйма и соединителей трубок.
- Закрепите резиновую прокладку, чтобы обеспечить контролируемый равномерный поток на отдельных ячейках вдоль пути потока (рис. 1). Резиновая прокладка бывает разных размеров в зависимости от профиля потока (ламинарный или турбулентный) и желаемой области наблюдения (например, длина 22,5 мм, ширина 2,5 мм и высота 0,254 мм) (рис. 1).
- Запрограммируйте насос на вливание и отвод определенного объема жидкости (например, 60 мл) с заданной скоростью (например, 1 мл / мин) и выберите соответствующие шприцы (например, 60 мл).
ПРИМЕЧАНИЕ: Учитывайте предустановки максимального объема инфузии и вывода, чтобы избежать заклинивания или неисправности. Используйте уравнение (2) для расчета требуемой скорости сдвига насоса (при условии, что требуемое напряжение и вязкость известны).
- Предварительная настройка сдвига
- Наполните шприц подготовленной вязкой текучей средой.
- Прикрепите шприц, заполненный 60 или 100 мл (или по мере необходимости) вязкой текучей среды, и пустой шприц объемом 60 мл к соответствующим местам на программируемом шприц-насосе. С помощью трубок и соединителей трубок подсоедините оба шприца к проточной камере.
- Чтобы обеспечить легкую идентификацию отдельных ячеек и надежное соединение между проточной камерой и чашкой Петри, прикрепите резиновую прокладку к проточной камере.
- Аспирируйте питательную среду из чашки Петри, содержащей интересующие клетки.
- Смойте мертвые клетки и слабо прикрепленные клетки с помощью фосфатно-буферного физиологического раствора (PBS).
- Аспирируйте PBS.
- Вставьте и закрепите проточную камеру и резиновую прокладку (~ 34 мм x 9 мм) на чашке Петри (35 мм x 10 мм), содержащей прикрепленные ячейки.
- Поместите установленную микрофлюидную проточную камеру + клетки на культивируемую чашку на инвертированный микроскоп с объективом микроскопа, достаточно высоким для получения высококачественных изображений с высокими значениями пикселей (обычно от 40-кратного до 63-кратного увеличения) и монитором.
- Выберите параметр живого изображения (покадровая съемка в некоторых программах) в программном обеспечении микроскопа на мониторе. Убедитесь, что программное обеспечение микроскопа на ПК имеет функцию t (покадровая съемка) или может делать видеозаписи.
- Сфокусируйте объектив микроскопа, обеспечив достаточный контраст и четкие края ячеек. Это необходимо для анализа изображений после сдвига. Переместите столик микроскопа, чтобы клетки были хорошо видны на мониторе дисплея и представляли собой живые изображения.
- Выберите ячейку или несколько отдельных ячеек в пределах визуализации/пути потока установленной проточной камеры + чашки Петри (область/путь, создаваемый подгонкой прокладки к проточной камере).
- Сдвиг и визуализация
- Чтобы поддерживать непрерывный равномерный поток, выберите одинаковые скорости инфузии и отведения, и обеспечьте ламинарный поток жидкости, обычно от 1 мл / мин до 5 мл / мин. Для режимов с низким ламинарным потоком обеспечьте число Рейнольда Re < 100.
- Нажмите « Запустить » на сдвиговом насосе, чтобы непрерывно впрыскивать и отводить срезную жидкость (подготовленную вязкую среду). Убедитесь, что во время инфузии жидкости нет пузырьков, так как это может привести к внешнему неучтенному стрессу на клетки.
- Начните запись видео, нажав кнопку «Запись » в программном обеспечении микроскопа до того, как введенная сдвиговая жидкость вступит в контакт с интересующей клеткой (клетками) под микроскопом.
- Продолжайте запись в течение 7 минут, или в течение желаемой продолжительности воздействия стресса, или до тех пор, пока интересующая клетка (клетки) не срежет дно тарелки. Нажмите «Остановить запись » в программном обеспечении микроскопа, когда запуск будет завершен должным образом.
- Сохраните запись и извлеките в виде .tiff файлов. Предпочтительно извлекать изображения со скоростью 1 кадр в секунду для упрощения анализа.
3. Обработка данных
- Процедура корреляции цифровых изображений (анализ изображений)
- Если запись с микроскопа была извлечена в виде видеофайла, преобразуйте ее в кадры изображения (желательно .tiff формат файла).
- Импортируйте изображения, полученные в результате записи анализа сдвига, в программное обеспечение Davis 10.1.2 (программное обеспечение DIC) для отслеживания движения структур клетки с естественным рисунком путем определения местоположения каждого блока пикселя (подмножества) эталонного изображения в соответствующих новых изображениях (деформированных изображениях) (рис. 2).
- Для оптимизированной корреляции используйте размер подмножества 31 x 31 пиксель, размер шага (расстояние деформации каждого подмножества) 20 пикселей и сумму параметра дифференциальной дорожки , которая отслеживает деформацию нового изображения по отношению к последнему изображению. Результатом этой корреляции является график деформации-времени (рис. 3), который может быть экспортирован в виде файла .csv для дальнейшего анализа в MATLAB.
- Нанесите на карту интересующую область для выбранной отдельной ячейки. Выберите произвольные точки в сопоставленной ячейке, чтобы отслеживать деформацию. Для неправильной формы, такой как ячейка, используйте многоугольник-маску , чтобы отобразить геометрию ячейки.
- После картирования выберите определенные точки на клетке (ядро или цитоплазма) для анализа, щелкнув «Добавить тензодатчик » и нарисовав отдельные тензодатчики в точках в пределах определенной клеточной границы.
- Нажмите « Выполнить », чтобы начать обработку деформации и получить данные о зависимости деформации от времени.
- Дважды щелкните (или щелкните правой кнопкой мыши) сгенерированный график времени деформации и выберите «Экспортировать данные в виде электронной таблицы».
4. Характеристика механических свойств
- Характеристика вязкоупругих свойств
- Сохраните файл .csv, содержащий данные о времени деформации из программного обеспечения DIC, в отдельной папке для удобства чтения MATLAB.
- Запустите MATLAB и перейдите на вкладку редактора, чтобы открыть страницу редактора для написания кода, который читает электронную таблицу, ячейка за ячейкой.
- Измените путь MATLAB (путь к папке, которая обращается к интересующему файлу), чтобы получить доступ к папке, содержащей анализируемые данные, например, Users/Username/Desktop/data.
- На странице редактора MATLAB получите доступ к данным электронной таблицы с помощью настроенного кода. Например: a1= xlsread('data','run1','A4:A183'), где a1 представляет идентификатор, xlsread — функция MATLAB , которая считывает файл .csv (в данном случае в виде электронной таблицы), data — имя файла, run1 — имя листа, а A4:A183 — диапазон интересующих данных в ячейке A анализируемых данных электронной таблицы . Для полного соответствия проанализируйте x и y (время и напряжение соответственно). Например:
a1=xlsread('data','run1','A4:A183');
b1=xlsread('data','run1','B4:B183');
a1 = x (время) и b1 = y (деформация). - В MATLAB щелкните Приложения | Слесарь по кривой | Пользовательское уравнение. Очистите репрезентативное пользовательское уравнение и введите уравнение вязкоупругой модели [уравнение (1)], где ε представляет переменную x, а t — переменную y.
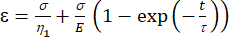 (1)
(1)
Здесь ε представляет собой деформацию, σ представляет собой напряжение сдвига, η1 представляет вязкость, E представляет собой упругость, t представляет собой время, а τ представляет собой время релаксации, которое характеризует максимальное время, необходимое ячейке для возвращения своей первоначальной формы после первичной деформации. Он выражается как τ =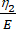 , где η2 — член вторичной вязкости для второго приборного экрана (рис. 4).
, где η2 — член вторичной вязкости для второго приборного экрана (рис. 4). - Переназначьте новые переменные вязкоупругим параметрам в пользовательском интерфейсе уравнений. (ε, η1, E, σ, t и τ =
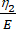 ) будет представлять (x, a, b, K, y и c) соответственно. Здесь x и y являются независимыми и зависимыми переменными соответственно. Напряжение сдвига (σ) можно определить с помощью уравнения (2):
) будет представлять (x, a, b, K, y и c) соответственно. Здесь x и y являются независимыми и зависимыми переменными соответственно. Напряжение сдвига (σ) можно определить с помощью уравнения (2):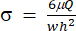 (2)
(2)
Здесь μ представляет вязкость среды сдвиговой жидкости, Q — расход насоса, а w и h — ширину и высоту проточного канала, показанные на рисунке 1C, соответственно. - Нажмите «Выбрать данные», чтобы выбрать время (a1) и напряжение (b1) для каждого набора данных.
- Убедитесь, что установлен флажок «Автоподгонка ». При выборе данных (x и y) выполняется автоматическая подгонка.
- Выберите методы подгонки для ужесточения граничных условий. Нажмите « Дополнительные параметры » в категории « Методы » и выберите « Нелинейный метод наименьших квадратов». В разделе " Надежный" выберите "Выкл.", а в разделе " Алгоритм" выберите "Регион доверия". Все остальные параметры оставьте как есть.
- Новые переменные после подгонки (a, b и c) представляют вязкоупругие свойства, вязкость, эластичность и время релаксации (η1, E, EQUAT) ячейки соответственно (рис. 5).
- Обратите внимание на высокое значение R-квадрата подгонки (R2 > 80%), чтобы убедиться, что выходные данные можно считать истинным соответствием вязкоупругой модели (рис. 3)
Результаты
Протокол анализа сдвига в сочетании с анализом деформации с использованием DIC и вязкоупругой модели успешно определяет механические свойства одной ячейки in vitro. Этот метод был протестирован на клеточных линиях человека и мышей, включая нормальные клетки молочной железы человека (...
Обсуждение
Метод сдвигового анализа, который включает в себя создание псевдомеханобиологической среды для моделирования взаимодействия клеток с окружающим механическим микроокружением и их реакции на механические нагрузки, позволил создать каталог клеточных механических свойств, закономерн?...
Раскрытие информации
У авторов нет конкурирующих финансовых интересов, которые они могли бы раскрыть.
Благодарности
Авторы благодарят предыдущих исследователей из группы Собоеджо в Вустерском политехническом институте, которые первыми применили эту технику: докторов Ифан Цао, Цзинцзе Ху и Ванессу Узонванне. Эта работа была поддержана Национальным институтом рака (NIH / NCI K22 CA258410 по MD). Фигуры были созданы с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| CELL CULTURE | |||
| .25% Trypsin, 2.21 mM EDTA, 1x[-] sodium bicarbonate | Corning | 25-053-ci | For cellular detachment from substrate in cell culture |
| 15 mL centrifuge tubes | Falcon by Corning | 05-527-90 | |
| 35 mm Petri dishes | Corning | 430165 | |
| 50 mL centrifuge tubes | Falcon by Corning | 14-432-22 | |
| centrifuge | any | For sterile cell culture | |
| Dulbecco's Modification of Eagle's Medium (DMEM) 1x | Corning | 10-013-cv | Or any other media for culturing cells. DMEM was used for culturing U87 cells |
| gloves | any | For sterile cell culture | |
| Heracell Vios 160i CO2 Incubator | Thermo Scientific | 51033770 | For Incubation during cell culture |
| Hood | any | For sterile cell culture | |
| micropipette | any | For sterile cell culture | |
| micropipette tips | any | For sterile cell culture | |
| Microscope | Leica/any | For sterile cell culture | |
| Phosphate Buffered Saline without calcium and magnesium PBS, 1x | Corning | 21-040-CM | |
| pipetman | any | For sterile cell culture | |
| pipette tips | any | For sterile cell culture | |
| Precision GP 10 liquid incubator | Thermo Scientific | TSGP02 | |
| T25 flask | Corning | 430639 | |
| T75 flask | Corning | 430641U | |
| SHEAR ASSAY | |||
| 100 mL beaker | any | For creating DMEM + methyl cellulose viscous shear media | |
| DMEM | Corning | ||
| Flow chamber + rubber gasket | Glycotech | 31-001 | Circular Flow chamber Kit ( for 35 mm tissue culture dishes) |
| Hybrid Rheometer | HR-2 Discovery Hybrid Rheometer | For determination of shear fluid viscosity | |
| magnetic stir bar | any | For creating DMEM + methyl cellulose viscous shear media | |
| magnetic stir plate | any | For creating DMEM + methyl cellulose viscous shear media | |
| methyl cellulose | any | To increase viscosity of DMEM in flow media | |
| Syringe Pump | KD Scientific Geminin 88 plus | 788088 | For programming fluid infusion and withdrawal |
| syringes, tubing, and connectors | For shear apparatus setup | ||
| SOFTWARE | |||
| ABAQUS software | Simulia | ||
| Digitial Image Correlation software | LaVision, Germany | DAVIS 10.1.2 | |
| Imaging software | Leica/any microscope software | ||
| MATLAB | MATLAB | MATLAB_R2020B |
Ссылки
- Sethi, S., Ali, S., Philip, P. A., Sarkar, F. H. Clinical advances in molecular biomarkers for cancer diagnosis and therapy. International Journal of Molecular Sciences. 14 (7), 14771-14784 (2013).
- Runel, G., Lopez-Ramirez, N., Chlasta, J., Masse, I. Biomechanical properties of cancer cells. Cells. 10 (4), 887 (2021).
- Hu, J., Zhou, Y., Obayemi, J. D., Du, J., Soboyejo, W. O. An investigation of the viscoelastic properties and the actin cytoskeletal structure of triple negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 86, 1-13 (2018).
- Onwudiwe, K., et al. Investigation of creep properties and the cytoskeletal structures of non-tumorigenic breast cells and triple-negative breast cancer cells. Journal of Biomedical Materials Research. Part A. 110 (5), 1004-1020 (2022).
- Ani, C. J., et al. A shear assay study of single normal/breast cancer cell deformation and detachment from poly-di-methyl-siloxane (PDMS) surfaces. Journal of the Mechanical Behavior of Biomedical Materials. 91, 76-90 (2019).
- Suresh, S. Biomechanics and biophysics of cancer cells. Acta Biomaterialia. 3 (4), 413-438 (2007).
- Cao, Y., et al. Investigation of the viscoelasticity of human osteosarcoma cells using a shear assay method. Journal of Materials Research. 21 (8), 1922-1930 (2006).
- Cao, Y. On the measurement of human osteosarcoma cell elastic modulus using shear assay experiments. Journal of Materials Science. Materials in Medicine. 18 (1), 103-109 (2007).
- Onwudiwe, K., et al. Actin cytoskeletal structure and the statistical variations of the mechanical properties of non-tumorigenic breast and triple-negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 119, 104505 (2021).
- Kirmizis, D., Logothetidis, S. Atomic force microscopy probing in the measurement of cell mechanics. International Journal of Nanomedicine. 5, 137-145 (2010).
- Haase, K., Pelling, A. E. Investigating cell mechanics with atomic force microscopy. Journal of the Royal Society. Interface. 12 (104), 20140970 (2015).
- Zhang, H., Liu, K. K. Optical tweezers for single cells. Journal of the Royal Society. Interface. 5 (24), 671-690 (2008).
- Peterman, E. J. G., Gittes, F., Schmidt, C. F. Laser-induced heating in optical traps. Biophysical Journal. 84, 1308-1316 (2003).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Evans, E., Yeung, A. Apparent viscosity and corticcal tension of blood granulocytes determined by micropipet aspiration. Biophysical Journal. 56 (1), 151-160 (1989).
- Van Vliet, K. J., Bao, G., Suresh, S. The biomechanics toolbox: experimental approaches for living cells and biomolecules. Acta Materialia. 51 (19), 5881-5905 (2003).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews. Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Choi, H. Y., et al. Hydrodynamic shear stress promotes epithelial-mesenchymal transition by downregulating ERK and GSK3beta activities. Breast Cancer Research. 21 (1), 6 (2019).
- Northcott, J. M., Dean, I. S., Mouw, J. K., Weaver, V. M. Feeling stress: The mechanics of cancer progression and aggression. Frontiers in Cell and Developmental Biology. 6, 17 (2018).
- Onwudiwe, K., Najera, J., Siri, S., Datta, M. Do tumor mechanical stresses promote cancer immune escape. Cells. 11 (23), 3840 (2022).
- Heldin, C. H., Rubin, K., Pietras, K., Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nature Reviews. Cancer. 4 (10), 806-813 (2004).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Mao, B. H., Nguyen Thi, K. M., Tang, M. J., Kamm, R. D., Tu, T. Y. The interface stiffness and topographic feature dictate interfacial invasiveness of cancer spheroids. Biofabrication. 15 (1), (2023).
- Kashani, A. S., Packirisamy, M. Cancer cells optimize elasticity for efficient migration. Royal Society Open Science. 7 (10), 200747 (2020).
- Riehl, B. D., Kim, E., Bouzid, T., Lim, J. Y. The role of microenvironmental cues and mechanical loading milieus in breast cancer cell progression and metastasis. Frontiers in Bioengineering and Biotechnology. 8, 608526 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены