Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tek Hücreli Malzeme Özelliklerinin Belirlenmesi için Kesme Testi Protokolü
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, kanserli ve kanserli olmayan hücre hatlarının mekanik özelliklerinin in vitro olarak ölçülmesini özetlemektedir. Kanserli ve normal hücrelerin mekaniğindeki korunmuş farklılıklar, prognoz ve tanıda etkileri olabilecek bir biyobelirteç görevi görebilir.
Özet
Düzensiz biyomekanik, kapsamlı bir çalışmaya tabi tutulan kanser biyolojisinin ayırt edici bir özelliğidir. Bir hücrenin mekanik özellikleri bir malzemeninkine benzer. Bir hücrenin strese ve gerilmeye karşı direnci, gevşeme süresi ve elastikiyeti, türetilebilen ve diğer hücre türleriyle karşılaştırılabilen özelliklerdir. Kanserli (malign) hücrelerin normal (malign olmayan) hücrelere karşı mekanik özelliklerini ölçmek, araştırmacıların bu hastalığın biyofiziksel temellerini daha da ortaya çıkarmalarını sağlar. Kanser hücrelerinin mekanik özelliklerinin normal hücrelerin mekanik özelliklerinden sürekli olarak farklı olduğu bilinmesine rağmen, bu özellikleri kültürdeki hücrelerden çıkarmak için standart bir deneysel prosedür eksiktir.
Bu yazıda, bir sıvı kesme testi kullanılarak in vitro olarak tek hücrelerin mekanik özelliklerini ölçmek için bir prosedür özetlenmektedir. Bu tahlilin arkasındaki prensip, sıvı kesme stresinin tek bir hücreye uygulanmasını ve zaman içinde ortaya çıkan hücresel deformasyonun optik olarak izlenmesini içerir. Hücre mekanik özellikleri daha sonra dijital görüntü korelasyonu (DIC) analizi kullanılarak ve DIC analizinden üretilen deneysel verilere uygun bir viskoelastik model takılarak karakterize edilir. Genel olarak, burada özetlenen protokol, tedavisi zor kanserlerin teşhisi için daha etkili ve hedefli bir yöntem sağlamayı amaçlamaktadır.
Giriş
Kanserli ve kanserli olmayan hücreler arasındaki biyofiziksel farklılıkların incelenmesi, yeni tanı ve tedavi fırsatlarına izin verir1. Biyomekanik/mekanobiyolojideki farklılıkların tümör progresyonuna ve tedavi direncine nasıl katkıda bulunduğunun anlaşılması, hedefe yönelik tedavi ve erken tanı için yeni yollar ortaya çıkaracaktır2.
Kanser hücresinin mekanik özelliklerinin normal hücrelerden farklı olduğu bilinmekle birlikte (örneğin, plazma zarının ve nükleer zarfın viskoelastisitesi)3,4,5, canlı hücrelerde bu özellikleri ölçmek için sağlam ve tekrarlanabilir yöntemler eksiktir6. Kesme testi yöntemi, tek hücreleri sıvı kesme stresine maruz bırakarak ve uygulanan strese karşı bireysel tepkilerini ve dirençlerini analiz ederek hücrelerin mekanik özelliklerini ölçmek için kullanılır 3,4,5,7,8,9. Tek hücrelerin mekanik özelliklerini karakterize etmek için çeşitli yöntem ve teknikler kullanılmasına rağmen, bunlar i) girinti derinliği, karmaşık uç geometrileri veya atomik kuvvet mikroskobu (AFM) ile ilişkili substrat sertleşmesi nedeniyle hücre zarını delerek / zarar vererek, 10,11, ii) optik yakalama sırasında hücresel fotohasarı indükleyerek hücre materyali özelliklerini etkileme eğilimindedir 12, 13 veya iii) mikropipet aspirasyonu ile ilişkili karmaşık stres durumlarını indüklemek14,15. Bu dış etkiler, hücre viskoelastisite ölçümlerinin doğruluğundaki önemli belirsizliklerle ilişkilidir 6,16,17.
Bu sınırlamaları ele almak için, burada açıklanan kesme testi yöntemi, süreçteki hücresel materyal özelliklerini etkilemeden vücuttaki fizyolojik akışı simüle etmek için oldukça kontrol edilebilir ve basit bir yaklaşım sağlar. Bu tahlildeki sıvı kesme gerilmeleri, vücuttaki hücrelerin tümör interstisyumu içindeki sıvılar tarafından veya dolaşım sırasında kanda yaşadığı mekanik stresleri temsil eder18,19,20. Ayrıca, bu sıvı stresleri, kanser hücrelerinde, progresyon, göç, metastaz ve hücre ölümü 19,21,22,23 dahil olmak üzere, tümörojenik ve tümörojenik olmayan hücreler arasında değişen çeşitli malign davranışları teşvik eder. Dahası, kanser hücrelerinin değişmiş mekanik özellikleri (yani, aynı organda bulunan normal hücrelerden genellikle "daha yumuşaktırlar"), düşmanca tümör mikro ortamlarında devam etmelerine, çevredeki normal dokuları istila etmelerine ve uzak bölgelere metastaz yapmalarına izin verir24,25,26. Hücrelerin fizyolojik seviyelerde sıvı kesme stresi yaşadığı sahte biyolojik bir ortam yaratarak, fizyolojik olarak alakalı ve hücre için yıkıcı olmayan bir süreç elde edilir. Uygulanan bu sıvı kesme gerilmelerine verilen hücresel tepkiler, hücre mekanik özelliklerini karakterize etmemizi sağlar.
Bu yazıda, uygulanan kesme stresi altında kanserli ve kanserli olmayan hücrelerin mekanik özellikleri ve davranışlarının kapsamlı bir şekilde incelenmesi için bir kesme testi protokolü sunulmaktadır. Hücreler dış kuvvetlere elastik ve viskoz bir şekilde tepki verir ve bu nedenle viskoelastik bir malzeme olarak idealize edilebilir3. Bu teknik şu şekilde kategorize edilir: (i) dağınık tek hücrelerin hücre kültürü, (ii) sıvı kesme gerilmesinin kontrollü uygulanması, (iii) in situ görüntüleme ve hücresel davranışın gözlemlenmesi (stres ve deformasyona karşı direnç dahil), (iv) deformasyonun derecesini belirlemek için hücrelerin gerinim analizi ve (v) tek hücrelerin viskoelastik özelliklerinin karakterizasyonu. Bu mekanik özellikleri ve davranışları sorgulayarak, karmaşık hücresel mekanobiyoloji ölçülebilir verilere damıtılabilir. Bu yöntemi özetleyen bir protokol, çeşitli malign ve malign olmayan hücre tiplerinin kataloglanmasına ve karşılaştırılmasına izin verir. Bu farklılıkların ölçülmesi, tanısal ve terapötik biyobelirteçler oluşturma potansiyeline sahiptir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Tek hücreli kesme testi için hazırlık
- Hücre kültürü
- 2 mL kültür ortamı içeren 35 mm x 10 mm Petri kabında yaklaşık 50.000 asılı tek hücreyi tohumlayın.
NOT: Hücre agregalarını parçalamak için tohumlamadan önce askıya alınmış hücreleri vorteks. - Hücreleri 37 ° C'de inkübe edin ve hücre bağlanması ve tam sitoiskelet protein oluşumu için 10 ila 48 saat arasında bekleyin.
NOT: Hücre agregasyonunu önlerken yeterli hücresel büyüme ve bağlanmayı sağlamak için hücresel bağlanma süresinin yanı sıra çoğalma ve büyüme oranlarını da göz önünde bulundurun. Bu parametreler hücre tipine göre değişir.
- 2 mL kültür ortamı içeren 35 mm x 10 mm Petri kabında yaklaşık 50.000 asılı tek hücreyi tohumlayın.
2. Kesme testi deneyi
- Kesme testi viskoz akış ortamının hazırlanması
- Hafif viskoz bir akış ortamı (0.015-0.02 Pa · s) sağlamak için, ağırlık ağırlığın% 0.05'ini ölçün ve kültür ortamına toksik olmayan ve alerjik olmayan metilselülozun (4 Pa · s) ekleyin.
- Homojen bir karışım sağlamak için, baz kültür ortamını manyetik bir karıştırıcı / sıcak plaka ile ~60-70 ° C'lik bir sıcaklıkta ~ 10-20 dakika önceden ısıtın. Ortamı sürekli karıştırırken, metilselüloz parçacıklarının pıhtılaşmasını önlemek için metilselülozu hızla dağılacak şekilde yavaşça ekleyin. Net bir ortam + selüloz çözeltisi sağlamak için bu işlemin ~ 15-24 saat devam etmesine izin verin.
NOT: Çözeltinin aşırı ısınmasından kaçının. - Akış ortamının viskozitesini ölçmek için, bir reometre kullanarak temsili akış ortamının ~ 0,5-1 mL'sini test edin. Okumadan sonra, akışkan viskozitesini belirleyin ve bu değeri, denklemi (2) kullanarak kayma gerilimini hesaplamak için kesme akışkanı ortamının (μ) viskozitesini temsil etmek için kullanın.
- Kesme aparatı kurulumu
- Viskoz kültür ortamının infüzyonu ve geri çekilmesi için programlanabilir bir şırınga pompasına bağlı çift şırıngadan (60 mL veya 100 mL) oluşan kesme tahlil sistemini kurun (Şekil 1).
- Her iki şırıngayı da 1/16 inç boru ve boru konektörleri aracılığıyla akış odasına takın.
- Akış yolu boyunca tek hücreler üzerinde kontrollü, düzgün bir akış sağlamak için kauçuk bir contayı sabitleyin (Şekil 1). Kauçuk conta, elde edilecek akış profiline (laminer veya türbülanslı) ve istenen gözlem alanına (örneğin, 22,5 mm uzunluk, 2,5 mm genişlik ve 0,254 mm yükseklik) bağlı olarak farklı boyutlarda gelir (Şekil 1).
- Pompayı, belirli bir hacimdeki sıvıyı (örneğin, 60 mL) belirlenen bir hızda (örneğin, 1 mL/dak) demlemek ve çekmek üzere programlayın ve ilgili şırıngaları seçin (örneğin, 60 mL).
NOT: Sıkışma veya arızayı önlemek için maksimum infüzyon ve geri çekme hacmi ön ayarlarını hesaba katın. Gerekli pompa kesme hızının hesaplanması için denklem (2)'yi kullanın (gerekli gerilim ve viskozitenin bilindiği varsayılarak).
- Ön kesme ayarı
- Şırıngayı hazırlanan viskoz akış ortamı ile doldurun.
- 60 veya 100 mL (veya gerektiğinde) viskoz akış ortamı ve boş bir 60 mL şırınga ile doldurulmuş şırıngayı programlanabilir şırınga pompasındaki ilgili yerlerine takın. Boru ve boru konektörleri aracılığıyla, her iki şırıngayı da akış odasına bağlayın.
- Tek hücrelerin kolayca tanımlanmasını ve akış odası ile Petri kabı arasında sabitlenmiş bir bağlantı olmasını sağlamak için, kauçuk contayı akış odasına takın.
- İlgilenilen hücreleri içeren Petri kabından hücre kültürü ortamını aspire edin.
- Ölü hücreleri ve gevşek bir şekilde tutturulmuş hücreleri fosfat tamponlu salin (PBS) kullanarak yıkayın.
- PBS'yi aspire edin.
- Akış haznesini ve kauçuk contayı (~34 mm x 9 mm) takılı hücreleri içeren Petri kabına (35 mm x 10 mm) takın ve sabitleyin.
- Takılı mikroakışkan akış odası + hücreleri, yüksek piksel değerlerine (genellikle 40x ila 63x büyütme arasında) yüksek kaliteli görüntüler elde etmek için yeterince yüksek bir mikroskop hedefi ve bir ekran monitörü ile kültürlenmiş bir tabak üzerine ters çevrilmiş bir mikroskop üzerine yerleştirin.
- Ekran monitöründeki mikroskop yazılımından canlı görüntü (bazı yazılımlarda hızlandırılmış çekim) seçeneğini belirleyin. PC'deki mikroskop yazılımının t (hızlandırılmış) işlevselliğe sahip olduğundan veya video kayıtları alabildiğinden emin olun.
- Mikroskop hedefine odaklanın, yeterli kontrast ve farklı hücre kenarları sağlayın. Bu, kesme sonrası görüntü analizi için gereklidir. Hücrelerin ekran monitöründe açıkça görülebildiğinden ve canlı görüntüler olduğundan emin olmak için mikroskop aşamasını hareket ettirin.
- Takılı akış odasının görüntüleme/akış yolu + Petri kabı (contanın akış odasına takılmasıyla oluşturulan alan/yol) içinde bir hücre veya birden fazla farklı hücre seçin.
- Kesme ve görüntüleme
- Sürekli düzgün bir akışı sürdürmek için, benzer infüzyon ve geri çekilme oranlarını seçin ve sıvının laminer akışını, genellikle 1 mL / dak ile 5 mL / dak arasında sağlayın. Düşük laminer akış rejimleri için, bir Reynold'un Re < 100 sayısını sağlayın.
- Kesme sıvısını (hazırlanan viskoz ortam) sürekli bir hızda enjekte etmek ve geri çekmek için kesme pompasında Çalıştır'a tıklayın. Sıvı infüzyonu sırasında kabarcık olmadığından emin olun, çünkü bu, hücreler üzerinde harici hesaplanmamış strese neden olabilir.
- İnfüze edilen kesme sıvısı mikroskop altında ilgili hücrelerle temas etmeden önce mikroskop yazılımında kayda tıklayarak bir video kaydetmeye başlayın.
- 7 dakika boyunca veya istenen strese maruz kalma süresi boyunca veya ilgilenilen hücre (ler) çanağın dibinden kesilene kadar kayıt yapmaya devam edin. Çalıştırma istenildiği gibi tamamlandığında mikroskop yazılımında kaydı durdur'u tıklatın.
- Kaydı kaydedin ve .tiff dosyaları olarak ayıklayın. Tercihen, kolay analiz için görüntüleri saniyede 1 kare hızında ayıklayın.
3. Veri işleme
- Dijital görüntü korelasyon prosedürü (görüntü analizi)
- Mikroskoptan kayıt bir video dosyası olarak çıkarıldıysa, görüntü çerçevelerine (tercihen .tiff dosya formatına) dönüştürün.
- Kesme testi kaydından elde edilen görüntüleri Davis 10.1.2 yazılımına (DIC yazılımı) aktararak, referans görüntünün her bir piksel bloğunu (alt küme) ilgili yeni görüntülerde (deforme olmuş görüntüler) konumlandırarak hücrenin doğal desenli yapılarının hareketini izleyin (Şekil 2).
- Optimize edilmiş bir korelasyon için, 31 x 31 piksellik bir alt küme boyutunu, 20 piksellik bir adım boyutunu (her bir alt kümenin deformasyon mesafesi) ve son görüntüye göre yeni bir görüntünün deformasyonunu izleyen diferansiyel iz seçeneğinin toplamını kullanın. Bu korelasyonun sonucu, MATLAB'da daha fazla analiz için .csv dosyası olarak dışa aktarılabilen bir gerinim zamanı grafiğidir (Şekil 3).
- Seçilen tek bir hücre için ilgilenilen bölgenin haritasını çıkarın. Deformasyonu izlemek için eşlenen hücre içindeki rasgele noktaları seçin. Hücre gibi düzensiz bir şekil için, hücrenin geometrisini haritalamak üzere çokgen maskesi kullanın.
- Eşlemeden sonra, gerinim ölçer ekle'yi tıklatarak ve tanımlanan hücresel sınır içindeki noktalarda bireysel gerinim ölçerleri çizerek analiz edilecek hücre üzerindeki belirli noktaları (çekirdek veya sitoplazma) seçin.
- Gerinim işlemeye başlamak ve gerinim ve zaman verilerini almak için Çalıştır'a tıklayın.
- Oluşturulan gerinim zamanı grafiğine çift tıklayın (veya sağ tıklayın) ve verileri elektronik tablo olarak dışa aktar'ı seçin.
4. Mekanik özellik karakterizasyonu
- Viskoelastik özellik karakterizasyonu
- DIC yazılımından gelen gerinim süresi verilerini içeren .csv dosyasını, MATLAB tarafından kolay okunabilirlik için ayrı bir klasöre kaydedin.
- MATLAB'ı çalıştırın ve elektronik tabloyu hücre hücre okuyan bir kod yazmak üzere bir düzenleyici sayfası açmak için düzenleyici sekmesine tıklayın.
- MATLAB yolunu (ilgili dosyaya erişen klasör yolu) çözümlenecek verileri içeren klasöre (örneğin, Kullanıcılar/Kullanıcı Adı/Masaüstü/veriler) erişecek şekilde değiştirin.
- MATLAB düzenleyicisi sayfasında, özelleştirilmiş kodu kullanarak elektronik tablo verilerine erişin. Örneğin: a1= xlsread('data','run1','A4:A183'), burada a1 tanımlayıcıyı temsil eder, xlsread .csv dosyasını okuyan MATLAB işlevidir (bu durumda elektronik tablo olarak), veri dosya adıdır, run1 sayfa adıdır ve A4:A183 analiz edilecek elektronik tablo verilerinin A hücresinde ilgilenilen veri aralığıdır. Tam bir uyum için, x ve y'yi analiz edin (sırasıyla zaman ve gerinim). Mesela:
a1=xlsread('veri','run1','A4:A183');
b1=xlsread('veri','run1','B4:B183');
a1 = x (zaman) ve b1 = y (gerinim). - MATLAB'de Uygulamalar | Eğri Fitter | Özel Denklem. Temsili özel denklemi temizleyin ve viskoelastik model denklemini [denklem (1)] girin, burada ε x değişkenini ve t y değişkenini temsil eder.
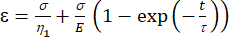 (1)
(1)
Burada, ε gerinimini temsil eder, σ kayma gerilmesini temsil eder, η1 viskoziteyi, E elastikiyeti, t zamanı ve τ , hücrenin birincil deformasyondan sonra orijinal şekline dönmesi için gereken maksimum süreyi karakterize eden gevşeme süresini temsil eder. τ =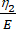 olarak ifade edilir, burada η2 , ikinci dashpot için ikincil viskozite terimidir (Şekil 4).
olarak ifade edilir, burada η2 , ikinci dashpot için ikincil viskozite terimidir (Şekil 4). - Özel denklem arabirimindeki viskoelastik parametrelere yeni değişkenleri yeniden atayın. (ε, η1, E, σ, t ve τ =
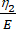 ) sırasıyla (x, a, b, K, y ve c) temsil edecektir. Burada, x ve y sırasıyla bağımsız ve bağımlı değişkenlerdir. Kayma gerilmesi (σ) denklem (2) kullanılarak belirlenebilir:
) sırasıyla (x, a, b, K, y ve c) temsil edecektir. Burada, x ve y sırasıyla bağımsız ve bağımlı değişkenlerdir. Kayma gerilmesi (σ) denklem (2) kullanılarak belirlenebilir: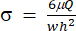 (2)
(2)
Burada, μ kesme sıvısı ortamının viskozitesini temsil eder, Q pompa akış hızıdır ve w ve h , sırasıyla Şekil 1C'de gösterilen akış kanalının genişliği ve yüksekliğidir. - Her veri kümesi için Zaman (a1) ve Gerinim (b1) seçmek üzere Veri Seç'e tıklayın.
- Otomatik Sığdır kutusu seçeneğinin işaretli olduğundan emin olun. Bu, veriler (x ve y) seçildiğinde sığdırmayı otomatik olarak çalıştırır.
- Sınır koşullarını sıkılaştırmak için montaj yöntemlerini seçin. Yöntemler kategorisi altındaki Gelişmiş Seçenekler'e tıklayın ve Doğrusal Olmayan En Küçük Kareler'i seçin. Sağlam'ın altında Kapalı'yı seçin ve Algoritma'nın altında Güven Bölgesi'ni seçin. Diğer tüm parametreleri olduğu gibi bırakın.
- Uydurma sonrası yeni değişkenler (a, b ve c) sırasıyla hücrenin viskoelastik özelliklerini, viskozitesini, elastikiyetini ve gevşeme süresini (η1, E, EQUAT) temsil eder (Şekil 5).
- Veri çıkışının viskoelastik modelin gerçek bir uyumu olarak kabul edilebilmesini sağlamak için uyumun yüksek bir R-kare değerini (R2 > %80) arayın (Şekil 3)
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
DIC ve viskoelastik bir model kullanılarak deformasyon analizi ile birleştirilen kesme testi protokolü, in vitro olarak tek bir hücrenin mekanik özelliklerini ölçmede başarılıdır. Bu yöntem, normal insan meme hücreleri (MCF-10A)3,4,9, daha az metastatik üçlü negatif meme kanseri hücreleri (MDA-MB-468)3, üçlü negatif meme kanseri hücreleri (MDA-MB-231)3, insan osteosarkom hücreleri
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Hücrelerin çevredeki mekanik mikro çevre ile etkileşimini ve mekanik gerilmelere tepkilerini simüle etmek için psödo-mekanobiyolojik bir ortam kurmayı içeren kesme testi yöntemi, desenleri kanserli hücre hatları arasında korunmuş fiziksel atipiye işaret eden bir hücresel mekanik özellikler kataloğu üretmiştir 3,4,5,7,8 . Bu yöntem, hücrel...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacağı rakip finansal çıkarları yoktur.
Teşekkürler
Yazarlar, bu tekniğe ilk öncülük eden Worcester Politeknik Enstitüsü'ndeki Soboyejo grubundan önceki araştırmacılara teşekkür ediyor: Dr. Yifang Cao, Jingjie Hu ve Vanessa Uzonwanne. Bu çalışma Ulusal Kanser Enstitüsü (NIH / NCI K22 CA258410 to MD) tarafından desteklenmiştir. Figürler BioRender.com ile oluşturulmuştur.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| CELL CULTURE | |||
| .25% Trypsin, 2.21 mM EDTA, 1x[-] sodium bicarbonate | Corning | 25-053-ci | For cellular detachment from substrate in cell culture |
| 15 mL Centrifuge tubes | Falcon by Corning | 05-527-90 | |
| 35 mm Petri dishes | Corning | 430165 | |
| 50 mL Centrifuge tubes | Falcon by Corning | 14-432-22 | |
| Centrifuge | any | For sterile cell culture | |
| Dulbecco's Modification of Eagle's Medium (DMEM) 1x | Corning | 10-013-cv | Or any other media for culturing cells. DMEM was used for culturing U87 cells |
| Gloves | any | For sterile cell culture | |
| Heracell Vios 160i CO2 Incubator | Thermo Scientific | 51033770 | For Incubation during cell culture |
| Hood | any | For sterile cell culture | |
| Micropipette | any | For sterile cell culture | |
| Micropipette tips | any | For sterile cell culture | |
| Microscope | Leica/any | For sterile cell culture | |
| Phosphate Buffered Saline without calcium and magnesium PBS, 1x | Corning | 21-040-CM | |
| Pipetman | any | For sterile cell culture | |
| Pipette tips | any | For sterile cell culture | |
| Precision GP 10 liquid incubator | Thermo Scientific | TSGP02 | |
| T25 Flask | Corning | 430639 | |
| T75 Flask | Corning | 430641U | |
| SHEAR ASSAY | |||
| 100 mL beaker | any | For creating DMEM + methyl cellulose viscous shear media | |
| DMEM | Corning | ||
| Flow chamber + rubber gasket | Glycotech | 31-001 | Circular Flow chamber Kit ( for 35 mm tissue culture dishes) |
| Hybrid Rheometer | HR-2 Discovery Hybrid Rheometer | For determination of shear fluid viscosity | |
| Magnetic stir bar | any | For creating DMEM + methyl cellulose viscous shear media | |
| Magnetic stir plate | any | For creating DMEM + methyl cellulose viscous shear media | |
| Methyl cellulose | any | To increase viscosity of DMEM in flow media | |
| Syringe Pump | KD Scientific Geminin 88 plus | 788088 | For programming fluid infusion and withdrawal |
| Syringes, tubing, and connectors | For shear apparatus setup | ||
| SOFTWARE | |||
| ABAQUS software | Simulia | ||
| Digitial Image Correlation software | LaVision, Germany | DAVIS 10.1.2 | |
| Imaging software | Leica/any microscope software | ||
| MATLAB | MATLAB | MATLAB_R2020B |
Referanslar
- Sethi, S., Ali, S., Philip, P. A., Sarkar, F. H. Clinical advances in molecular biomarkers for cancer diagnosis and therapy. International Journal of Molecular Sciences. 14 (7), 14771-14784 (2013).
- Runel, G., Lopez-Ramirez, N., Chlasta, J., Masse, I. Biomechanical properties of cancer cells. Cells. 10 (4), 887(2021).
- Hu, J., Zhou, Y., Obayemi, J. D., Du, J., Soboyejo, W. O. An investigation of the viscoelastic properties and the actin cytoskeletal structure of triple negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 86, 1-13 (2018).
- Onwudiwe, K., et al. Investigation of creep properties and the cytoskeletal structures of non-tumorigenic breast cells and triple-negative breast cancer cells. Journal of Biomedical Materials Research. Part A. 110 (5), 1004-1020 (2022).
- Ani, C. J., et al. A shear assay study of single normal/breast cancer cell deformation and detachment from poly-di-methyl-siloxane (PDMS) surfaces. Journal of the Mechanical Behavior of Biomedical Materials. 91, 76-90 (2019).
- Suresh, S. Biomechanics and biophysics of cancer cells. Acta Biomaterialia. 3 (4), 413-438 (2007).
- Cao, Y., et al. Investigation of the viscoelasticity of human osteosarcoma cells using a shear assay method. Journal of Materials Research. 21 (8), 1922-1930 (2006).
- Cao, Y. On the measurement of human osteosarcoma cell elastic modulus using shear assay experiments. Journal of Materials Science. Materials in Medicine. 18 (1), 103-109 (2007).
- Onwudiwe, K., et al. Actin cytoskeletal structure and the statistical variations of the mechanical properties of non-tumorigenic breast and triple-negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 119, 104505(2021).
- Kirmizis, D., Logothetidis, S. Atomic force microscopy probing in the measurement of cell mechanics. International Journal of Nanomedicine. 5, 137-145 (2010).
- Haase, K., Pelling, A. E. Investigating cell mechanics with atomic force microscopy. Journal of the Royal Society. Interface. 12 (104), 20140970(2015).
- Zhang, H., Liu, K. K. Optical tweezers for single cells. Journal of the Royal Society. Interface. 5 (24), 671-690 (2008).
- Peterman, E. J. G., Gittes, F., Schmidt, C. F. Laser-induced heating in optical traps. Biophysical Journal. 84, 1308-1316 (2003).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Evans, E., Yeung, A. Apparent viscosity and corticcal tension of blood granulocytes determined by micropipet aspiration. Biophysical Journal. 56 (1), 151-160 (1989).
- Van Vliet, K. J., Bao, G., Suresh, S. The biomechanics toolbox: experimental approaches for living cells and biomolecules. Acta Materialia. 51 (19), 5881-5905 (2003).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews. Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Choi, H. Y., et al. Hydrodynamic shear stress promotes epithelial-mesenchymal transition by downregulating ERK and GSK3beta activities. Breast Cancer Research. 21 (1), 6(2019).
- Northcott, J. M., Dean, I. S., Mouw, J. K., Weaver, V. M. Feeling stress: The mechanics of cancer progression and aggression. Frontiers in Cell and Developmental Biology. 6, 17(2018).
- Onwudiwe, K., Najera, J., Siri, S., Datta, M. Do tumor mechanical stresses promote cancer immune escape. Cells. 11 (23), 3840(2022).
- Heldin, C. H., Rubin, K., Pietras, K., Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nature Reviews. Cancer. 4 (10), 806-813 (2004).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Mao, B. H., Nguyen Thi, K. M., Tang, M. J., Kamm, R. D., Tu, T. Y. The interface stiffness and topographic feature dictate interfacial invasiveness of cancer spheroids. Biofabrication. 15 (1), (2023).
- Kashani, A. S., Packirisamy, M. Cancer cells optimize elasticity for efficient migration. Royal Society Open Science. 7 (10), 200747(2020).
- Riehl, B. D., Kim, E., Bouzid, T., Lim, J. Y. The role of microenvironmental cues and mechanical loading milieus in breast cancer cell progression and metastasis. Frontiers in Bioengineering and Biotechnology. 8, 608526(2021).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır