Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Protocolo de ensayo de cizallamiento para la determinación de las propiedades del material unicelular
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe la cuantificación de las propiedades mecánicas de líneas celulares cancerosas y no cancerosas in vitro. Las diferencias conservadas en la mecánica de las células cancerosas y normales pueden actuar como un biomarcador que puede tener implicaciones en el pronóstico y el diagnóstico.
Resumen
La biomecánica irregular es un sello distintivo de la biología del cáncer sujeto a un extenso estudio. Las propiedades mecánicas de una célula son similares a las de un material. La resistencia de una célula al estrés y la tensión, su tiempo de relajación y su elasticidad son propiedades que se pueden derivar y comparar con otros tipos de células. La cuantificación de las propiedades mecánicas de las células cancerosas (malignas) frente a las normales (no malignas) permite a los investigadores descubrir aún más los fundamentos biofísicos de esta enfermedad. Si bien se sabe que las propiedades mecánicas de las células cancerosas difieren consistentemente de las propiedades mecánicas de las células normales, falta un procedimiento experimental estándar para deducir estas propiedades de las células en cultivo.
Este documento describe un procedimiento para cuantificar las propiedades mecánicas de células individuales in vitro utilizando un ensayo de cizallamiento de fluidos. El principio detrás de este ensayo consiste en aplicar tensión de cizallamiento de fluido en una sola célula y monitorear ópticamente la deformación celular resultante a lo largo del tiempo. Las propiedades mecánicas celulares se caracterizan posteriormente mediante el análisis de correlación digital de imágenes (DIC) y el ajuste de un modelo viscoelástico apropiado a los datos experimentales generados a partir del análisis DIC. En general, el protocolo descrito aquí tiene como objetivo proporcionar un método más eficaz y específico para el diagnóstico de cánceres difíciles de tratar.
Introducción
El estudio de las diferencias biofísicas entre las células cancerosas y no cancerosas permite nuevas oportunidades diagnósticas y terapéuticas1. Comprender cómo las diferencias en biomecánica / mecanobiología contribuyen a la progresión tumoral y la resistencia al tratamiento revelará nuevas vías para la terapia dirigida y el diagnóstico temprano2.
Si bien se sabe que las propiedades mecánicas de las células cancerosas difieren de las células normales (por ejemplo, la viscoelasticidad de la membrana plasmática y la envoltura nuclear)3,4,5, faltan métodos robustos y reproducibles para medir estas propiedades en células vivas6. El método de ensayo de cizallamiento se utiliza para cuantificar las propiedades mecánicas de las células sometiendo células individuales a tensión de cizallamiento del fluido y analizando sus respuestas individuales y resistencia a la tensión aplicada 3,4,5,7,8,9. Aunque se han utilizado varios métodos y técnicas para caracterizar las propiedades mecánicas de células individuales, éstas tienden a afectar las propiedades del material celular i) perforando/dañando la membrana celular debido a la profundidad de indentación, geometrías complejas de la punta o rigidez del sustrato asociado con la microscopía de fuerza atómica (AFM)10,11, ii) induciendo fotodaño celular durante el atrapamiento óptico 12, 13, o iii) inducir estados complejos de estrés asociados a la aspiración de micropipetas14,15. Estos efectos externos están asociados con incertidumbres significativas en la precisión de las mediciones de viscoelasticidad celular 6,16,17.
Para abordar estas limitaciones, el método de ensayo de cizallamiento descrito aquí proporciona un enfoque altamente controlable y simple para simular el flujo fisiológico en el cuerpo sin afectar las propiedades del material celular en el proceso. Las tensiones de cizallamiento de fluidos en este ensayo representan tensiones mecánicas experimentadas por las células en el cuerpo, ya sea por fluidos dentro del intersticio tumoral o en la sangre durante la circulación18,19,20. Además, estas tensiones fluidas promueven diversos comportamientos malignos en las células cancerosas, incluyendo progresión, migración, metástasis y muerte celular 19,21,22,23 que varían entre células tumorigénicas y no tumorígenas. Además, las características mecánicas alteradas de las células cancerosas (es decir, a menudo son "más blandas" que las células normales que se encuentran dentro del mismo órgano) les permiten persistir en microambientes tumorales hostiles, invadir los tejidos normales circundantes y hacer metástasis a sitios distantes24,25,26. Al crear un entorno pseudobiológico donde las células experimentan niveles fisiológicos de estrés de cizallamiento del fluido, se logra un proceso que es fisiológicamente relevante y no destructivo para la célula. Las respuestas celulares a estas tensiones de cizallamiento de fluido aplicadas nos permiten caracterizar las propiedades mecánicas celulares.
Este documento proporciona un protocolo de ensayo de cizallamiento para el estudio exhaustivo de las propiedades mecánicas y el comportamiento de las células cancerosas y no cancerosas bajo estrés de cizallamiento aplicado. Las células responden a las fuerzas externas de manera elástica y viscosa y, por lo tanto, pueden idealizarse como un material viscoelástico3. Esta técnica se clasifica en: (i) cultivo celular de células individuales dispersas, (ii) aplicación controlada de esfuerzo cortante de fluido, (iii) imágenes in situ y observación del comportamiento celular (incluida la resistencia al estrés y la deformación), (iv) análisis de deformación de células para determinar el grado de deformación, y (v) caracterización de las propiedades viscoelásticas de células individuales. Al interrogar estas propiedades y comportamientos mecánicos, la mecanobiología celular compleja se puede destilar a datos cuantificables. Un protocolo que describe este método permite la catalogación y comparación entre varios tipos de células malignas y no malignas. La cuantificación de estas diferencias tiene el potencial de establecer biomarcadores diagnósticos y terapéuticos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparación para el ensayo de cizallamiento unicelular
- Cultivo celular
- Sembrar aproximadamente 50.000 células individuales suspendidas en una placa de Petri de 35 mm x 10 mm que contenga 2 ml de medios de cultivo.
NOTA: Vórtice las células suspendidas antes de la siembra para separar los agregados celulares. - Incubar las células a 37 °C y dejar entre 10 y 48 h para la unión celular y la formación completa de proteínas citoesqueléticas.
NOTA: Considere la duración de la unión celular, así como las tasas de proliferación y crecimiento, para garantizar un crecimiento y unión celular adecuados evitando la agregación celular. Estos parámetros varían según el tipo de célula.
- Sembrar aproximadamente 50.000 células individuales suspendidas en una placa de Petri de 35 mm x 10 mm que contenga 2 ml de medios de cultivo.
2. Experimento de ensayo de cizallamiento
- Preparación de medios de flujo viscoso de ensayo de cizallamiento
- Para asegurar un medio de flujo ligeramente viscoso (0.015-0.02 Pa·s), medir y agregar 0.05% en peso de metilcelulosa no tóxica y no alergénica (4 Pa·s) a los medios de cultivo.
- Para asegurar una mezcla homogénea, precaliente el medio de cultivo base durante ~10-20 min a una temperatura de ~60-70 °C con un agitador magnético/placa caliente. Mientras agita continuamente el medio, agregue suavemente la metilcelulosa de modo que se disperse rápidamente, para evitar la coagulación de las partículas de metilcelulosa. Permita que este proceso continúe durante ~ 15-24 h para garantizar una solución clara de medios + celulosa.
NOTA: Evite el calentamiento excesivo de la solución. - Para medir la viscosidad del medio de flujo, pruebe ~ 0.5-1 ml del medio de flujo representativo con un reómetro. A partir de la lectura, determine la viscosidad del fluido y utilice este valor para representar la viscosidad del medio fluido de corte (μ) para calcular la tensión de cizallamiento utilizando la ecuación (2).
- Configuración del aparato de corte
- Configure el sistema de ensayo de cizallamiento de jeringas duales (60 ml o 100 ml) conectadas a una bomba de jeringa programable para la infusión y extracción de los medios de cultivo viscosos (Figura 1).
- Conecte ambas jeringas a la cámara de flujo a través de tubos de 1/16 de pulgada y conectores de tubos.
- Sujete una junta de goma para proporcionar un flujo controlado y uniforme en celdas individuales a lo largo de la trayectoria de flujo (Figura 1). La junta de goma viene en diferentes tamaños dependiendo del perfil de flujo a alcanzar (laminar o turbulento) y el área de observación deseada (por ejemplo, longitud de 22.5 mm, ancho de 2.5 mm y altura de 0.254 mm) (Figura 1).
- Programe la bomba para infundir y extraer un cierto volumen de líquido (por ejemplo, 60 ml) a una velocidad designada (por ejemplo, 1 ml/min) y seleccione las jeringas correspondientes (por ejemplo, 60 ml).
NOTA: Tenga en cuenta los ajustes preestablecidos máximos de volumen de infusión y extracción para evitar atascos o mal funcionamiento. Utilice la ecuación (2) para el cálculo de la velocidad de cizallamiento de la bomba requerida (suponiendo que se conozcan la tensión y la viscosidad requeridas).
- Configuración previa al cizallamiento
- Llene la jeringa con el medio de flujo viscoso preparado.
- Conecte la jeringa, llena con 60 o 100 ml (o según sea necesario) de medios de flujo viscoso, y una jeringa vacía de 60 ml a sus respectivas ubicaciones en la bomba de jeringa programable. A través de tubos y conectores de tubos, conecte ambas jeringas a la cámara de flujo.
- Para garantizar una fácil identificación de celdas individuales y una conexión sujeta entre la cámara de flujo y la placa de Petri, conecte la junta de goma a la cámara de flujo.
- Aspirar los medios de cultivo celular de la placa de Petri que contiene las células de interés.
- Lave las células muertas y las células sueltas con solución salina tamponada con fosfato (PBS).
- Aspirar el PBS.
- Inserte y fije la cámara de flujo y la junta de goma (~34 mm x 9 mm) en la placa de Petri (35 mm x 10 mm) que contiene las celdas adheridas.
- Coloque la cámara de flujo microfluídico + células en un plato cultivado en un microscopio invertido, con un objetivo de microscopio lo suficientemente alto como para obtener imágenes de alta calidad con altos valores de píxeles (generalmente entre 40x y 63x aumento) y un monitor de visualización.
- Seleccione la opción de imagen en vivo (lapso de tiempo en algún software) del software del microscopio en el monitor de visualización. Asegúrese de que el software del microscopio en la PC tenga una funcionalidad t (lapso de tiempo) o pueda tomar grabaciones de video.
- Enfocar el objetivo del microscopio, asegurando un contraste adecuado y bordes de celda distintos. Esto es necesario para el análisis de imágenes después del cizallamiento. Mueva la etapa del microscopio para asegurarse de que las células sean claramente visibles en el monitor de la pantalla y sean imágenes en vivo.
- Seleccione una celda o varias celdas distintas dentro de la trayectoria de imagen/flujo de la cámara de flujo instalada + placa de Petri (el área/trayectoria creada por la instalación de la junta en la cámara de flujo).
- Cizalladura e imágenes
- Para mantener un flujo uniforme continuo, seleccione velocidades de infusión y extracción similares y asegure el flujo laminar del líquido, generalmente entre 1 ml / min y 5 ml / min. Para regímenes de flujo laminar bajos, asegúrese de que el número de Reynold de Re < 100.
- Haga clic en Ejecutar en la bomba de cizalla para inyectar y extraer el fluido de cizallamiento (medio viscoso preparado) a una velocidad continua. Asegúrese de que no haya burbujas durante la infusión de líquido, ya que esto podría introducir estrés externo no contabilizado en las células.
- Comience a grabar un video haciendo clic en grabar en el software del microscopio antes de que el líquido de cizallamiento infundido haga contacto con la(s) célula(s) de interés bajo el microscopio.
- Continúe grabando durante 7 minutos, o durante la duración deseada de la exposición al estrés, o hasta que la(s) cel(s) de interés corte el fondo del plato. Haga clic en detener grabación en el software del microscopio cuando la ejecución se complete como se desea.
- Guarde la grabación y extráigala como .tiff archivos. Preferiblemente, extraiga imágenes a 1 fotograma por segundo para facilitar el análisis.
3. Tratamiento de datos
- Procedimiento de correlación de imágenes digitales (análisis de imágenes)
- Si la grabación del microscopio se extrajo como un archivo de vídeo, conviértalo en fotogramas de imagen (preferiblemente .tiff formato de archivo).
- Importe las imágenes derivadas de la grabación del ensayo de cizallamiento al software Davis 10.1.2 (software DIC) para rastrear el movimiento de las estructuras con patrones naturales de la celda ubicando cada bloque de píxel (subconjunto) de la imagen de referencia en las nuevas imágenes respectivas (imágenes deformadas) (Figura 2).
- Para una correlación optimizada, utilice un tamaño de subconjunto de 31 x 31 píxeles, un tamaño de paso (distancia de deformación de cada subconjunto) de 20 píxeles y la suma de la opción de pista diferencial , que rastrea la deformación de una nueva imagen con respecto a la última imagen. El resultado de esta correlación es una gráfica de tiempo de deformación (Figura 3) que se puede exportar como un archivo .csv para su posterior análisis en MATLAB.
- Planifique la región de interés para una sola celda elegida. Seleccione puntos arbitrarios dentro de la celda asignada para realizar un seguimiento de la deformación. Para una forma irregular, como la celda, use una máscara de polígono para trazar la geometría de la celda.
- Después del mapeo, elija puntos específicos en la célula (núcleo o citoplasma) a analizar haciendo clic en agregar galgas extensométricas y dibujando galgas extensométricas individuales en puntos dentro del límite celular definido.
- Haga clic en Ejecutar para comenzar el procesamiento de la deformación y obtener datos de deformación frente al tiempo.
- Haga doble clic (o haga clic con el botón derecho) en el gráfico de tiempo de deformación generado y seleccione exportar datos como una hoja de cálculo.
4. Caracterización de propiedades mecánicas
- Caracterización de propiedades viscoelásticas
- Guarde el archivo .csv que contiene los datos de tiempo de deformación del software DIC en una carpeta separada para facilitar la lectura de MATLAB.
- Ejecute MATLAB y haga clic en la pestaña del editor para abrir una página de editor para escribir un código que lea la hoja de cálculo, celda por celda.
- Cambie la ruta de MATLAB (la ruta de la carpeta que accede al archivo de interés) para acceder a la carpeta que contiene los datos a analizar, por ejemplo, Usuarios / Nombre de usuario / Escritorio / datos.
- En la página del editor de MATLAB, acceda a los datos de la hoja de cálculo mediante el código personalizado. Por ejemplo: a1= xlsread('data','run1','A4:A183'), donde a1 representa el identificador, xlsread es la función de MATLAB que lee el archivo .csv (en este caso, como una hoja de cálculo), data es el nombre del archivo, run1 es el nombre de la hoja y A4:A183 es el rango de datos de interés en la celda A de los datos de la hoja de cálculo que se van a analizar. Para un ajuste completo, analice x e y (tiempo y tensión, respectivamente). Por ejemplo:
a1=xlsread('data','run1','A4:A183');
b1=xlsread('data','run1','B4:B183');
a1 = x (tiempo) y b1 = y (tensión). - En MATLAB, haga clic en Aplicaciones | Ajustador de curvas | Ecuación personalizada. Borre la ecuación personalizada representativa e introduzca la ecuación del modelo viscoelástico [ecuación (1)], donde ε representa la variable x y t representa la variable y.
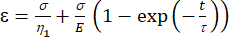 (1)
(1)
Aquí, ε representa la deformación, σ representa el esfuerzo cortante, η1 representa la viscosidad, E representa la elasticidad, t representa el tiempo y τ representa el tiempo de relajación, que caracteriza el tiempo máximo requerido para que la celda vuelva a su forma original después de la deformación primaria. Se expresa como τ =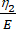 , donde η2 es el término de viscosidad secundario para el segundo guión (Figura 4).
, donde η2 es el término de viscosidad secundario para el segundo guión (Figura 4). - Reasignar nuevas variables a los parámetros viscoelásticos dentro de la interfaz de ecuaciones personalizadas. (ε, η1, E, σ, t y τ =
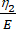 ) representará (x, a, b, K, y y c), respectivamente. Aquí, x e y son las variables independientes y dependientes, respectivamente. El esfuerzo cortante (σ) se puede determinar utilizando la ecuación (2):
) representará (x, a, b, K, y y c), respectivamente. Aquí, x e y son las variables independientes y dependientes, respectivamente. El esfuerzo cortante (σ) se puede determinar utilizando la ecuación (2):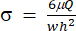 (2)
(2)
Aquí, μ representa la viscosidad del medio fluido de corte, Q es el caudal de la bomba, y w y h son el ancho y la altura del canal de flujo que se muestra en la Figura 1C, respectivamente. - Haga clic en Seleccionar datos para seleccionar el tiempo (a1) y la deformación (b1) para cada conjunto de datos.
- Asegúrese de que la opción de casilla Ajuste automático esté marcada. Esto ejecuta el ajuste automáticamente cuando se seleccionan datos (x e y).
- Seleccione los métodos de ajuste para ajustar las condiciones de contorno. Haga clic en Opciones avanzadas en la categoría Métodos y seleccione Mínimos cuadrados no lineales. En Robusto, seleccione Desactivado y, en Algoritmo, seleccione Región de confianza. Deje todos los demás parámetros como están.
- Las nuevas variables post-ajuste (a, b y c) representan las propiedades viscoelásticas, viscosidad, elasticidad y tiempo de relajación (η1, E, EQUAT), de la célula, respectivamente (Figura 5).
- Busque un valor R-cuadrado alto del ajuste (R2 > 80%) para asegurarse de que la salida de datos pueda considerarse un ajuste real del modelo viscoelástico (Figura 3)
Access restricted. Please log in or start a trial to view this content.
Resultados
El protocolo de ensayo de cizallamiento junto con el análisis de deformación utilizando DIC y un modelo viscoelástico tiene éxito en la cuantificación de las propiedades mecánicas de una sola célula in vitro. Este método se ha probado en líneas celulares humanas y murinas, incluidas células mamarias humanas normales (MCF-10A)3,4,9, células de cáncer de mama triple negativo menos metastásico (MDA-MB-468)3, células de cáncer de mama triple negativo (MDA-MB-231)3, células de ...
Access restricted. Please log in or start a trial to view this content.
Discusión
El método de ensayo de cizallamiento, que incluye la creación de un entorno pseudomecanobiológico para simular la interacción de las células con el microambiente mecánico circundante y sus respuestas a las tensiones mecánicas, ha producido un catálogo de propiedades mecánicas celulares, cuyos patrones muestran atipia física conservada entre líneas celulares cancerosas 3,4,5,7,8 ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen intereses financieros contrapuestos que revelar.
Agradecimientos
Los autores agradecen a los investigadores anteriores del grupo Soboyejo en el Instituto Politécnico de Worcester que fueron pioneros en esta técnica: los doctores Yifang Cao, Jingjie Hu y Vanessa Uzonwanne. Este trabajo fue apoyado por el Instituto Nacional del Cáncer (NIH/NCI K22 CA258410 a M.D.). Las figuras fueron creadas con BioRender.com.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| CELL CULTURE | |||
| .25% Trypsin, 2.21 mM EDTA, 1x[-] sodium bicarbonate | Corning | 25-053-ci | For cellular detachment from substrate in cell culture |
| 15 mL Centrifuge tubes | Falcon by Corning | 05-527-90 | |
| 35 mm Petri dishes | Corning | 430165 | |
| 50 mL Centrifuge tubes | Falcon by Corning | 14-432-22 | |
| Centrifuge | any | For sterile cell culture | |
| Dulbecco's Modification of Eagle's Medium (DMEM) 1x | Corning | 10-013-cv | Or any other media for culturing cells. DMEM was used for culturing U87 cells |
| Gloves | any | For sterile cell culture | |
| Heracell Vios 160i CO2 Incubator | Thermo Scientific | 51033770 | For Incubation during cell culture |
| Hood | any | For sterile cell culture | |
| Micropipette | any | For sterile cell culture | |
| Micropipette tips | any | For sterile cell culture | |
| Microscope | Leica/any | For sterile cell culture | |
| Phosphate Buffered Saline without calcium and magnesium PBS, 1x | Corning | 21-040-CM | |
| Pipetman | any | For sterile cell culture | |
| Pipette tips | any | For sterile cell culture | |
| Precision GP 10 liquid incubator | Thermo Scientific | TSGP02 | |
| T25 Flask | Corning | 430639 | |
| T75 Flask | Corning | 430641U | |
| SHEAR ASSAY | |||
| 100 mL beaker | any | For creating DMEM + methyl cellulose viscous shear media | |
| DMEM | Corning | ||
| Flow chamber + rubber gasket | Glycotech | 31-001 | Circular Flow chamber Kit ( for 35 mm tissue culture dishes) |
| Hybrid Rheometer | HR-2 Discovery Hybrid Rheometer | For determination of shear fluid viscosity | |
| Magnetic stir bar | any | For creating DMEM + methyl cellulose viscous shear media | |
| Magnetic stir plate | any | For creating DMEM + methyl cellulose viscous shear media | |
| Methyl cellulose | any | To increase viscosity of DMEM in flow media | |
| Syringe Pump | KD Scientific Geminin 88 plus | 788088 | For programming fluid infusion and withdrawal |
| Syringes, tubing, and connectors | For shear apparatus setup | ||
| SOFTWARE | |||
| ABAQUS software | Simulia | ||
| Digitial Image Correlation software | LaVision, Germany | DAVIS 10.1.2 | |
| Imaging software | Leica/any microscope software | ||
| MATLAB | MATLAB | MATLAB_R2020B |
Referencias
- Sethi, S., Ali, S., Philip, P. A., Sarkar, F. H. Clinical advances in molecular biomarkers for cancer diagnosis and therapy. International Journal of Molecular Sciences. 14 (7), 14771-14784 (2013).
- Runel, G., Lopez-Ramirez, N., Chlasta, J., Masse, I. Biomechanical properties of cancer cells. Cells. 10 (4), 887(2021).
- Hu, J., Zhou, Y., Obayemi, J. D., Du, J., Soboyejo, W. O. An investigation of the viscoelastic properties and the actin cytoskeletal structure of triple negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 86, 1-13 (2018).
- Onwudiwe, K., et al. Investigation of creep properties and the cytoskeletal structures of non-tumorigenic breast cells and triple-negative breast cancer cells. Journal of Biomedical Materials Research. Part A. 110 (5), 1004-1020 (2022).
- Ani, C. J., et al. A shear assay study of single normal/breast cancer cell deformation and detachment from poly-di-methyl-siloxane (PDMS) surfaces. Journal of the Mechanical Behavior of Biomedical Materials. 91, 76-90 (2019).
- Suresh, S. Biomechanics and biophysics of cancer cells. Acta Biomaterialia. 3 (4), 413-438 (2007).
- Cao, Y., et al. Investigation of the viscoelasticity of human osteosarcoma cells using a shear assay method. Journal of Materials Research. 21 (8), 1922-1930 (2006).
- Cao, Y. On the measurement of human osteosarcoma cell elastic modulus using shear assay experiments. Journal of Materials Science. Materials in Medicine. 18 (1), 103-109 (2007).
- Onwudiwe, K., et al. Actin cytoskeletal structure and the statistical variations of the mechanical properties of non-tumorigenic breast and triple-negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 119, 104505(2021).
- Kirmizis, D., Logothetidis, S. Atomic force microscopy probing in the measurement of cell mechanics. International Journal of Nanomedicine. 5, 137-145 (2010).
- Haase, K., Pelling, A. E. Investigating cell mechanics with atomic force microscopy. Journal of the Royal Society. Interface. 12 (104), 20140970(2015).
- Zhang, H., Liu, K. K. Optical tweezers for single cells. Journal of the Royal Society. Interface. 5 (24), 671-690 (2008).
- Peterman, E. J. G., Gittes, F., Schmidt, C. F. Laser-induced heating in optical traps. Biophysical Journal. 84, 1308-1316 (2003).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Evans, E., Yeung, A. Apparent viscosity and corticcal tension of blood granulocytes determined by micropipet aspiration. Biophysical Journal. 56 (1), 151-160 (1989).
- Van Vliet, K. J., Bao, G., Suresh, S. The biomechanics toolbox: experimental approaches for living cells and biomolecules. Acta Materialia. 51 (19), 5881-5905 (2003).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews. Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Choi, H. Y., et al. Hydrodynamic shear stress promotes epithelial-mesenchymal transition by downregulating ERK and GSK3beta activities. Breast Cancer Research. 21 (1), 6(2019).
- Northcott, J. M., Dean, I. S., Mouw, J. K., Weaver, V. M. Feeling stress: The mechanics of cancer progression and aggression. Frontiers in Cell and Developmental Biology. 6, 17(2018).
- Onwudiwe, K., Najera, J., Siri, S., Datta, M. Do tumor mechanical stresses promote cancer immune escape. Cells. 11 (23), 3840(2022).
- Heldin, C. H., Rubin, K., Pietras, K., Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nature Reviews. Cancer. 4 (10), 806-813 (2004).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Mao, B. H., Nguyen Thi, K. M., Tang, M. J., Kamm, R. D., Tu, T. Y. The interface stiffness and topographic feature dictate interfacial invasiveness of cancer spheroids. Biofabrication. 15 (1), (2023).
- Kashani, A. S., Packirisamy, M. Cancer cells optimize elasticity for efficient migration. Royal Society Open Science. 7 (10), 200747(2020).
- Riehl, B. D., Kim, E., Bouzid, T., Lim, J. Y. The role of microenvironmental cues and mechanical loading milieus in breast cancer cell progression and metastasis. Frontiers in Bioengineering and Biotechnology. 8, 608526(2021).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados