需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于测定单细胞材料特性的剪切测定方案
* 这些作者具有相同的贡献
摘要
该协议概述了 体外癌性和非癌性细胞系的机械特性的定量。癌细胞和正常细胞力学的保守差异可以作为生物标志物,可能对预后和诊断产生影响。
摘要
不规则生物力学是癌症生物学的标志,需要广泛研究。电池的机械性能与材料的机械性能相似。细胞对压力和应变的抵抗力、弛豫时间和弹性都是可以得出并与其他类型的细胞进行比较的特性。量化癌细胞(恶性)与正常(非恶性)细胞的机械特性使研究人员能够进一步揭示这种疾病的生物物理基础。虽然已知癌细胞的机械性能始终与正常细胞的机械性能不同,但缺乏从培养细胞中推断出这些特性的标准实验程序。
本文概述了使用流体剪切测定法在 体外量化 单细胞机械性能的程序。该测定背后的原理涉及将流体剪切应力施加到单个细胞上,并随着时间的推移光学监测由此产生的细胞变形。随后使用数字图像相关(DIC)分析表征细胞机械性能,并将适当的粘弹性模型拟合到DIC分析生成的实验数据中。总体而言,此处概述的方案旨在为诊断难以治疗的癌症提供更有效和有针对性的方法。
引言
研究癌细胞和非癌细胞之间的生物物理差异提供了新的诊断和治疗机会1。了解生物力学/机械生物学的差异如何影响肿瘤进展和治疗耐药性,将揭示靶向治疗和早期诊断的新途径2。
虽然已知癌细胞的机械性能与正常细胞不同(例如,质膜和核包膜的粘弹性)3,4,5,但缺乏在活细胞中测量这些特性的稳健且可重复的方法6。剪切测定方法用于量化细胞的机械性能,方法是使单个细胞承受流体剪切应力并分析其个体响应和对施加应力的抵抗力3,4,5,7,8,9。尽管已经使用了几种方法和技术来表征单个细胞的机械性能,但这些方法和技术往往会通过以下方式影响细胞材料性能:i)由于压痕深度,复杂的尖端几何形状或与原子力显微镜(AFM)相关的基板刚度而穿孔/损坏细胞膜10,11,ii)在光学捕获期间诱导细胞光损伤12, 13或iii)诱导与微量移液器抽吸相关的复杂应力状态14,15。这些外部效应与细胞粘弹性测量精度的显著不确定性有关6,16,17。
为了解决这些限制,这里描述的剪切测定方法提供了一种高度可控且简单的方法来模拟体内的生理流动,而不会影响过程中的细胞材料特性。该测定中的流体剪切应力表示体内细胞在循环过程中通过肿瘤间质内的液体或血液中的液体所经历的机械应力18,19,20。此外,这些流体应激促进癌细胞中的各种恶性行为,包括进展,迁移,转移和细胞死亡19,21,22,23,这些行为在致瘤细胞和非致瘤细胞之间有所不同。此外,癌细胞改变的机械特征(即,它们通常比同一器官中发现的正常细胞"更软")使它们能够在敌对的肿瘤微环境中持续存在,侵入周围的正常组织,并转移到远处24,25,26。通过创造一个伪生物环境,使细胞经历生理水平的流体剪切应力,实现了生理相关且对细胞不具有破坏性的过程。细胞对这些施加的流体剪切应力的反应使我们能够表征细胞的机械性能。
本文为广泛研究施加剪切应力下癌细胞和非癌细胞的力学性能和行为提供了一种剪切测定方案。细胞以弹性和粘性的方式响应外力,因此可以理想化为粘弹性材料3。该技术分为:(i)分散的单细胞的细胞培养,(ii)流体剪切应力的受控应用,(iii)细胞行为的 原位 成像和观察(包括抗应力和变形),(iv)细胞应变分析以确定变形程度,以及(v)表征单个细胞的粘弹性特性。通过研究这些机械特性和行为,可以将复杂的细胞力学生物学提炼为可量化的数据。概述该方法的方案允许对各种恶性和非恶性细胞类型进行编目和比较。量化这些差异有可能建立诊断和治疗生物标志物。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 单细胞剪切测定的准备
- 细胞培养
- 在含有 2 mL 培养基的 35 mm x 10 mm 培养皿中接种约 50,000 个悬浮单细胞。
注意:在接种前涡旋悬浮细胞以分解细胞聚集体。 - 将细胞在37°C孵育,并允许10至48小时用于细胞附着和完整的细胞骨架蛋白形成。
注意:考虑细胞附着的持续时间,以及增殖和生长速率,以确保足够的细胞生长和附着,同时避免细胞聚集。这些参数因细胞类型而异。
- 在含有 2 mL 培养基的 35 mm x 10 mm 培养皿中接种约 50,000 个悬浮单细胞。
2. 剪切测定实验
- 剪切测定粘性流动介质的制备
- 为确保略微粘稠的流动培养基(0.015-0.02 Pa·s),测量并向培养基中加入0.05 wt%的无毒无过敏性甲基纤维素(4 Pa·s)。
- 为确保混合均匀,用磁力搅拌器/热板在~60-70°C的温度下预热基础培养基~10-20分钟。在不断搅拌介质的同时,轻轻加入甲基纤维素,使其快速分散,以避免甲基纤维素颗粒凝结。让此过程持续~15-24小时,以确保培养基+纤维素的澄清溶液。
注意:避免溶液过热。 - 要测量流动介质的粘度,请使用流变仪测试 ~0.5-1 mL 的代表性流动介质。从读数中,确定流体粘度并利用该值表示剪切流体介质的粘度(μ),以使用公式(2)计算剪切应力。
- 剪切设备设置
- 设置连接到可编程注射泵的双注射器(60 mL或100 mL)的剪切测定系统,用于输注和取出粘性培养基(图1)。
- 通过 1/16 英寸管路和管路连接器 将 两个注射器连接到流动室。
- 拧紧橡胶垫圈,沿流路在单个细胞上提供受控、均匀的流动(图 1)。橡胶垫圈有不同的尺寸,具体取决于要达到的流动曲线(层流或湍流)和所需的观察区域(例如,长度为 22.5 mm、宽度为 2.5 mm 和高度为 0.254 mm)(图 1)。
- 对泵进行编程,使其以指定的速率(例如 1 mL/min)输注和抽出一定体积的液体(例如 60 mL),并选择相应的注射器(例如 60 mL)。
注意:考虑最大输液量和出液量预设,以避免卡住或故障。使用公式(2)计算所需的泵剪切速率(假设所需的应力和粘度已知)。
- 预剪切设置
- 用准备好的粘性流动介质填充注射器。
- 将装有 60 或 100 mL(或根据需要)粘性流动介质的注射器和空的 60 mL 注射器连接到可编程注射泵上的相应位置。 通过 管道和管道连接器,将两个注射器连接到流动室。
- 为了确保易于识别单个细胞以及流动室和培养皿之间的固定连接,请将橡胶垫圈连接到流动室。
- 从含有目标细胞的培养皿中吸出细胞培养基。
- 使用磷酸盐缓冲盐水(PBS)洗去死细胞和松散附着的细胞。
- 吸出 PBS。
- 将流动室和橡胶垫圈(~34 mm x 9 mm)插入并固定到含有附着细胞的培养皿(35 mm x 10 mm)上。
- 将安装的微流体流动室+细胞放在培养皿上倒置显微镜上,显微镜物镜足够高以获得具有高像素值(通常在 40 倍至 63 倍放大倍率之间)的高质量图像和显示器。
- 从显示器上的显微镜软件中选择 实时图像 (在某些软件上是延时摄影)选项。确保PC上的显微镜软件具有t(延时)功能或可以进行视频录制。
- 聚焦显微镜物镜,确保足够的对比度和清晰的细胞边缘。这对于剪切后的图像分析是必要的。移动显微镜载物台,以确保细胞在显示器上清晰可见并且是实时图像。
- 在安装的流动室+培养皿(通过将垫圈安装到流动室而形成的区域/路径)的成像/流路中选择一个或多个不同的细胞。
- 剪切和成像
- 为了保持连续的均匀流动,请选择相似的输注和取出速率,并确保液体的层流,通常在 1 mL/ min 和 5 mL/min 之间。对于低层流状态,请确保雷诺数 Re < 100。
- 单击剪切泵上的 "运行 ",以连续速率注入和抽出剪切流体(制备的粘性介质)。确保在液体输注过程中没有气泡,因为这可能会对细胞造成外部无法解释的压力。
- 在注入的剪切液与显微镜下感兴趣的细胞接触之前,通过单击显微镜软件上的录制开始 录制 视频。
- 继续记录7分钟,或所需的压力暴露持续时间,或直到感兴趣的细胞从培养皿底部剪切下来。根据需要完成运行后,单击显微镜软件上的 停止记录 。
- 保存录音并提取为 .tiff文件。优选地,以 每秒1帧 的速度提取图像以进行轻松分析。
3. 数据处理
- 数字图像相关程序(图像分析)
- 如果从显微镜中提取的记录是作为视频文件提取的,请将其转换为图像帧(最好.tiff文件格式)。
- 将从剪切测定记录中获得的图像导入Davis 10.1.2软件(DIC软件),通过在相应的新图像(变形图像)中定位参考图像的每个像素块(子集)来跟踪细胞自然图案结构的运动(图2)。
- 为了优化相关性,请使用 31 x 31 像素的子集大小、 20 像素的步长(每个子集的变形距离)以及 差分轨迹选项的总和 ,该选项跟踪新图像相对于最后一个图像的变形。这种相关性的结果是一个应变时间图(图 3),可以导出为.csv文件,以便在 MATLAB 中进行进一步分析。
- 绘制出所选单个像元的感兴趣区域。选择映射单元格内的任意点以跟踪变形。对于不规则形状(如单元格),请使用 多边形蒙版 映射单元格的几何图形。
- 映射后,通过单击添加应变片并在定义的细胞边界内的点处绘制单个 应变片 ,选择要分析的细胞(细胞核或细胞质)上的特定点。
- 单击 "运行 "开始应变处理并获取应变与时间的数据。
- 双击(或右键单击)生成的应变时间图,然后选择 将数据导出为电子表格。
4. 机械性能表征
- 粘弹性特性表征
- 将包含DIC软件应变时间数据的.csv文件保存在单独的文件夹中,以便MATLAB轻松读取。
- 运行 MATLAB 并单击编辑器选项卡以打开 编辑器 页面以编写逐个单元格读取电子表格的代码。
- 更改 MATLAB 路径(访问感兴趣文件的文件夹路径)以访问包含要分析的数据的文件夹,例如 用户/用户名/桌面/数据。
- 在 MATLAB 编辑器页面上,使用自定义代码访问电子表格数据。例如:a1= xlsread('data','run1','A4:A183'),其中 a1 表示标识符,xlsread 是读取.csv文件的 MATLAB 函数(在本例中为电子表格),数据是文件名,run1 是工作表名称,A4:A183 是要分析的电子表格数据的单元格 A 中感兴趣的数据范围。 对于完全拟合,请分析 x 和 y(分别为时间和应变)。例如:
a1=xlsread('data','run1','A4:A183');
b1=xlsread('data','run1','B4:B183');
a1 = x(时间),b1 = y(应变)。 - 在 MATLAB 中,单击" 应用程序 |曲线拟合器 |自定义公式。清除具有代表性的自定义方程并输入粘弹性模型方程 [方程 (1)],其中 ε 表示 x 变量,t 表示 y 变量。
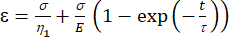 (1)
(1)
这里,ε表示应变,σ表示剪切应力,η1 表示粘度,E表示弹性,t表示时间,τ 表示松弛时间,表征细胞在初级变形后恢复其原始形状所需的最长时间。它表示为 τ =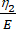 ,其中 η2 是第二个仪表盘的二级粘度项(图 4)。
,其中 η2 是第二个仪表盘的二级粘度项(图 4)。 - 将新变量重新分配给自定义方程接口中的粘弹性参数。(ε、 η1、E、σ、t 和 τ =
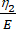 )将分别表示 (x、a、b、K、y 和 c)。在这里,x 和 y 分别是自变量和因变量。剪切应力(σ)可以使用公式(2)确定:
)将分别表示 (x、a、b、K、y 和 c)。在这里,x 和 y 分别是自变量和因变量。剪切应力(σ)可以使用公式(2)确定: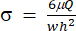 (二)
(二)
这里,μ表示剪切流体介质的粘度,Q是泵的流量, w 和 h 分别是 图1C所示的流道的宽度和高度。 - 单击"选择数据"以选择每组数据的时间 (a1) 和应变 (b1)。
- 确保选中" 自动调整"框选项 。这将在选择数据(x 和 y)时自动运行拟合。
- 选取拟合方法以收紧边界条件。单击"方法"类别下的"高级选项",然后选择"非线性最小二乘法"。在"可靠"下,选择"关闭",在"算法"下,选择"信任区域"。将所有其他参数保留原样。
- 拟合后的新变量(a、b 和 c)分别表示细胞的粘弹性、粘度、弹性和松弛时间(η1、E、EQUAT)(图 5)。
- 寻找拟合的高 R 平方值(R2 > 80%),以确保数据输出可以被视为粘弹性模型的真实拟合(图 3)
Access restricted. Please log in or start a trial to view this content.
结果
剪切测定方案与使用 DIC 和粘弹性模型的变形分析相结合,成功地在体外量化了单个细胞的机械性能。该方法已在人和鼠细胞系上进行了测试,包括正常人乳腺细胞(MCF-10A)3,4,9,转移性较小的三阴性乳腺癌细胞(MDA-MB-468)3,三阴性乳腺癌细胞(MDA-MB-231)3,人骨肉瘤细胞7,8以及最近的胶质母细胞瘤细...
Access restricted. Please log in or start a trial to view this content.
讨论
剪切测定方法,包括建立一个伪机械生物学环境来模拟细胞与周围机械微环境的相互作用及其对机械应力的反应,已经产生了细胞力学性能目录,其模式显示了癌细胞系中保守的物理异型性3,4,5,7,8.该方法结合了对基本流体力学和物理学的理解,以表征细胞的独特机械性能,?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有相互竞争的经济利益需要披露。
致谢
作者感谢伍斯特理工学院Soboyejo小组的先前研究人员,他们首先开创了这项技术:Yifang Cao博士,Jingjie Hu博士和Vanessa Uzonwanne博士。这项工作得到了美国国家癌症研究所(NIH / NCI K22 CA258410至医学博士)的支持。人物是用 BioRender.com 创造的。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| CELL CULTURE | |||
| .25% Trypsin, 2.21 mM EDTA, 1x[-] sodium bicarbonate | Corning | 25-053-ci | For cellular detachment from substrate in cell culture |
| 15 mL Centrifuge tubes | Falcon by Corning | 05-527-90 | |
| 35 mm Petri dishes | Corning | 430165 | |
| 50 mL Centrifuge tubes | Falcon by Corning | 14-432-22 | |
| Centrifuge | any | For sterile cell culture | |
| Dulbecco's Modification of Eagle's Medium (DMEM) 1x | Corning | 10-013-cv | Or any other media for culturing cells. DMEM was used for culturing U87 cells |
| Gloves | any | For sterile cell culture | |
| Heracell Vios 160i CO2 Incubator | Thermo Scientific | 51033770 | For Incubation during cell culture |
| Hood | any | For sterile cell culture | |
| Micropipette | any | For sterile cell culture | |
| Micropipette tips | any | For sterile cell culture | |
| Microscope | Leica/any | For sterile cell culture | |
| Phosphate Buffered Saline without calcium and magnesium PBS, 1x | Corning | 21-040-CM | |
| Pipetman | any | For sterile cell culture | |
| Pipette tips | any | For sterile cell culture | |
| Precision GP 10 liquid incubator | Thermo Scientific | TSGP02 | |
| T25 Flask | Corning | 430639 | |
| T75 Flask | Corning | 430641U | |
| SHEAR ASSAY | |||
| 100 mL beaker | any | For creating DMEM + methyl cellulose viscous shear media | |
| DMEM | Corning | ||
| Flow chamber + rubber gasket | Glycotech | 31-001 | Circular Flow chamber Kit ( for 35 mm tissue culture dishes) |
| Hybrid Rheometer | HR-2 Discovery Hybrid Rheometer | For determination of shear fluid viscosity | |
| Magnetic stir bar | any | For creating DMEM + methyl cellulose viscous shear media | |
| Magnetic stir plate | any | For creating DMEM + methyl cellulose viscous shear media | |
| Methyl cellulose | any | To increase viscosity of DMEM in flow media | |
| Syringe Pump | KD Scientific Geminin 88 plus | 788088 | For programming fluid infusion and withdrawal |
| Syringes, tubing, and connectors | For shear apparatus setup | ||
| SOFTWARE | |||
| ABAQUS software | Simulia | ||
| Digitial Image Correlation software | LaVision, Germany | DAVIS 10.1.2 | |
| Imaging software | Leica/any microscope software | ||
| MATLAB | MATLAB | MATLAB_R2020B |
参考文献
- Sethi, S., Ali, S., Philip, P. A., Sarkar, F. H. Clinical advances in molecular biomarkers for cancer diagnosis and therapy. International Journal of Molecular Sciences. 14 (7), 14771-14784 (2013).
- Runel, G., Lopez-Ramirez, N., Chlasta, J., Masse, I. Biomechanical properties of cancer cells. Cells. 10 (4), 887(2021).
- Hu, J., Zhou, Y., Obayemi, J. D., Du, J., Soboyejo, W. O. An investigation of the viscoelastic properties and the actin cytoskeletal structure of triple negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 86, 1-13 (2018).
- Onwudiwe, K., et al. Investigation of creep properties and the cytoskeletal structures of non-tumorigenic breast cells and triple-negative breast cancer cells. Journal of Biomedical Materials Research. Part A. 110 (5), 1004-1020 (2022).
- Ani, C. J., et al. A shear assay study of single normal/breast cancer cell deformation and detachment from poly-di-methyl-siloxane (PDMS) surfaces. Journal of the Mechanical Behavior of Biomedical Materials. 91, 76-90 (2019).
- Suresh, S. Biomechanics and biophysics of cancer cells. Acta Biomaterialia. 3 (4), 413-438 (2007).
- Cao, Y., et al. Investigation of the viscoelasticity of human osteosarcoma cells using a shear assay method. Journal of Materials Research. 21 (8), 1922-1930 (2006).
- Cao, Y. On the measurement of human osteosarcoma cell elastic modulus using shear assay experiments. Journal of Materials Science. Materials in Medicine. 18 (1), 103-109 (2007).
- Onwudiwe, K., et al. Actin cytoskeletal structure and the statistical variations of the mechanical properties of non-tumorigenic breast and triple-negative breast cancer cells. Journal of the Mechanical Behavior of Biomedical Materials. 119, 104505(2021).
- Kirmizis, D., Logothetidis, S. Atomic force microscopy probing in the measurement of cell mechanics. International Journal of Nanomedicine. 5, 137-145 (2010).
- Haase, K., Pelling, A. E. Investigating cell mechanics with atomic force microscopy. Journal of the Royal Society. Interface. 12 (104), 20140970(2015).
- Zhang, H., Liu, K. K. Optical tweezers for single cells. Journal of the Royal Society. Interface. 5 (24), 671-690 (2008).
- Peterman, E. J. G., Gittes, F., Schmidt, C. F. Laser-induced heating in optical traps. Biophysical Journal. 84, 1308-1316 (2003).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Evans, E., Yeung, A. Apparent viscosity and corticcal tension of blood granulocytes determined by micropipet aspiration. Biophysical Journal. 56 (1), 151-160 (1989).
- Van Vliet, K. J., Bao, G., Suresh, S. The biomechanics toolbox: experimental approaches for living cells and biomolecules. Acta Materialia. 51 (19), 5881-5905 (2003).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews. Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Choi, H. Y., et al. Hydrodynamic shear stress promotes epithelial-mesenchymal transition by downregulating ERK and GSK3beta activities. Breast Cancer Research. 21 (1), 6(2019).
- Northcott, J. M., Dean, I. S., Mouw, J. K., Weaver, V. M. Feeling stress: The mechanics of cancer progression and aggression. Frontiers in Cell and Developmental Biology. 6, 17(2018).
- Onwudiwe, K., Najera, J., Siri, S., Datta, M. Do tumor mechanical stresses promote cancer immune escape. Cells. 11 (23), 3840(2022).
- Heldin, C. H., Rubin, K., Pietras, K., Ostman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nature Reviews. Cancer. 4 (10), 806-813 (2004).
- Krog, B. L., Henry, M. D. Biomechanics of the circulating tumor cell microenvironment. Advances in Experimental Medicine and Biology. 1092, 209-233 (2018).
- Moose, D. L., et al. Cancer cells resist mechanical destruction in circulation via RhoA/actomyosin-dependent mechano-adaptation. Cell Reports. 30 (11), 3864-3874 (2020).
- Mao, B. H., Nguyen Thi, K. M., Tang, M. J., Kamm, R. D., Tu, T. Y. The interface stiffness and topographic feature dictate interfacial invasiveness of cancer spheroids. Biofabrication. 15 (1), (2023).
- Kashani, A. S., Packirisamy, M. Cancer cells optimize elasticity for efficient migration. Royal Society Open Science. 7 (10), 200747(2020).
- Riehl, B. D., Kim, E., Bouzid, T., Lim, J. Y. The role of microenvironmental cues and mechanical loading milieus in breast cancer cell progression and metastasis. Frontiers in Bioengineering and Biotechnology. 8, 608526(2021).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。