A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في المختبر رسم الخرائط الكيميائية لهياكل الحمض النووي G-quadruplex بواسطة Bis-3-chloropiperidines
In This Article
Summary
Bis-3-chloropiperidines (B-CePs) هي مجسات كيميائية مفيدة لتحديد وتوصيف هياكل G-quadruplex في قوالب الحمض النووي في المختبر. يفصل هذا البروتوكول الإجراء الخاص بإجراء تفاعلات التحقيق مع B-CePs وحل منتجات التفاعل عن طريق الرحلان الكهربائي عالي الدقة لهلام بولي أكريلاميد عالي الدقة.
Abstract
G-quadruplexes (G4s) هي هياكل الحمض النووي غير المتعارف عليها بيولوجيا والتي تلعب دورا مهما في التعبير الجيني والأمراض ، وتمثل أهدافا علاجية مهمة. هناك حاجة إلى طرق يمكن الوصول إليها لتوصيف الحمض النووي في المختبر ضمن تسلسلات تشكيل G-quadruplex المحتملة (PQSs). B-CePs هي فئة من عوامل الألكلة التي أثبتت أنها مجسات كيميائية مفيدة للتحقيق في البنية ذات الترتيب الأعلى للأحماض النووية. تصف هذه الورقة مقايسة رسم خرائط كيميائية جديدة تستغل التفاعل النوعي ل B-CePs مع N7 من الجوانين ، متبوعا بالانقسام المباشر في Gs الألكيلية.
وبالتحديد ، لتمييز طيات G4 عن أشكال الحمض النووي غير المطوية ، نستخدم B-CeP 1 لفحص أبتامير المرتبط بالثرومبين (TBA) ، وهو حمض نووي 15 مير قادر على تحمل ترتيب G4. ينتج عن تفاعل الجوانين المستجيب ل B-CeP مع B-CeP 1 منتجات يمكن حلها عن طريق الرحلان الكهربائي عالي الدقة لهلام بولي أكريلاميد (PAGE) على مستوى نيوكليوتيد واحد عن طريق تحديد موقع مقرب الألكلة الفردي وانقسام حبلا الحمض النووي في الجوانين الألكيل. يعد رسم الخرائط باستخدام B-CePs أداة بسيطة وقوية للتوصيف المختبري لتسلسلات الحمض النووي المكونة ل G-quadruplex ، مما يتيح تحديد الموقع الدقيق للجوانين المشاركة في تكوين G-tetrads.
Introduction
بالإضافة إلى الحلزون المزدوج النموذجي Watson-Crick ، يمكن للأحماض النووية اعتماد هياكل ثانوية مختلفة ، مثل الشكل البديل G-quadruplex (G4) ، بسبب تسلسلاتها الغنية بالجوانين. يعتمد هيكل G4 على تكوين رباعيات مستوية ، تسمى G-tetrades ، حيث تتفاعل أربعة جوانين من خلال روابط هيدروجينية Hoogsteen. يتم تكديس G-tetrads وتثبيتها بشكل أكبر بواسطة الكاتيونات أحادية التكافؤ التي يتم تنسيقها في وسط قلب الجوانين (الشكل 1)1.
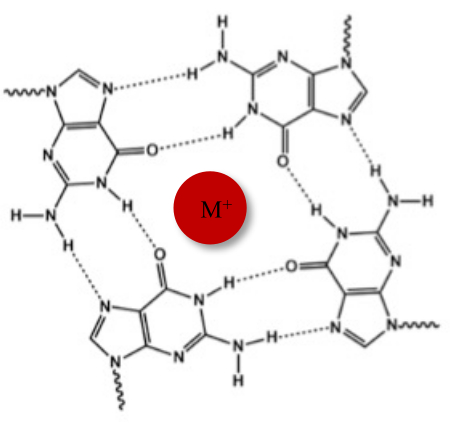
الشكل 1: تمثيل تخطيطي لهيكل G-quadruplex. (أ) تمثيل تخطيطي لرباعي G. يتم تثبيت الصفيف المستوي بواسطة اقتران قاعدة Hoogsteen وبواسطة كاتيون مركزي (M +). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
التسلسلات التي تحتوي على أربعة أشواط أو أكثر من نيوكليوتيدات الجوانين المتتالية على الأقل هي تسلسلات محتملة لتشكيل G-quadruplex (PQSs) يمكن طيها في هياكل G-quadruplex. توجد PQSs في العديد من السياقات الخلوية المختلفة ، مثل التيلوميرات ، ومروجات الجينات ، والحمض النووي الريبوسومي ، ومواقع إعادة التركيب ، وتشارك في تنظيم العديد من العمليات البيولوجية2. ومن ثم، فإن تحديد G4s والتحقق التجريبي من صحتها في الجينوم البشري، والذي يتم إجراؤه حاليا في المقام الأول من خلال الأدوات الحسابية، هو قضية ذات صلة بيولوجية3. من أجل دعم التنبؤات الحسابية أو الكشف عن هياكل G4 غير المتوقعة ، يتم عرض طريقة يمكن الوصول إليها تعتمد على رسم الخرائط الكيميائية لتحديد تكوين G4 في قالب الحمض النووي هنا ، مما يتيح التحديد الدقيق للجوانين التي تشكل بنية G-tetrad.
يستغل اختبار رسم الخرائط الكيميائية المبلغ عنه التفاعل المختلف لثنائي 3-كلوروبيريدين (B-CePs) مع الجوانين بعد تكوين هياكل G4. نظرا لتفاعلها العالي مع النيوكليوفيليات4،5،6،7،8،9 ، فإن B-CePs هي عوامل ألكلة الحمض النووي مع القدرة على التفاعل بكفاءة عالية مع موضع N7 من نيوكليوتيدات الجوانين10. يتبع الألكلة التطهير والانقسام الخيطي في تركيبات الحمض النووي المفردة والمزدوجة الشريط. على العكس من ذلك ، فإن الجوانين المشاركة في تكوين G-tetrads في ترتيبات G4 منيعة على ألكلة B-CeP ، حيث أن موضع N7 من الجوانين متورط في روابط Hoogsteen الهيدروجينية. لا يسمح هذا التفاعل المحدد ل B-CePs باكتشاف هياكل G4 فحسب ، بل يسمح أيضا بتحديد الجوانين التي تشكل رباعي (رباعيات) ، حيث يمكن استنتاجها من حمايتها النسبية من الألكلة مقارنة بالجوانين في الحمض النووي أحادي ومزدوج الشريط.
تم الإبلاغ عن بروتوكول رسم الخرائط الكيميائية هنا باستخدام B-CeP 1 (الشكل 2A) كمسبار لتوصيف أبتامير المرتبط بالثرومبين (TBA) ، وهو حمض نووي 15-mer قادر على افتراض ترتيب G4 في وجود كاتيونات البوتاسيوم11,12. تتم مقارنة ترتيب G4 ل TBA (G4-TBA) مباشرة مع اثنين من عناصر التحكم ، وهما TBA في الشكل أحادي الشريط (ssTBA) و TBA الملدن إلى تسلسله التكميلي لتشكيل البناء المزدوج الذي تقطعت به السبل (dsTBA) (الجدول 1). يتم حل نواتج تفاعلات الفحص عن طريق الرحلان الكهربائي عالي الدقة لهلام بولي أكريلاميد (PAGE) على مستوى النوكليوتيدات المفردة عن طريق تحديد موقع مضافات الألكلة الفردية وانقسام حبلا الحمض النووي عند الجوانين الألكيل. يتم تمكين التصور على الجل عن طريق اقتران قليل النوكليوتيد TBA مع فلوروفور في نهايته 3'-end (الجدول 1). يوضح هذا البروتوكول كيفية طي TBA في مطابقاته المختلفة (G4 وعناصر التحكم) ، وكيفية إجراء تفاعلات التحقيق مع B-CePs متبوعة ب PAGE.
Protocol
1. إعداد الحمض النووي والمسبار الكيميائي
- الأحماض النووية
ملاحظة: قليل النوكليوتيد المسمى "TBA" هو تسلسل الحمض النووي 15-mer 5'-GGT-TGG-TGT-GGT-TGG-3' المسمى في النهاية 3'بواسطة الفلوروفور 5-كربوكسي فلوريسئين (FAM) لتمكين التصور على الهلام. قليل النوكليوتيد غير المسمى "cTBA" هو تسلسل الحمض النووي التكميلي 5'-CCA-ACC-ACA-CCA-ACC-3'. يتم استخدام TBA و cTBA للحصول على الهياكل الثلاثة المختلفة ، كما هو موضح في الجدول 1.- نصائح الأوتوكلاف وأنابيب 0.5 مل من أجل الحصول على المستهلكات المعقمة وتجنب التلوث.
- تحضير محاليل المخزون لإذابة كل قليل النوكليوتيد في ماء عالي النقاء إلى تركيز نهائي يبلغ 100 ميكرومتر. حدد تركيز قليل النوكليوتيد الدقيق باستخدام مقياس الطيف الضوئي المرئي للأشعة فوق البنفسجية (UV-Vis) ، باستخدام معامل الانقراض عند 260 نانومتر المقدم من الشركة المصنعة.
ملاحظة: تم استخدام معاملات الانقراض: 164,300 M-1 cm-1 و 138,600 M-1 cm-1 ل TBA و cTBA ، على التوالي. - قم بتخزين حلول مخزون TBA و cTBA في -20 درجة مئوية (لعدة أشهر في هذه الظروف).
- مجمع B-CeP 1
ملاحظة: يتم تصنيع المركب B-CeP 1 كما تم الإبلاغ عنه سابقا6.- قم بإعداد حل الأسهم B-CeP 1 عند ~ 10 مللي مول. قم بوزن ~ 1 مجم من المركب المجفف بالتجميد باستخدام ميزان تحليلي موجود في غطاء دخان وقم بإذابته في 100٪ ثنائي ميثيل سلفوكسيد (DMSO).
- احسب تركيز المركب الدقيق بناء على الكمية الفعلية للمركب و DMSO (d = 1.1 جم / سم3) المستخدمة.
ملاحظة: تعامل مع المركب بالقفازات في جميع الأوقات (عند تجفيفه بالتجميد وعند إذابته في DMSO)13,14.
الجدول 1: هياكل قليل النوكليوتيد المستخدمة في هذا البروتوكول. الرجاء الضغط هنا لتنزيل هذا الجدول.
2. طي تركيبات الحمض النووي
- إعداد المخازن المؤقتة
- تحضير محلول عازل BPE (حمض ثنائي الفوسفات - إيثيلين ديامينيترايتيك [EDTA] ، 5x: 2 mM NaH 2 PO 4 ، 6mM Na 2 HPO 4 ، 1 mMNa 2EDTA ،درجة الحموضة7.4) ومحلول 500 mM KCl في ماء عالي النقاء. قم بتصفية المحاليل من خلال مرشحات حجم المسام 0.22 ميكرومتر.
ملاحظة: للحصول على أفضل النتائج، استخدم المحاليل الطازجة. يمكن تخزين المخزن المؤقت BPE عند 4 درجات مئوية لمدة تصل إلى 15 يوما.
- تحضير محلول عازل BPE (حمض ثنائي الفوسفات - إيثيلين ديامينيترايتيك [EDTA] ، 5x: 2 mM NaH 2 PO 4 ، 6mM Na 2 HPO 4 ، 1 mMNa 2EDTA ،درجة الحموضة7.4) ومحلول 500 mM KCl في ماء عالي النقاء. قم بتصفية المحاليل من خلال مرشحات حجم المسام 0.22 ميكرومتر.
- طي عينات G4-TBA و ssTBA و dsTBA عن طريق إجراء إعادة الطي بالحرارة
ملاحظة: كاتيونات البوتاسيوم ضرورية لطي بنية G4 (G4-TBA). لا تقم بإضافة كاتيونات البوتاسيوم في محلول الطي لعناصر التحكم ssTBA و dsTBA.- تحضير 40 ميكرولتر من محلول 4 ميكرومتر من G4-TBA في 1x BPE و 100 mM KCl. قم بتطهير محلول قليل النوكليوتيد G4-TBA عن طريق تسخين الأنبوب إلى 95 درجة مئوية لمدة 5 دقائق وتبريده ببطء إلى درجة حرارة الغرفة (RT) للسماح ل TBA بالطي إلى G-quadruplexes.
- تحضير 40 ميكرولتر من محلول 4 ميكرومتر من ssTBA في 1x BPE. قم بإجراء إعادة الطي الحراري ، كما هو مذكور في الخطوة 2.2.1 ، لطي TBA في شكله أحادي الشريط.
- تحضير 40 ميكرولتر من محلول 4 ميكرومتر من dsTBA عن طريق خلط كميات متساوية المولية من TBA و cTBA في 1x BPE. قم بإجراء إعادة الطي الحراري كما هو مذكور أعلاه (الخطوة 2.2.1) ل TBA للصلب إلى تسلسله التكميلي cTBA وتشكيل الشكل المزدوج الذي تقطعت به السبل من TBA.
ملاحظة: يعتمد الحجم النهائي لكل محلول قابل للطي على عدد العينات لتفاعلات الفحص ، مع الأخذ في الاعتبار أنه ستكون هناك حاجة إلى 5 ميكرولتر من محلول 4 ميكرومتر لكل عينة. قم بإعداد القليل من الحجم الزائد لكل حل لتجنب أخطاء الماصة.
3. التحقيق في ردود الفعل
ملاحظة: يجب إجراء تفاعلات الفحص مباشرة بعد إجراء إعادة الطي بالحرارة.
- عندما يتم تبريد حلول الطي ل G4-TBA و ssTBA و dsTBA إلى RT ، قم بإجراء طرد مركزي قصير الدوران (7000 × جم لمدة 5-8 ثوان في RT) وابدأ تفاعلات الفحص.
- تحضير 21 أنبوب تعقيم فارغ 0.5 مل. قم بتنظيمها في ثلاث مجموعات من سبعة أنابيب في كل منها في الرف لعينات المختبر ، كما هو مذكور في الجدول 2.
ملاحظة: تتوافق كل مجموعة أعمدة مع شروط الطي الثلاثة المختلفة TBA G4-TBA و ssTBA و dsTBA. كل صف يتوافق مع ثلاثة أوقات حضانة مختلفة. تتوافق كل خلية داخل العمود مع تركيز مسبار B-CeP 1 النهائي (الجدول 2). تأكد من تسمية الأنابيب بوضوح. - أضف 3 ميكرولتر من الماء عالي النقاء في كل أنبوب.
- أضف 5 ميكرولتر من G4-TBA المطوي في كل أنبوب من المجموعة الأولى (الخطوة 3.2). أضف 5 ميكرولتر من ssTBA المطوية في كل أنبوب من المجموعة الثانية. أضف 5 ميكرولتر من dsTBA المطوي في كل أنبوب من المجموعة الثالثة.
- قم بتخفيف محلول المخزون B-CeP 1 إلى 250 ميكرومتر و 25 ميكرومتر في ماء فائق النقاء.
ملاحظة: يجب تحضير تخفيفات المسبار الكيميائي B-CeP 1 حديثا وتفاعلها على الفور مع ركيزة الحمض النووي لتجنب التفاعلات المتنافسة مع الماء. - أضف 2 ميكرولتر من تخفيف B-CeP 1 المناسب (25 ميكرومتر و 250 ميكرومتر) إلى العينات. استبدل المركب بماء عالي النقاء في عينات التحكم الثلاث (C) لتحليل TBAs المطوية بشكل مختلف في حالة عدم وجود المركب. احتضان جميع العينات عند 37 درجة مئوية.
- بعد 1 ساعة و 4 ساعات و 15 ساعة من الحضانة ، أوقف التفاعل عن طريق وضع الأنابيب عند -20 درجة مئوية حتى الخطوة التالية.
ملاحظة: يمكن تخزين العينات في هذه الظروف لبضعة أيام. - تجفيف العينات في جهاز طرد مركزي فراغ.
ملاحظة: يمكن تخزين العينات المجففة في -20 درجة مئوية لأسابيع قبل الشروع في تحليل PAGE.
الجدول 2: عينات لتفاعلات الفحص (الهياكل ، تركيزات المسبار ، ووقت الحضانة). تتوافق كل مجموعة أعمدة مع شروط طي TBA الثلاثة المختلفة (G4-TBA و ssTBA و dsTBA). يتوافق كل صف مع ثلاثة أوقات حضانة مختلفة (1 ، 4 ، 15 ساعة). تتوافق كل خلية داخل العمود مع تركيز مسبار B-CeP 1 النهائي (5 أو 50 ميكرومتر). يتوافق التحكم (C) لكل مجموعة مع عينة من TBAs المطوية بشكل مختلف المحتضنة لفترة أطول (15 ساعة) في حالة عدم وجود مركب. الرجاء الضغط هنا لتنزيل هذا الجدول.
4. صفحة عالية الدقة
- تحضير محلول بولي أكريلاميد الذي يتمسخ
ملاحظة: تحضير مقدما 500 مل من محلول هلام بولي أكريلاميد 20٪ من تغيير طبيعة الملطخ. سيتم استخدام حوالي 80 مل من هذا المحلول لكل تجربة. استخدم زجاجة زجاجية كهرمانية أو قم بتغطية زجاجة زجاجية بورق الألمنيوم لتخزين المحلول في RT.
تنبيه: بولي أكريلاميد سام للأعصاب. خلال جميع خطوات تحضير الجل وصبه ، ارتد قفازات ومعطف مختبر. تخلص من مادة الأكريلاميد المبلمرة في صندوق مناسب للمواد الملوثة.- وزن 210 g من اليوريا في كأس زجاجية سعة 1 لتر. أضف 250 مل من محلول الأكريلاميد / بيساكريلاميد (19/1) بنسبة 40٪ و 50 مل من 10x TBE (890 مللي متر Tris-HCl ، 890 mM بورات ، 20 mM EDTA ، درجة الحموضة 8).
- ضع الدورق على طبق تحريك واخلط المحلول بقضيب التقليب. قم بتغطية الدورق بورق الألمنيوم أثناء الخلط لمنع الرش والتلوث.
- امزج المحلول حتى يذوب اليوريا تماما ويصبح المحلول صافيا.
ملاحظة: قد تستغرق هذه الخطوة عدة ساعات. لتعزيز انحلال اليوريا ، أضف حصة صغيرة من الماء دون تجاوز الحجم النهائي المطلوب. - قم بإزالة قضيب التحريك. صب المحلول في أسطوانة وأضف الماء إلى الحجم النهائي الدقيق البالغ 500 mL.
- إعداد جهاز هلام
- نظف لوحين (أحدهما محزز والآخر غير محزز) بنسبة 70٪ من الإيثانول ، واتركهما يجفان ، ثم عالج الألواح بمحلول ثنائي ميثيل ثنائي كلورو سيلان.
ملاحظة: يمكن تخطي Silanization ، على الرغم من أنه يساعد على إطلاق الجل من إحدى الأطباق عند تفكيك شطيرة الجل.
تنبيه: تعامل مع محلول silanization بالقفازات وقم بإجراء معالجة اللوحة باستخدام هذا المحلول في غطاء دخان. - ضع الفواصل 0.4 مم على طول الحواف الطويلة للوحة الأطول ، ضع اللوحة القصيرة فوق الأخرى ، وقم بمحاذاة اللوحين في الأسفل.
- ضع طبقات متعددة من الشريط الورقي على طول جميع الحواف باستثناء الجزء العلوي.
- لتجنب التسرب أثناء الصب ، أضف طبقة إضافية من الشريط إلى أسفل الجل.
- قم بقص جوانب الشطيرة الزجاجية بمشابك نظيفة باتباع تعليمات المورد (يستخدم الموردون المختلفون أجهزة مختلفة قليلا ، ومشابك شطيرة ، وحشيات).
- نظف لوحين (أحدهما محزز والآخر غير محزز) بنسبة 70٪ من الإيثانول ، واتركهما يجفان ، ثم عالج الألواح بمحلول ثنائي ميثيل ثنائي كلورو سيلان.
- صب الجل
ملاحظة: صب الجل في RT (25 درجة مئوية) ، لأن بلمرة بولي أكريلاميد حساسة لدرجة الحرارة.- في دورق ، صب 80 مل من محلول بولي أكريلاميد المعد مسبقا (الخطوة 4.1) ، و 450 ميكرولتر من محلول كبريتات الأمونيوم 10٪ م / فولت (APS) ، و 45 ميكرولتر من رباعي ميثيل إيثيلين ديامين (TEMED) مباشرة قبل الاستخدام.
- امزج المحلول واسكبه بسرعة بين الألواح الزجاجية باستخدام حقنة سعة 50 مل. أدخل المشط بالعدد المطلوب من الآبار بين الألواح الزجاجية ، وتجنب الفقاعات. أضف محلول جل لملء الساندويتش تماما ، إذا لزم الأمر. ضع أربعة مشابك على المشط للضغط لأسفل والسماح بالتوزيع المتساوي للآبار.
- دع الجل يتبلمر لمدة 45 دقيقة على الأقل.
- تشغيل الجل
- بعد البلمرة ، قم بإزالة جميع المشابك وطبقات الشريط الورقي. قم بإزالة المشط ببطء وشطف الآبار بالماء المقطر.
- اتبع التعليمات من المورد المحدد لوضع شطيرة الجل بشكل صحيح في جهاز الرحلان الكهربائي العمودي.
- قم بإعداد مخزن مؤقت تشغيل TBE (1x: 89 mM Tris-HCl ، 89 mM بورات ، 2 mM EDTA ، درجة الحموضة 8) في الماء منزوع الأيونات واملأ كل من الخزانات العلوية والسفلية بالمخزن المؤقت.
- قم بتسخين الألواح عن طريق إجراء تشغيل مسبق للرحلان الكهربائي الهلامي لمدة 30 دقيقة على الأقل عند 50 وات.
- تحضير المخزن المؤقت لتحميل الجل الذي لا يشبه طبيعة (DGLB: 1 M Tris-HCl ، 80٪ فورماميد ، 50٪ جلسرين ، 0.05٪ بروموفينول أزرق) في ماء فائق النقاء.
ملاحظة: يساعد GLB على تتبع حركة عينات قليل النوكليوتيد في نظام الهلام ويسمح بتحميل العينات في آبار الهلام. يسمح وجود عامل تغيير طبيعة الفورماميد لأنواع الحمض النووي بالانفصال وفقا للحجم ، حتى في PAGE غير المتسخ. - أعد تعليق العينات المجففة (عينات من الخطوة 3.8) في 5 ميكرولتر من DGLB.
- قبل تحميل العينات ، قم بتنظيف الآبار باستخدام حقنة صغيرة ومخزن TBE في الغرفة العازلة العلوية لإزالة اليوريا من الآبار.
ملاحظة: كرر هذه الخطوة عدة مرات لتنظيف الآبار بدقة ، وبالتالي تجنب النطاقات التي يصعب تفسيرها. - قم بتحميل العينات في الآبار النظيفة وقم بتدوين ترتيب التحميل.
- قم بتشغيل الرحلان الكهربائي للهلام لمدة ساعتين عند 50 واط ، أو على الأقل حتى تعمل صبغة البروموفينول الزرقاء 2/3 أسفل الجل.
- تصوير الجل
- بعد الرحلان الكهربائي ، قم بإيقاف تشغيل مصدر الطاقة ، وإزالة شطيرة الزجاج ، وتنظيف النظارات.
- اكتشف مضان نطاقات قليل النوكليوتيد المسمى FAM عن طريق المسح باستخدام جهاز تصوير هلامي.
النتائج
يوضح الشكل 2 نتيجة تمثيلية لمقايسة رسم الخرائط الكيميائية التي تم إجراؤها ، كما هو موضح في البروتوكول مع B-CeP 1 على قليل النوكليوتيد TBA المطوي في ثلاثة هياكل مختلفة. تم الحصول على ترتيب G-quadruplex ل TBA (G4-TBA) عن طريق طي قليل النوكليوتيد في BPE وفي وجود الكاتيون K + ، في حين تم طي ا?...
Discussion
G-quadruplexes هي هياكل ثانوية للحمض النووي تطوى عادة داخل تسلسل الحمض النووي الغني بالجوانين ، وهي أهداف بحثية مهمة بسبب ارتباطها بالتحكم الجيني والأمراض. يعد رسم الخرائط الكيميائية بواسطة B-CePs بروتوكولا مفيدا لتوصيف الحمض النووي G4s ، والذي يمكن استخدامه لتحديد قواعد الجوانين المشاركة في تكوي?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذا العمل من قبل قسم العلوم الصيدلانية والدوائية ، جامعة بادوفا (PRIDJ-BIRD2019).
Materials
| Name | Company | Catalog Number | Comments |
| Acrylamide/bis-acrylamide solution 40% | Applichem | A3658 | R45-46-20/21-25-36/38-43-48/23/ 24/25-62 |
| Ammonium per-sulfate (APS) | Sigma Aldrich | A7460 | |
| Analytical balance | Mettler Toledo | ||
| Autoclave | pbi international | ||
| Boric acid | Sigma Aldrich | B0252 | |
| Bromophenol blue Brilliant blue R | Sigma Aldrich | B0149 | |
| di-Sodium hydrogen phosphate dodecahydrate | Fluka | 71649 | |
| DMSO | Sigma Aldrich | 276855 | |
| DNA oligonucleotides | Integrated DNA Technologies | synthesis of custom sequences | |
| EDTA disodium | Sigma Aldrich | E5134 | |
| Formamide | Fluka | 40248 | H351-360D-373 |
| Gel imager | GE Healtcare | STORM B40 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Micro tubes 0.5 mL | Sarstedt | 72.704 | |
| Potassium Chloride | Sigma Aldrich | P9541 | |
| Sequencing apparatus | Biometra | Model S2 | |
| Silanization solution I | Fluka | 85126 | H225, 314, 318, 336, 304, 400, 410 |
| Sodium phosphate monobasic | Carlo Erba | 480086 | |
| Speedvac concentrator | Thermo Scientific | Savant DNA 120 | |
| TEMED | Fluka | 87689 | R11-21/22-23-34 |
| Tris-HCl | MERCK | 1.08387.2500 | |
| Urea | Sigma Aldrich | 51456 | |
| UV-Vis spectrophotometer | Thermo Scientific | Nanodrop 1000 |
References
- Davis, J. T. G-quartets 40 years later: from 5'-GMP to molecular biology and supramolecular chemistry. Angewandte Chemie. 43 (6), 668-698 (2004).
- Varshney, D., Spiegel, J., Zyner, K., Tannahill, D., Balasubramanian, S. The regulation and functions of DNA and RNA G-quadruplexes. Nature Reviews Molecular Cell Biology. 21 (8), 459-474 (2020).
- Chambers, V. S., et al. High-throughput sequencing of DNA G-quadruplex structures in the human genome. Nature Biotechnology. 33 (8), 877-881 (2015).
- Zuravka, I., Sosic, A., Gatto, B., Gottlich, R. Synthesis and evaluation of a bis-3-chloropiperidine derivative incorporating an anthraquinone pharmacophore. Bioorganic & Medicinal Chemistry Letters. 25 (20), 4606-4609 (2015).
- Zuravka, I., Roesmann, R., Sosic, A., Gottlich, R., Gatto, B. Bis-3-chloropiperidines containing bridging lysine linkers: Influence of side chain structure on DNA alkylating activity. Bioorganic & Medicinal Chemistry. 23 (6), 1241-1250 (2015).
- Zuravka, I., et al. Synthesis and DNA cleavage activity of bis-3-chloropiperidines as alkylating agents. ChemMedChem. 9 (9), 2178-2185 (2014).
- Sosic, A., Gottlich, R., Fabris, D., Gatto, B. B-CePs as cross-linking probes for the investigation of RNA higher-order structure. Nucleic Acids Research. 49 (12), 6660-6672 (2021).
- Sosic, A., et al. Bis-3-chloropiperidines targeting TAR RNA as a novel strategy to impair the HIV-1 nucleocapsid protein. Molecules. 26 (7), 1874 (2021).
- Sosic, A., et al. In vitro evaluation of bis-3-chloropiperidines as RNA modulators targeting TAR and TAR-protein interaction. International Journal of Molecular Sciences. 23 (2), 582 (2022).
- Sosic, A., et al. Direct and topoisomerase II mediated DNA damage by bis-3-chloropiperidines: The importance of being an earnest G. ChemMedChem. 12 (17), 1471-1479 (2017).
- Bock, L. C., Griffin, L. C., Latham, J. A., Vermaas, E. H., Toole, J. J. Selection of single-stranded DNA molecules that bind and inhibit human thrombin. Nature. 355 (6360), 564-566 (1992).
- Paborsky, L. R., McCurdy, S. N., Griffin, L. C., Toole, J. J., Leung, L. L. The single-stranded DNA aptamer-binding site of human thrombin. The Journal of Biological Chemistry. 268 (28), 20808-20811 (1993).
- Carraro, C., et al. Behind the mirror: chirality tunes the reactivity and cytotoxicity of chloropiperidines as potential anticancer agents. ACS Medicinal Chemistry Letters. 10 (4), 552-557 (2019).
- Carraro, C., et al. Appended aromatic moieties in flexible bis-3-chloropiperidines confer tropism against pancreatic cancer cells. ChemMedChem. 16 (5), 860-868 (2021).
- Kypr, J., Kejnovska, I., Renciuk, D., Vorlickova, M. Circular dichroism and conformational polymorphism of DNA. Nucleic Acids Research. 37 (6), 1713-1725 (2009).
- Onel, B., Wu, G., Sun, D., Lin, C., Yang, D. Electrophoretic mobility shift assay and dimethyl sulfate footprinting for characterization of G-quadruplexes and G-quadruplex-protein complexes. Methods in Molecular Biology. 2035, 201-222 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved