JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
In Vitro (시험관) Bis-3-Chloropiperidines에 의한 G-Quadruplex DNA 구조의 화학적 매핑
요약
Bis-3-chloropiperidines(B-CeP)는 in vitro에서 DNA 템플릿의 G-quadruplex 구조를 식별하고 특성화하는 데 유용한 화학 프로브입니다. 이 프로토콜은 B-CeP를 사용하여 프로빙 반응을 수행하고 고분해능 폴리아크릴아미드 겔 전기영동으로 반응 생성물을 분해하는 절차를 자세히 설명합니다.
초록
G-quadruplex(G4s)는 유전자 발현 및 질병에 중요한 역할을 하는 생물학적으로 관련된 비표준 DNA 구조로, 중요한 치료 표적을 나타냅니다. 잠재적인 G-quadruplex-forming sequences(PQS) 내에서 DNA의 in vitro 특성 분석을 위해서는 접근 가능한 방법이 필요합니다. B-CeP는 핵산의 고차원 구조 조사에 유용한 화학 프로브로 입증된 알킬화제의 한 종류입니다. 이 논문은 B-CeP와 구아닌의 N7의 특정 반응성을 활용한 후 알킬화된 Gs에서 직접 가닥 절단을 수행하는 새로운 화학 매핑 분석에 대해 설명합니다.
즉, G4 접힘과 풀린 DNA 형태를 구별하기 위해 B-CeP 1을 사용하여 G4 배열을 가정할 수 있는 15-mer DNA인 트롬빈 결합 압타머(TBA)를 조사합니다. B-CeP 반응 구아닌과 B-CeP 1의 반응은 알킬화된 구아닌에서 개별 알킬화 부가물 및 DNA 가닥 절단을 찾아 단일 뉴클레오티드 수준에서 고분해능 폴리아크릴아미드 겔 전기영동(PAGE)으로 분해할 수 있는 산물을 생성합니다. B-CeP를 사용한 맵핑은 G-quadruplex 형성 DNA 염기서열의 in vitro 특성 분석을 위한 간단하고 강력한 도구로, G-tetrads 형성에 관여하는 구아닌의 정확한 위치를 파악할 수 있습니다.
서문
전형적인 왓슨-크릭(Watson-Crick) 이중나선 외에도, 핵산은 구아닌이 풍부한 서열로 인해 양자택일 G-4중(G4) 형태와 같은 다양한 2차 구조를 채택할 수 있습니다. G4 구조는 4개의 구아닌이 Hoogsteen 수소 결합을 통해 상호 작용하는 G-tetrads라고 하는 평면 사량체의 형성을 기반으로 합니다. G-tetrad는 구아닌 코어의 중심에서 조정되는 1가 양이온에 의해 적층되고 더욱 안정화됩니다(그림 1)1.
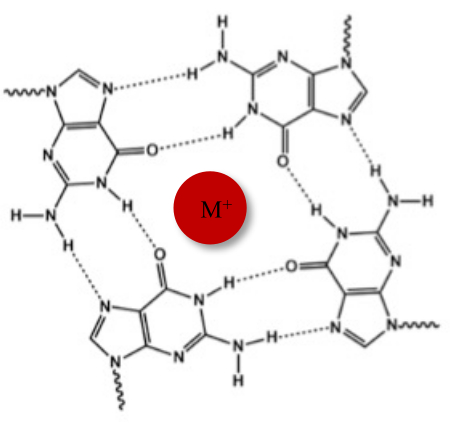
그림 1: G-quadruplex 구조 의 개략도. (A) G-tetrad의 개략적 표현. 평면 어레이는 Hoogsteen 염기쌍과 중심 양이온(M+)에 의해 안정화됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
적어도 2개의 연속적인 구아닌 뉴클레오티드가 4회 이상 실행된 서열은 G-4중복합 구조에서 접힐 수 있는 잠재적인 G-사중-형성 서열(PQS)이다. PQS는 텔로미어, 유전자 프로모터, 리보솜 DNA, 재조합 부위 등 다양한 세포 환경에 위치하며, 많은 생물학적 과정의 조절에 관여한다2. 따라서 현재 주로 계산 도구를 통해 수행되는 인간 게놈에서 G4의 식별 및 실험적 검증은 생물학적으로 관련된 문제입니다3. 전산 예측을 지원하거나 예측하지 못한 G4 구조를 검출하기 위해 DNA 템플릿에서 G4 형성을 식별하기 위한 화학적 매핑을 기반으로 하는 접근 가능한 방법이 여기에 표시되어 G-tetrad 구조를 형성하는 구아닌을 정확하게 식별할 수 있습니다.
보고된 화학 매핑 분석은 G4 구조 형성 후 구아닌과 비스-3-클로로피페리딘(B-CeP)의 다양한 반응성을 이용합니다. 친핵체 4,5,6,7,8,9와의 높은 반응성으로 인해 B-CeP 는 구아닌 뉴클레오티드 10의 N 7 위치와 매우 효율적으로 반응할 수 있는 핵산 알킬화제입니다. 알킬화 다음에는 단일 및 이중 가닥 DNA 구조에서 탈피 및 가닥 절단이 뒤따릅니다. 반대로, G4 배열에서 G-테트라드의 형성에 관여하는 구아닌은 구아닌의 N7 위치가 Hoogsteen 수소 결합에 연루되어 있기 때문에 B-CeP 알킬화에 영향을 받지 않습니다. B-CeP의 이러한 특이적 반응성은 G4 구조의 검출뿐만 아니라 단일 및 이중 가닥 DNA의 구아닌과 비교하여 알킬화로부터 상대적인 보호로부터 추론할 수 있기 때문에 테트라드를 형성하는 구아닌의 식별도 가능하게 합니다.
화학적 매핑 프로토콜은 칼륨 양이온(11,12)의 존재 하에서 G4 배열을 가정할 수 있는 15-mer DNA인 트롬빈 결합 압타머(TBA)의 특성화를 위한 프로브로서 B-CeP 1(그림 2A)을 사용하여 여기에 보고됩니다. TBA(G4-TBA)의 G4 배열은 두 개의 대조군, 즉 단일 가닥 형태의 TBA(ssTBA)와 이중 가닥 구조(dsTBA)를 형성하기 위해 상보적인 서열로 어닐링된 TBA와 직접 비교됩니다(표 1). 프로빙 반응 산물은 알킬화된 구아닌에서 개별 알킬화 부가물과 DNA 가닥 절단을 찾아 단일 뉴클레오티드 수준에서 고분해능 폴리아크릴아미드 겔 전기영동(PAGE)으로 분해됩니다. 겔의 시각화는 TBA 올리고뉴클레오티드와 3'-말단의 형광단을 결합함으로써 가능합니다(표 1). 이 프로토콜은 TBA를 다양한 형태(G4 및 대조군)로 접는 방법과 B-CeP를 사용한 후 PAGE를 사용하여 프로빙 반응을 수행하는 방법을 보여줍니다.
프로토콜
1. 핵산 및 화학 탐침 준비
- 핵산
참고: "TBA"라는 올리고뉴클레오티드는 형광단 5-카르복시플루오레세인(FAM)에 의해 3'-말단에 표지된 15-mer DNA 서열 5'-GGT-TGG-TGT-GGT-TGG-3'으로 겔에 시각화를 가능하게 합니다. 표지되지 않은 올리고뉴클레오티드 "cTBA"는 DNA 상보적 서열 5'-CCA-ACC-ACA-CCA-ACC-3'입니다. 표 1에 나타낸 바와 같이 3개의 상이한 구조를 얻기 위해 TBA 및 cTBA가 채용된다.- 오토클레이브 팁과 0.5mL 튜브를 사용하여 멸균 일회용품을 얻고 오염을 방지할 수 있습니다.
- 각 올리고뉴클레오티드를 초순수에 최종 농도 100μM까지 용해시키는 원액을 준비합니다. 제조업체에서 제공한 260nm의 흡광 계수를 사용하여 자외선 가시광선(UV-Vis) 분광 광도계로 정확한 올리고뉴클레오티드 농도를 결정합니다.
참고: 흡광 계수: TBA 및 cTBA에는 각각 164,300 M-1 cm-1 및 138,600 M-1 cm-1이 사용되었습니다. - TBA 및 cTBA 원액을 -20°C에서 보관하십시오(이러한 조건에서 몇 달 동안).
- 화합물 B-CeP 1
참고: 화합물 B-CeP 1은 이전에 보고된바와 같이 합성된다 6.- ~10mM에서 B-CeP 1 원액을 준비합니다. 흄 후드에 있는 분석 저울을 사용하여 동결건조된 화합물 ~1mg을 칭량하고 100% 디메틸 설폭사이드(DMSO)에 용해시킵니다.
- 사용된 화합물 및 DMSO(d = 1.1g/cm3)의 실제 양을 기준으로 정확한 화합물 농도를 계산합니다.
알림: 항상 장갑을 끼고 화합물을 다루십시오(동결건조된 경우와 DMSO에 용해된 경우 모두)13,14.
표 1: 이 프로토콜에 사용된 올리고뉴클레오티드 구조. 이 표를 다운로드하려면 여기를 클릭하십시오.
2. 핵산 구조체의 접힘
- 완충액의 준비
- BPE 완충 용액 (biphosphate-ethylenediaminetetraacetic acid [EDTA], 5x : 2 mM NaH 2 PO 4, 6 mM Na 2 HPO 4, 1 mM Na2EDTA, pH7.4) 및 500 mM KCl 용액을 초순수에 준비합니다. 0.22μm 공극 크기 필터를 통해 용액을 여과합니다.
알림: 최상의 결과를 얻으려면 새로 준비된 용액을 사용하십시오. BPE 완충액은 4°C에서 최대 15일 동안 보관할 수 있습니다.
- BPE 완충 용액 (biphosphate-ethylenediaminetetraacetic acid [EDTA], 5x : 2 mM NaH 2 PO 4, 6 mM Na 2 HPO 4, 1 mM Na2EDTA, pH7.4) 및 500 mM KCl 용액을 초순수에 준비합니다. 0.22μm 공극 크기 필터를 통해 용액을 여과합니다.
- G4-TBA, ssTBA 및 dsTBA 샘플의 접기 열 재접기 절차에 의한
참고: 칼륨 양이온은 G4 구조(G4-TBA)를 접는 데 필요합니다. 대조군 ssTBA 및 dsTBA의 접는 용액에 칼륨 양이온을 추가하지 마십시오.- 1x BPE 및 100mM KCl에서 G4-TBA의 4μM 용액 40μL를 준비합니다. 튜브를 95°C로 5분 동안 가열하여 올리고뉴클레오티드 G4-TBA 용액을 변성시키고 TBA가 G-4중으로 접힐 수 있도록 실온(RT)으로 천천히 냉각합니다.
- 40μL의 ssTBA 용액 1μL를 1x BPE로 준비합니다. 2.2.1단계에서 언급한 대로 열 재접기 절차를 수행하여 TBA를 단일 가닥 형태로 접습니다.
- 40x BPE에서 등몰량의 TBA와 cTBA를 혼합하여 dsTBA의 4μM 용액 1μL를 준비합니다. TBA에 대해 위에서 언급한 열 재접힘 절차(2.2.1단계)를 수행하여 보완 서열 cTBA에 어닐링하고 이중 가닥 형태의 TBA를 형성합니다.
참고: 각 접힘 용액의 최종 부피는 각 시료에 대해 5μL의 4μM 용액이 필요하다는 점을 고려하여 프로빙 반응을 위한 시료 수를 기준으로 합니다. 피펫팅 오류를 방지하기 위해 각 용액을 약간 초과하여 준비합니다.
3. 프로빙 반응
알림: 프로빙 반응은 열 재접기 절차 직후에 수행해야 합니다.
- G4-TBA, ssTBA 및 dsTBA의 폴딩 용액이 RT로 냉각되면 짧은 스핀 원심분리(RT에서 5-8초 동안 7,000× g )를 수행하고 프로빙 반응을 시작합니다.
- 빈 0.5mL 고압멸균 튜브 21개를 준비합니다. 표 2에 보고된 대로 실험실 샘플용 랙에 각각 7개의 튜브로 구성된 3세트로 구성합니다.
참고: 각 열 집합은 세 가지 TBA 접기 조건 G4-TBA, ssTBA 및 dsTBA에 해당합니다. 각 행은 세 가지 다른 배양 시간에 해당합니다. 컬럼 내의 각 셀은 최종 B-CeP 1 프로브 농도에 해당합니다(표 2). 튜브에 명확하게 라벨을 부착하십시오. - 각 튜브에 3μL의 초순수를 추가합니다.
- 첫 번째 세트의 각 튜브에 접힌 G5-TBA 4μL를 추가합니다(3.2단계). 두 번째 세트의 각 튜브에 접힌 ssTBA 5μL를 추가합니다. 세 번째 세트의 각 튜브에 접힌 dsTBA 5μL를 추가합니다.
- B-CeP 1 원액을 초순수에 250μM 및 25μM로 희석합니다.
참고: B-CeP 1 화학 프로브의 희석액은 물과의 경쟁 반응을 피하기 위해 신선하게 준비되고 즉시 DNA 기질과 반응해야 합니다. - 적절한 B-CeP 1 희석액 2μL(25μM 및 250μM)를 샘플에 추가합니다. 화합물이 없는 경우 다르게 접힌 TBA를 분석하기 위해 3개의 대조군 샘플(C)에서 화합물을 초순수로 교체합니다. 모든 샘플을 37°C에서 배양합니다.
- 1시간, 4시간, 15시간 배양 후 다음 단계까지 튜브를 -20°C에 두어 반응을 중지합니다.
참고: 샘플은 이러한 조건에서 며칠 동안 보관할 수 있습니다. - 진공 원심분리기에서 샘플을 건조시킵니다.
참고: 건조된 샘플은 PAGE 분석을 진행하기 전에 -20°C에서 몇 주 동안 보관할 수 있습니다.
표 2: 프로빙 반응에 대한 샘플(구조, 프로브 농도 및 배양 시간). 각 컬럼 세트는 세 가지 TBA 접기 조건(G4-TBA, ssTBA 및 dsTBA)에 해당합니다. 각 행은 세 가지 다른 배양 시간(1시간, 4시간, 15시간)에 해당합니다. 컬럼 내의 각 셀은 최종 B-CeP 1 프로브 농도(5 또는 50μM)에 해당합니다. 각 세트에 대한 대조군 (C)는 화합물이 없는 상태에서 더 긴 시간(15시간) 동안 배양된 다르게 접힌 TBA의 샘플에 해당합니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
4. 고해상도 PAGE
- 변성 폴리아크릴아미드 용액의 제조
참고: 500% 변성 폴리아크릴아미드 겔 용액 20mL를 미리 준비합니다. 이 용액의 약 80mL가 각 실험에 사용됩니다. 호박색 유리병을 사용하거나 유리병을 알루미늄 호일로 덮어 용액을 RT에 보관합니다.
주의: 폴리아크릴아미드는 신경독성이 있습니다. 젤 준비 및 붓기의 모든 단계에서 장갑과 실험실 가운을 착용하십시오. 중합된 아크릴아마이드는 오염된 물질에 적합한 상자에 넣어 폐기하십시오.- 1L 비커에 요소 210g의 무게를 잰다. 250 mL의 40 % 아크릴 아마이드 / 비스 아크릴 아미드 (19/1) 용액과 50x TBE (890mM Tris-HCl, 890mM 붕산염, 20mM EDTA, pH 8)를 추가합니다.
- 비커를 교반 접시에 놓고 용액을 교반 막대와 혼합합니다. 튀거나 오염되는 것을 방지하기 위해 혼합하는 동안 알루미늄 호일로 비커를 덮으십시오.
- 요소가 완전히 용해되고 용액이 맑아질 때까지 용액을 혼합합니다.
참고: 이 단계는 몇 시간이 걸릴 수 있습니다. 요소의 용해를 촉진하려면 원하는 최종 부피를 초과하지 않고 작은 물 분취액을 추가하십시오. - 교반 막대를 제거합니다. 용액을 실린더에 붓고 정확한 최종 부피 500mL까지 물을 추가합니다.
- 겔 장치의 설치
- 70% 에탄올로 두 개의 플레이트(노치가 있는 플레이트와 노치가 없는 플레이트)를 청소하고 건조시킨 다음 플레이트를 디메틸디클로로실란 용액으로 처리합니다.
알림: 실란화는 건너뛸 수 있지만 젤 샌드위치를 분해할 때 플레이트 중 하나에서 젤을 방출하는 데 도움이 됩니다.
주의 : 장갑으로 실란화 용액을 취급하고 흄 후드에서 이 용액으로 플레이트 처리를 수행하십시오. - 긴 플레이트의 긴 가장자리를 따라 0.4mm 스페이서를 놓고 짧은 플레이트를 다른 플레이트 위에 놓고 두 플레이트를 바닥에 맞춥니다.
- 상단을 제외한 모든 가장자리를 따라 여러 겹의 종이 테이프를 놓습니다.
- 주조 중 누출을 방지하려면 젤 바닥에 테이프 층을 추가하십시오.
- 깨끗한 cl로 유리 샌드위치의 측면을 클립합니다.amp공급업체의 지침에 따라 s(공급업체마다 약간 다른 장치를 사용합니다.amps 및 개스킷).
- 70% 에탄올로 두 개의 플레이트(노치가 있는 플레이트와 노치가 없는 플레이트)를 청소하고 건조시킨 다음 플레이트를 디메틸디클로로실란 용액으로 처리합니다.
- 젤 붓기
참고: 폴리아크릴아미드 중합은 온도에 민감하기 때문에 RT(25°C)에서 겔을 붓습니다.- 비커에 이전에 준비한 변성 폴리아크릴아미드 용액 80mL(단계 4.1), 10% m/V 과황산암모늄(APS) 용액 450μL, 테트라메틸에틸렌디아민(TEMED) 45μL를 사용 직전에 붓습니다.
- 용액을 혼합하고 50mL 주사기를 사용하여 유리판 사이에 빠르게 붓습니다. 기포를 피하면서 유리판 사이에 원하는 수의 웰이 있는 빗을 도입합니다. 필요한 경우 샌드위치를 완전히 채우기 위해 젤 용액을 추가합니다. 빗에 4개의 클램프를 놓아 아래로 누르고 우물이 고르게 분포되도록 합니다.
- 겔을 최소 45분 동안 중합시킵니다.
- 젤 실행
- 중합 후 모든 클램프와 종이 테이프 층을 제거합니다. 빗을 천천히 제거하고 증류수로 우물을 철저히 헹굽니다.
- 특정 공급업체의 지침에 따라 겔 샌드위치를 수직 겔 전기영동 장치에 올바르게 배치하십시오.
- 탈이온수에 TBE 러닝 버퍼(1x: 89mM Tris-HCl, 89mM 붕산염, 2mM EDTA, pH 8)를 준비하고 상단 및 하단 저장소를 모두 버퍼로 채웁니다.
- 50W에서 최소 30분 동안 겔 전기영동을 사전 실행하여 플레이트를 예열합니다.
- 변성 겔 로딩 버퍼 (DGLB : 1 M Tris-HCl, 80 % 포름 아미드, 50 % 글리세롤, 0.05 % 브로 모 페놀 블루)를 초순수로 준비합니다.
참고: GLB는 올리고뉴클레오티드 샘플이 겔 시스템으로 이동하는 것을 추적하고 샘플을 겔의 웰에 로드할 수 있도록 도와줍니다. 변성제 포름아미드의 존재는 비변성 PAGE에서도 DNA 종을 크기에 따라 분리할 수 있도록 합니다. - 건조된 샘플(3.8단계의 샘플)을 5μL의 DGLB에 재현탁시킵니다.
- 샘플을 로드하기 전에 작은 주사기를 사용하여 웰을 세척하고 상부 버퍼 챔버의 TBE 버퍼를 사용하여 웰에서 요소를 제거합니다.
알림: 이 단계를 여러 번 반복하여 웰을 정확하게 청소하여 해석하기 어려운 밴드를 피하십시오. - 샘플을 깨끗한 우물에 넣고 적재 순서를 기록해 둡니다.
- 50W에서 2시간 동안 또는 적어도 브로모페놀 청색 염료가 겔 아래로 2/3 정도 흐를 때까지 겔 전기영동을 실행합니다.
- 겔 이미징
- 전기영동 후 전원을 끄고 유리 샌드위치를 제거한 다음 안경을 청소하십시오.
- 겔 이미저를 사용하여 스캔하여 FAM 표지 올리고뉴클레오티드 띠의 형광을 검출합니다.
결과
그림 2는 세 가지 다른 구조로 접힌 TBA 올리고뉴클레오티드에 대한 B-CeP 1을 사용한 프로토콜에 설명된 대로 수행된 화학 매핑 분석의 대표적인 결과를 보여줍니다. TBA(G4-TBA)의 G-4중이중 배열은 BPE에서 올리고뉴클레오티드를 접고 K+ 양이온의 존재 하에서 얻은 반면, 동일한 TBA 서열의 단일 가닥 형태(ssTBA)는 칼륨이 없는 상태에서 접혔습니다. 이중-가닥 구조체(dsTBA)?...
토론
G-quadruplex는 일반적으로 구아닌이 풍부한 DNA 염기서열 내에서 접히는 핵산 2차 구조이며, 유전적 제어 및 질병과의 연관성 때문에 중요한 연구 대상입니다. B-CePs에 의한 화학적 매핑은 생리학적 염분 조건에서 G-tetrads의 형성에 관여하는 구아닌 염기를 식별하는 데 사용할 수 있는 DNA G4의 특성 분석에 유용한 프로토콜입니다.
이 프로토콜에 사용된 화학 프로브는 B-CeP 1(
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 파도바 대학교 제약 및 약리학과(PRIDJ-BIRD2019)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Acrylamide/bis-acrylamide solution 40% | Applichem | A3658 | R45-46-20/21-25-36/38-43-48/23/ 24/25-62 |
| Ammonium per-sulfate (APS) | Sigma Aldrich | A7460 | |
| Analytical balance | Mettler Toledo | ||
| Autoclave | pbi international | ||
| Boric acid | Sigma Aldrich | B0252 | |
| Bromophenol blue Brilliant blue R | Sigma Aldrich | B0149 | |
| di-Sodium hydrogen phosphate dodecahydrate | Fluka | 71649 | |
| DMSO | Sigma Aldrich | 276855 | |
| DNA oligonucleotides | Integrated DNA Technologies | synthesis of custom sequences | |
| EDTA disodium | Sigma Aldrich | E5134 | |
| Formamide | Fluka | 40248 | H351-360D-373 |
| Gel imager | GE Healtcare | STORM B40 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Micro tubes 0.5 mL | Sarstedt | 72.704 | |
| Potassium Chloride | Sigma Aldrich | P9541 | |
| Sequencing apparatus | Biometra | Model S2 | |
| Silanization solution I | Fluka | 85126 | H225, 314, 318, 336, 304, 400, 410 |
| Sodium phosphate monobasic | Carlo Erba | 480086 | |
| Speedvac concentrator | Thermo Scientific | Savant DNA 120 | |
| TEMED | Fluka | 87689 | R11-21/22-23-34 |
| Tris-HCl | MERCK | 1.08387.2500 | |
| Urea | Sigma Aldrich | 51456 | |
| UV-Vis spectrophotometer | Thermo Scientific | Nanodrop 1000 |
참고문헌
- Davis, J. T. G-quartets 40 years later: from 5'-GMP to molecular biology and supramolecular chemistry. Angewandte Chemie. 43 (6), 668-698 (2004).
- Varshney, D., Spiegel, J., Zyner, K., Tannahill, D., Balasubramanian, S. The regulation and functions of DNA and RNA G-quadruplexes. Nature Reviews Molecular Cell Biology. 21 (8), 459-474 (2020).
- Chambers, V. S., et al. High-throughput sequencing of DNA G-quadruplex structures in the human genome. Nature Biotechnology. 33 (8), 877-881 (2015).
- Zuravka, I., Sosic, A., Gatto, B., Gottlich, R. Synthesis and evaluation of a bis-3-chloropiperidine derivative incorporating an anthraquinone pharmacophore. Bioorganic & Medicinal Chemistry Letters. 25 (20), 4606-4609 (2015).
- Zuravka, I., Roesmann, R., Sosic, A., Gottlich, R., Gatto, B. Bis-3-chloropiperidines containing bridging lysine linkers: Influence of side chain structure on DNA alkylating activity. Bioorganic & Medicinal Chemistry. 23 (6), 1241-1250 (2015).
- Zuravka, I., et al. Synthesis and DNA cleavage activity of bis-3-chloropiperidines as alkylating agents. ChemMedChem. 9 (9), 2178-2185 (2014).
- Sosic, A., Gottlich, R., Fabris, D., Gatto, B. B-CePs as cross-linking probes for the investigation of RNA higher-order structure. Nucleic Acids Research. 49 (12), 6660-6672 (2021).
- Sosic, A., et al. Bis-3-chloropiperidines targeting TAR RNA as a novel strategy to impair the HIV-1 nucleocapsid protein. Molecules. 26 (7), 1874 (2021).
- Sosic, A., et al. In vitro evaluation of bis-3-chloropiperidines as RNA modulators targeting TAR and TAR-protein interaction. International Journal of Molecular Sciences. 23 (2), 582 (2022).
- Sosic, A., et al. Direct and topoisomerase II mediated DNA damage by bis-3-chloropiperidines: The importance of being an earnest G. ChemMedChem. 12 (17), 1471-1479 (2017).
- Bock, L. C., Griffin, L. C., Latham, J. A., Vermaas, E. H., Toole, J. J. Selection of single-stranded DNA molecules that bind and inhibit human thrombin. Nature. 355 (6360), 564-566 (1992).
- Paborsky, L. R., McCurdy, S. N., Griffin, L. C., Toole, J. J., Leung, L. L. The single-stranded DNA aptamer-binding site of human thrombin. The Journal of Biological Chemistry. 268 (28), 20808-20811 (1993).
- Carraro, C., et al. Behind the mirror: chirality tunes the reactivity and cytotoxicity of chloropiperidines as potential anticancer agents. ACS Medicinal Chemistry Letters. 10 (4), 552-557 (2019).
- Carraro, C., et al. Appended aromatic moieties in flexible bis-3-chloropiperidines confer tropism against pancreatic cancer cells. ChemMedChem. 16 (5), 860-868 (2021).
- Kypr, J., Kejnovska, I., Renciuk, D., Vorlickova, M. Circular dichroism and conformational polymorphism of DNA. Nucleic Acids Research. 37 (6), 1713-1725 (2009).
- Onel, B., Wu, G., Sun, D., Lin, C., Yang, D. Electrophoretic mobility shift assay and dimethyl sulfate footprinting for characterization of G-quadruplexes and G-quadruplex-protein complexes. Methods in Molecular Biology. 2035, 201-222 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유