É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
In vitro Mapeamento químico de estruturas do DNA G-Quadruplex por bis-3-cloropiperidinas;
Neste Artigo
Resumo
Bis-3-cloropiperidinas (B-CePs) são sondas químicas úteis para identificar e caracterizar estruturas G-quadruplex em modelos de DNA in vitro. Este protocolo detalha o procedimento para realizar reações de sondagem com B-CePs e para resolver produtos da reação por eletroforese em gel de poliacrilamida de alta resolução.
Resumo
G-quadruplexes (G4s) são estruturas de DNA biologicamente relevantes, não canônicas, que desempenham um papel importante na expressão gênica e doenças, representando alvos terapêuticos significativos. Métodos acessíveis são necessários para a caracterização in vitro do DNA dentro de potenciais sequências formadoras de G-quadruplex (PQSs). B-CePs são uma classe de agentes alquilantes que provaram ser sondas químicas úteis para a investigação da estrutura de ordem superior dos ácidos nucléicos. Este trabalho descreve um novo ensaio de mapeamento químico explorando a reatividade específica de B-CePs com o N7 de guaninas, seguido de clivagem direta em Gs alquilada.
Ou seja, para distinguir as dobras G4 das formas de DNA desdobradas, usamos B-CeP 1 para sondar o aptâmero ligante de trombina (TBA), um DNA de 15 meros capaz de assumir o arranjo G4. A reação de guaninas que respondem a B-CeP com B-CeP 1 produz produtos que podem ser resolvidos por eletroforese em gel de poliacrilamida de alta resolução (PAGE) em nível de nucleotídeo único, localizando adutos de alquilação individuais e clivagem de fita de DNA nas guaninas alquiladas. O mapeamento utilizando B-CePs é uma ferramenta simples e poderosa para a caracterização in vitro de sequências de DNA formador de G-quadruplex, possibilitando a localização precisa de guaninas envolvidas na formação de G-tétrades.
Introdução
Além da típica dupla hélice de Watson-Crick, os ácidos nucléicos podem adotar várias estruturas secundárias, como a forma alternativa G-quadruplex (G4), devido às suas sequências ricas em guanina. A estrutura G4 é baseada na formação de tetrâmeros planares, chamados de G-tétrades, nos quais quatro guaninas interagem através de ligações de hidrogênio Hoogsteen. As tétrades G são empilhadas e posteriormente estabilizadas por cátions monovalentes que são coordenados no centro do núcleo da guanina (Figura 1)1.
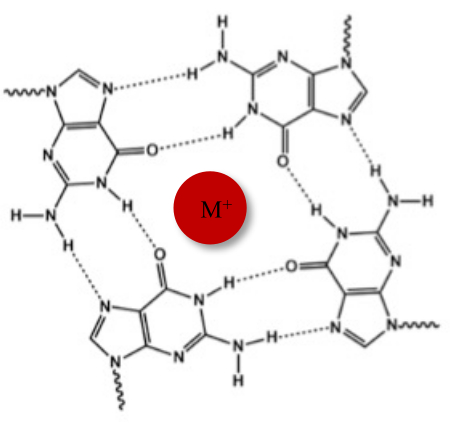
Figura 1: Representação esquemática de uma estrutura G-quadruplex (A) Representação esquemática de um G-tétrade. A matriz planar é estabilizada pelo pareamento de bases de Hoogsteen e por um cátion central (M+). Clique aqui para ver uma versão maior desta figura.
Sequências com quatro ou mais tiragens de pelo menos dois nucleotídeos guaninos consecutivos são potenciais sequências formadoras de G-quadruplex (PQSs) que podem dobrar em estruturas G-quadruplex . Os PQS estão localizados em diversos contextos celulares, como telômeros, promotores gênicos, DNA ribossomal e sítios de recombinação, e estão envolvidos na regulação de muitos processos biológicos2. Assim, a identificação e validação experimental de G4s no genoma humano, que atualmente é realizada principalmente por meio de ferramentas computacionais, é uma questão biologicamente relevante3. A fim de apoiar predições computacionais ou detectar estruturas G4 imprevisíveis, um método acessível baseado em mapeamento químico para identificar a formação de G4 em um molde de DNA é mostrado aqui, permitindo a identificação precisa de guaninas que formam a estrutura G-tétrade.
O ensaio de mapeamento químico relatado explora a reatividade diferente de bis-3-cloropiperidinas (B-CePs) com guaninas após a formação de estruturas G4. Devido à sua alta reatividade com nucleófilos 4,5,6,7,8,9, as B-CePs são agentes alquilantes de ácidos nucleicos com capacidade de reagir de forma muito eficiente com a posição N 7 dos nucleotídeos guanina10. A alquilação é seguida por depuração e clivagem de fitas em construções de DNA de fita simples e dupla. Pelo contrário, guaninas envolvidas na formação das G-tétrades em arranjos G4 são impermeáveis à alquilação B-CeP, já que a posição N7 das guaninas está implicada nas ligações de hidrogênio Hoogsteen. Essa reatividade específica dos B-CePs permite não apenas a detecção de estruturas G4, mas também a identificação das guaninas que formam a(s) tétrade(s), pois elas podem ser deduzidas de sua relativa proteção contra alquilação em comparação com guaninas em DNA de fita simples e dupla.
O protocolo de mapeamento químico é relatado aqui usando B-CeP 1 (Figura 2A) como sonda para a caracterização do aptâmero ligante de trombina (TBA), um DNA de 15 meros capaz de assumir o arranjo G4 na presença de cátions potássio11,12. O arranjo G4 do TBA (G4-TBA) é diretamente comparado com dois controles, a saber, TBA na forma de fita simples (ssTBA) e TBA recozido em sua sequência complementar para formar o construto de fita dupla (dsTBA) (Tabela 1). Os produtos das reações de sondagem são resolvidos por eletroforese em gel de poliacrilamida de alta resolução (PAGE) no nível de nucleotídeo único, localizando adutos de alquilação individuais e clivagem de fita de DNA nas guaninas alquiladas. A visualização do gel é possibilitada pela conjugação do oligonucleotídeo TBA com um fluoróforo em sua extremidade 3' (Tabela 1). Este protocolo mostra como dobrar TBA em suas diferentes conformações (G4 e controles), e como realizar reações de sondagem com B-CePs seguido de PAGE.
Protocolo
1. Ácido nucleico e preparação de sonda química
- Ácidos nucleicos
NOTA: O oligonucleotídeo denominado "TBA" é a sequência de DNA de 15 meros 5'-GGT-TGG-TGT-GGT-TGG-3' marcada na extremidade 3' pelo fluoróforo 5-carboxifluoresceína (FAM) para permitir a visualização no gel. O oligonucleotídeo não marcado "cTBA" é sua sequência complementar de DNA 5'-CCA-ACC-ACA-CCA-ACC-3'. A TBA e a CBT são empregadas para a obtenção das três diferentes estruturas, como mostra a Tabela 1.- Ponteiras de autoclave e tubos de 0,5 mL para obtenção de descartáveis estéreis e evitar contaminação.
- Preparar soluções-mãe solubilizando cada oligonucleotídeo em água ultrapura até uma concentração final de 100 μM. Determinar a concentração exata de oligonucleotídeos com um espectrofotômetro ultravioleta-visível (UV-Vis), usando o coeficiente de extinção a 260 nm fornecido pelo fabricante.
OBS: Foram utilizados coeficientes de extinção: 164.300 M-1 cm-1 e 138.600 M-1 cm-1 para TBA e CBAc, respectivamente. - Armazenar soluções estoque de TBA e cTBA a -20 °C (por meses nessas condições).
- Composto B-CeP 1
NOTA: O composto B-CeP 1 é sintetizado como relatado anteriormente6.- Prepare a solução-mãe B-CeP 1 a ~10 mM. Pesar ~1 mg do composto liofilizado usando uma balança analítica localizada em uma capela de fumaça e solubilizá-lo em 100% dimetilsulfóxido (DMSO).
- Calcular a concentração exata do composto com base na quantidade real de composto e DMSO (d = 1,1 g/cm3) usado.
OBS: Manipular o composto com luvas o tempo todo (tanto quando liofilizado quanto quando dissolvido em DMSO)13,14.
Tabela 1: Estruturas de oligonucleotídeos utilizadas neste protocolo. Clique aqui para baixar esta tabela.
2. Enovelamento de construções de ácidos nucleicos
- Preparação de tampões
- Preparar uma solução tampão BPE (ácido bifosfato-etilenodiaminotetracético [EDTA], 5x: 2 mM NaH 2 PO4, 6 mM Na 2 HPO 4, 1 mM Na2EDTA, pH7,4) e uma solução de 500 mM KCl em água ultrapura. Filtrar as soluções através de filtros de tamanho de poro de 0,22 μm.
NOTA: Para obter melhores resultados, use soluções recém-preparadas. O tampão BPE pode ser armazenado a 4 °C por até 15 dias.
- Preparar uma solução tampão BPE (ácido bifosfato-etilenodiaminotetracético [EDTA], 5x: 2 mM NaH 2 PO4, 6 mM Na 2 HPO 4, 1 mM Na2EDTA, pH7,4) e uma solução de 500 mM KCl em água ultrapura. Filtrar as soluções através de filtros de tamanho de poro de 0,22 μm.
- Dobramento de amostras de G4-TBA, ssTBA e dsTBA pelo procedimento de redobramento térmico
NOTA: Cátions potássio são necessários para dobrar a estrutura G4 (G4-TBA). Não adicionar cátions potássio na solução de dobramento dos controles ssTBA e dsTBA.- Preparar 40 μL de uma solução de 4 μM de G4-TBA em 1x BPE e 100 mM KCl. Desnaturar a solução de oligonucleotídeo G4-TBA aquecendo o tubo a 95 °C por 5 min e resfriá-lo lentamente até a temperatura ambiente (TR) para permitir que o TBA se dobre em G-quadruplexes.
- Preparar 40 μL de uma solução de 4 μM de ssTBA em 1x BPE. Efectuar o procedimento de redobração térmica, tal como referido no ponto 2.2.1, para dobrar o TBA na sua forma de fita simples.
- Preparar 40 μL de uma solução de 4 μM de dsTBA misturando quantidades equimolares de TBA e cTBA em 1x BPE. Executar o procedimento de redobramento térmico conforme mencionado acima (passo 2.2.1) para que o TBA recoza à sua sequência complementar de TBA e forme a forma de fita dupla do TBA.
NOTA: O volume final de cada solução de dobramento é baseado no número de amostras para as reações de sondagem, considerando que serão necessários 5 μL de solução de 4 μM para cada amostra. Prepare um pouco o volume excedente de cada solução para evitar erros de pipetagem.
3. Reações de sondagem
NOTA: As reações de sondagem devem ser feitas imediatamente após o procedimento de redobramento térmico.
- Quando as soluções de dobramento de G4-TBA, ssTBA e dsTBA tiverem resfriado para RT, execute uma centrifugação de spin curto (7.000 × g para 5-8 s em RT) e inicie as reações de sondagem.
- Preparar 21 tubos autoclavados vazios de 0,5 mL. Organizá-los em três conjuntos de sete tubos cada no rack para amostras de laboratório, conforme relatado na Tabela 2.
NOTA: Cada conjunto de colunas corresponde às três diferentes condições de dobramento de TBA G4-TBA, ssTBA e dsTBA. Cada linha corresponde a três tempos de incubação diferentes. Cada célula dentro da coluna corresponde à concentração final da sonda B-CeP 1 (Tabela 2). Certifique-se de rotular claramente os tubos. - Adicione 3 μL de água ultrapura em cada tubo.
- Adicionar 5 μL de G4-TBA dobrado em cada tubo do primeiro conjunto (passo 3.2). Adicionar 5 μL de ssTBA dobrado em cada tubo do segundo conjunto. Adicionar 5 μL de dsTBA dobrado em cada tubo do terceiro conjunto.
- Diluir a solução-mãe B-CeP 1 para 250 μM e 25 μM em água ultrapura.
NOTA: As diluições da sonda química B-CeP 1 devem ser preparadas na hora e reagir imediatamente com o substrato de ADN para evitar reacções concorrentes com a água. - Adicionar 2 μL da diluição B-CeP 1 adequada (25 μM e 250 μM) às amostras. Substitua o composto por água ultrapura nas três amostras de controle (C) para análise dos TBAs dobrados de forma diferente na ausência do composto. Incubar todas as amostras a 37 °C.
- Após 1 h, 4 h e 15 h de incubação, pare a reação colocando os tubos a -20 °C até a próxima etapa.
NOTA: As amostras podem ser armazenadas nestas condições durante alguns dias. - Secar as amostras em centrífuga a vácuo.
NOTA: As amostras secas podem ser armazenadas a -20 °C durante semanas antes de prosseguir com a análise PAGE.
Tabela 2: Amostras para as reações de sondagem (estruturas, concentrações de sonda e tempo de incubação). Cada conjunto de colunas corresponde às três diferentes condições de dobramento da TBA (G4-TBA, ssTBA e dsTBA). Cada linha corresponde a três tempos de incubação diferentes (1, 4, 15 h). Cada célula dentro da coluna corresponde à concentração final da sonda B-CeP 1 (5 ou 50 μM). O controle (C) para cada conjunto corresponde a uma amostra dos TBAs dobrados de forma diferente incubados por maior tempo (15 h) na ausência do composto. Clique aqui para baixar esta tabela.
4. PÁGINA de alta resolução
- Preparação da solução desnaturante de poliacrilamida
NOTA: Preparar com antecedência 500 mL de solução de gel de poliacrilamida desnaturante a 20%. Cerca de 80 mL dessa solução serão utilizados para cada experimento. Use uma garrafa de vidro âmbar ou cubra uma garrafa de vidro com papel alumínio para armazenar a solução em RT.
CUIDADO: A poliacrilamida é neurotóxica. Durante todas as etapas de preparação e derramamento do gel, use luvas e jaleco. Descarte a acrilamida polimerizada em caixa apropriada para materiais contaminados.- Pesar 210 g de ureia num copo de 1 L. Adicionar 250 mL de solução de acrilamida/bisacrilamida a 40% (19/1) e 50 mL de TBE 10x (Tris-HCl 890 mM, borato 890 mM, EDTA 20 mM, pH 8).
- Coloque o copo num prato agitado e misture a solução com uma vareta agitadora. Cubra o copo com papel alumínio durante a mistura para evitar respingos e contaminação.
- Misture a solução até que a ureia esteja completamente dissolvida e a solução esteja límpida.
Observação : esta etapa pode levar muitas horas. Para promover a dissolução da ureia, adicione uma pequena alíquota de água sem ultrapassar o volume final desejado. - Retire a haste de agitação. Deite a solução num cilindro e adicione água a um volume final exato de 500 ml.
- Instalação de aparelhos de gel
- Limpe duas placas (uma com entalhe e outra sem entalhe) com etanol a 70%, deixe-as secar e, em seguida, trate as placas com uma solução de dimetildiclorosilano.
NOTA: A silanização pode ser ignorada, embora ajude a liberar o gel de uma das placas quando o sanduíche de gel é desmontado.
CUIDADO: Manuseie a solução de silanização com luvas e realize o tratamento da placa com esta solução em uma coifa de fumaça. - Coloque os espaçadores de 0,4 mm ao longo das bordas longas da placa mais longa, coloque a placa curta em cima da outra e alinhe as duas placas na parte inferior.
- Coloque várias camadas de fita de papel ao longo de todas as bordas, exceto na parte superior.
- Para evitar vazamentos durante a fundição, adicione uma camada adicional de fita ao fundo do gel.
- Encaixe as laterais do sanduíche de vidro com abraçadeiras limpas seguindo as instruções do fornecedor (diferentes fornecedores usam aparelhos ligeiramente diferentes, abraçadeiras de sanduíche e juntas).
- Limpe duas placas (uma com entalhe e outra sem entalhe) com etanol a 70%, deixe-as secar e, em seguida, trate as placas com uma solução de dimetildiclorosilano.
- Despejando o gel
NOTA: Deite o gel em RT (25 °C), uma vez que a polimerização da poliacrilamida é sensível à temperatura.- Num béquer, deitar 80 ml da solução de poliacrilamida desnaturante previamente preparada (passo 4.1), 450 μL de uma solução de persulfato de amónio (APS) a 10% m/V e 45 μL de tetrametiletilenodiamina (TEMED) imediatamente antes da utilização.
- Misture a solução e despeje-a rapidamente entre as placas de vidro usando uma seringa de 50 mL. Introduza o pente com o número desejado de poços entre as placas de vidro, evitando bolhas. Adicione a solução de gel para encher o sanduíche completamente, se necessário. Coloque quatro grampos no pente para pressionar para baixo e permitir uma distribuição uniforme dos poços.
- Deixe o gel polimerizar por pelo menos 45 min.
- Executando o gel
- Após a polimerização, remova todas as abraçadeiras e camadas de fita adesiva. Retire o pente lentamente e enxágue bem os poços com água destilada.
- Siga as instruções do fornecedor específico para colocar corretamente o sanduíche de gel no aparelho de eletroforese vertical de gel.
- Prepare o tampão de funcionamento TBE (1x: 89 mM Tris-HCl, borato 89 mM, EDTA 2 mM, pH 8) em água deionizada e encha os reservatórios superior e inferior com o tampão.
- Aqueça as placas realizando uma pré-corrida da eletroforese em gel por pelo menos 30 min a 50 W.
- Preparar tampão de carregamento de gel desnaturante (DGLB: 1 M Tris-HCl, 80% formamida, 50% glicerol, 0,05% azul de bromofenol) em água ultrapura.
NOTA: O GLB ajuda a rastrear o movimento das amostras de oligonucleotídeos no sistema de gel e permite carregar as amostras nos poços do gel. A presença do agente desnaturante formamida permite que as espécies de DNA se separem de acordo com o tamanho, mesmo em um PAGE não desnaturante. - Ressuspender as amostras secas (amostras do passo 3.8) em 5 μL de DGLB.
- Antes de carregar as amostras, limpe os poços usando uma seringa pequena e o tampão TBE na câmara tampão superior para remover a ureia dos poços.
OBS: Repita este passo várias vezes para limpar com precisão os poços, evitando assim bandas difíceis de serem interpretadas. - Coloque as amostras nos poços limpos e anote a ordem de carregamento.
- Execute a eletroforese em gel por 2 h a 50 W, ou pelo menos até que o corante azul de bromofenol tenha corrido 2/3 abaixo do gel.
- Imagem do gel
- Após a eletroforese, desligue a fonte de alimentação, retire o sanduíche de vidro e limpe os óculos.
- Detecte a fluorescência das bandas de oligonucleotídeos marcadas com FAM por varredura usando um imageador de gel.
Resultados
A Figura 2 mostra um resultado representativo de um ensaio de mapeamento químico realizado, conforme descrito no protocolo com B-CeP 1, sobre o oligonucleotídeo TBA dobrado em três estruturas diferentes. O arranjo G-quadruplex do TBA (G4-TBA) foi obtido dobrando o oligonucleotídeo em BPE e na presença do cátion K+, enquanto a forma de fita simples da mesma sequência de TBA (ssTBA) foi dobrada na ausência de potássio. O construto de fita dupla (dsTBA) foi preparado por rec...
Discussão
G-quadruplexos são estruturas secundárias de ácidos nucleicos que tipicamente se dobram dentro de sequências de DNA ricas em guanina, e são alvos significativos de pesquisa por causa de sua associação com controle genético e doenças. O mapeamento químico por B-CePs é um protocolo útil para a caracterização do DNA G4s, que pode ser usado para identificar as bases guaninas envolvidas na formação de G-tétrades sob condições fisiológicas salinas.
A sonda química utilizada nest...
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Este trabalho foi apoiado pelo Departamento de Ciências Farmacêuticas e Farmacológicas da Universidade de Padova (PRIDJ-BIRD2019).
Materiais
| Name | Company | Catalog Number | Comments |
| Acrylamide/bis-acrylamide solution 40% | Applichem | A3658 | R45-46-20/21-25-36/38-43-48/23/ 24/25-62 |
| Ammonium per-sulfate (APS) | Sigma Aldrich | A7460 | |
| Analytical balance | Mettler Toledo | ||
| Autoclave | pbi international | ||
| Boric acid | Sigma Aldrich | B0252 | |
| Bromophenol blue Brilliant blue R | Sigma Aldrich | B0149 | |
| di-Sodium hydrogen phosphate dodecahydrate | Fluka | 71649 | |
| DMSO | Sigma Aldrich | 276855 | |
| DNA oligonucleotides | Integrated DNA Technologies | synthesis of custom sequences | |
| EDTA disodium | Sigma Aldrich | E5134 | |
| Formamide | Fluka | 40248 | H351-360D-373 |
| Gel imager | GE Healtcare | STORM B40 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Micro tubes 0.5 mL | Sarstedt | 72.704 | |
| Potassium Chloride | Sigma Aldrich | P9541 | |
| Sequencing apparatus | Biometra | Model S2 | |
| Silanization solution I | Fluka | 85126 | H225, 314, 318, 336, 304, 400, 410 |
| Sodium phosphate monobasic | Carlo Erba | 480086 | |
| Speedvac concentrator | Thermo Scientific | Savant DNA 120 | |
| TEMED | Fluka | 87689 | R11-21/22-23-34 |
| Tris-HCl | MERCK | 1.08387.2500 | |
| Urea | Sigma Aldrich | 51456 | |
| UV-Vis spectrophotometer | Thermo Scientific | Nanodrop 1000 |
Referências
- Davis, J. T. G-quartets 40 years later: from 5'-GMP to molecular biology and supramolecular chemistry. Angewandte Chemie. 43 (6), 668-698 (2004).
- Varshney, D., Spiegel, J., Zyner, K., Tannahill, D., Balasubramanian, S. The regulation and functions of DNA and RNA G-quadruplexes. Nature Reviews Molecular Cell Biology. 21 (8), 459-474 (2020).
- Chambers, V. S., et al. High-throughput sequencing of DNA G-quadruplex structures in the human genome. Nature Biotechnology. 33 (8), 877-881 (2015).
- Zuravka, I., Sosic, A., Gatto, B., Gottlich, R. Synthesis and evaluation of a bis-3-chloropiperidine derivative incorporating an anthraquinone pharmacophore. Bioorganic & Medicinal Chemistry Letters. 25 (20), 4606-4609 (2015).
- Zuravka, I., Roesmann, R., Sosic, A., Gottlich, R., Gatto, B. Bis-3-chloropiperidines containing bridging lysine linkers: Influence of side chain structure on DNA alkylating activity. Bioorganic & Medicinal Chemistry. 23 (6), 1241-1250 (2015).
- Zuravka, I., et al. Synthesis and DNA cleavage activity of bis-3-chloropiperidines as alkylating agents. ChemMedChem. 9 (9), 2178-2185 (2014).
- Sosic, A., Gottlich, R., Fabris, D., Gatto, B. B-CePs as cross-linking probes for the investigation of RNA higher-order structure. Nucleic Acids Research. 49 (12), 6660-6672 (2021).
- Sosic, A., et al. Bis-3-chloropiperidines targeting TAR RNA as a novel strategy to impair the HIV-1 nucleocapsid protein. Molecules. 26 (7), 1874 (2021).
- Sosic, A., et al. In vitro evaluation of bis-3-chloropiperidines as RNA modulators targeting TAR and TAR-protein interaction. International Journal of Molecular Sciences. 23 (2), 582 (2022).
- Sosic, A., et al. Direct and topoisomerase II mediated DNA damage by bis-3-chloropiperidines: The importance of being an earnest G. ChemMedChem. 12 (17), 1471-1479 (2017).
- Bock, L. C., Griffin, L. C., Latham, J. A., Vermaas, E. H., Toole, J. J. Selection of single-stranded DNA molecules that bind and inhibit human thrombin. Nature. 355 (6360), 564-566 (1992).
- Paborsky, L. R., McCurdy, S. N., Griffin, L. C., Toole, J. J., Leung, L. L. The single-stranded DNA aptamer-binding site of human thrombin. The Journal of Biological Chemistry. 268 (28), 20808-20811 (1993).
- Carraro, C., et al. Behind the mirror: chirality tunes the reactivity and cytotoxicity of chloropiperidines as potential anticancer agents. ACS Medicinal Chemistry Letters. 10 (4), 552-557 (2019).
- Carraro, C., et al. Appended aromatic moieties in flexible bis-3-chloropiperidines confer tropism against pancreatic cancer cells. ChemMedChem. 16 (5), 860-868 (2021).
- Kypr, J., Kejnovska, I., Renciuk, D., Vorlickova, M. Circular dichroism and conformational polymorphism of DNA. Nucleic Acids Research. 37 (6), 1713-1725 (2009).
- Onel, B., Wu, G., Sun, D., Lin, C., Yang, D. Electrophoretic mobility shift assay and dimethyl sulfate footprinting for characterization of G-quadruplexes and G-quadruplex-protein complexes. Methods in Molecular Biology. 2035, 201-222 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados