需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
体外研究双-3-氯哌啶对G-四链体DNA结构的化学定位
摘要
双-3-氯哌啶 (B-CePs) 是有用的化学探针,用于在体外鉴定和表征 DNA 模板中的 G-四链 体结构。该协议详细介绍了用B-CeP进行探测反应和通过高分辨率聚丙烯酰胺凝胶电泳分离反应产物的过程。
摘要
G-四链体 (G4s) 是生物学相关的非典型 DNA 结构,在基因表达和疾病中起重要作用,代表重要的治疗靶点。在潜在的 G 四链体形成序列 (PQS) 中对 DNA 进行 体外 表征需要可用的方法。B-CeP是一类烷化剂,已被证明是研究核酸高级结构的有用化学探针。本文描述了一种新的化学定位分析方法,利用 B-CePs 与鸟嘌呤 N7 的特异性反应性,然后在烷基化 Gs 处直接链裂解。
也就是说,为了区分 G4 折叠和未折叠的 DNA 形式,我们使用 B-CeP 1 探测凝血酶结合适配体 (TBA),这是一种能够承担 G4 排列的 15 聚体 DNA。B-CeP 响应鸟嘌呤与 B-CeP 1 的反应产生的产物可以通过高分辨率聚丙烯酰胺凝胶电泳 (PAGE) 在单核苷酸水平上解析,方法是在烷基化鸟嘌呤上定位单个烷基化加合物和 DNA 链切割。使用 B-CePs 进行定位是一种简单而强大的工具,用于体 外 表征 G-四链体形成的 DNA 序列,能够精确定位参与 G-四链体形成的鸟嘌呤。
引言
除了典型的 Watson-Crick 双螺旋结构外,核酸还可以采用各种二级结构,例如替代的 G-四链体 (G4) 形式,因为它们富含鸟嘌呤的序列。G4 结构基于平面四聚体的形成,称为 G-四聚体,其中四个鸟嘌呤通过 Hoogsteen 氢键相互作用。G-四分体通过在鸟嘌呤核心中心配位的一价阳离子堆叠并进一步稳定(图1)1。
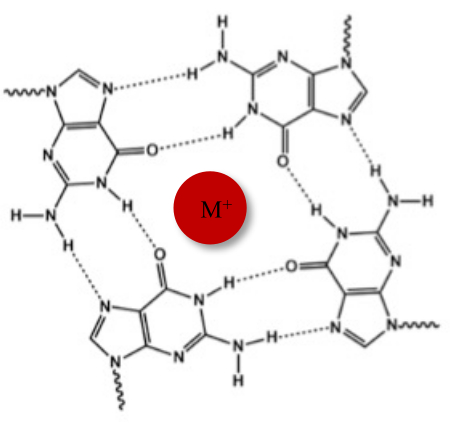
图 1:G 四链体结构的示意图。 (A) G-四联体的示意图。平面阵列通过Hoogsteen碱基配对和中心阳离子(M +)稳定。请点击这里查看此图的较大版本.
具有至少两个连续鸟嘌呤核苷酸的四次或更多次运行的序列是潜在的 G 四链体形成序列 (PQS),它们可以折叠成 G 四链体结构。PQS 位于许多不同的细胞环境中,例如端粒、基因启动子、核糖体 DNA 和重组位点,并参与许多生物过程的调节2。因此,目前主要通过计算工具进行的人类基因组中 G4 的鉴定和实验验证是一个生物学相关问题3。为了支持计算预测或检测不可预测的 G4 结构,本文展示了一种基于化学图谱的可识别方法,用于识别 DNA 模板中 G4 的形成,从而能够精确识别形成 G-四体结构的鸟嘌呤。
报道的化学定位分析利用了双-3-氯哌啶 (B-CePs) 在 G4 结构形成后与鸟嘌呤的不同反应性。由于 B-CeP 与亲核试剂 4,5,6,7,8,9 的高反应性,因此是核酸烷基化剂,能够非常有效地与鸟嘌呤核苷酸10 的 N 7 位置反应。烷基化之后是单链和双链 DNA 构建体中的脱嘌呤和链切割。相反,参与 G4 排列中 G-四分体形成的鸟嘌呤不受 B-CeP 烷基化的影响,因为鸟嘌呤的 N7 位置与 Hoogsteen 氢键有关。B-CePs 的这种特异性反应性不仅可以检测 G4 结构,还可以鉴定形成四联体的鸟嘌呤,因为与单链和双链 DNA 中的鸟嘌呤相比,它们可以从相对保护中推断出免受烷基化的影响。
本文报道了使用 B-CeP 1(图 2A)作为表征凝血酶结合适配体 (TBA) 的探针的化学定位方案,TBA 是一种 15 聚体 DNA,能够在钾阳离子存在下呈现 G4 排列11,12。将TBA(G4-TBA)的G4排列直接与两个对照进行比较,即单链形式的TBA(ssTBA)和TBA退火到其互补序列以形成双链结构(dsTBA)(表1)。探测反应产物通过在烷基化鸟嘌呤上定位单个烷基化加合物和 DNA 链切割,在单核苷酸水平上通过高分辨率聚丙烯酰胺凝胶电泳 (PAGE) 进行解析。通过将TBA寡核苷酸与3'端的荧光基团偶联,可以在凝胶上实现可视化(表1)。该协议显示了如何将TBA折叠在其不同的构象(G4和对照)中,以及如何使用B-CeP后跟PAGE进行探测反应。
研究方案
1.核酸及化学探针制备
- 核酸
注:名为“TBA”的寡核苷酸是 15-mer DNA 序列 5'-GGT-TGG-TGT-GGT-TGG-TGG-3',由荧光基团 5-羧基荧光素 (FAM) 在 3'-末端标记,以实现凝胶上的可视化。未标记的寡核苷酸“cTBA”是其DNA互补序列5'-CCA-ACC-ACA-CCA-ACC-3'。采用TBA和cTBA获得三种不同的结构,如 表1所示。- 高压灭菌器吸头和 0.5 mL 试管,以获得无菌一次性用品并避免污染。
- 制备将每种寡核苷酸溶解在超纯水中至终浓度为100μM的储备溶液。 使用制造商提供的260nm处的消光系数,使用紫外可见(UV-Vis)分光光度计确定确切的寡核苷酸浓度。
注:消光系数:TBA 和 cTBA 分别使用 164,300 M-1 cm-1 和 138,600 M-1 cm-1。 - 将TBA和cTBA储备溶液储存在-20°C(在这些条件下储存数月)。
- 化合物 B-CeP 1
注:化合物 B-CeP 1 的合成如前所述6.- 制备~10mM的B-CeP 1储备溶液。使用位于通风橱中的分析天平称取~1mg冻干化合物,并将其溶解在100%二甲基亚砜(DMSO)中。
- 根据实际使用的化合物和DMSO(d = 1.1 g / cm3)的量计算确切的化合物浓度。
注意:始终戴手套处理化合物(冻干和溶解在DMSO中时)13,14。
表1:该协议中使用的寡核苷酸结构。请按此下载此表格。
2. 核酸构建体的折叠
- 缓冲液的制备
- 制备BPE缓冲溶液(二磷酸 - 乙二胺四乙酸[EDTA],5x:2mM NaH 2 PO 4,6mMNa 2 HPO 4,1mM Na2EDTA,pH7.4)和500mM KCl的超纯水溶液。通过0.22μm孔径过滤器过滤溶液。
注意:为获得最佳效果,请使用新鲜制备的溶液。BPE缓冲液可在4°C下储存长达15天。
- 制备BPE缓冲溶液(二磷酸 - 乙二胺四乙酸[EDTA],5x:2mM NaH 2 PO 4,6mMNa 2 HPO 4,1mM Na2EDTA,pH7.4)和500mM KCl的超纯水溶液。通过0.22μm孔径过滤器过滤溶液。
- 通过热复性程序折叠 G4-TBA、ssTBA 和 dsTBA 样品
注意:钾阳离子是折叠 G4 结构 (G4-TBA) 所必需的。不要在对照ssTBA和dsTBA的折叠溶液中添加钾阳离子。- 在1x BPE和100mM KCl中制备40μL的4μMG4-TBA溶液。 通过将管加热至95°C5分钟并使寡核苷酸G4-TBA溶液变性,并将其缓慢冷却至室温(RT),使TBA折叠成G-四链体。
- 在1x BPE中制备40μL的4μMsTBA溶液。执行步骤 2.2.1 中提到的热复性程序,以单链形式折叠 TBA。
- 通过在1x BPE中混合等摩尔量的TBA和cTBA,制备40μL的4μMdsTBA溶液。执行上述热复性程序(步骤2.2.1),使TBA退火到其互补序列cTBA并形成TBA的双链形式。
注:考虑到每个样品需要 5 μL 的 4 μM 溶液,每个折叠溶液的最终体积基于探测反应的样品数量。准备少量过量的每种溶液,以避免移液错误。
3. 探测反应
注意:探测反应必须在热复性程序后立即进行。
- 当G4-TBA,ssTBA和dsTBA的折叠溶液冷却至室温时,进行短离心(室温下7,000× g ,持续5-8秒)并开始探测反应。
- 准备 21 个空的 0.5 mL 高压灭菌管。如 表2所示,将它们组织在三组,每组七个管中,用于实验室样品。
注意:每个列集对应三种不同的 TBA 折叠条件 G4-TBA、ssTBA 和 dsTBA。每行对应三个不同的孵育时间。色谱柱内的每个细胞对应于最终的B-CeP 1探针浓度(表2)。确保清楚地标记试管。 - 在每个试管中加入 3 μL 超纯水。
- 在第一组的每个管中加入5μL折叠的G4-TBA(步骤3.2)。在第二组的每个管中加入 5 μL 折叠的 ssTBA。在第三组的每个试管中加入 5 μL 折叠的 dsTBA。
- 在超纯水中将 B-CeP 1 储备溶液稀释至 250 μM 和 25 μM。
注意:B-CeP 1化学探针的稀释液必须是新鲜制备的,并立即与DNA底物反应,以避免与水发生竞争性反应。 - 向样品中加入 2 μL 适当的 B-CeP 1 稀释液(25 μM 和 250 μM)。在三个对照样品(C)中用超纯水代替化合物,以便在没有化合物的情况下分析不同折叠的TBA。将所有样品在37°C孵育。
- 孵育1小时,4小时和15小时后,通过将管置于-20°C直至下一步来停止反应。
注意:样品可以在这些条件下储存几天。 - 在真空离心机中干燥样品。
注意:干燥的样品可以在-20°C下储存数周,然后再进行PAGE分析。
表 2:探测反应的样品(结构、探针浓度和孵育时间)。 每个色谱柱组对应于三种不同的 TBA 折叠条件(G4-TBA、ssTBA 和 dsTBA)。每行对应于三个不同的孵育时间(1,4,15小时)。色谱柱内的每个细胞对应于最终的B-CeP 1探针浓度(5或50μM)。每组的对照(C)对应于在没有化合物的情况下孵育较长时间(15小时)的不同折叠TBA的样品。 请按此下载此表格。
4.高分辨率PAGE
- 变性聚丙烯酰胺溶液的制备
注:提前准备 500 mL 20% 变性聚丙烯酰胺凝胶溶液。每个实验将使用大约 80 mL 的该溶液。使用琥珀色玻璃瓶或用铝箔盖住玻璃瓶,将溶液储存在室温下。
注意:聚丙烯酰胺具有神经毒性。在凝胶制备和倾倒的所有步骤中,戴上手套和实验室外套。将聚合丙烯酰胺丢弃在适当的盒子中,以处理受污染的材料。- 在 1 L 烧杯中称取 210 g 尿素。加入 250 mL 40% 丙烯酰胺/双丙烯酰胺 (19/1) 溶液和 50 mL 10x TBE(890 mM Tris-HCl、890 mM 硼酸盐、20 mM EDTA,pH 8)。
- 将烧杯放在搅拌板上,用搅拌棒混合溶液。搅拌时用铝箔盖住烧杯,防止飞溅和污染。
- 混合溶液,直到尿素完全溶解,溶液澄清。
注意:此步骤可能需要数小时。为了促进尿素的溶解,加入一小份等分试样的水,不要超过所需的最终体积。 - 拆下搅拌棒。将溶液倒入圆柱体中,加水至精确的最终体积为 500 mL。
- 凝胶装置的设置
- 用70%乙醇清洗两块板(一块有缺口,一块无缺口),晾干,然后用二甲基二氯硅烷溶液处理板。
注意:硅烷化可以跳过,尽管当凝胶三明治被拆开时,它有助于从其中一个板中释放凝胶。
注意: 戴手套处理硅烷化溶液,并在通风橱中用该溶液进行板处理。 - 将 0.4 毫米垫片沿较长板的长边放置,将短板放在另一块板的顶部,并将两块板对齐底部。
- 沿着除顶部以外的所有边缘放置多层纸胶带。
- 为避免在灌注过程中发生泄漏,请在凝胶底部添加一层额外的胶带。
- 按照供应商的说明,用干净的夹子夹住玻璃夹层的侧面(不同的供应商使用的设备、夹层夹具和垫圈略有不同)。
- 用70%乙醇清洗两块板(一块有缺口,一块无缺口),晾干,然后用二甲基二氯硅烷溶液处理板。
- 倒入凝胶
注意:在室温(25°C)下倒入凝胶,因为聚丙烯酰胺聚合对温度敏感。- 在烧杯中,立即使用前倒入 80 mL 先前制备的变性聚丙烯酰胺溶液(步骤 4.1)、450 μL 10% m/V 过硫酸铵 (APS) 溶液和 45 μL 四甲基乙二胺 (TEMED)。
- 混合溶液并使用 50 mL 注射器将其快速倒入玻璃板之间。在玻璃板之间引入具有所需孔数的梳子,避免气泡。如有必要,加入凝胶溶液以完全填充三明治。放置四个夹子amps 在梳子上向下压,使孔均匀分布。
- 让凝胶聚合至少45分钟。
- 电泳凝胶
- 聚合后,去除所有夹具和纸带层。慢慢取下梳子,用蒸馏水彻底冲洗孔。
- 按照特定供应商的说明将凝胶夹心正确放置在垂直凝胶电泳仪中。
- 在去离子水中制备TBE电泳缓冲液(1x:89mM Tris-HCl,89mM硼酸盐,2mM EDTA,pH 8),并用缓冲液填充顶部和底部储液槽。
- 通过在50W下进行凝胶电泳的预运行至少30分钟来预热板。
- 在超纯水中制备变性凝胶上样缓冲液(DGLB:1M Tris-HCl,80%甲酰胺,50%甘油,0.05%溴酚蓝)。
注:GLB有助于跟踪寡核苷酸样品进入凝胶系统的过程,并允许将样品加载到凝胶孔中。变性剂甲酰胺的存在使DNA物种能够根据大小分离,即使在非变性PAGE中也是如此。 - 将干燥的样品(来自步骤3.8的样品)重悬于5μL的DGLB中。
- 在加载样品之前,使用小注射器和上缓冲室中的TBE缓冲液清洁孔,以从孔中除去尿素。
注意: 重复此步骤数次以准确清洁孔,从而避免难以解释的条带。 - 将样品加载到干净的孔中,并记下加载顺序。
- 在50W下运行凝胶电泳2小时,或至少直到溴酚蓝染料在凝胶下运行2/3。
- 凝胶成像
- 电泳后,关闭电源,取下玻璃夹层,清洁眼镜。
- 通过使用凝胶成像仪扫描来检测FAM标记的寡核苷酸条带的荧光。
结果
图2显示了在折叠成三种不同结构的TBA寡核苷酸上进行化学定位测定的代表性结果,如方案中所述的B-CeP 1。TBA 的 G-四链体排列 (G4-TBA) 是通过在 BPE 中折叠寡核苷酸并在 K+ 阳离子存在下获得的,而同一 TBA 序列的单链形式 (ssTBA) 是在无钾的情况下折叠的。通过在BPE缓冲液中将TBA退火至其互补序列来制备双链构建体(dsTBA)。将终浓度为5或50μM的B-CeP 1与2μM的G4-TBA?...
讨论
G-四链体是核酸二级结构,通常折叠在富含鸟嘌呤的DNA序列中,并且由于它们与遗传控制和疾病有关,因此是重要的研究目标。B-CePs 的化学定位是表征 DNA G4s 的有用方案,可用于鉴定在生理盐条件下参与 G-四分体形成的鸟嘌呤碱基。
该协议中使用的化学探针是B-CeP 1(图2A),其通过与鸟嘌呤核碱基的 N7特异性反应,可以区分参与G-四链体四链体形...
披露声明
作者没有要披露的利益冲突。
致谢
这项工作得到了帕多瓦大学制药和药理学系(PRIDJ-BIRD2019)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Acrylamide/bis-acrylamide solution 40% | Applichem | A3658 | R45-46-20/21-25-36/38-43-48/23/ 24/25-62 |
| Ammonium per-sulfate (APS) | Sigma Aldrich | A7460 | |
| Analytical balance | Mettler Toledo | ||
| Autoclave | pbi international | ||
| Boric acid | Sigma Aldrich | B0252 | |
| Bromophenol blue Brilliant blue R | Sigma Aldrich | B0149 | |
| di-Sodium hydrogen phosphate dodecahydrate | Fluka | 71649 | |
| DMSO | Sigma Aldrich | 276855 | |
| DNA oligonucleotides | Integrated DNA Technologies | synthesis of custom sequences | |
| EDTA disodium | Sigma Aldrich | E5134 | |
| Formamide | Fluka | 40248 | H351-360D-373 |
| Gel imager | GE Healtcare | STORM B40 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Micro tubes 0.5 mL | Sarstedt | 72.704 | |
| Potassium Chloride | Sigma Aldrich | P9541 | |
| Sequencing apparatus | Biometra | Model S2 | |
| Silanization solution I | Fluka | 85126 | H225, 314, 318, 336, 304, 400, 410 |
| Sodium phosphate monobasic | Carlo Erba | 480086 | |
| Speedvac concentrator | Thermo Scientific | Savant DNA 120 | |
| TEMED | Fluka | 87689 | R11-21/22-23-34 |
| Tris-HCl | MERCK | 1.08387.2500 | |
| Urea | Sigma Aldrich | 51456 | |
| UV-Vis spectrophotometer | Thermo Scientific | Nanodrop 1000 |
参考文献
- Davis, J. T. G-quartets 40 years later: from 5'-GMP to molecular biology and supramolecular chemistry. Angewandte Chemie. 43 (6), 668-698 (2004).
- Varshney, D., Spiegel, J., Zyner, K., Tannahill, D., Balasubramanian, S. The regulation and functions of DNA and RNA G-quadruplexes. Nature Reviews Molecular Cell Biology. 21 (8), 459-474 (2020).
- Chambers, V. S., et al. High-throughput sequencing of DNA G-quadruplex structures in the human genome. Nature Biotechnology. 33 (8), 877-881 (2015).
- Zuravka, I., Sosic, A., Gatto, B., Gottlich, R. Synthesis and evaluation of a bis-3-chloropiperidine derivative incorporating an anthraquinone pharmacophore. Bioorganic & Medicinal Chemistry Letters. 25 (20), 4606-4609 (2015).
- Zuravka, I., Roesmann, R., Sosic, A., Gottlich, R., Gatto, B. Bis-3-chloropiperidines containing bridging lysine linkers: Influence of side chain structure on DNA alkylating activity. Bioorganic & Medicinal Chemistry. 23 (6), 1241-1250 (2015).
- Zuravka, I., et al. Synthesis and DNA cleavage activity of bis-3-chloropiperidines as alkylating agents. ChemMedChem. 9 (9), 2178-2185 (2014).
- Sosic, A., Gottlich, R., Fabris, D., Gatto, B. B-CePs as cross-linking probes for the investigation of RNA higher-order structure. Nucleic Acids Research. 49 (12), 6660-6672 (2021).
- Sosic, A., et al. Bis-3-chloropiperidines targeting TAR RNA as a novel strategy to impair the HIV-1 nucleocapsid protein. Molecules. 26 (7), 1874 (2021).
- Sosic, A., et al. In vitro evaluation of bis-3-chloropiperidines as RNA modulators targeting TAR and TAR-protein interaction. International Journal of Molecular Sciences. 23 (2), 582 (2022).
- Sosic, A., et al. Direct and topoisomerase II mediated DNA damage by bis-3-chloropiperidines: The importance of being an earnest G. ChemMedChem. 12 (17), 1471-1479 (2017).
- Bock, L. C., Griffin, L. C., Latham, J. A., Vermaas, E. H., Toole, J. J. Selection of single-stranded DNA molecules that bind and inhibit human thrombin. Nature. 355 (6360), 564-566 (1992).
- Paborsky, L. R., McCurdy, S. N., Griffin, L. C., Toole, J. J., Leung, L. L. The single-stranded DNA aptamer-binding site of human thrombin. The Journal of Biological Chemistry. 268 (28), 20808-20811 (1993).
- Carraro, C., et al. Behind the mirror: chirality tunes the reactivity and cytotoxicity of chloropiperidines as potential anticancer agents. ACS Medicinal Chemistry Letters. 10 (4), 552-557 (2019).
- Carraro, C., et al. Appended aromatic moieties in flexible bis-3-chloropiperidines confer tropism against pancreatic cancer cells. ChemMedChem. 16 (5), 860-868 (2021).
- Kypr, J., Kejnovska, I., Renciuk, D., Vorlickova, M. Circular dichroism and conformational polymorphism of DNA. Nucleic Acids Research. 37 (6), 1713-1725 (2009).
- Onel, B., Wu, G., Sun, D., Lin, C., Yang, D. Electrophoretic mobility shift assay and dimethyl sulfate footprinting for characterization of G-quadruplexes and G-quadruplex-protein complexes. Methods in Molecular Biology. 2035, 201-222 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。