A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحليل الآلي الأمثل لتعديل توازن الميتوكوندريا العصبية الحية بواسطة مستقبلات حمض الريتينويك الخاصة بالنظائر
In This Article
Summary
شبكة الميتوكوندريا معقدة للغاية ، مما يجعل تحليلها صعبا للغاية. تقوم أداة MATLAB الجديدة بتحليل الميتوكوندريا الحية المصورة متحدة البؤر في صور الفاصل الزمني ولكنها تؤدي إلى حجم إخراج كبير يتطلب اهتماما يدويا فرديا. لمعالجة هذه المشكلة ، تم تطوير تحسين روتيني ، مما يسمح بتحليل سريع للملف.
Abstract
تجعل شبكة الميتوكوندريا المعقدة من الصعب للغاية تقسيم الخلايا الحية ومتابعتها وتحليلها. تسمح أدوات MATLAB بتحليل الميتوكوندريا في ملفات الفاصل الزمني ، مما يبسط ويسرع عملية معالجة الصور إلى حد كبير. ومع ذلك ، فإن الأدوات الحالية تنتج حجم إخراج كبير ، يتطلب اهتماما يدويا فرديا ، والإعدادات التجريبية الأساسية لها إخراج من آلاف الملفات ، كل منها يتطلب معالجة واسعة النطاق وتستغرق وقتا طويلا.
لمعالجة هذه المشكلات ، تم تطوير تحسين روتيني ، في كل من كود MATLAB ونماذج النص المباشر ، مما يسمح بتحليل سريع للملفات وتقليل قراءة المستندات ومعالجة البيانات بشكل كبير. بسرعة 100 ملف / دقيقة ، يسمح التحسين بإجراء تحليل سريع شامل. يحقق التحسين مخرجات النتائج عن طريق حساب متوسط البيانات الخاصة بالإطار للميتوكوندريا الفردية عبر الأطر الزمنية ، وتحليل البيانات بطريقة محددة ، بما يتفق مع تلك المخرجات من الأدوات الحالية. تم إجراء التصوير الحي متحد البؤر باستخدام صبغة رباعي ميثيل رودامين إستر الميثيل ، وتم التحقق من صحة التحسين الروتيني من خلال علاج الخلايا العصبية بمنبهات مستقبلات حمض الريتينويك (RAR) ، والتي تم تحديد آثارها على الميتوكوندريا العصبية في الأدبيات. كانت النتائج متسقة مع الأدبيات وسمحت بمزيد من التوصيف لسلوك شبكة الميتوكوندريا استجابة لتعديل RAR الخاص بالنظائر.
سمحت هذه المنهجية الجديدة بالتوصيف السريع والتحقق من صحة شبكة الميتوكوندريا العصبية الكاملة ، ولكنها تسمح أيضا بالتمايز بين الميتوكوندريا المحورية وجسم الخلية ، وهي ميزة أساسية يجب تطبيقها في مجال علم الأعصاب. علاوة على ذلك ، يمكن تطبيق هذا البروتوكول على التجارب التي تستخدم علاجات سريعة المفعول ، مما يسمح بتصوير نفس الخلايا قبل وبعد العلاج ، متجاوزا مجال علم الأعصاب.
Introduction
تقع الميتوكوندريا الخلوية في مركز جميع الحالات الفسيولوجية ، والفهم الشامل لتوازنها (الميتوستاسيس) وسلوكها أمر بالغ الأهمية للمساعدة في تحديد العلاج الدوائي لمجموعة واسعة من الأمراض ، بما في ذلك السرطان ومرض الزهايمر 1,2.
تلعب الميتوكوندريا أدوارا خلوية حاسمة في توازن الطاقة ، وتوليد ATP ، وتخزين الكالسيوم المؤقت ، وتنظيم أنواع الأكسجين التفاعلية ، والميتوكستاس ضروري للحفاظ على توازن البروتين لأن المرافقين الجزيئيين يعتمدون على الطاقة3. ويتطلب ذلك تعديلا ثابتا وديناميا للشبكة وتكيفا لتلبية الاحتياجات الخلوية بكفاءة، وينظم نقل الميتوكوندريا مسارات إشارات مختلفة؛ وقد وصف العمل السابق أحد هذه المسارات ، وهو مستقبلات حمض الريتينويك (RARs)4,5. حمض الريتينويك (RA) يعزز نمو المحور العصبي والعصبي عن طريق تنشيط RAR. في الخلايا العصبية القشرية الأولية للفأر ، يشجع تنشيط RAR-β نمو الميتوكوندريا وسرعتها وحركتها في الخلايا العصبية6.
بالنظر إلى قدرة شبكة الميتوكوندريا على التكيف وديناميكياتها ، فإن إمكانية تقييم الانقسام في "الوقت الفعلي" ضرورية ليس فقط للتحقيق في توازن الطاقة ، ولكن أيضا للبروتين أو الصحة الخلوية أو الانتشار أو الإشارات. تعتمد الطريقة الشائعة الاستخدام لتقييم الانقسام على الفحص المجهري متحد البؤر بعد تسليط الضوء على الميتوكوندريا باستخدام صبغة أو علامة فلورية ، بالإضافة إلى إعداد مجهري محدد يسمح بدرجة الحرارة و / أو تنظيم CO2 7. يستلزم هذا النوع من الإعداد التجريبي إجراء نسخة تجريبية واحدة في كل مرة. بالإضافة إلى التكرار التجريبي للمعالجات المختلفة ، يجب مراعاة أن معظم التجارب يجب أن يكون لها تكراراتها التقنية (حيث يتم تصوير أكثر من موضع واحد لكل لوحة) ، مع تسجيل سلسلة من المستويات البؤرية (z-stacks) في سلسلة من النقاط الزمنية. وبالتالي ، فإن التصميم التجريبي مع ثلاثة تكرارات لعنصر تحكم واحد ومعالجتين ، مع خمسة أوضاع تصوير لكل لوحة ، و 15 نقطة زمنية ، ينتج عنه 225 مكدسا لتتم معالجتها. كلاسيكيا ، تم تحليل مقاطع الفيديو الخاصة بالميتوكوندريا الحية عن طريق رسم أجهزة القياس الكمي ، والتي سيتم تحليلها بشكل فردي8 ، في عملية تستغرق وقتا طويلا وتتطلب إدخالا يدويا مكثفا ، حتى عند الاعتماد على أدوات الكمبيوتر.
تموصف خوارزمية 9 مؤخرا تسمح بالتجزئة الآلية وتتبع الميتوكوندريا في ملفات الفاصل الزمني 2-D و 3-D للخلايا الحية. تتوفر تقنيات القياس الكمي الأخرى ، ولكل منها حدودها10. يعد Mitometer ، وهو تطبيق آلي مفتوح المصدر ، مناسبا بشكل خاص لتحليل ديناميكيات الفاصل الزمني والميتوكوندريا ، مما يتطلب مدخلات منخفضة من المستخدم. يتمتع هذا التطبيق بسلسلة من المزايا مقارنة بالأدوات الأخرى القائمة على MATLAB ، وهي السماح بالمعالجة التلقائية لمكدسات TIF الفردية ، باستخدام ما يصل إلى 13 معلمة مختلفة ، مثيرة للاهتمام بشكل خاص لعلوم الأعصاب ، لأنها تميز بين الميتوكوندريا المحيطة بالنواة وعن بعد.
ومع ذلك ، بالنسبة لتجربة مثل الموضحة أعلاه ، فإن هذه المعلمات ال 13 المطبقة على 225 مكدسا ينتج عنها 2925 ملف إخراج فردي. تتطلب هذه أربعة مدخلات كمبيوتر فردية ، والتي يصل مجموعها إلى أكثر من 10000 إدخال يدوي مطلوب لتنزيل جميع ملفات الإخراج. بالنسبة للتصميمات التجريبية الكبيرة ، ينتج عن ذلك تحليل مستهلك للوقت للغاية لكل ملف وتكامل البيانات. نقدم هنا تحسينا روتينيا يسمح بتحليل سريع للملفات ، مما يقلل بشكل كبير من قراءة المستندات ومعالجة البيانات ، وتحليل البيانات بطريقة محددة ، بما يتفق مع المخرجات من الأدوات الحالية.
Access restricted. Please log in or start a trial to view this content.
Protocol
ملاحظة: يحتوي هذا البروتوكول على خطوتين رئيسيتين: خطوة معملية رطبة ، تتضمن زراعة الخلايا والفحص المجهري الحي متحد البؤر للحصول على صور للميتوكوندريا الحية (الشكل 1) وخطوة في السيليكو لتحليل الصور التي تم الحصول عليها (الشكل 2). لتحليل البيانات الآلي للميتوكوندريا الحية ثلاثية الأبعاد ، تم استخدام مقياس Mitometer لتطبيق MATLAB على النحو المقدم من Lefebvre et al.9. التحسين الروتيني مكتوب في MATLAB. يتوفر البرنامج والإصدارات المحدثة ومعالجة وحدات ماكرو ImageJ مجانا عبر الإنترنت من خلال GitHub ، في https://github.com/JoseJoaoMV/Routine_Optimization_Mitometer_APP_MATLAB.
1. الفحص المجهري المباشر
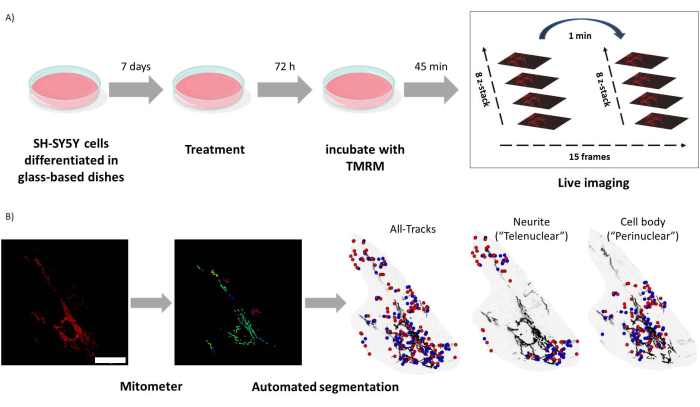
الشكل 1: البروتوكول التجريبي. تم تمييز خلايا SH-SY5Y ومعالجتها بالرتينوئيدات. (أ) تم استخدام TMRM لتصوير الميتوكوندريا السليمة الحية في الخلايا المعالجة باستخدام مجهر متحد البؤر ، والتقاط كومة z بفاصل زمني من خمسة مجالات بصرية. (ب) تطبيق مقياس الميتومتر يقوم MATLAB تلقائيا بتقطيع وتحليل صور الميتوكوندريا. بالإضافة إلى التحليل ، يميز هذا البرنامج تلقائيا الميتوكوندريا وفقا للقرب النووي. النقاط الزرقاء هي المواضع الأولية للميتوكوندريا. النقاط الحمراء هي المواضع النهائية. شريط المقياس = 30 ميكرومتر. اختصار: TMRM = رباعي ميثيل رودامين ، ميثيل استر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- زراعة الخلايا
- احتضان خلايا SH-SY5Y عند 37 درجة مئوية في جو مرطب بنسبة 5٪ CO2 و 95٪ هواء ، مستزرع في أجزاء متساوية من MEM (الحد الأدنى من الوسط الأساسي) و F12 (مزيج المغذيات F12 من لحم الخنزير) ، مع استكمال مصل بقري الجنين بنسبة 10٪ (FBS).
- لوحة خلايا SH-SY5Y في أطباق الخلايا ذات القاع الزجاجي بكثافة 15 × 104 خلايا / مل.
- التفريق بين الخلايا مع 5 أيام من العلاج بحمض الريتينويك المتحولة بالكامل 10 ميكرومتر في وسط استزراع يحتوي على 1٪ FBS ، يليه يومان من العلاج بعامل التغذية العصبية المشتق من الدماغ 10 ميكروغرام / مل (BDNF).
- علاج الخلايا
- اغسل الخلايا بمحلول ملحي معقم مخزن بالفوسفات (PBS) وعالجه لمدة 72 ساعة باستخدام ناهضات 10-7 M RAR-isoform ، في أجزاء متساوية من MEM (الحد الأدنى من الوسط الأساسي) و F12 (مزيج المغذيات F12 من Ham) ، مع استكمال 1٪ FBS.
ملاحظة: ناهض RARα المستخدم كان AM580; ناهض RARβ المستخدم كان CD2314. تم استخدام Ch55 كناهض مثل RARα وناهض مشارك β. فيتم استخدام التهاب المفاصل الروماتويدي كعنصر تحكم إيجابي. تم استخدام BMS493 كمضاد لعموم RAR.
- اغسل الخلايا بمحلول ملحي معقم مخزن بالفوسفات (PBS) وعالجه لمدة 72 ساعة باستخدام ناهضات 10-7 M RAR-isoform ، في أجزاء متساوية من MEM (الحد الأدنى من الوسط الأساسي) و F12 (مزيج المغذيات F12 من Ham) ، مع استكمال 1٪ FBS.
- التصوير المباشر متحد البؤر
- استبدل وسط الاستزراع بوسط استزراع جديد يحتوي على 1٪ FBS ب 20 نانومتر رباعي ميثيل رودامين ، إستر الميثيل (TMRM) لمدة 45 دقيقة.
ملاحظة: TMRM عبارة عن صبغة فلورية ذات خلايا ، معزولة بواسطة الميتوكوندريا النشطة ، وتسمح فترة الحضانة هذه ل TMRM بالوصول إلى التوازن وتناولها بواسطة الميتوكوندرياالمستقطبة 11. يجب أن يبدأ التصوير قبل إنشاء التوازن حيث يمكن أن تزيد شدة إشارة TMRM بشكل مصطنع أثناء التصوير. - ضع الخلايا في حاضنة متصلة بمجهر متحد البؤر للمسح بالليزر عند 37 درجة مئوية.
- التقط الصور باستخدام هدف apochromat 63x للغمر بالزيت ، بحجم صورة 512 × 512 بكسل تم الحصول عليه بفتحة ثقب تبلغ 1 وحدة جيدة التهوية ، والتقاط سلسلة زمنية من 15 إطارا من خمسة مجالات بصرية مختلفة في كل لوحة خلية ، ومكدس z من 8 طائرات z متساوية المسافة. ملف .lsm الناتج هو مكدس الوقت والموضع و z.
ملاحظة: يجب تحسين إعدادات الكسب والتباين والسطوع في البداية باستخدام الحد الأدنى من طاقة الليزر اللازمة لاستخدام النطاق الديناميكي الكامل للكاشف والحفاظ على ثباته طوال فترة الدراسة ، مما يضمن إجراء جميع عمليات التصوير في نفس الظروف. يمكن تسجيل ما يصل إلى تسعة مواضع مختلفة في هذه المجموعة من الأجهزة والبرامج ودورات المجهر بين مواضع التصوير تلقائيا.
- استبدل وسط الاستزراع بوسط استزراع جديد يحتوي على 1٪ FBS ب 20 نانومتر رباعي ميثيل رودامين ، إستر الميثيل (TMRM) لمدة 45 دقيقة.
2. تحليل الصور
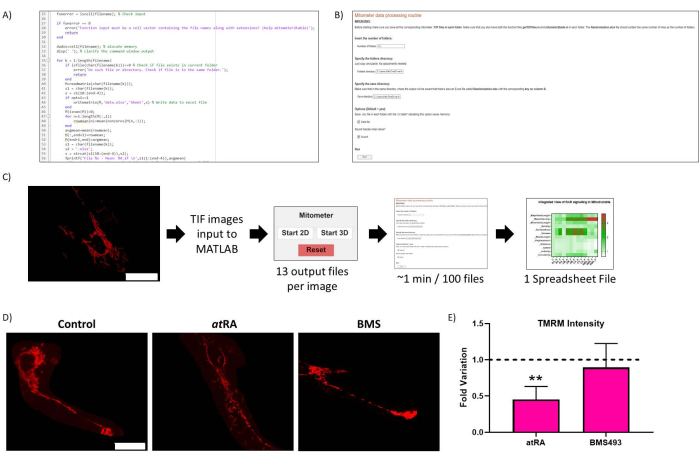
الشكل 2: التحسين الروتيني. (أ) رمز تمثيلي للتحسين الروتيني. (ب) التحسين الروتيني للنص المباشر. (ج) سير عمل التحسين الروتيني. (د) التحقق من صحة نتائج التحسين الروتيني: صورة تمثيلية للميتوكوندريا في الخلايا غير المعالجة (اللوحة اليسرى) ، تعامل معRA (10-7 M ، 72 h ، اللوحة الوسطى) ، وتعالج بمضاد RAR BMS493 (10-7 M ، 72 ساعة ، اللوحة اليمنى) ، تم تصويرها بعد الحضانة باستخدام TMRM (20 نانومتر ، 45 دقيقة حضانة). شريط المقياس = 30 ميكرومتر. (ه) كثافة TMRM في الميتوكوندريا في جسم الخلية. انخفاض معنوي مع معالجة حمض الريتينويك المتحولة بالكامل (عندالتهاب المفاصل الروماتويدي ، 10-7 م ، 72 ساعة) ، مقارنة بالسيطرة (p = 00062) ، لم يلاحظ عند معالجته بمضادات RAR (BMS493 ، 10-7 M ، 72 ساعة). تم قياس خمس خلايا من كل من التكرار الثلاثة لكل حالة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- معالجة الصور
- افتح الملفات في ImageJ 2.1.0 وافصل مكدسات المواضع حسب المجال المرئي: افتح ImageJ وانقر فوق شريط القوائم | صورة | مكررة | شرائح الإدخال/رقم الإطار | حسنا.
ملاحظة: لتقليل المدخلات المتكررة للبرنامج ، تم تطوير ImageJ Macro لتسهيل نسخ صور المجال المرئي وحفظها.
- افتح الملفات في ImageJ 2.1.0 وافصل مكدسات المواضع حسب المجال المرئي: افتح ImageJ وانقر فوق شريط القوائم | صورة | مكررة | شرائح الإدخال/رقم الإطار | حسنا.
- بروتوكول الماكرو
- ارسم منطقة اهتمام (ROI) حول الخلية باستخدام أداة التحديد المجانية.
- قم بتشغيل الماكرو عن طريق فتح ImageJ والانتقال إلى شريط القوائم | الإضافات | وحدات الماكرو | تشغيل مسح الخلفية وحفظ ماكرو الصور.
ملاحظة: يمكن اختيار الصور عشوائيا في هذه العملية، وتخزين مفتاح الحل وفقا لمتطلبات التحسين. - تحديد حجم البكسل وعمق فوكسل: افتح ImageJ | الصورة وانتقل إلى شريط القوائم | صورة | الخصائص.
- بروتوكول مباشر بديل
ملاحظة: لا يستخدم هذا البديل ماكرو لمعالجة الصور- ابحث عن حجم البكسل وعمق فوكسل: افتح ImageJ | افتح الصورة وانتقل إلى شريط القوائم | صورة | الخصائص.
- ارسم عائد استثمار حول الخلية باستخدام أداة التحديد المجانية ، مع التأكد من أنها تشمل الخلية بأكملها في جميع أنحاء الإطارات ال 15.
- انتقل إلى شريط القوائم | تحرير | واضح من الخارج.
- انتقل إلى شريط القوائم | ملف | حفظ باسم | حدد Tiff.
- حدد حفظ المجلد وانقر فوق حفظ.
ملاحظة: يمكن تعمية الصور / عشوائية يدويا في هذه المرحلة قبل متابعة التحليل.
- التحليل الآلي للصور
- تحضير المجلدات لملفات التحليل.
- قم بإنشاء ثلاثة مجلدات رئيسية بعنوان "جميع المسارات" و "المسارات المحيطة بالنواة" و "المسارات النووية عن بعد".
ملاحظة: تتطابق هذه مع خيارات المسار الآلي الرئيسية. - في كل مجلد رئيسي ، قم بإنشاء مجلد فرعي لكل صورة لمعالجتها ، يتم تحديدها عدديا من 1 إلى أعلى.
- أضف نسخة من الملفين التكميليين للتحسين الروتيني (mitometer2table.m وgetTXTfiles.m) إلى كل مجلد صورة.
ملاحظة: تساعد هذه الملفات في تحليل البيانات وترتيب التنسيق النهائي. يجب أن يتطابق عدد المجلدات مع عدد العناصر في جدول البيانات العشوائي (.xlsx). بعد إنشاء جميع المجلدات الفرعية المرقمة مع الملفات التكميلية لمجموعة بيانات واحدة ، يمكن نسخها دفعة واحدة ولصقها في مجموعات البيانات المتبقية.
- قم بإنشاء ثلاثة مجلدات رئيسية بعنوان "جميع المسارات" و "المسارات المحيطة بالنواة" و "المسارات النووية عن بعد".
- تحضير المجلدات لملفات التحليل.
- استخدم مقياس Mitometer لتطبيق MATLAB لتحليل الصور.
ملاحظة: تم تشغيل هذا البروتوكول على مقياس ميتومتر مثبت على MATLAB R2022a. قم بتحميل الصور على دفعات من 30 للحصول على أفضل وقت للتشغيل وتوازن الإخراج. يتم فرض الحد الأقصى لحجم ملف MAT بواسطة نظام الملفات الأصلي: بشكل افتراضي ، يمكن لعمليات "الحفظ" إنشاء ملف < 231 بايت (~ 2 جيجابايت) ؛ حفظ تنسيق يمكن استخدام MAT-Files الإصدار 7.3 بدلا من ذلك ، لأنه يسمح بأحجام متغيرة قصوى أكبر من 2 جيجابايت.- تحديد/تغيير إصدار ملف MAT الافتراضي: في علامة التبويب الصفحة الرئيسية في قسم البيئة ، انقر فوق التفضيلات وحدد MATLAB | عام | ملفات MAT.
- استخدم أداة MATLAB Mitometer لتحليل: افتح MATLAB وانتقل إلى شريط القوائم | تطبيقات | افتح ميتوميتر | حدد بدء 3D | بيانات الإدخال (حجم البكسل (ميكرومتر): 0.1395089 / الوقت بين الإطارات (الإطارات): 2 / عدد z-الطائرات: 8 / المسافة المحورية بين الطائرات z (ميكرومتر): 0.418809 | حدد الصور لإدخالها.
- انتقل إلى القائمة الجانبية لمقياس الميتوميتر ، وحدد صورة ، وانقر فوق تحديد مميز ، وانتقل إلى شريط قوائم مقياس الميتوميتر | حدد المسارات | تتبع المشاهدات | حدد جميع المسارات أو النواة عن بعد أو شبه النووي | ميتوميتر شريط القوائم | حدد التحليل | اختر عنصرا (أي الطول) | حدد حفظ إلى ".txt".
ملاحظة: يمكن تنزيل أكثر من معلمة واحدة في وقت واحد، إذا تم تحديدها بشكل متزامن. - استخراج ملفات النتائج إلى المجلدات التي تم إنشاؤها (2.2.1).
- التحسين الروتيني وتحليل البيانات
- قم بإعداد / تكييف ملف "Randomization.xlsx" الذي يحتوي على مفتاح ترميز الصورة.
- أدخل قائمة بالأعداد الصحيحة المتتالية، من 1 إلى أعلى، في العمود A.
ملاحظة: ينصح بالاحتفاظ بمجلد مكرر بالصور المسماة في الأصل. - ضع المتغيرات التحليلية في العمود B ، المكون من أحرف أبجدية رقمية.
ملاحظة: يجب أن يكون عدد الأسطر في المستند متسقا مع عدد المجلدات الموجودة في مجموعة البيانات الرئيسية. انسخ والصق ملف "Randomization.xlsx" هذا في مجموعتي البيانات الرئيسيتين الأخريين.
- أدخل قائمة بالأعداد الصحيحة المتتالية، من 1 إلى أعلى، في العمود A.
- تحليل البيانات الأمثل
- انقر نقرا مزدوجا فوق "executable.mlx" ، وأدخل عدد المجلدات ، وحدد دليل المجلدات (انسخ الدليل من أعلى المجلد) | دليل الحفظ (انسخ الدليل من أعلى المجلد) | اسم جدول البيانات في ملف الإخراج وانقر فوق تشغيل.
- إجراء التحليل الإحصائي حسب الضرورة.
ملاحظة: قد يتم تحديد إنشاء اختياري لملف .xlsx في كل مجلد مع بيانات .txt والتنبيه الصوتي إلى نهاية التحليل. يقوم Live Script بإخراج ملف جدول بيانات واحد بتنسيق جدول. في هذا الناتج ، تمثل الأعمدة المعلمات التي تم تحليلها (على سبيل المثال ، "طول المحور الرئيسي" ؛ "الكثافة") وتمثل الخطوط المجالات المرئية للمتغيرات التحليلية (على سبيل المثال ، "التحكم").
- قم بإعداد / تكييف ملف "Randomization.xlsx" الذي يحتوي على مفتاح ترميز الصورة.
Access restricted. Please log in or start a trial to view this content.
النتائج
لتعزيز وتسريع تحليل ملفات الإخراج بتنسيق .txt ، تم ترميز تحسين روتيني يقرأ البيانات المتوافقة مع Mitometer .txt ملفات الإخراج ، مع أعمدة تمثل إطارا وخطوطا تمثل الميتوكوندريا المحددة. ينتج التحسين الروتيني بيانات بقيمة واحدة لكل معلمة عن طريق حساب متوسط الإطارات لكل ميتوكوندريا محددة ثم حساب متو?...
Access restricted. Please log in or start a trial to view this content.
Discussion
ينتج التصوير الخلوي الحي ملفات كبيرة تتطلب معالجة حوسبة جادة ، ولكن حتى أحدث الأدوات تتطلب إدخالا يدويا مكثفا للمعالجة. يركز هذا التحسين الروتيني على تبسيط عملية تحليل الميتوكوندريا على مقياس الانقسام لأن هذه الأداة تقدم توازنا جيدا جدا بين مدخلات المستخدم وإخراج البيانات. تمت مراجعة مق...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم إجراء الحصول على الصور في منشأة LiM الخاصة ب iBiMED ، وهي عقدة PPBI (المنصة البرتغالية للتصوير الحيوي): POCI-01-0145-FEDER-022122. تم دعم هذا العمل من قبل FCT (EXPL / BTM-SAL/0902/2021) LCF (CI21-00276) ، وهي منحة إلى DT من Fundação para a Ciência e Tecnologia of Ministério da Educação e Ciência (2020.02006.CEECIND) ، منحة من ATG-The Gabba Alumni Association إلى نائب الرئيس ، ومعهد الطب الحيوي-iBiMED ، جامعة أفيرو.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| AM580 | Sigma-Aldrich | A8843 | |
| BDNF | Thermo-Fisher | RP8642 | |
| BMS493 | Tocris Bioscience | 3409 | |
| CD2314 | Tocris Bioscience | 3824 | |
| Ch55 | Tocris Bioscience | 2020 | |
| Foetal Bovine Serum | Thermo-Fisher | 10270106 | |
| GraphPad Prism v4.0 | GraphPad Software, La Jolla | n/a | |
| Ham’s F12 Nutrient Mix | Thermo-Fisher | 21765029 | |
| MATLAB R2022a | MathWorks | n/a | |
| Minimal Essential Medium | Thermo-Fisher | 31095 | |
| Nunc Glass Bottom Dishes | Thermo-Fisher | 150680 | |
| Phosphate Buffer Saline Solution | Thermo-Fisher | 28372 | |
| Retinoic acid | Sigma-Aldrich | R2625 | |
| TMRM | Thermo-Fisher | T668 | |
| Zeiss LSM 510 | Carl Zeiss | n/a | Equiped with live-cell imaging culture chamber and 63x oil immersion objective |
References
- Trigo, D., Avelar, C., Fernandes, M., Sa, J., da Cruz, E. S. O. Mitochondria, energy, and metabolism in neuronal health and disease. FEBS Letters. 596 (9), 1095-1110 (2022).
- Zong, W. X., Rabinowitz, J. D., White, E. Mitochondria and cancer. Molecular Cell. 61 (5), 667-676 (2016).
- Clare, D. K., Saibil, H. R. ATP-driven molecular chaperone machines. Biopolymers. 99 (11), 846-859 (2013).
- Tourniaire, F., et al. All-trans retinoic acid induces oxidative phosphorylation and mitochondria biogenesis in adipocytes. Journal of Lipid Research. 56 (6), 1100-1109 (2015).
- Psarra, A. M., Sekeris, C. E. Nuclear receptors and other nuclear transcription factors in mitochondria: regulatory molecules in a new environment. Biochimica et Biophysica Acta. 1783 (1), 1-11 (2008).
- Trigo, D., Goncalves, M. B., Corcoran, J. P. T. The regulation of mitochondrial dynamics in neurite outgrowth by retinoic acid receptor beta signaling. FASEB Journal. 33 (6), 7225-7235 (2019).
- Mitra, K., Lippincott-Schwartz, J. Analysis of mitochondrial dynamics and functions using imaging approaches. Current Protocols in Cell Biology. Chapter 4 (Unit 4), 1-21 (2010).
- Sajic, M., et al. Impulse conduction increases mitochondrial transport in adult mammalian peripheral nerves in vivo. PLoS Biology. 11 (12), e1001754(2013).
- Lefebvre, A., Ma, D., Kessenbrock, K., Lawson, D. A., Digman, M. A. Automated segmentation and tracking of mitochondria in live-cell time-lapse images. Nature Methods. 18 (9), 1091-1102 (2021).
- Chu, C. -H., Tseng, W. -W., Hsu, C. -M., Wei, A. -C. Image analysis of the mitochondrial network morphology with applications in cancer research. Frontiers in Physics. 10, 855775(2022).
- Creed, S., McKenzie, M. Measurement of mitochondrial membrane potential with the fluorescent dye tetramethylrhodamine methyl ester (TMRM). Methods in Molecular Biology. 1928, 69-76 (2019).
- Kovalevich, J., Langford, D. Considerations for the use of SH-SY5Y neuroblastoma cells in neurobiology. Methods in Molecular Biology. 1078, 9-21 (2013).
- Sahin, M., Oncu, G., Yilmaz, M. A., Ozkan, D., Saybasili, H. Transformation of SH-SY5Y cell line into neuron-like cells: Investigation of electrophysiological and biomechanical changes. Neuroscience Letters. 745, 135628(2021).
- Trigo, D., et al. Mitochondria dysfunction and impaired response to oxidative stress promotes proteostasis disruption in aged human cells. Mitochondrion. 69, 1-9 (2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved