A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח אוטומטי אופטימלי של אפנון הומאוסטזיס מיטוכונדריה עצבית חיה על ידי קולטני חומצה רטינואית ספציפיים לאיזופורם
In This Article
Summary
הרשת המיטוכונדריאלית מורכבת ביותר, מה שהופך אותה למאתגרת מאוד לניתוח. כלי חדשני של MATLAB מנתח מיטוכונדריה עם תמונות קונפוקליות חיות בתמונות timelapse, אך התוצאה היא נפח פלט גדול הדורש תשומת לב ידנית אישית. כדי להתמודד עם בעיה זו, פותחה אופטימיזציה שגרתית, המאפשרת ניתוח קבצים מהיר.
Abstract
הרשת המיטוכונדריאלית המורכבת מאתגרת מאוד לפלח, לעקוב ולנתח תאים חיים. כלי MATLAB מאפשרים ניתוח מיטוכונדריה בקובצי timelapse, ובכך מפשטים ומאיצים באופן משמעותי את תהליך עיבוד התמונה. עם זאת, הכלים הקיימים מייצרים נפח פלט גדול, הדורש תשומת לב ידנית פרטנית, ולמערכי ניסוי בסיסיים יש פלט של אלפי קבצים, שכל אחד מהם דורש טיפול נרחב וגוזל זמן.
כדי להתמודד עם בעיות אלה, פותחה אופטימיזציה שגרתית, הן בקוד MATLAB והן בטופסי סקריפט חי, המאפשרת ניתוח קבצים מהיר ומפחיתה משמעותית את קריאת המסמכים ועיבוד הנתונים. עם מהירות של 100 קבצים לדקה, האופטימיזציה מאפשרת ניתוח מהיר כולל. המיטוב משיג את תפוקת התוצאות על ידי ממוצע נתונים ספציפיים למסגרת עבור מיטוכונדריה בודדים לאורך מסגרות זמן, ניתוח נתונים באופן מוגדר, עקבי עם אלה פלט מכלים קיימים. הדמיה קונפוקלית חיה בוצעה באמצעות הצבע טטרמתילרודאמין מתיל אסטר, והאופטימיזציה השגרתית אומתה על ידי טיפול בתאים עצביים עם אגוניסטים לקולטן חומצה רטינואית (RAR), שהשפעתם על מיטוכונדריה עצבית מבוססת בספרות. התוצאות תאמו את הספרות ואפשרו אפיון נוסף של התנהגות הרשת המיטוכונדריאלית בתגובה לאפנון RAR ספציפי לאיזופורם.
מתודולוגיה חדשה זו אפשרה אפיון מהיר ותקף של רשת מיטוכונדריה של נוירונים שלמים, אך היא גם מאפשרת הבחנה בין אקסון למיטוכונדריה של גוף התא, תכונה חיונית ליישום בתחום מדעי המוח. יתר על כן, פרוטוקול זה יכול להיות מיושם על ניסויים באמצעות טיפולים מהירים, המאפשר הדמיה של אותם תאים לפני ואחרי טיפולים, מעבר לתחום מדעי המוח.
Introduction
מיטוכונדריה תאית ניצבת במרכז כל המצבים הפיזיולוגיים, והבנה מעמיקה של ההומאוסטזיס (מיטוסטזיס) והתנהגותם היא בעלת חשיבות עליונה כדי לסייע בזיהוי טיפול תרופתי למגוון רחב של מחלות, כולל סרטן ואלצהיימר 1,2.
מיטוכונדריה ממלאים תפקידים תאיים מכריעים בהומאוסטזיס אנרגיה, בייצור ATP, בחציצה של סידן ובוויסות ROS, ומיטוסטאזיס חיוני לשמירה על הומאוסטזיס חלבונים, שכן מלווים מולקולריים תלויים באנרגיה3. אלה דורשים אפנון רשת קבוע ודינמי והסתגלות כדי לענות ביעילות על הצרכים התאיים, והעברת המיטוכונדריה מווסתת על ידי מסלולי איתות שונים; עבודות קודמות תיארו מסלול אחד כזה, זה של קולטני חומצה רטינואית (RARs)4,5. חומצה רטינואית (RA) מקדמת צמיחה אקסונלית ועצבית באמצעות הפעלת RAR. בתאי עצב ראשוניים בקליפת המוח של עכברים, הפעלת RAR-β מעודדת גדילה מיטוכונדריאלית, מהירות וניידות בנוירוט6.
בהתחשב ביכולת ההסתגלות והדינמיקה של הרשת המיטוכונדריאלית, האפשרות להעריך מיטוסטזיס "בזמן אמת" חיונית לא רק לחקר הומאוסטזיס אנרגיה, אלא גם לפרוטאוסטזיס, בריאות התאים, שגשוג או איתות. שיטה נפוצה להערכת מיטוסטזיס מסתמכת על מיקרוסקופ קונפוקלי לאחר הדגשת מיטוכונדריה באמצעות צבע פלואורסצנטי או סמן, כמו גם מערך מיקרוסקופיה ספציפי המאפשר ויסות טמפרטורה ו / או CO2 7. סוג זה של מערך ניסיוני כרוך בכך שהעתק ניסיוני אחד יבוצע בכל פעם. בנוסף לחזרה ניסיונית על טיפולים שונים, יש לקחת בחשבון שלרוב הניסויים צריכים להיות העתקים טכניים שלהם (שבהם יותר ממיקום אחד מצולם לכל לוחית), עם סדרה של מישורי מוקד (ערימות z) המתועדים בסדרה של נקודות זמן. לפיכך, תכנון ניסיוני עם שלוש חזרות של בקרה אחת ושני טיפולים, עם חמש עמדות הדמיה לכל צלחת, ו -15 נקודות זמן, מביא לעיבוד של 225 ערימות. באופן קלאסי, סרטונים של מיטוכונדריה חיים נותחו על ידי שרטוט קימוגרפים, אשר ינותחו בנפרד8, בתהליך גוזל זמן הדורש קלט ידני נרחב, גם כאשר מסתמכים על כלי מחשב.
לאחרונה תואר אלגוריתם9 המאפשר פילוח ומעקב אוטומטיים אחר מיטוכונדריה בקבצים דו-ממדיים ותלת-ממדיים של תאים חיים. קיימות טכניקות כימות אחרות, ולכולן יש מגבלות10. מיטומטר, יישום קוד פתוח אוטומטי, מתאים במיוחד לניתוח דינמיקת מיטוכונדריה בחלוף זמן, הדורש קלט משתמש נמוך. ליישום זה יש שורה של יתרונות על פני כלים קיימים אחרים מבוססי MATLAB, כלומר מאפשר עיבוד אוטומטי של ערימות TIF בודדות, תוך שימוש בעד 13 פרמטרים שונים, מעניין במיוחד עבור מדעי המוח, שכן הוא מבדיל בין מיטוכונדריה פרי-גרעינית וטלה-גרעינית.
עם זאת, עבור ניסוי כמו זה שתואר לעיל, 13 פרמטרים אלה החלים על 225 ערימות מביאים ל- 2,925 קבצי פלט נפרדים. אלה דורשים ארבע כניסות מחשב נפרדות, המסכמות עד 10,000 קלטים ידניים הנדרשים כדי להוריד את כל קבצי הפלט. עבור עיצובים ניסיוניים גדולים, התוצאה היא ניתוח גוזל זמן רב שלא לצורך של כל שילוב קובץ ונתונים. כאן אנו מציגים אופטימיזציה שגרתית המאפשרת ניתוח קבצים מהיר, צמצום משמעותי של קריאת מסמכים ועיבוד נתונים, ניתוח נתונים באופן מוגדר, עקבי עם הפלט מהכלים הקיימים.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: לפרוטוקול הזה יש שני שלבים עיקריים: שלב מעבדה רטוב, הכולל תרבית תאים ומיקרוסקופ קונפוקלי חי כדי לקבל תמונות של מיטוכונדריה חיים (איור 1), ושלב בסיליקו כדי לנתח תמונות שהתקבלו (איור 2). לניתוח נתונים אוטומטי של מיטוכונדריה תלת-ממדית בהדמיה חיה, נעשה שימוש במיטומטר של יישום MATLAB כפי שסופק על ידי Lefebvre et al.9. האופטימיזציה השגרתית כתובה ב-MATLAB. התוכנה, הגרסאות המעודכנות ועיבוד פקודות המאקרו של ImageJ זמינים באופן חופשי באינטרנט דרך GitHub, בשעה https://github.com/JoseJoaoMV/Routine_Optimization_Mitometer_APP_MATLAB.
1. מיקרוסקופ חי
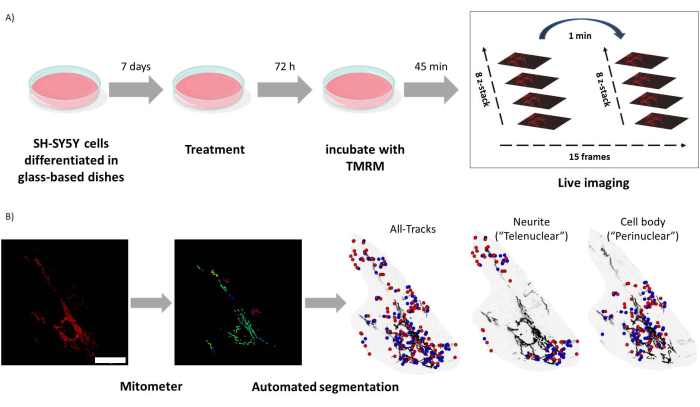
איור 1: פרוטוקול ניסויי. תאי SH-SY5Y התמינו וטופלו ברטינואידים. (A) TMRM שימש להדמיה חיה של מיטוכונדריה בריאה בתאים שטופלו באמצעות מיקרוסקופ קונפוקלי, ולכידת ערימת z בהילוך מהיר של חמישה שדות ראייה. (B) יישום מיטומטר MATLAB מפלח ומנתח באופן אוטומטי תמונות מיטוכונדריה. בנוסף לניתוח, תוכנה זו מפלה באופן אוטומטי מיטוכונדריה על פי קרבה גרעינית. נקודות כחולות הן מיקומים התחלתיים מיטוכונדריאליים; נקודות אדומות הן מיקומים סופיים. סרגל קנה מידה = 30 מיקרומטר. קיצור: TMRM = tetramethylrhodamine, מתיל אסטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- תרבית תאים
- יש לדגור על תאי SH-SY5Y בטמפרטורה של 37°C באטמוספירה לחה של 5%CO2 ו-95% אוויר, בתרבית בחלקים שווים של MEM (Minimal Essential Medium) ו-F12 (Ham's F12 Nutrient Mix) Medium, בתוספת סרום בקר עוברי 10% (FBS).
- צלחת SH-SY5Y תאים בצלחות תא תחתית זכוכית בצפיפות של 15 × 104 תאים / מ"ל.
- להבדיל תאים עם 5 ימי טיפול עם 10 מיקרומטר all-trans חומצה רטינואית בתווך תרבית 1% המכיל FBS, ולאחר מכן יומיים של טיפול עם 10 ƞg / mL גורם נוירוטרופי המוח (BDNF).
- טיפול תאי
- יש לשטוף תאים עם מלח סטרילי חוצץ פוספט (PBS) ולטפל במשך 72 שעות עם אגוניסטים 10-7 M RAR-isoform, בחלקים שווים של MEM (Minimal Essential Medium) ו-F12 (Ham's F12 Nutrient Mix) Medium, בתוספת FBS 1%.
הערה: אגוניסט RARα בשימוש היה AM580; אגוניסט נדיר בשימוש היה CD2314; Ch55 שימש כאגוניסט כ-RARα וכאגוניסט משותף β; ב-RA שימש כבקרה חיובית; BMS493 שימש כאנטגוניסט פאן RAR.
- יש לשטוף תאים עם מלח סטרילי חוצץ פוספט (PBS) ולטפל במשך 72 שעות עם אגוניסטים 10-7 M RAR-isoform, בחלקים שווים של MEM (Minimal Essential Medium) ו-F12 (Ham's F12 Nutrient Mix) Medium, בתוספת FBS 1%.
- הדמיה קונפוקלית חיה
- החלף את מדיום התרבית בתווך תרבית טרי 1% המכיל FBS בטטרמתילרודמין 20 ננומטר, מתיל אסטר (TMRM) למשך 45 דקות.
הערה: TMRM הוא צבע פלואורסצנטי המותאם לתאים, המופרד על ידי מיטוכונדריה פעילה, ותקופת הדגירה הזו מאפשרת ל-TMRM להגיע לשיווי משקל ולהיקלט על ידי מיטוכונדריהמקוטבת 11. יש להתחיל בהדמיה לפני קביעת שיווי משקל מכיוון שעוצמת אות TMRM יכולה לעלות באופן מלאכותי במהלך ההדמיה. - הניחו את התאים באינקובטור המחובר למיקרוסקופ קונפוקלי סורק לייזר בטמפרטורה של 37°C.
- צלם תמונות באמצעות מטרה אפוכרומט טבילת שמן 63x, עם גודל תמונה של 512 x 512 פיקסלים המתקבל עם מפתח צמצם של חור סיכה של יחידה אוורירית אחת, לכידת סדרת זמן של 15 פריימים מחמישה שדות חזותיים שונים בכל לוח תא, וערימת z של 8 מישורי z במרחק שווה. קובץ ה- .lsm המתקבל הוא מחסנית זמן, מיקום ו- z.
הערה: הגדרות הרווח, הניגודיות והבהירות חייבות להיות ממוטבות תחילה תוך שימוש בעוצמת הלייזר המינימלית הדרושה לשימוש בכל הטווח הדינמי של הגלאי ולשמור עליהן קבועות לאורך כל המחקר, כדי להבטיח שכל ההדמיה מבוצעת באותם תנאים. ניתן להקליט עד תשעה מיקומים שונים בשילוב חומרה-תוכנה זה והמיקרוסקופ עובר בין מיקומי הדמיה באופן אוטומטי.
- החלף את מדיום התרבית בתווך תרבית טרי 1% המכיל FBS בטטרמתילרודמין 20 ננומטר, מתיל אסטר (TMRM) למשך 45 דקות.
2. ניתוח תמונות
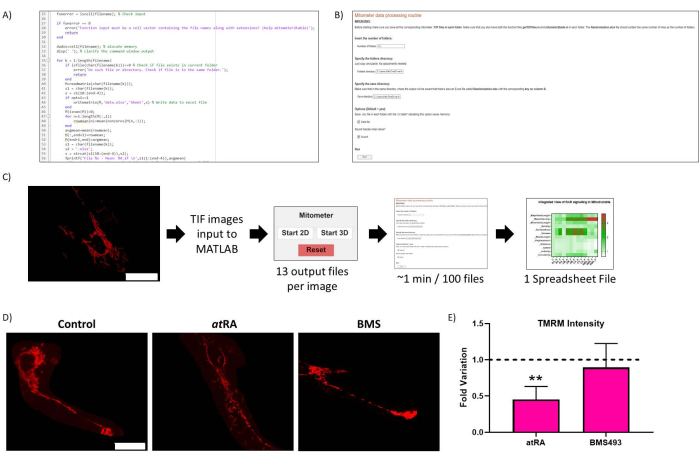
איור 2: אופטימיזציה שגרתית. (A) קוד מייצג של המיטוב השגרתי. (B) אופטימיזציה שגרתית של Live-Script. (C) זרימת עבודה שגרתית של אופטימיזציה. (D) אימות תוצאת אופטימיזציה שגרתית: תמונה מייצגת של מיטוכונדריה בתאים לא מטופלים (פאנל שמאלי), מטופלים ב- RA (10-7 M, 72 שעות, פאנל אמצעי), ומטופלים עם אנטגוניסט RAR BMS493 (10-7 M, 72 שעות, פאנל ימני), שצולם לאחר הדגירה עם TMRM (20 ננומטר, 45 דקות דגירה). סרגל קנה מידה = 30 מיקרומטר. (E) עוצמת TMRM במיטוכונדריה של גוף התא. ירידה משמעותית בטיפול בחומצה רטינואית all-trans (ב- RA, 10-7 M, 72 שעות), בהשוואה לביקורת (p = 0,0062), שלא נצפתה כאשר טופלה עם אנטגוניסט RAR (BMS493, 10-7 M, 72 שעות). חמישה תאים כומתו מכל אחת משלוש חזרות לכל מצב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- עיבוד תמונה
- פתיחת קבצים ב- ImageJ 2.1.0 וערימות מיקום נפרדות לפי שדה חזותי: פתח את ImageJ ולחץ על שורת התפריטים | תמונה | שכפול | קלט פרוסות/מספר מסגרת | בסדר.
הערה: כדי להפחית קלט חוזר לתוכנה, פותח מאקרו ImageJ כדי להקל על שכפול ושמירה של תמונות שדה חזותי.
- פתיחת קבצים ב- ImageJ 2.1.0 וערימות מיקום נפרדות לפי שדה חזותי: פתח את ImageJ ולחץ על שורת התפריטים | תמונה | שכפול | קלט פרוסות/מספר מסגרת | בסדר.
- פרוטוקול מאקרו
- צייר אזור עניין (ROI) מסביב לתא באמצעות כלי הבחירה החופשית.
- הפעל את המאקרו על-ידי פתיחת ImageJ וניווט אל שורת התפריטים | תוספים | פקודות מאקרו | הפעל את נקה את הרקע ושמור תמונות מאקרו.
הערה: ניתן לחלק תמונות באופן אקראי בתהליך זה, תוך אחסון מפתח הפתרון בהתאם לדרישות המיטוב. - קביעת גודל פיקסל ועומק ווקסל: פתח את ImageJ | התמונה ונווט אל שורת התפריטים | תמונה | מאפיינים.
- פרוטוקול ישיר חלופי
הערה: חלופה זו אינה משתמשת במאקרו לעיבוד תמונות- מצא את גודל הפיקסל ואת עומק הווקסל: פתח את ImageJ | פתח תמונה ונווט אל שורת התפריטים | תמונה | מאפיינים.
- צייר החזר השקעה סביב התא באמצעות כלי הבחירה החופשית, וודא שהוא מקיף את התא כולו לאורך 15 המסגרות.
- נווט אל שורת התפריטים | עריכה | ברור בחוץ.
- נווט אל שורת התפריטים | קובץ | שמירה בשם | בחר Tiff.
- בחר שמירת תיקיה ולחץ על שמור.
הערה: ניתן לסנוור/אקראי תמונות באופן ידני בשלב זה לפני המשך הניתוח.
- ניתוח תמונה אוטומטי
- הכן את התיקיות עבור קבצי ניתוח.
- צור שלוש תיקיות ראשיות, שכותרתן "כל הרצועות", "רצועות פרי-גרעיניות" ו"רצועות טלגרעיניות".
הערה: אפשרויות אלה תואמות לאפשרויות המסלול האוטומטי העיקריות. - בכל תיקייה ראשית, צרו תיקיית משנה לכל תמונה לעיבוד, המזוהה מספרית מ-1 ומעלה.
- הוסף עותק של שני הקבצים המשלימים למיטוב שגרתי (mitometer2table.m ו- getTXTfiles.m) לכל תיקיית תמונה.
הערה: קבצים אלה מסייעים בניתוח נתונים ובסידור פורמט סופי. מספר התיקיות חייב להתאים למספר הרכיבים בגיליון האלקטרוני האקראי (.xlsx). לאחר יצירת כל תיקיות המשנה הממוספרות עם קבצים משלימים לערכת נתונים אחת, ניתן להעתיק ולהדביק אותן באצווה בערכות הנתונים הנותרות.
- צור שלוש תיקיות ראשיות, שכותרתן "כל הרצועות", "רצועות פרי-גרעיניות" ו"רצועות טלגרעיניות".
- הכן את התיקיות עבור קבצי ניתוח.
- השתמשו במיטומטר של יישום MATLAB כדי לנתח תמונות.
הערה: פרוטוקול זה הופעל על מיטומטר, שהותקן ב-MATLAB R2022a. טען תמונות באצוות של 30 לקבלת זמן ריצה אופטימלי ואיזון פלט. גודל קובץ MAT מרבי מוטל על-ידי מערכת הקבצים המקורית: כברירת מחדל, פעולות "שמירה" יכולות ליצור קובץ < 231 בתים (~ 2 GB); ניתן להשתמש במקום זאת בפורמט שמירה MAT-Files גרסה 7.3, מכיוון שהיא מאפשרת גדלים משתנים מרביים הגדולים מ- 2 GB.- זיהוי/שינוי גרסת ברירת המחדל של קובץ MAT: בכרטיסיה 'בית ' במקטע 'סביבה ', לחצו על 'העדפות ' ובחרו MATLAB | כללי | קבצי MAT.
- השתמשו בכלי MATLAB מיטומטר כדי לנתח: פתחו את MATLAB ונווטו אל שורת התפריטים | אפליקציות | מיטומטר פתוח | בחר התחל תלת-ממד | נתוני קלט (גודל פיקסלים (μm): 0.1395089/זמן בין פריימים (ים): 2/מספר z-מישורים: 8/מרחק ציר בין מישורי z (μm): 0.418809 | בחרו תמונות להזנה.
- עבור לתפריט הצד של המיטומטר, בחר תמונה, לחץ על בחר מסומן, נווט לשורת התפריטים של המיטומטר | בחר מסלולים | מעקב אחר תצוגות | בחר All-Tracks, Telenuclear או Perinuclear | מיטומטר שורת תפריטים | בחר ניתוח | בחר רכיב (כלומר, אורך) | בחר שמור ל- ".txt".
הערה: ניתן להוריד יותר מפרמטר אחד בבת אחת, אם נבחר במקביל. - חלץ קבצי תוצאה לתיקיות שנוצרו (2.2.1).
- אופטימיזציה שוטפת וניתוח נתונים
- הכינו/התאימו את קובץ "Randomization.xlsx" המכיל את המפתח לקידוד תמונה.
- הוסף רשימה של מספרים שלמים עוקבים, מ- 1 ומעלה, בעמודה A.
הערה: מומלץ לשמור תיקייה משוכפלת עם תמונות בשם המקורי. - מקם את המשתנים האנליטיים בעמודה B, המורכבת מתווים אלפאנומריים.
הערה: מספר השורות במסמך חייב להיות עקבי עם מספר התיקיות הקיימות בערכת הנתונים הראשית. העתק והדבק קובץ "Randomization.xlsx" זה בשתי ערכות הנתונים העיקריות האחרות.
- הוסף רשימה של מספרים שלמים עוקבים, מ- 1 ומעלה, בעמודה A.
- ניתוח נתונים ממוטב
- לחץ פעמיים על "executable.mlx", הזן את מספר התיקיות, ציין את ספריית התיקיות (העתק את הספרייה מראש התיקייה) | ספריית השמירה (העתק את הספרייה מראש התיקיה) | שם הגיליון האלקטרוני בקובץ הפלט ולחץ על הפעל.
- ביצוע ניתוח סטטיסטי לפי הצורך.
הערה: ניתן לבחור ביצירה אופציונלית של קובץ .xlsx בכל תיקיה עם נתוני .txt והתראת קול לסוף הניתוח. Live Script מפיק קובץ גיליון אלקטרוני יחיד בתבנית טבלה. בפלט זה, עמודות מייצגות פרמטרים מנותחים (לדוגמה, "אורך ציר ראשי"; "עוצמה") וקווים מייצגים שדות ראייה של משתנים אנליטיים (למשל, "שליטה").
- הכינו/התאימו את קובץ "Randomization.xlsx" המכיל את המפתח לקידוד תמונה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
כדי לשפר ולהאיץ את הניתוח של קבצי פלט בפורמט .txt, קודד אופטימיזציה שגרתית הקוראת נתונים התואמים למיטומטר .txt קבצי פלט, עם עמודות המייצגות מסגרת וקווים המייצגים מיטוכונדריה מזוהים. המיטוב השגרתי מפיק נתונים בערך יחיד לכל פרמטר על ידי ממוצע המסגרות עבור כל מיטוכונדריה מזוהה ולאחר מכן ממוצע ה...
Access restricted. Please log in or start a trial to view this content.
Discussion
דימות תאים חי מייצר קבצים גדולים הדורשים עיבוד מחשוב רציני, אך אפילו הכלים העדכניים ביותר דורשים קלט ידני נרחב לעיבוד. אופטימיזציה שגרתית זו מתמקדת בפישוט תהליך ניתוח המיטוכונדריה במיטומטר מכיוון שכלי זה מציג איזון טוב מאוד בין קלט המשתמש לפלט הנתונים. השוואה מקיפה בין כלים שונים לניתוח ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
רכישת התמונה בוצעה במתקן LiM של iBiMED, צומת של PPBI (פלטפורמה פורטוגזית של BioImaging): POCI-01-0145-FEDER-022122. עבודה זו נתמכה על ידי FCT (EXPL/BTM-SAL/0902/2021) LCF (CI21-00276), מענק ל- DT מ- Fundação para a Ciência e Tecnologia of the Ministério da Educação e Ciência (2020.02006.CEECIND), מענק מ- ATG-The Gabba Alumni Association לסמנכ"ל, והמכון לביו-רפואה-iBiMED, אוניברסיטת אביירו.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| AM580 | Sigma-Aldrich | A8843 | |
| BDNF | Thermo-Fisher | RP8642 | |
| BMS493 | Tocris Bioscience | 3409 | |
| CD2314 | Tocris Bioscience | 3824 | |
| Ch55 | Tocris Bioscience | 2020 | |
| Foetal Bovine Serum | Thermo-Fisher | 10270106 | |
| GraphPad Prism v4.0 | GraphPad Software, La Jolla | n/a | |
| Ham’s F12 Nutrient Mix | Thermo-Fisher | 21765029 | |
| MATLAB R2022a | MathWorks | n/a | |
| Minimal Essential Medium | Thermo-Fisher | 31095 | |
| Nunc Glass Bottom Dishes | Thermo-Fisher | 150680 | |
| Phosphate Buffer Saline Solution | Thermo-Fisher | 28372 | |
| Retinoic acid | Sigma-Aldrich | R2625 | |
| TMRM | Thermo-Fisher | T668 | |
| Zeiss LSM 510 | Carl Zeiss | n/a | Equiped with live-cell imaging culture chamber and 63x oil immersion objective |
References
- Trigo, D., Avelar, C., Fernandes, M., Sa, J., da Cruz, E. S. O. Mitochondria, energy, and metabolism in neuronal health and disease. FEBS Letters. 596 (9), 1095-1110 (2022).
- Zong, W. X., Rabinowitz, J. D., White, E. Mitochondria and cancer. Molecular Cell. 61 (5), 667-676 (2016).
- Clare, D. K., Saibil, H. R. ATP-driven molecular chaperone machines. Biopolymers. 99 (11), 846-859 (2013).
- Tourniaire, F., et al. All-trans retinoic acid induces oxidative phosphorylation and mitochondria biogenesis in adipocytes. Journal of Lipid Research. 56 (6), 1100-1109 (2015).
- Psarra, A. M., Sekeris, C. E. Nuclear receptors and other nuclear transcription factors in mitochondria: regulatory molecules in a new environment. Biochimica et Biophysica Acta. 1783 (1), 1-11 (2008).
- Trigo, D., Goncalves, M. B., Corcoran, J. P. T. The regulation of mitochondrial dynamics in neurite outgrowth by retinoic acid receptor beta signaling. FASEB Journal. 33 (6), 7225-7235 (2019).
- Mitra, K., Lippincott-Schwartz, J. Analysis of mitochondrial dynamics and functions using imaging approaches. Current Protocols in Cell Biology. Chapter 4 (Unit 4), 1-21 (2010).
- Sajic, M., et al. Impulse conduction increases mitochondrial transport in adult mammalian peripheral nerves in vivo. PLoS Biology. 11 (12), e1001754(2013).
- Lefebvre, A., Ma, D., Kessenbrock, K., Lawson, D. A., Digman, M. A. Automated segmentation and tracking of mitochondria in live-cell time-lapse images. Nature Methods. 18 (9), 1091-1102 (2021).
- Chu, C. -H., Tseng, W. -W., Hsu, C. -M., Wei, A. -C. Image analysis of the mitochondrial network morphology with applications in cancer research. Frontiers in Physics. 10, 855775(2022).
- Creed, S., McKenzie, M. Measurement of mitochondrial membrane potential with the fluorescent dye tetramethylrhodamine methyl ester (TMRM). Methods in Molecular Biology. 1928, 69-76 (2019).
- Kovalevich, J., Langford, D. Considerations for the use of SH-SY5Y neuroblastoma cells in neurobiology. Methods in Molecular Biology. 1078, 9-21 (2013).
- Sahin, M., Oncu, G., Yilmaz, M. A., Ozkan, D., Saybasili, H. Transformation of SH-SY5Y cell line into neuron-like cells: Investigation of electrophysiological and biomechanical changes. Neuroscience Letters. 745, 135628(2021).
- Trigo, D., et al. Mitochondria dysfunction and impaired response to oxidative stress promotes proteostasis disruption in aged human cells. Mitochondrion. 69, 1-9 (2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved