需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Methods Article
通过亚型特异性视黄酸受体对活神经元线粒体稳态调节进行优化的自动分析
摘要
线粒体网络极其复杂,因此分析起来非常具有挑战性。一种新颖的MATLAB工具可分析延时摄影图像中的实时共聚焦成像线粒体,但输出量很大,需要单独手动操作。为了解决这个问题,开发了一个例行优化,允许快速的文件分析。
摘要
复杂的线粒体网络使得分割、跟踪和分析活细胞变得非常具有挑战性。MATLAB 工具允许分析延时文件中的线粒体,从而大大简化和加快图像处理过程。尽管如此,现有工具产生的输出量很大,需要单独的手动关注,并且基本的实验设置有数千个文件的输出,每个文件都需要大量且耗时的处理。
为了解决这些问题,我们开发了一种例行优化,包括 MATLAB 代码和实时脚本形式,允许快速进行文件分析并显着减少文档读取和数据处理。以 100 个文件/分钟的速度,优化允许整体快速分析。优化通过在整个时间范围内对单个线粒体的特定帧数据进行平均,以定义的方式分析数据,与现有工具的输出一致,从而实现结果输出。使用染料四甲基罗丹明甲酯进行实时共聚焦成像,并通过用视黄酸受体 (RAR) 激动剂处理神经元细胞来验证常规优化,其对神经元线粒体的影响已在文献中确定。结果与文献一致,并允许进一步表征线粒体网络行为以响应亚型特异性 RAR 调节。
这种新方法可以快速和验证全神经元线粒体网络的表征,但它也允许区分轴突和细胞体线粒体,这是应用于神经科学领域的基本特征。此外,该协议可应用于使用速效治疗的实验,允许在治疗前后对相同的细胞进行成像,超越了神经科学领域。
引言
细胞线粒体位于所有生理状态的中心,透彻了解它们的稳态(有丝分裂)和行为对于帮助确定各种疾病(包括癌症和阿尔茨海默病)的药物治疗至关重要 1,2。
线粒体在能量稳态、ATP 生成、钙缓冲和 ROS 调节中起着至关重要的细胞作用,而有丝分裂对于维持蛋白质稳态至关重要,因为分子伴侣是能量依赖性的3。这些需要持续和动态的网络调制和适应才能有效地满足细胞需求,并且线粒体转运受不同信号通路的调节;以前的工作已经描述了一种这样的途径,即视黄酸受体 (RAR) 4,5。视黄酸 (RA) 通过 RAR 激活促进轴突和神经突的生长。在小鼠原代皮层神经元中,RAR-β 的激活可促进神经突中的线粒体生长、速度和活动性6。
考虑到线粒体网络的适应性和动态性,"实时"评估有丝分裂的可能性不仅对于研究能量稳态至关重要,而且对于蛋白稳态、细胞健康、增殖或信号传导也至关重要。评估有丝分裂的常用方法依赖于使用荧光染料或标记物突出线粒体后进行共聚焦显微镜检查,以及允许温度和/或 CO2 调节的特定显微镜设置7。这种类型的实验设置需要一次执行一个实验重复。除了不同处理的实验重复外,还应该考虑大多数实验应该有其技术重复(其中每个板对多个位置进行成像),并在一系列时间点中记录一系列焦平面(z-stacks)。因此,实验设计具有三个重复的一种对照和两种处理,每个板有五个成像位置和 15 个时间点,导致要处理 225 个堆栈。传统上,活线粒体的视频是通过绘制 kymographs 来分析的,这将单独分析8,这是一个耗时的过程,需要大量的手动输入,即使依赖计算机工具也是如此。
最近描述了一种算法9 ,该算法允许自动分割和跟踪活细胞2-D和3-D延时文件中的线粒体。其他定量技术可用,但都有其局限性10.Mitometer 是一种自动化的开源应用程序,特别适合时间流逝和线粒体动力学分析,需要很少的用户输入。与其他现有的基于MATLAB的工具相比,该应用程序具有一系列优势,即允许使用多达13个不同的参数自动处理单个TIF堆栈,这对神经科学特别感兴趣,因为它可以区分核周和远核线粒体。
但是,对于上述实验,应用于 225 个堆栈的这 13 个参数会产生 2,925 个单独的输出文件。这些需要四个单独的计算机输入,总共需要超过 10,000 个手动输入才能下载所有输出文件。对于大型实验设计,这会导致对每个文件和数据集成进行不必要的极其耗时的分析。在这里,我们提出了一个例行优化,允许快速的文件分析,大大减少文档阅读和数据处理,以定义的方式分析数据,与现有工具的输出一致。
研究方案
注意:该协议有两个主要步骤:湿实验室步骤,涉及细胞培养和活共聚焦显微镜以获得活线粒体的图像(图1)和 计算机步骤分析 获得的图像(图2)。为了对 3D 实时成像线粒体进行自动数据分析,使用了 Lefebvre 等人提供的 MATLAB 应用程序 Mitometer9。例程优化是用 MATLAB 编写的。该软件、更新版本和处理 ImageJ 宏可通过 GitHub 免费在线获得,网址为 https://github.com/JoseJoaoMV/Routine_Optimization_Mitometer_APP_MATLAB。
1. 活体显微镜
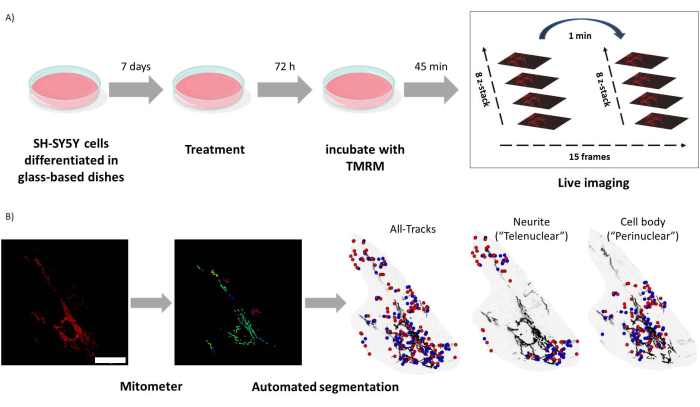
图1:实验方案。对SH-SY5Y细胞进行分化并用类视黄醇处理。 (A) TMRM 用于使用共聚焦显微镜对处理细胞中的健康线粒体进行实时成像,捕获五个视野的延时 z 堆栈。(B) 线粒体计应用程序MATLAB自动分割和分析线粒体图像。除了分析之外,该软件还根据核接近度自动区分线粒体。蓝点是线粒体的初始位置;红点是最终位置。比例尺 = 30 μm。缩写:TMRM=四甲基罗丹明,甲酯。 请点击这里查看此图的较大版本.
- 细胞培养
- 在37°C下在5%CO2 和95%空气的湿润气氛中孵育SH-SY5Y细胞,在等量的MEM(最小必需培养基)和F12(Ham的F12营养混合物)培养基中培养,补充有10%胎牛血清(FBS)。
- 将 SH-SY5Y 细胞以 15 × 104 个细胞/mL 的密度平板放入玻璃底细胞培养皿中。
- 在含 1% FBS 的培养基中用 10 μM 全反 式视黄酸处理 5 天分化细胞,然后用 10 ƞg/mL 脑源性神经营养因子 (BDNF) 处理 2 天。
- 细胞治疗
- 用无菌磷酸盐缓冲盐水(PBS)洗涤细胞,并用10-7M RAR亚型激动剂处理72小时,在MEM(最小必需培养基)和F12(Ham's F12营养混合物)培养基的等量中,补充有1%FBS。
注意:使用的RARα激动剂为AM580;使用的RARβ激动剂为CD2314;Ch55 用作 RARα 的激动剂和 β 的共激动剂; 在RA作为阳性对照;BMS493被用作RAR 泛拮抗剂。
- 用无菌磷酸盐缓冲盐水(PBS)洗涤细胞,并用10-7M RAR亚型激动剂处理72小时,在MEM(最小必需培养基)和F12(Ham's F12营养混合物)培养基的等量中,补充有1%FBS。
- 实时共聚焦成像
- 用20nM四甲基罗丹明甲酯(TMRM)替换新的1%含FBS的培养基45分钟。
注意:TMRM 是一种细胞渗透性荧光染料,被活性线粒体隔离,该孵育期使 TMRM 达到平衡并被极化线粒体11 吸收。成像应在建立平衡之前开始,因为 TMRM 信号强度可能会在成像过程中人为增加。 - 将细胞置于连接到37°C激光扫描共聚焦显微镜的培养箱中。
- 使用 63 倍油浸复消色差物镜捕获图像,图像大小为 512 x 512 像素,针孔孔径为 1 个通风单元,从每个单元板中的五个不同视野捕获 15 帧的时间序列,以及 8 个等距 z 平面的 z 堆栈。生成的 .lsm 文件是时间、位置和 z 堆栈。
注意:增益、对比度和亮度的设置必须首先使用使用探测器整个动态范围所需的最小激光功率进行优化,并在整个研究过程中保持恒定,确保所有成像都在相同的条件下进行。在这种软硬件组合中,最多可以记录九个不同的位置,并且显微镜在成像位置之间自动循环。
- 用20nM四甲基罗丹明甲酯(TMRM)替换新的1%含FBS的培养基45分钟。
2. 图像分析
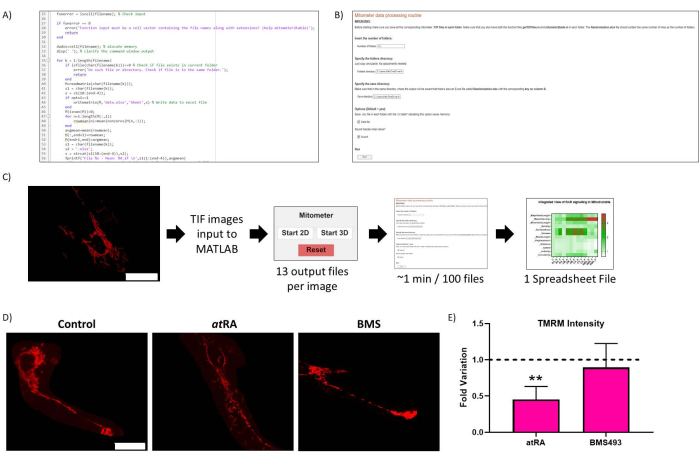
图 2:例程优化。 (一)例程优化的代表性代码。(B) 例程优化 Live-Script。(C) 常规优化工作流程。(D) 常规优化结果验证:未处理细胞(左图)中线粒体的代表性图像,在RA 下处理(10-7 M,72 小时,中图),并用 RAR 拮抗剂 BMS493 处理(10-7 M,72 小时,右图),在用 TMRM 孵育后成像(20 nM,孵育 45 分钟)。比例尺 = 30 μm。 (E) 细胞体线粒体中的 TMRM 强度。与对照组(p = 0,0062)相比,全反式维甲酸处理(RA,10-7 M,72小时)显着降低,用RAR拮抗剂处理时未观察到(BMS493,10-7 M,72小时)。从每个条件的三次重复中,每个细胞量化五个细胞。请点击这里查看此图的较大版本.
- 图像处理
- 在 ImageJ 2.1.0 中打开文件并按视野分隔位置堆栈:打开 ImageJ 并单击 菜单栏 |图片 |复制 |输入切片/帧编号 |好的。
注意:为了减少对软件的重复输入,开发了 ImageJ 宏,以促进视野图像的复制和保存。
- 在 ImageJ 2.1.0 中打开文件并按视野分隔位置堆栈:打开 ImageJ 并单击 菜单栏 |图片 |复制 |输入切片/帧编号 |好的。
- 宏协议
- 使用 自由选择工具在单元格周围绘制感兴趣区域 (ROI)。
- 通过打开 ImageJ 并导航到 Menu Bar |插件 |宏 |运行"清除背景并保存图像"宏。
注意:在此过程中,图像可以随机化,根据优化要求存储解决方案密钥。 - 确定像素大小和体素深度:打开 ImageJ | 图像 并导航到 菜单栏 |图片 |属性。
- 替代直接协议
注意:此替代方法不使用宏来处理图像- 查找像素大小和体素深度: 打开 ImageJ |打开图像 并导航到 菜单栏 |图片 |属性。
- 使用 自由选择工具在单元格周围绘制 ROI,确保它在 15 帧中包含整个单元格。
- 导航到 菜单栏 |编辑 |外面清澈。
- 导航到 菜单栏 |文件 |另存为 |选择 Tiff。
- 选择"保存文件夹",然后单击" 保存"。
注意:在继续分析之前,此时可以手动对图像进行盲法/随机化。
- 自动图像分析
- 准备分析文件的文件夹。
- 创建三个主文件夹,标题为"所有轨道"、"核周轨道"和"远程核轨道"。
注意:这些与主要的自动轨道选项相匹配。 - 在每个主文件夹中,为要处理的每个图像创建一个子文件夹,从1开始以数字标识。
- 将两个例程优化补充文件(mitometer2table.m 和 getTXTfiles.m)的副本添加到每个映像文件夹。
注意:这些文件有助于数据分析和最终格式安排。文件夹数必须与随机电子表格 (.xlsx) 中的元素数匹配。为一个数据集创建所有带有补充文件的编号子文件夹后,可以批量复制这些子文件夹并将其粘贴到其余数据集中。
- 创建三个主文件夹,标题为"所有轨道"、"核周轨道"和"远程核轨道"。
- 准备分析文件的文件夹。
- 使用 MATLAB 应用程序 Mitometer 分析图像。
注意:该协议在安装在 MATLAB R2022a 上的线粒度计上运行。以 30 个为一组加载图像,以实现最佳时间运行和输出平衡。最大 MAT 文件大小由本机文件系统施加:默认情况下,"保存"操作可以创建 231 字节 (~2 GB) <文件;可以改用保存格式 MAT-Files 7.3 版,因为它允许大于 2 GB 的最大可变大小。- 识别/更改默认 MAT 文件版本:在" 主页 "选项卡的" 环境 "部分,单击" 首选项 ",然后选择 "MATLAB"|"一般 |MAT 文件。
- 使用 MATLAB 工具 Mitometer 进行分析:打开 MATLAB 并导航到 菜单栏 |应用程序 |打开Mitometer |选择"启动 3D"|"输入数据(像素大小(μm):0.1395089/帧间隔时间(秒):2/z平面数:8/z平面轴距(μm):0.418809 |选择要输入的图像。
- 转到线粒体计侧边菜单,选择 图像,单击 选择突出显示,导航到线粒体计 菜单栏 |选择曲目 |跟踪视图 | 选择 All-Tracks、Telenuclear 或 Perinuclear | 线粒体计菜单栏 |选择"分析"|"选择一个元素 (即 长度) |选择 保存到".txt"。
注意:如果同时选择,可以一次下载多个参数。 - 将结果文件解压到创建的文件夹 (2.2.1)。
- 日常优化和数据分析
- 准备/调整包含图像编码密钥的"Randomization.xlsx"文件。
- 在 A 列中插入从 1 开始的连续整数列表。
注意:建议保留一个带有原始命名图像的重复文件夹。 - 将分析变量放在由字母数字字符组成的 B 列中。
注意:文档中的行数必须与主数据集中存在的文件夹数一致。将此"Randomization.xlsx"文件复制并粘贴到其他两个主要数据集中。
- 在 A 列中插入从 1 开始的连续整数列表。
- 优化的数据分析
- 双击"executable.mlx",输入文件夹数量, 指定文件夹目录(从文件夹顶部复制目录)|保存目录(从文件夹顶部复制目录)|电子表格名称 ,然后单击 运行。
- 根据需要执行统计分析。
注意:可以选择在每个文件夹中创建一个.xlsx文件,其中包含.txt数据和声音警报,直到分析结束。Live Script 以表格格式输出单个电子表格文件。在此输出中,列表示分析的参数(例如," 主轴长度";"强度")和线表示分析变量的视野(例如,"控制")。
- 准备/调整包含图像编码密钥的"Randomization.xlsx"文件。
结果
为了增强和加速对.txt格式输出文件的分析,对例程优化进行了编码,该优化读取与Mitometer一致的数据.txt输出文件,列表示帧,线表示已识别的线粒体。例程优化通过对每个已识别线粒体的帧进行平均,然后对每个视野中所有线粒体的结果进行平均,从而为每个参数生成单个值的数据。开发的例程从编号从 1 向上的文件夹中读取文件。Live Script 例程优化以表格格式输出单个电子表格文件。在此输?...
讨论
活细胞成像产生的大文件需要大量的计算处理,但即使是最新的工具也需要大量的手动输入来处理。这种常规优化的重点是简化线粒体计上的线粒体分析过程,因为该工具在用户输入和数据输出之间实现了非常好的平衡。之前已经回顾了不同线粒体图像分析工具之间的全面比较10.虽然其他管道更侧重于分析线粒体网络和簇质量或分析膜电位变化,但这里介绍的这种新方法可以快?...
披露声明
作者没有利益冲突需要声明。
致谢
图像采集在 iBiMED 的 LiM 设施中进行,这是 PPBI(葡萄牙生物成像平台)的一个节点:POCI-01-0145-FEDER-022122。这项工作得到了 FCT (EXPL/BTM-SAL/0902/2021) LCF (CI21-00276)、教育与科学部科学与技术基金会 (2020.02006.CEECIND) 对 DT 的资助、ATG-Gabba 校友会对副总裁的资助以及阿威罗大学生物医学研究所-iBiMED 的资助。
材料
| Name | Company | Catalog Number | Comments |
| AM580 | Sigma-Aldrich | A8843 | |
| BDNF | Thermo-Fisher | RP8642 | |
| BMS493 | Tocris Bioscience | 3409 | |
| CD2314 | Tocris Bioscience | 3824 | |
| Ch55 | Tocris Bioscience | 2020 | |
| Foetal Bovine Serum | Thermo-Fisher | 10270106 | |
| GraphPad Prism v4.0 | GraphPad Software, La Jolla | n/a | |
| Ham’s F12 Nutrient Mix | Thermo-Fisher | 21765029 | |
| MATLAB R2022a | MathWorks | n/a | |
| Minimal Essential Medium | Thermo-Fisher | 31095 | |
| Nunc Glass Bottom Dishes | Thermo-Fisher | 150680 | |
| Phosphate Buffer Saline Solution | Thermo-Fisher | 28372 | |
| Retinoic acid | Sigma-Aldrich | R2625 | |
| TMRM | Thermo-Fisher | T668 | |
| Zeiss LSM 510 | Carl Zeiss | n/a | Equiped with live-cell imaging culture chamber and 63x oil immersion objective |
参考文献
- Trigo, D., Avelar, C., Fernandes, M., Sa, J., da Cruz, E. S. O. Mitochondria, energy, and metabolism in neuronal health and disease. FEBS Letters. 596 (9), 1095-1110 (2022).
- Zong, W. X., Rabinowitz, J. D., White, E. Mitochondria and cancer. Molecular Cell. 61 (5), 667-676 (2016).
- Clare, D. K., Saibil, H. R. ATP-driven molecular chaperone machines. Biopolymers. 99 (11), 846-859 (2013).
- Tourniaire, F., et al. All-trans retinoic acid induces oxidative phosphorylation and mitochondria biogenesis in adipocytes. Journal of Lipid Research. 56 (6), 1100-1109 (2015).
- Psarra, A. M., Sekeris, C. E. Nuclear receptors and other nuclear transcription factors in mitochondria: regulatory molecules in a new environment. Biochimica et Biophysica Acta. 1783 (1), 1-11 (2008).
- Trigo, D., Goncalves, M. B., Corcoran, J. P. T. The regulation of mitochondrial dynamics in neurite outgrowth by retinoic acid receptor beta signaling. FASEB Journal. 33 (6), 7225-7235 (2019).
- Mitra, K., Lippincott-Schwartz, J. Analysis of mitochondrial dynamics and functions using imaging approaches. Current Protocols in Cell Biology. Chapter 4 (Unit 4), 1-21 (2010).
- Sajic, M., et al. Impulse conduction increases mitochondrial transport in adult mammalian peripheral nerves in vivo. PLoS Biology. 11 (12), e1001754 (2013).
- Lefebvre, A., Ma, D., Kessenbrock, K., Lawson, D. A., Digman, M. A. Automated segmentation and tracking of mitochondria in live-cell time-lapse images. Nature Methods. 18 (9), 1091-1102 (2021).
- Chu, C. -. H., Tseng, W. -. W., Hsu, C. -. M., Wei, A. -. C. Image analysis of the mitochondrial network morphology with applications in cancer research. Frontiers in Physics. 10, 855775 (2022).
- Creed, S., McKenzie, M. Measurement of mitochondrial membrane potential with the fluorescent dye tetramethylrhodamine methyl ester (TMRM). Methods in Molecular Biology. 1928, 69-76 (2019).
- Kovalevich, J., Langford, D. Considerations for the use of SH-SY5Y neuroblastoma cells in neurobiology. Methods in Molecular Biology. 1078, 9-21 (2013).
- Sahin, M., Oncu, G., Yilmaz, M. A., Ozkan, D., Saybasili, H. Transformation of SH-SY5Y cell line into neuron-like cells: Investigation of electrophysiological and biomechanical changes. Neuroscience Letters. 745, 135628 (2021).
- Trigo, D., et al. Mitochondria dysfunction and impaired response to oxidative stress promotes proteostasis disruption in aged human cells. Mitochondrion. 69, 1-9 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。