A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس التنفس عالي الدقة لتقييم وظيفة الميتوكوندريا في الحيوانات المنوية البشرية
In This Article
Erratum Notice
Summary
يسمح تحليل وظيفة الميتوكوندريا للحيوانات المنوية عن طريق قياس التنفس عالي الدقة بقياس استهلاك الأكسجين للحيوانات المنوية المتحركة بحرية في نظام الغرفة المغلقة. يمكن تطبيق هذه التقنية لقياس التنفس في الحيوانات المنوية البشرية ، والتي توفر معلومات عن خصائص الميتوكوندريا المنوية وسلامتها.
Abstract
غالبا ما تتم دراسة جودة السائل المنوي عن طريق تحليل السائل المنوي الروتيني ، وهو وصفي وغالبا ما يكون غير حاسم. يرتبط العقم عند الذكور بنشاط الميتوكوندريا للحيوانات المنوية المتغيرة ، وبالتالي فإن قياس وظيفة الميتوكوندريا للحيوانات المنوية هو مؤشر على جودة الحيوانات المنوية. قياس التنفس عالي الدقة هو طريقة لقياس استهلاك الأكسجين للخلايا أو الأنسجة في نظام الغرفة المغلقة. يمكن تنفيذ هذه التقنية لقياس التنفس في الحيوانات المنوية البشرية وتوفر معلومات حول جودة وسلامة الميتوكوندريا المنوية. يسمح قياس التنفس عالي الدقة للخلايا بالتحرك بحرية ، وهي ميزة مسبقة في حالة الحيوانات المنوية. يمكن تطبيق هذه التقنية مع الحيوانات المنوية السليمة أو المتداخلة وتسمح بدراسة وظيفة الميتوكوندريا المنوية السليمة ونشاط مجمعات السلسلة التنفسية الفردية. تستخدم أداة oxygraph عالية الدقة أجهزة استشعار لقياس تركيز الأكسجين إلى جانب برامج حساسة لحساب استهلاك الأكسجين. تستخدم البيانات لحساب مؤشرات الجهاز التنفسي بناء على نسب استهلاك الأكسجين. وبالتالي ، فإن المؤشرات هي نسب معدلين لاستهلاك الأكسجين ويتم تطبيعها داخليا إلى عدد الخلايا أو كتلة البروتين. مؤشرات الجهاز التنفسي هي مؤشر على وظيفة الميتوكوندريا المنوية والخلل الوظيفي.
Introduction
يقدر أن العقم عند الذكور يمثل 40٪ -50٪ من جميع حالات العقم عند الأزواج1. يلعب تحليل السائل المنوي التقليدي دورا حاسما في تحديد خصوبة الذكور. ومع ذلك ، فإن ما يقرب من 15 ٪ من الرجال المصابين بالعقم لديهم معايير الحيوانات المنوية الطبيعية2. بالإضافة إلى ذلك ، يوفر تحليل السائل المنوي الروتيني معلومات محدودة حول وظيفة الحيوانات المنوية ولا يعكس عيوب الحيوانات المنوية الدقيقة3.
الميتوكوندريا المنوية لها بنية خاصة ، حيث يتم ترتيبها كغمد حلزوني حول السوط. يحتوي غمد الميتوكوندريا على عدد متغير من الميتوكوندريا المتصلة بواسطة روابط بين الميتوكوندريا ومثبتة على الهيكل الخلوي عن طريق ترتيبات البروتين المطلوبة على غشاء الميتوكوندريا الخارجي 4,5. هذا التركيب يجعل من الصعب بشكل خاص عزل الميتوكوندريا المنوية. لذلك ، فإن معظم الدراسات حول وظيفة الميتوكوندريا للحيوانات المنوية تستخدم التحليلات في الموقع أو الحيوانات المنويةالمفككة 6.
تم ربط بنية الميتوكوندريا المنوية ووظيفتها باستمرار بالعقم عند الذكور7،8،9،10،11 ، مما يشير إلى أن تحليل بنية ووظيفة هذه العضيات قد يكون مرشحا جيدا لإدراجها في تحليل الحيوانات المنوية.
تلعب الميتوكوندريا دورا مهما في استقلاب الطاقة الخلوية ، لا سيما باستخدام الأكسجين لإنتاج أدينوسين ثلاثي الفوسفات (ATP) من خلال الفسفرة التأكسدية (OXPHOS). في الحيوانات المنوية ، على وجه الخصوص ، مصدر ATP (تحلل السكر مقابل OXPHOS) متنازع عليه ، ولا يزال الكثير من البيانات مثيرا للجدل ويعتمد على مناهج تجريبية مختلفة4،12،13. تقدم قياسات التنفس عن طريق قياس التأكسج رؤى مهمة حول القدرة التنفسية للميتوكوندريا ، وسلامة الميتوكوندريا ، واستقلاب الطاقة للخلية14،15،16. تقليديا ، تم تنفيذ هذه التقنية باستخدام قطب الأكسجين كلارك - أداة تم استخدامها لقياس تنفس الميتوكوندريا لأكثر من 50 عاما17,18. بالإضافة إلى ذلك ، تم تحليل استهلاك الأكسجين في الميتوكوندريا المنوية باستخدام قطب الأكسجين الكلاسيكيكلارك 19،20،21. يوفر قياس التنفس عالي الدقة (HRR) باستخدام أجهزة الأوكسجين (Oroboros) حساسية أعلى من استخدام أجهزة قياس التنفس الكلاسيكية22. تتكون أجهزة الأوكسجين من غرفتين مع منافذ حقن ، وتحتوي كل غرفة على مستشعر أكسجين بولاروغرافي. باستخدام هذه التقنية ، من الممكن تحليل شرائح الأنسجة والخلايا ومعلقات الميتوكوندريا المعزولة. يتم تحريك العينة باستمرار في الغرفة ، وخلال التجربة ، يتم قياس استهلاك الأكسجين ، ويتم حساب معدلات الأكسجين باستخدام برنامج محدد. تظهر الغرف انخفاضا في تسرب الأكسجين ، وهي ميزة على أجهزة قطب الأكسجين التقليدية14,23.
كما هو الحال مع الخلايا الأخرى ، في حالة الحيوانات المنوية ، تكون حساسية معدات HRR أعلى من قياس التنفس التقليدي ، مما يعني أنه يمكن استخدام معدات HRR لتحليل عدد محدود من خلايا الحيوانات المنوية السليمة أو المتخللة. هناك استراتيجيتان رئيسيتان لتقييم وظيفة الميتوكوندريا للحيوانات المنوية بواسطة HRR: (أ) قياس استهلاك الأكسجين في الخلايا السليمة ، والذي يتضمن إعادة إنتاج وظيفة الجهاز التنفسي في وسط يحتوي على ركائز مثل الجلوكوز ، أو (ب) قياس استهلاك الأكسجين في الخلايا النفاذية باستخدام أحد معقدات OXPHOS ، مع إضافة ركائز محددة لمراقبة كل وظيفة على حدة.
في هذه الدراسة ، وصفنا استخدام HRR لتحديد تنفس الميتوكوندريا في خلايا الحيوانات المنوية البشرية.
Protocol
تمت الموافقة على التجارب من قبل لجنة الأخلاقيات التابعة لكلية الطب بجامعة الجمهورية ، مونتيفيديو ، أوروغواي.
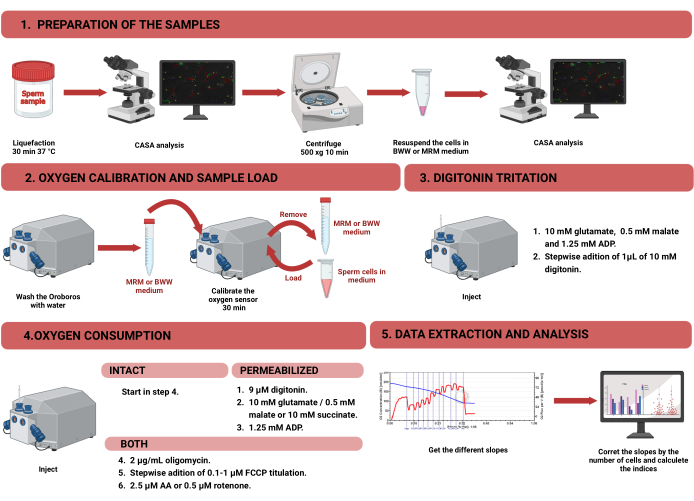
الشكل 1: سير عمل قياس التنفس عالي الدقة لتقييم وظيفة الميتوكوندريا في الحيوانات المنوية البشرية السليمة والنفاذة. تم تقسيم البروتوكول إلى أربع خطوات مختلفة: 1) تحضير العينة ، 2) معايرة الأكسجين في أداة Oroboros ، 3) قياس استهلاك الأكسجين للخلايا السليمة والمتخللة ، و 4) استخراج البيانات من المعدات والتحليل. الاختصارات: CASA = تحليل الحيوانات المنوية بمساعدة الكمبيوتر. BWW = بيجرز ويتن ويتنغهام متوسطة ؛ MRM = وسط تنفس الميتوكوندريا. ADP = أدينوسين ثنائي الفوسفات. FCCP = سيانيد الكربونيل -p- ثلاثي فلورو روميثوكسي فينيل هيدرازون ؛ AA = مضاد الميسين أ. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
ملاحظة: يظهر سير العمل لقياس استهلاك الأكسجين في خلايا الحيوانات المنوية باستخدام HRR في الشكل 1. يتم تقديم معلومات حول المواد والمعدات والكواشف المستخدمة في البروتوكول في جدول المواد.
1. إعداد العينة
- جمع العينات
- جمع السائل المنوي البشري المقذوف حديثا عن طريق الاستمناء بعد الامتناع عن ممارسة الجنس لمدة 3 أيام في حاوية بلاستيكية معقمة. نقل العينات على الفور إلى المختبر.
- احتضان العينات لمدة 30-60 دقيقة في درجة حرارة الغرفة (RT) لتسييل24 تماما.
- بعد التسييل ، قم بتخزين العينات في درجة حرارة 37 درجة مئوية حتى تبدأ التجربة.
- تقييم الحيوانات المنوية باستخدام تحليل الحيوانات المنوية بمساعدة الكمبيوتر (CASA)
- امزج العينة ، وقم بتحميل 7 ميكرولتر في غرفة عد الحيوانات المنوية التي تم تسخينها مسبقا.
- ضع الحجرة على مرحلة التسخين المسبق (37 درجة مئوية) من المجهر الضوئي المباشر.
- افتح برنامج تحليل الحيوانات المنوية المحوسب ، وأدخل وحدة الحركة والتركيز (انقر فوق Mot).
- حدد التكوين الذي يتوافق مع ظروف الحيوانات المنوية البشرية.
ملاحظة: يجب تكييف التكوين مع نوع وعمق الغرفة وكذلك مع أنواع العينات ونظام CASA. - قم بتحليل 10 حقول مختلفة لكل غرفة بشكل عشوائي بالنقر فوق الزر "تحليل ".
- انقر فوق النتائج للحصول على تركيز العينة وحركتها.
- إعداد الخلية
ملاحظة: إذا لم تتم معايرة HRR ، فابدأ بالخطوات 2.1-2.2 قبل تحضير الخلايا (الخطوة 1.3). من المهم قياس استهلاك الأكسجين فورا عند إعادة تعليق خلايا الحيوانات المنوية في الوسط.- أجهزة الطرد المركزي العينات في 400 × غرام لمدة 10 دقائق في RT.
- إزالة البلازما المنوية ، وإعادة تعليق الحيوانات المنوية في 2 مل من Biggers Whitten Whittingham (BWW) لإجراء تجارب على الخلايا السليمة أو وسط التنفس الميتوكوندريا (MRM) للدراسات مع الخلايا النفاذية. يتم عرض تركيبات الوسائط في الجدول 1.
- كرر الخطوات الموضحة في الخطوة 1.2 لدراسات تركيز الحيوانات المنوية.
2. قياس التنفس عالي الدقة: تحليل OXPHOS
ملاحظة: يدمج HRR أجهزة الأوكسجين عالية الحساسية (Oxygraph-2 K; Oroboros Instruments GmbH، إنسبروك، النمسا) مع برنامج (DatLab, version 4.2; أوروبوروس إنسترومنتس جي إم بي إتش). يتم عرض البيانات التجريبية على أنها تركيز الأكسجين مقابل الوقت (مثل pmol ل O2/106 خلايا · min−1) وكتحولات في الوقت الفعلي لهذه البيانات ، مما يسمح للمجرب بتتبع التنفس (استهلاك الأكسجين ، تدفق الأكسجين) للعينات البيولوجية والكيميائية الحيوية بينما لا تزال التجربة جارية. يمكن استخدام HRR لمتابعة تنفس الخلايا الحية والمتحركة ، وهو أمر مفيد بشكل خاص للحيوانات المنوية ، التي ترتبط حركتها بجودة الحيوانات المنوية وإمكانات الخصوبة. يستخدم المختبر HRR Oroboros Oxygraph2-k ، أدوات Oroboros ، مع غرفتين. يجب تنفيذ الخطوات الموضحة في هذا البروتوكول بشكل مستقل لكل من غرف 2 مل.
- إعداد المعدات
- قم بتشغيل HRR ، وقم بتوصيله ببرنامج قياس التنفس (DatLab) للحصول على البيانات وتحليلها.
- استبدل الإيثانول بنسبة 70٪ في غرفة الأوكسيجراف ب ddH2O. حركه باستمرار باستخدام قضيب التحريك المغناطيسي في الحجرة عند 750 دورة في الدقيقة. اتركه لمدة 10 دقائق ، واستنشق H2O المقطر المزدوج (dd) بعد ذلك.
- اغسل الحجرة ثلاث مرات باستخدام ddH2O لمدة 5 دقائق في كل مرة.
ملاحظة: هذه الخطوة ضرورية لإزالة الإيثانول المتبقي من الغرف. خلايا الحيوانات المنوية حساسة للغاية للإيثانول. يمكن اختراق التسجيل إذا تم حذف هذه الخطوة.
- معايرة مستشعرات الأكسجين
ملاحظة: يختلف إجراء المعايرة قليلا حسب الجهاز. قم بإجراء معايرة الهواء لمستشعر الأكسجين البولوجرافي كما هو موضح من قبل الشركة المصنعة25. في هذا القسم ، يتم شرح بروتوكول المعايرة بإيجاز.- قم بإزالة ddH 2 O ، وماصة2مل من نفس الوسط المستخدم لإعداد الخلية في الغرفة. ضع السدادات ، تاركا فقاعة تبادل الهواء.
ملاحظة: من المهم معرفة حجم الغرفة لتحديد الحجم الدقيق للوسط المطلوب. - سجل قيم معايرة الأكسجين (انقر فوق تخطيط > 01 Calibration Exp. Gr3-Temp) لمراقبة أداء غشاء المستشعر عن طريق تحريك الوسط بقضيب التحريك عند 750 دورة في الدقيقة لمدة 30 دقيقة على الأقل عند 37 درجة مئوية. استخدم الإعدادات الأخرى كما ذكر: كسب المستشعر: 2 ؛ جهد الاستقطاب: 800 مللي فولت ؛ الفاصل الزمني لتسجيل البيانات: 2.0 ثانية.
ملاحظة: من المتوقع الحصول على منحدر O 2 غير مصحح (خط أحمر) ضمن ±2 pmol∙s−1∙mL−1 مع إشارة مستقرة من مستشعر البولاروغرافيا. - اسحب الماوس أثناء الضغط باستمرار على زر الماوس الأيسر ومفتاح shift لتحديد منطقة يكون فيها التغيير في تركيز الأكسجين (تركيز Y1 O2 ، الخط الأزرق) مستقرا.
- افتح نافذة معايرة O2 (انقر فوق Oxygraph > معايرة O2). في معايرة الهواء، قم بتغيير العلامة المحددة إلى المنطقة المحددة في الخطوة 2.2.3. قم بإنهاء بالنقر فوق معايرة ونسخ إلى الحافظة.
- أوقف التسجيل واحفظه بالنقر فوق Oxygraph > Ok Control > حفظ وقطع الاتصال.
ملاحظة: يجب حفظ مجموعة البيانات هذه بحيث يمكن استخدامها في جميع تجارب اليوم. يتم إجراء المعايرة مرة واحدة فقط يوميا لكل وسيط.
- قم بإزالة ddH 2 O ، وماصة2مل من نفس الوسط المستخدم لإعداد الخلية في الغرفة. ضع السدادات ، تاركا فقاعة تبادل الهواء.
- معايرة نفاذية الديجيتونين
- افتح الغرفة ، واستنشق الوسط من الداخل.
- تحميل في الغرفة على الأقل 24 × 10 6 وليس أكثر من 70 × 106 خلايا الحيوانات المنوية في حجم نهائي من 2 مل من MRM.
ملاحظة: من المهم قياس عدد الخلايا في الغرفة من أجل ضبط استهلاك الأكسجين في نهاية التجربة. لا يمكن قياس عدد أقل من الخلايا عن الموصى به. - أغلق الحجرة عن طريق دفع السدادات بالكامل ، واستنشاق السائل المتبقي في الأعلى. ابدأ التجربة بنفس إعدادات المعايرة: سرعة التحريك: 750 دورة في الدقيقة ؛ درجة الحرارة: 37 °C ؛ كسب للمستشعر: 2 ؛ جهد الاستقطاب: 800 مللي فولت ؛ والفاصل الزمني لتسجيل البيانات: 2.0 ثانية.
- لتحميل المعايرة ، انقر نقرا مزدوجا فوق مربع Pos Calib في الزاوية السفلية. افتح المعايرة التي تم إجراؤها في الخطوة 2.2 (انقر فوق Oxygraph > O2 Calibration > Copy from File) ، وانقر فوق معايرة ونسخ إلى الحافظة.
ملاحظة: سيتغير صندوق نقاط البيع كاليب من الأصفر إلى الأخضر. يتم عرض البيانات في تدفق الأكسجين المصحح لكل مخططات الحجم (التخطيط 05 تدفق لكل وحدة تخزين غير مصحح). تتوفر تخطيطات مختلفة في تخطيط > Oxygraph. - أضف 5 ميكرولتر من 0.5 M أدينوسين ثنائي الفوسفات (ADP) ، 10 ميكرولتر من 2 M الغلوتامات ، و 2.5 ميكرولتر من 0.4 M malate (التركيزات النهائية: 1.25 mM ، 10 mM ، و 0.5 mM). قم بقياس استهلاك الأكسجين حتى تستقر الإشارة.
ملاحظة: تستخدم محاقن هاملتون الدقيقة الدقيقة للحقن من خلال منفذ التحميل في السدادة. استخدم حقنة واحدة لكل دواء لتجنب التلوث المتبادل. انقر فوق F4 للتسجيل ، وقم بالإشارة في سجل الأكسجين عند إضافة العلاج.
ملاحظة: يتم تحضير الركائز في ماء عالي النقاء وتخزينها في -20 درجة مئوية لمدة 3 أشهر. - تريت بإضافة 1 ميكرولتر من 10 مللي متر ديجيتونين في خطوات متتالية حتى يصل استهلاك الأكسجين إلى الحد الأقصى.
ملاحظة: يعد الغسيل الشامل بالماء و 70٪ إيثانول و 100٪ إيثانول أمرا ضروريا إذا تم استخدام نفس الغرفة لإجراء تجربتين في نفس اليوم.
ملاحظة: يتم تحضير الديجيتونين في ماء عالي النقاء وتخزينه في -20 درجة مئوية لمدة 3 أشهر.
- بروتوكول التقييم التنفسي الروتيني للحيوانات المنوية السليمة والمتخللة (المركب الأول أو المعقد الثاني)
- افتح الغرفة ، واستنشق الوسط من الداخل.
- تحميل في الغرفة على الأقل 24 × 10 6 وليس أكثر من 70 × 106 خلايا الحيوانات المنوية في حجم نهائي من 2 مل من BWW (تحليل الخلايا السليمة) أو MRM (تحليل الخلايا النفاذية).
- ابدأ التجربة بنفس إعدادات المعايرة (هذا موضح في الخطوة 2.3.3).
- قم بتحميل المعايرة التي تم إجراؤها في الخطوة 2.2 كما هو موضح في الخطوة 2.3.4.
- سجل تنفس الخلايا لمدة 5 دقائق على الأقل حتى يتم الحصول على إشارة مستقرة. يتوافق هذا القياس مع التنفس القاعدي في الخلايا السليمة.
- إذا كانت التجربة مع خلايا سليمة، فانتقل إلى الخطوة 2.4.9. للخلايا النفاذية ، حقن 4.5 ميكرولتر من 10 مللي متر ديجيتونين (التركيز النهائي: 22.5 ميكرومتر). تتخلل الخلايا لمدة 5 دقائق.
- أضف الركائز: 10 ميكرولتر من 2 M الغلوتامات و 2.5 ميكرولتر من 0.4 M malate (التركيزات النهائية: 10 mM و 0.5 mM ، على التوالي) للمركب I أو 20 μL من 1 M succinate (التركيز النهائي: 10 mM) للمركب II. قم بقياس استهلاك الأكسجين حتى تزداد الإشارة وتستقر . هذه هي الحالة 4، وهو ما يعني أن المركب القاعدي I أو المركب القاعدي II يدعم التنفس في غياب جزيء ADP .
ملاحظة: يتم تحضير الركائز في ماء عالي النقاء وتخزينها في -20 درجة مئوية لمدة 3 أشهر. - حقن 5 ميكرولتر من 0.5 M ADP (التركيز النهائي: 1.25 mM). قم بقياس استهلاك الأكسجين حتى تزداد الإشارة وتستقر . تؤدي إضافة ADP إلى زيادة الإشارة المقابلة للحد الأقصى لاستهلاك الأكسجين من خلال المركب I أو المعقد II (الحالة 3 ، في الخلايا المتداخلة).
- أضف 1 ميكرولتر من 4 ملغ / مل oligomycin (التركيز النهائي: 2 ميكروغرام / مل) ، مثبط ATP synthetase. قم بقياس استهلاك الأكسجين حتى تنخفض الإشارة وتستقر .
ملاحظة: يتم تحضير Oligomycin في الإيثانول وتخزينه في -20 درجة مئوية لمدة 3 أشهر. - قم بالمعايرة بإضافة 1 ميكرولتر من 0.1 mM إلى 1 mM كربونيل سيانيد-P- ثلاثي فلورو روميثوكسي-فينيل هيدرازون (FCCP) في خطوات متتالية حتى يتم الوصول إلى أقصى معدل تنفس غير مقترن. قم بقياس استهلاك الأكسجين حتى تزداد الإشارة وتستقر .
ملاحظة: يتم تحضير FCCP في الإيثانول وتخزينه في -20 درجة مئوية لمدة 3 أشهر. - يعتمد التركيز النهائي ل FCCP على العينة. توقف عن حقن الدواء عندما يبدأ استهلاك الأكسجين في الانخفاض.
- أخيرا ، حقن 1 ميكرولتر من 5 mM antimycin A (2.5 μM التركيز النهائي). هذا مثبط معقد III للتمييز بين استهلاك الميتوكوندريا والأكسجين المتبقي (التنفس غير الميتوكوندريا). لتحليل المركب I ، أضف 1 ميكرولتر من 1 mM rotenone (0.5 μM التركيز النهائي) ، وهو مثبط لهذا المركب ، بدلا من AA. قم بقياس استهلاك الأكسجين حتى تنخفض الإشارة وتستقر .
ملاحظة: يتم تحضير الأدوية في الإيثانول وتخزينها في -20 درجة مئوية لمدة 3 أشهر.
3. استخراج البيانات وتحليلها
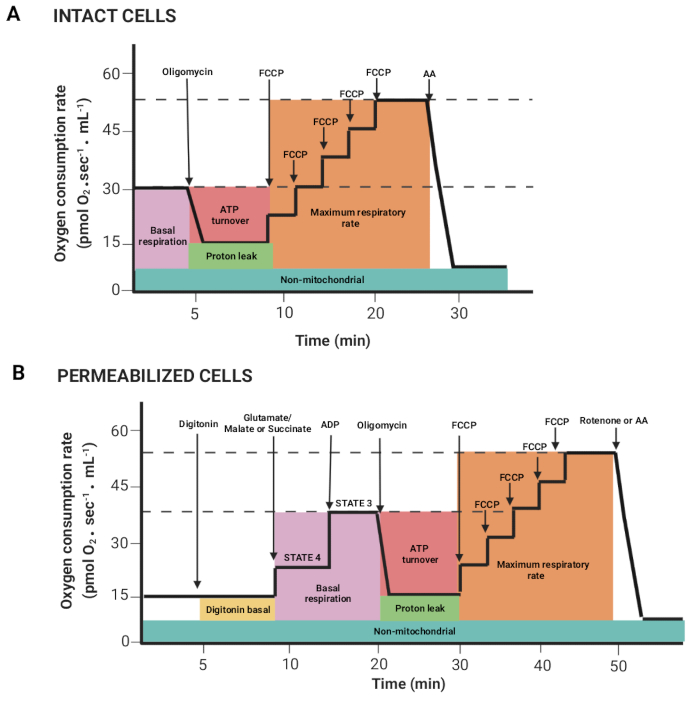
الشكل 2: اكتساب معلمات تنفسية من تجربة قياس التنفس عالية الاستبانة. (أ ، ب) التمثيلات التخطيطية للرسوم البيانية التي تم الحصول عليها ، كما هو موضح في الشكل 1 ، للخلايا السليمة والمتخلصة ، على التوالي. تم وصف هذه المعلمات سابقا15. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- اسحب الماوس عن طريق الضغط على زر الماوس الأيسر ومفتاح shift لتحديد المناطق التي يرتبط فيها تدفق الأكسجين لكل وحدة تخزين (Y2 O2 المنحدر uncorr. ، الخط الأحمر) مستقرا بعد حقن الركيزة أو المانع. ويبين الشكل 2 البارامترات المختلفة التي تم الحصول عليها من السجل الموصوف سابقا15.
ملاحظة: تعتمد المعلمات على التجربة ؛ كلها على النحو التالي: التنفس القاعدي في الخلايا السليمة والتنفس في وجود الغلوتامات / مالات أو سكسينات (الحالة 4) ، ADP (الحالة 3) ، oligomycin (تسرب البروتون) ، FCCP (أقصى معدل للتنفس) ، روتينون / AA (التنفس غير الميتوكوندريا). في الخلايا النفاذية ، يتوافق التنفس القاعدي مع الحالة 3. - انقر فوق نوافذ العلامات > الإحصائيات ، وقم بتصدير البيانات.
- تطبيع البيانات التي تم الحصول عليها لكل 1 مليون خلية منوية. وحدات المنحدرات هي pmolO2 · s − 1 · mL − 1 · 10−6 خلايا.
- اطرح استهلاك الأكسجين غير الميتوكوندريا من جميع القيم قبل حساب المؤشرات.
- احسب المؤشرات باستخدام المعادلات المختلفة الموضحة سابقا15:

النتائج
تحديد التركيز الأمثل للديجيتونين في خلايا الحيوانات المنوية
في هذا البروتوكول ، نقدم استخدام HRR لمراقبة التغيرات في الوقت الفعلي في OXPHOS في خلايا الحيوانات المنوية البشرية. نظرا لأنه يمكن استخدام الطريقة لتحليل الحيوانات المنوية السليمة أو النفاذة للديجيتونين ، فإننا نقدم أول...
Discussion
يعتمد HRR بشكل حاسم على عدة خطوات: (أ) صيانة المعدات ، (ب) المعايرة الدقيقة لأجهزة استشعار الأكسجين ، (ج) معايرة جهاز فكالتوصيل 26 ، وأخيرا ، (د) الاستخدام المناسب للمؤشرات التي تمثل وظيفة الميتوكوندريا. صيانة المعدات أمر بالغ الأهمية. يوصى باستبدال أغشية مستشعر الأكسجين البولاروغ...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نود أن نشكر عيادة فيرتيلاب لأمراض الذكورة ، وخاصة خوسيه ماريا مونتيس وأندريا تورنتس ، للسماح لنا بالوصول إلى المتبرعين. التمويل: يتم دعم AC بمنح من جامعة الجمهورية (CSIC_2018 ، Espacio Interdisciplinario_2021). وتم الحصول على تمويل إضافي من برنامج تنمية العلوم البيولوجية (PEDECIBA، أوروغواي). يتم دعم PI و R.S. من قبل Universidad de la República (I + D ، CSIC 2014 ؛ I + D ، CSIC 2016 ، Iniciación a la Investigación ، CSIC 2019 و FMV_1_2017_1_136490 ANII- أوروغواي). يتم دعم PI من قبل POS_FMV_2018_1_1007814 و CAP-UDELAR 2020. تم توضيح الأرقام باستخدام Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| Acid free- Bovine serum albumine | Sigma Aldrich | A8806 | |
| Adenosine 5'-diphosphate monopotassium salt dihydrate | Sigma Aldrich | A5285 | |
| Animycin A from streptomyces sp. | Sigma Aldrich | A8674 | |
| Calcium chloride | Sigma Aldrich | C4901 | |
| carbonyl cyanide-P- trifluoromethoxy-phenylhydrazone | Sigma Aldrich | C2920 | |
| DatLab sofware version 4,2 | Oroboros Instruments GmbH | N/A | |
| D-glucose | Sigma Aldrich | G7021 | |
| Digitonin | Sigma Aldrich | D141 | |
| EGTA | Sigma Aldrich | E4378 | |
| HEPES | Sigma Aldrich | H3375 | |
| L glutamic acid | Sigma Aldrich | G1251 | |
| L malic acid | Sigma Aldrich | M1000 | |
| Magnesium sulphate | Sigma Aldrich | M7506 | |
| Microliter Syringes | Hamilton | 87900 or 80400 | |
| Microscope camera | Basler | acA780-75gc | |
| Microscope Eclipse E200 with phase contrast 10X Ph+ | Nikon | N/A | |
| Monopotassium phosphate | Sigma Aldrich | P5655 | |
| MOPS | Sigma Aldrich | M1254 | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Oxygraph-2 K | Oroboros Instruments GmbH | N/A | |
| Potassium chloride | Sigma Aldrich | P3911 | |
| Power O2k-Respirometer | Oroboros Intruments | 10033-01 | |
| Rotenone | Sigma Aldrich | R8875 | |
| Saccharose | Sigma Aldrich | S0389 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium lactate | Sigma Aldrich | L7022 | |
| Sodium pyruvate | Sigma Aldrich | P2256 | |
| Sperm class analyzer 6.3.0.59 Evolution-SCA Research | Microptic | N/A | |
| Sperm Counting Chamber DRM-600 | Millennium Sciences CELL-VU | N/A | |
| Succinate disodium salt | Sigma Aldrich | W327700 |
References
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13, 37 (2015).
- Guzick, D. S., et al. Sperm morphology, motility, and concentration in fertile and infertile men. The New England Journal of Medicine. 345 (19), 1388-1393 (2001).
- Wang, C., Swerdloff, R. S. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertility and Sterility. 102 (6), 1502-1507 (2014).
- Amaral, A. Energy metabolism in mammalian sperm motility. WIREs Mechanisms of Disease. 14 (5), e1569 (2022).
- Leung, M. R., et al. In-cell structures of conserved supramolecular protein arrays at the mitochondria-cytoskeleton interface in mammalian sperm. Proceedings of the National Academy of Sciences of the United States of America. 118 (45), e2110996118 (2021).
- Moraes, C. R., Meyers, S. The sperm mitochondrion: Organelle of many functions. Animal Reproduction Science. 194, 71-80 (2018).
- Cassina, A., et al. Defective human sperm cells are associated with mitochondrial dysfunction and oxidant production. Biology of Reproduction. 93 (5), 119 (2015).
- Marchetti, C., Obert, G., Deffosez, A., Formstecher, P., Marchetti, P. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm. Human Reproduction. 17 (5), 1257-1265 (2002).
- Amaral, A., Lourenço, B., Marques, M., Ramalho-Santos, J. Mitochondria functionality and sperm quality. Reproduction. 146 (5), R163-R174 (2013).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), e13666 (2021).
- Uribe, P., et al. Use of the fluorescent dye tetramethylrhodamine methyl ester perchlorate for mitochondrial membrane potential assessment in human spermatozoa. Andrologia. 49 (9), e12753 (2017).
- Storey, B. T. Mammalian sperm metabolism: Oxygen and sugar, friend and foe. The International Journal of Developmental Biology. 52 (5-6), 427-437 (2008).
- Tourmente, M., Sansegundo, E., Rial, E., Roldan, E. R. S. Capacitation promotes a shift in energy metabolism in murine sperm. Frontiers in Cell and Developmental Biology. 10, 950979 (2022).
- Gnaiger, E., Dykens, J. A., Will, Y. Chapter 12 - Polarographic oxygen sensors, the oxygraph, and high-resolution respirometry to assess mitochondrial function. Drug-Induced Mitochondrial Dysfunction. , 325-352 (2008).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Awadhpersad, R., Jackson, C. B. High-resolution respirometry to assess bioenergetics in cells and tissues using chamber- and plate-based respirometers. Journal of Visualized Experiments: JoVE. (176), e63000 (2021).
- Chance, B., Williams, G. R. A simple and rapid assay of oxidative phosphorylation. Nature. 175 (4469), 1120-1121 (1955).
- Li, Z., Graham, B. H. Measurement of mitochondrial oxygen consumption using a Clark electrode. Methods in Molecular Biology. 837, 63-72 (2012).
- Stendardi, A., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. International Journal of Andrology. 34 (3), 247-255 (2011).
- Ferramosca, A., Focarelli, R., Piomboni, P., Coppola, L., Zara, V. Oxygen uptake by mitochondria in demembranated human spermatozoa: A reliable tool for the evaluation of sperm respiratory efficiency. International Journal of Andrology. 31 (3), 337-345 (2008).
- Ferramosca, A., et al. Modulation of human sperm mitochondrial respiration efficiency by plant polyphenols. Antioxidants. 10 (2), 217 (2021).
- Gnaiger, E., Steinlechner-Maran, R., Méndez, G., Eberl, T., Margreiter, R. Control of mitochondrial and cellular respiration by oxygen. Journal of Bioenergetics and Biomembranes. 27 (6), 583-596 (1995).
- . O2k Quality Control 1: Polarographic oxygen sensors and accuracy of calibration Available from: https://www.bioblst.at/images/archive/7/77/20210819114548%21MiPNet06.03_POS-Calibration-SOP.pdf (2020)
- WHO Laboratory Manual for the Examination and Processing of Human Semen. World Health Organization Available from: https://www.who.int/publications/i/item/9789240030787 (2010)
- . O2k-protocols SOP: O2k quality control 1 Available from: https://www.bioblast.at/images/9/9c/MiPNet06.03_POS-Calibration-SOP_DatLab8.pdf (2021)
- Gnaiger, E. . Mitochondrial Pathways and Respiratory Control. , (2012).
- Steinlechner-Maran, R., Eberl, T., Kunc, M., Margreiter, R., Gnaiger, E. Oxygen dependence of respiration in coupled and uncoupled endothelial cells. The American Journal of Physiology. 271, C2053-C2061 (1996).
- Holt, W. V., Van Look, K. J. W. Concepts in sperm heterogeneity, sperm selection and sperm competition as biological foundations for laboratory tests of semen quality. Reproduction. 127 (5), 527-535 (2004).
- Sousa, A. P., et al. Not all sperm are equal: Functional mitochondria characterize a subpopulation of human sperm with better fertilization potential. PloS One. 6 (3), e18112 (2011).
- Moscatelli, N., et al. Single-cell-based evaluation of sperm progressive motility via fluorescent assessment of mitochondria membrane potential. Scientific Reports. 7, 17931 (2017).
- Ferreira, J. J., et al. Increased mitochondrial activity upon CatSper channel activation is required for mouse sperm capacitation. Redox Biology. 48, 102176 (2021).
- Irigoyen, P., et al. Mitochondrial metabolism determines the functional status of human sperm and correlates with semen parameters. Frontiers in Cell and Developmental Biology. 10, 926684 (2022).
Erratum
Formal Correction: Erratum: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa
Posted by JoVE Editors on 9/26/2023. Citeable Link.
An erratum was issued for: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa. The Protocol and Representative Result sections were updated.
Step 2.4.12 of the Protocol was updated from:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex II inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
to:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex III inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
Figure 3 in the Representative Results section was updated from:
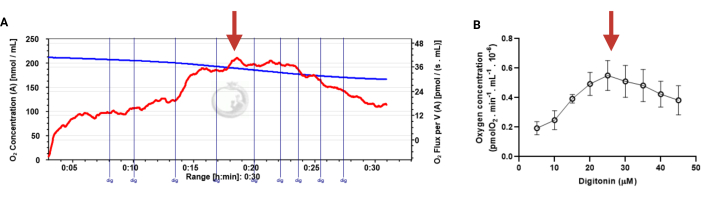
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
to:
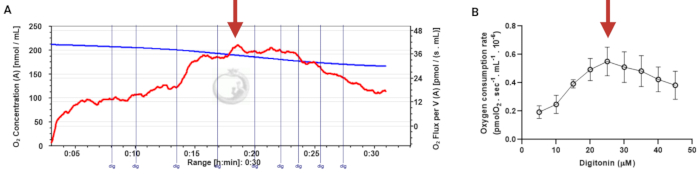
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved