需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
高分辨率呼吸测定法评估人类精子的线粒体功能
Erratum Notice
摘要
通过高分辨率呼吸测定法分析精子线粒体功能,可以测量密闭腔系统中自由移动的精子的耗氧量。该技术可用于测量人类精子的呼吸,从而提供有关精子线粒体特征和完整性的信息。
摘要
精液质量通常通过常规精液分析进行研究,常规精液分析是描述性的,通常没有定论。男性不育症与精子线粒体活性的改变有关,因此精子线粒体功能的测量是精子质量的指标。高分辨率呼吸测量法是一种测量密闭腔系统中细胞或组织耗氧量的方法。该技术可用于测量人类精子的呼吸,并提供有关精子线粒体质量和完整性的信息。高分辨率呼吸测量法允许细胞自由移动,这在精子的情况下是一个 先验 的优势。该技术可以应用于完整或透化的精子,并允许研究完整的精子线粒体功能和单个呼吸链复合物的活性。高分辨率氧谱仪使用传感器测量氧气浓度,并结合灵敏的软件来计算氧气消耗量。这些数据用于根据耗氧率计算呼吸指数。因此,这些指数是两种耗氧率的比例,并在内部归一化为细胞数量或蛋白质质量。呼吸指数是精子线粒体功能和功能障碍的指标。
引言
据估计,男性不育症占夫妻不育症病例的 40%-50%1。传统的精液分析在确定男性生育能力方面起着至关重要的作用;然而,大约 15% 的不育男性具有正常的精子参数2.此外,常规精液分析提供的精子功能信息有限,不能反映细微的精子缺陷3.
精子线粒体具有特殊的结构,因为它们在鞭毛周围排列成螺旋鞘。线粒体鞘包含数量不等的线粒体,线粒体通过线粒体间连接子连接,并通过线粒体外膜上的有序蛋白质排列锚定在细胞骨架上 4,5。这种结构使得分离精子线粒体特别困难。因此,大多数精子线粒体功能研究都使用原位分析或脱膜精子6。
精子线粒体结构和功能一直与男性不育症有关7,8,9,10,11,这表明对这些细胞器的结构和功能的分析可能是纳入精子分析的良好候选者。
线粒体在细胞能量代谢中起着重要作用,特别是利用氧气通过氧化磷酸化 (OXPHOS) 产生三磷酸腺苷 (ATP)。特别是在精子中,ATP(糖酵解与OXPHOS)的来源存在争议,许多数据仍然存在争议,并且取决于不同的实验方法4,12,13。通过血氧饱和度测量呼吸为细胞的线粒体呼吸能力、线粒体完整性和能量代谢提供了重要的见解14,15,16。传统上,该技术是使用 Clark 氧电极进行的,该电极是一种用于测量线粒体呼吸的仪器,已有 50 多年的历史17,18。此外,使用经典的克拉克氧电极19,20,21分析了精子线粒体耗氧量。使用氧合仪 (Oroboros) 的高分辨率呼吸测定法 (HRR) 比使用经典呼吸测定仪提供更高的灵敏度22。氧图仪由两个带有进样口的腔室组成,每个腔室都有一个极谱法氧传感器。使用这种技术,可以分析组织载玻片、细胞和分离的线粒体悬浮液。样品在腔室中连续搅拌,在实验过程中,测量耗氧量,并使用特定软件计算氧速率。这些腔室显示出减少的氧气泄漏,这是与传统的氧电极装置14,23相比的优势。
与其他细胞一样,在精子的情况下,HRR设备的灵敏度高于传统的呼吸测定法,这意味着HRR设备可用于分析有限数量的完整或透化精子细胞。通过HRR评估精子线粒体功能有两种主要策略:(a)测量完整细胞中的耗氧量,这涉及在含有葡萄糖等底物的培养基中再现呼吸功能,或(b)使用OXPHOS复合物之一测量透化细胞中的耗氧量,并添加特定的底物以分别监测每种功能。
在本研究中,我们描述了使用 HRR 来确定人类精子细胞中的线粒体呼吸。
研究方案
这些实验得到了乌拉圭蒙得维的亚共和国大学医学院伦理委员会的批准。
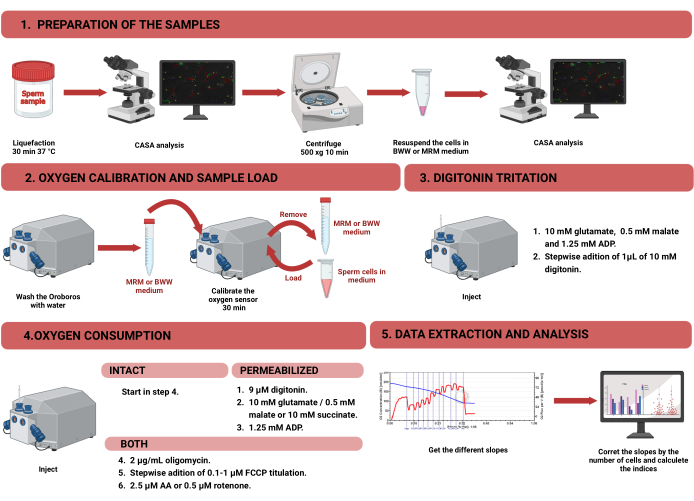
图 1:高分辨率呼吸测量法评估完整和透化人类精子中线粒体功能的工作流程。 该协议分为四个不同的步骤:1)样品的制备,2)Oroboros仪器中的氧气校准,3)完整和透化细胞的耗氧量测量,以及4)从设备中提取数据和分析。缩写:CASA = 计算机辅助精子分析;BWW = Biggers Whitten Whittingham 中等;MRM = 线粒体呼吸介质;ADP = 二磷酸腺苷;FCCP=羰基氰-p-三氟甲氧基苯腙;AA = 抗霉素 A. 请点击这里查看此图的较大版本.
注:使用HRR测量精子细胞耗氧量的工作流程如图 1所示。有关方案中使用的材料、设备和试剂的信息在 材料表中列出。
1. 样品制备
- 样品采集
- 在建议禁欲 3 天后,在无菌塑料容器中通过手淫收集新鲜射出的人类精液。立即将样品运送到实验室。
- 将样品在室温 (RT) 下孵育 30-60 分钟以完全液化24.
- 液化后,将样品储存在37°C直至实验开始。
- 使用计算机辅助精子分析(CASA)进行精子评估
- 混合样品,将 7 μL 加载到预热的精子计数室中。
- 将腔室放在直射光显微镜的预热(37°C)载物台上。
- 打开计算机化的精子分析软件,进入活力和浓度模块(点击 Mot)。
- 选择与人类精子状况相对应的配置。
注意:配置必须适应腔室的类型和深度以及样品种类和系统 CASA。 - 通过单击"分析"按钮随机 分析 每个腔室的 10 个不同字段。
- 单击 "结果 "以获得样品浓度和运动性。
- 细胞制备
注意:如果HRR未校准,请在准备细胞之前从步骤2.1-2.2开始(步骤1.3)。当精子细胞重悬于培养基中时,立即测量耗氧量非常重要。- 在室温下以400× g 离心样品10分钟。
- 取出精浆,将精子重悬于2mL Biggers Whitten Whittingham(BWW)中,用于完整细胞实验或线粒体呼吸培养基(MRM)进行透化细胞研究。介质的组成如 表1所示。
- 重复步骤1.2中描述的步骤进行精子浓度研究。
2. 高分辨率呼吸测定法:OXPHOS分析
注:HRR 集成了高度灵敏的氧图(Oxygraph-2 K;Oroboros Instruments GmbH,奥地利因斯布鲁克)和软件(DatLab,版本 4.2;Oroboros Instruments GmbH)。实验数据显示为氧浓度与时间的关系(以O2/106 个细胞·min−1的pmol)和这些数据的实时转换形式显示,使实验者能够在实验仍在进行时跟踪生物和生化样品的呼吸(耗氧量、氧通量)。HRR 可用于跟踪活细胞和运动细胞的呼吸,这对精子特别有用,精子的活力与精子质量和生育潜力有关。该实验室使用带有两个腔室的 HRR Oroboros Oxygraph2-k、Oroboros 仪器。该协议中描述的步骤必须对两个2 mL腔室独立执行。
- 设备准备
- 打开 HRR,将其连接到呼吸测量软件 (DatLab) 进行数据采集和分析。
- 用ddH2O替换氧合仪室中的70%乙醇,用室中的磁力搅拌棒以750rpm连续搅拌。静置 10 分钟,然后吸出双蒸馏 (dd) H2O。
- 用ddH2O洗涤腔室3次,每次5分钟。
注意:此步骤对于从腔室中除去剩余的乙醇是必要的。精子细胞对乙醇非常敏感。如果省略此步骤,录制可能会受到影响。
- 氧传感器的校准
注意: 校准程序因仪器的不同而略有不同。按照制造商25 的说明对极谱法氧传感器进行空气校准。在本节中,将简要说明校准协议。- 取出ddH 2 O,将2mL用于细胞制备的相同培养基移液到腔室中。放置塞子,留下空气交换气泡。
注意: 重要的是要知道腔室的体积以确定所需培养基的确切体积。 - 记录氧气校准值(单击 布局>01校准实验Gr3-Temp),通过在37°C下用搅拌棒以750rpm搅拌介质至少30分钟来监测传感器膜的性能。 使用上述其他设置:传感器增益:2;极化电压:800 mV;数据记录间隔:2.0 s。
注:预计在 ±2 pmol∙s−1∙mL−1 范围内获得 O 2 未校正的斜率(红线),极谱法传感器发出稳定信号。 - 在按住鼠标左键和 shift 键的同时拖动鼠标,选择氧气浓度(Y1 O2 浓度,蓝线)变化稳定的区域。
- 打开 O2 校准窗口(单击 Oxygraph > O2 校准)。在 "空气校准"中,将所选标记更改为在步骤 2.2.3 中选择的区域。单击 "校准"并复制到剪贴板完成。
- 停止录制,然后单击 Oxygraph > 确定控制 > 保存并断开连接。
注意:必须保存此数据集,以便可以在当天的所有实验中使用。每种介质每天仅进行一次校准。
- 取出ddH 2 O,将2mL用于细胞制备的相同培养基移液到腔室中。放置塞子,留下空气交换气泡。
- 洋地黄皂苷透化滴定法
- 打开腔室,吸出里面的培养基。
- 在腔室中加载至少 24 x 10 6 且不超过 70 x 106 个精子细胞,最终体积为 2 mL MRM。
注意:测量腔室中的细胞数量以调整实验结束时的耗氧量非常重要。无法测量低于推荐值的细胞数量。 - 将塞子完全推入,关闭腔室,并在顶部吸出剩余的液体。使用与校准相同的设置开始实验:搅拌速度:750 rpm;温度:37°C;传感器增益:2;极化电压:800 mV;数据记录间隔:2.0秒。
- 要加载校准,请双击底角的 Pos Calib 框。打开在步骤 2.2 中执行的校准(单击 Oxygraph > O2 校准>从文件复制),然后单击 校准并复制到剪贴板。
注意: POS Calib 框将从黄色变为绿色。数据显示在"每体积校正的氧气流量"图表中(布局 05:每体积通量未校正)。 Oxygraph > Layout 中提供了不同的布局。 - 加入 5 μL 0.5 M 二磷酸腺苷 (ADP)、10 μL 2 M 谷氨酸和 2.5 μL 0.4 M 苹果酸盐(终浓度:1.25 mM、10 mM 和 0.5 mM)。测量耗氧量,直到信号稳定。
注意:精密汉密尔顿微型注射器用于通过塞子中的装载口进行注射。每种药物使用一个注射器,以避免交叉污染。单击 F4 进行注册,并在添加治疗时在氧气注册器中标记。
注:将底物在超纯水中制备,并在-20°C下储存3个月。 - 通过连续添加 1 μL 10 mM 洋地黄皂苷进行氚化,直到耗氧量达到最大水平。
注意:如果在同一天使用同一个腔室进行两个实验,则必须用水、70% 乙醇和 100% 乙醇彻底清洗。
注:洋地黄皂苷在超纯水中制备,并在-20°C下储存3个月。
- 完整和通透精子细胞(复合物 I 或复合物 II)的常规呼吸评估方案
- 打开腔室,吸出里面的培养基。
- 在腔室中加载至少 24 x 10 6 且不超过 70 x 106 个精子细胞,最终体积为 2 mL BWW(完整细胞分析)或 MRM(透化细胞分析)。
- 使用与校准相同的设置开始实验(这在步骤 2.3.3 中描述)。
- 加载步骤 2.2 中执行的校准,如步骤 2.3.4 中所述。
- 记录细胞的呼吸至少5分钟,直到获得稳定的信号。该测量值对应于完整细胞的基础呼吸。
- 如果实验使用完整的细胞,请继续执行步骤2.4.9。对于透化的细胞,注射 4.5 μL 的 10 mM 洋地黄皂苷(终浓度:22.5 μM)。透化细胞5分钟。
- 加入底物:10μL的2M谷氨酸和2.5μL的0.4M苹果酸盐(终浓度分别为10mM和0.5mM)用于复合物I或20μL的1M琥珀酸盐(终浓度:10mM)用于复合物II。测量耗氧量,直到信号增加并稳定下来。这是状态 4,这意味着在没有 ADP 的情况下,基础复合物 I 或基础复合物 II 支持呼吸。
注:将底物在超纯水中制备,并在-20°C下储存3个月。 - 注入 5 μL 的 0.5 M ADP(终浓度:1.25 mM)。测量耗氧量,直到信号增加并稳定下来。ADP的加入增加了对应于通过复合物I或复合物II(状态3,在透化细胞中)的最大耗氧量的信号。
- 加入 1 μL 4 mg/mL 寡霉素(终浓度:2 μg/mL),一种 ATP 合成酶抑制剂。测量耗氧量,直到信号减弱并稳定下来。
注:寡霉素在乙醇中制备,并在-20°C下储存3个月。 - 通过连续步骤向 1 mM 羰基氰化物-P-三氟甲氧基苯腙 (FCCP) 中加入 1 μL 0.1 mM 滴定,直至达到最大非偶联呼吸速率。测量耗氧量,直到信号增加并稳定下来。
注:FCCP在乙醇中制备,并在-20°C下储存3个月。 - FCCP的最终浓度取决于样品。当耗氧量开始减少时停止注射药物。
- 最后,注射 1 μL 5 mM 抗霉素 A(2.5 μM 终浓度)。这是一种复合物III抑制剂,用于区分线粒体和残余耗氧量(非线粒体呼吸)。对于复合物I的分析,加入1μL的1mM鱼藤酮(0.5μM终浓度),该复合物的抑制剂,而不是AA。测量耗氧量,直到信号减弱并稳定下来。
注:药物在乙醇中制备,并在-20°C下储存3个月。
3. 数据提取和分析
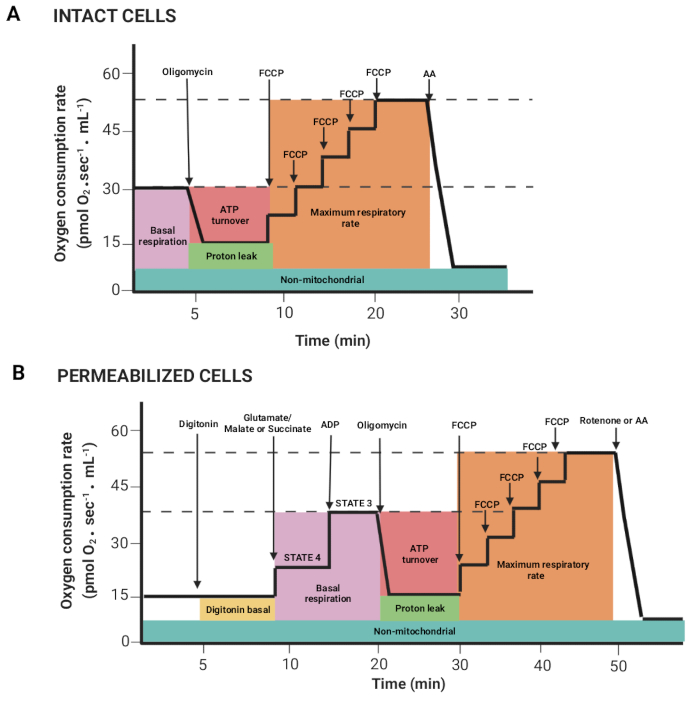
图 2:从高分辨率呼吸测量实验中获取呼吸参数。 (A,B)如图1所示,分别针对完整细胞和通透细胞获得的图示意图。这些参数在前面已经描述过15。请点击这里查看此图的较大版本.
- 通过按鼠标左键和 shift 键拖动鼠标,以选择在注射底物或抑制剂后单位体积氧通量相关的区域(Y2 O2 斜率无对应,红线)。 图2 显示了从前面描述的寄存器15获得的不同参数。
注意:参数取决于实验;它们都如下:完整细胞的基础呼吸和谷氨酸/苹果酸或琥珀酸盐存在下的呼吸(状态 4)、ADP(状态 3)、寡霉素(质子泄漏)、FCCP(最大呼吸速率)、鱼藤酮/AA(非线粒体呼吸)。在透化细胞中,基础呼吸对应于状态 3。 - 单击 "标记>统计 "窗口,然后导出数据。
- 对每100万个精子细胞获得的数据进行归一化。斜率的单位是pmolO2·s−1·mL−1·10−6细胞。
- 在计算指数之前,从所有值中减去非线粒体耗氧量。
- 使用前面描述的各种公式计算指数15:

结果
测定精子细胞中洋地黄皂苷的最佳浓度
在该协议中,我们介绍了使用HRR来监测人类精子细胞中OXPHOS的实时变化。由于该方法可用于分析完整或洋地黄皂苷透化的精子,我们首先介绍了透化精子细胞所需的洋地黄皂苷浓度的标准化(图3)。
洋地黄皂苷用于化学透化,允许底物进入细胞,并用于测量线粒体活性。该化合物必须在完整细胞中?...
讨论
HRR 主要取决于几个步骤:(a) 设备维护,(b) 氧传感器的精确校准,(c) 解偶联滴定26,最后,(d) 充分使用代表线粒体功能的指数。设备维护至关重要。建议定期更换极谱法氧传感器的膜,并校正仪器背景。从腔室收集精子后进行大量洗涤对于获得良好的重复至关重要,尤其是在仪器经常用于分析各种组织或细胞的实验室中。精子对少量鱼藤酮、AA、寡霉素和FCCP敏感,因?...
披露声明
作者没有什么可透露的。
致谢
我们要感谢Fertilab男科诊所,特别是JoséMaríaMontes和Andrea Torrents,让我们能够接触到捐赠者。资金:A.C.得到了共和国大学(CSIC_2018,Espacio Interdisciplinario_2021)的资助。从Programa de Desarrollo de Ciencias Básicas(乌拉圭PEDECIBA)获得了额外资金。P.I.和R.S.由共和国大学(I+D,CSIC 2014;I+D、CSIC 2016、Iniciación a la Investigación、CSIC 2019 和 FMV_1_2017_1_136490 ANII-乌拉圭)。PI 由 POS_FMV_2018_1_1007814 和 CAP-UDELAR 2020 提供支持。这些数字是用 Biorender.com 来说明的。
材料
| Name | Company | Catalog Number | Comments |
| Acid free- Bovine serum albumine | Sigma Aldrich | A8806 | |
| Adenosine 5'-diphosphate monopotassium salt dihydrate | Sigma Aldrich | A5285 | |
| Animycin A from streptomyces sp. | Sigma Aldrich | A8674 | |
| Calcium chloride | Sigma Aldrich | C4901 | |
| carbonyl cyanide-P- trifluoromethoxy-phenylhydrazone | Sigma Aldrich | C2920 | |
| DatLab sofware version 4,2 | Oroboros Instruments GmbH | N/A | |
| D-glucose | Sigma Aldrich | G7021 | |
| Digitonin | Sigma Aldrich | D141 | |
| EGTA | Sigma Aldrich | E4378 | |
| HEPES | Sigma Aldrich | H3375 | |
| L glutamic acid | Sigma Aldrich | G1251 | |
| L malic acid | Sigma Aldrich | M1000 | |
| Magnesium sulphate | Sigma Aldrich | M7506 | |
| Microliter Syringes | Hamilton | 87900 or 80400 | |
| Microscope camera | Basler | acA780-75gc | |
| Microscope Eclipse E200 with phase contrast 10X Ph+ | Nikon | N/A | |
| Monopotassium phosphate | Sigma Aldrich | P5655 | |
| MOPS | Sigma Aldrich | M1254 | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Oxygraph-2 K | Oroboros Instruments GmbH | N/A | |
| Potassium chloride | Sigma Aldrich | P3911 | |
| Power O2k-Respirometer | Oroboros Intruments | 10033-01 | |
| Rotenone | Sigma Aldrich | R8875 | |
| Saccharose | Sigma Aldrich | S0389 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium lactate | Sigma Aldrich | L7022 | |
| Sodium pyruvate | Sigma Aldrich | P2256 | |
| Sperm class analyzer 6.3.0.59 Evolution-SCA Research | Microptic | N/A | |
| Sperm Counting Chamber DRM-600 | Millennium Sciences CELL-VU | N/A | |
| Succinate disodium salt | Sigma Aldrich | W327700 |
参考文献
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13, 37 (2015).
- Guzick, D. S., et al. Sperm morphology, motility, and concentration in fertile and infertile men. The New England Journal of Medicine. 345 (19), 1388-1393 (2001).
- Wang, C., Swerdloff, R. S. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertility and Sterility. 102 (6), 1502-1507 (2014).
- Amaral, A. Energy metabolism in mammalian sperm motility. WIREs Mechanisms of Disease. 14 (5), e1569 (2022).
- Leung, M. R., et al. In-cell structures of conserved supramolecular protein arrays at the mitochondria-cytoskeleton interface in mammalian sperm. Proceedings of the National Academy of Sciences of the United States of America. 118 (45), e2110996118 (2021).
- Moraes, C. R., Meyers, S. The sperm mitochondrion: Organelle of many functions. Animal Reproduction Science. 194, 71-80 (2018).
- Cassina, A., et al. Defective human sperm cells are associated with mitochondrial dysfunction and oxidant production. Biology of Reproduction. 93 (5), 119 (2015).
- Marchetti, C., Obert, G., Deffosez, A., Formstecher, P., Marchetti, P. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm. Human Reproduction. 17 (5), 1257-1265 (2002).
- Amaral, A., Lourenço, B., Marques, M., Ramalho-Santos, J. Mitochondria functionality and sperm quality. Reproduction. 146 (5), R163-R174 (2013).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), e13666 (2021).
- Uribe, P., et al. Use of the fluorescent dye tetramethylrhodamine methyl ester perchlorate for mitochondrial membrane potential assessment in human spermatozoa. Andrologia. 49 (9), e12753 (2017).
- Storey, B. T. Mammalian sperm metabolism: Oxygen and sugar, friend and foe. The International Journal of Developmental Biology. 52 (5-6), 427-437 (2008).
- Tourmente, M., Sansegundo, E., Rial, E., Roldan, E. R. S. Capacitation promotes a shift in energy metabolism in murine sperm. Frontiers in Cell and Developmental Biology. 10, 950979 (2022).
- Gnaiger, E., Dykens, J. A., Will, Y. Chapter 12 - Polarographic oxygen sensors, the oxygraph, and high-resolution respirometry to assess mitochondrial function. Drug-Induced Mitochondrial Dysfunction. , 325-352 (2008).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Awadhpersad, R., Jackson, C. B. High-resolution respirometry to assess bioenergetics in cells and tissues using chamber- and plate-based respirometers. Journal of Visualized Experiments: JoVE. (176), e63000 (2021).
- Chance, B., Williams, G. R. A simple and rapid assay of oxidative phosphorylation. Nature. 175 (4469), 1120-1121 (1955).
- Li, Z., Graham, B. H. Measurement of mitochondrial oxygen consumption using a Clark electrode. Methods in Molecular Biology. 837, 63-72 (2012).
- Stendardi, A., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. International Journal of Andrology. 34 (3), 247-255 (2011).
- Ferramosca, A., Focarelli, R., Piomboni, P., Coppola, L., Zara, V. Oxygen uptake by mitochondria in demembranated human spermatozoa: A reliable tool for the evaluation of sperm respiratory efficiency. International Journal of Andrology. 31 (3), 337-345 (2008).
- Ferramosca, A., et al. Modulation of human sperm mitochondrial respiration efficiency by plant polyphenols. Antioxidants. 10 (2), 217 (2021).
- Gnaiger, E., Steinlechner-Maran, R., Méndez, G., Eberl, T., Margreiter, R. Control of mitochondrial and cellular respiration by oxygen. Journal of Bioenergetics and Biomembranes. 27 (6), 583-596 (1995).
- . O2k Quality Control 1: Polarographic oxygen sensors and accuracy of calibration Available from: https://www.bioblst.at/images/archive/7/77/20210819114548%21MiPNet06.03_POS-Calibration-SOP.pdf (2020)
- WHO Laboratory Manual for the Examination and Processing of Human Semen. World Health Organization Available from: https://www.who.int/publications/i/item/9789240030787 (2010)
- . O2k-protocols SOP: O2k quality control 1 Available from: https://www.bioblast.at/images/9/9c/MiPNet06.03_POS-Calibration-SOP_DatLab8.pdf (2021)
- Gnaiger, E. . Mitochondrial Pathways and Respiratory Control. , (2012).
- Steinlechner-Maran, R., Eberl, T., Kunc, M., Margreiter, R., Gnaiger, E. Oxygen dependence of respiration in coupled and uncoupled endothelial cells. The American Journal of Physiology. 271, C2053-C2061 (1996).
- Holt, W. V., Van Look, K. J. W. Concepts in sperm heterogeneity, sperm selection and sperm competition as biological foundations for laboratory tests of semen quality. Reproduction. 127 (5), 527-535 (2004).
- Sousa, A. P., et al. Not all sperm are equal: Functional mitochondria characterize a subpopulation of human sperm with better fertilization potential. PloS One. 6 (3), e18112 (2011).
- Moscatelli, N., et al. Single-cell-based evaluation of sperm progressive motility via fluorescent assessment of mitochondria membrane potential. Scientific Reports. 7, 17931 (2017).
- Ferreira, J. J., et al. Increased mitochondrial activity upon CatSper channel activation is required for mouse sperm capacitation. Redox Biology. 48, 102176 (2021).
- Irigoyen, P., et al. Mitochondrial metabolism determines the functional status of human sperm and correlates with semen parameters. Frontiers in Cell and Developmental Biology. 10, 926684 (2022).
Erratum
Formal Correction: Erratum: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa
Posted by JoVE Editors on 9/26/2023. Citeable Link.
An erratum was issued for: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa. The Protocol and Representative Result sections were updated.
Step 2.4.12 of the Protocol was updated from:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex II inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
to:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex III inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
Figure 3 in the Representative Results section was updated from:
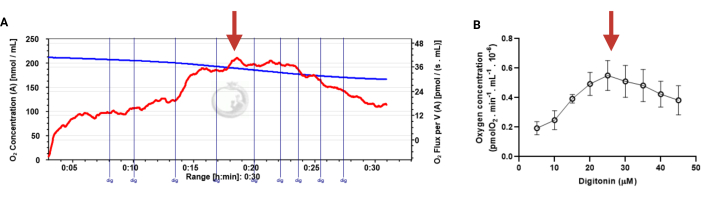
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
to:
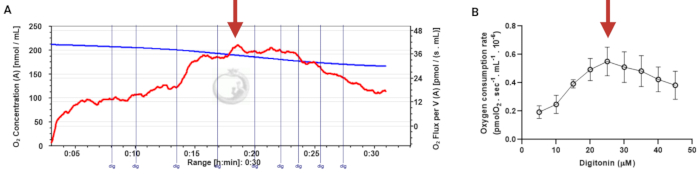
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。