JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간 정자의 미토콘드리아 기능을 평가하기 위한 고분해능 호흡 측정법
요약
고분해능 호흡 측정법에 의한 정자 미토콘드리아 기능 분석은 밀폐 챔버 시스템에서 자유롭게 움직이는 정자의 산소 소비량을 측정할 수 있습니다. 이 기술은 정자 미토콘드리아 특성 및 무결성에 대한 정보를 제공하는 인간 정자의 호흡을 측정하는 데 적용할 수 있습니다.
초록
정액의 질은 종종 일상적인 정액 분석을 통해 연구되며, 이는 설명적이며 종종 결정적이지 않습니다. 남성 불임은 정자 미토콘드리아 활동의 변화와 관련이 있으므로 정자 미토콘드리아 기능의 측정은 정자의 질을 나타내는 지표입니다. 고분해능 호흡 측정법은 밀폐 챔버 시스템에서 세포 또는 조직의 산소 소비량을 측정하는 방법입니다. 이 기술은 인간 정자의 호흡을 측정하기 위해 구현될 수 있으며 정자 미토콘드리아의 품질과 무결성에 대한 정보를 제공합니다. 고해상도 호흡 측정법은 세포가 자유롭게 움직일 수 있도록 하며, 이는 정자의 경우 선험적 이점입니다. 이 기술은 온전하거나 투과된 정자와 함께 적용할 수 있으며 온전한 정자 미토콘드리아 기능과 개별 호흡 사슬 복합체의 활성을 연구할 수 있습니다. 고분해능 산소 그래프 기기는 센서를 사용하여 산소 농도를 측정하고 민감한 소프트웨어와 함께 산소 소비량을 계산합니다. 이 데이터는 산소 소비 비율을 기반으로 호흡 지수를 계산하는 데 사용됩니다. 결과적으로, 지수는 두 산소 소비율의 비율이며 내부적으로 세포 수 또는 단백질 질량으로 정규화됩니다. 호흡 지수는 정자 미토콘드리아 기능과 기능 장애를 나타내는 지표입니다.
서문
남성 불임은 부부 불임 사례의 40%-50%를 차지하는 것으로 추정된다1. 기존의 정액 분석은 남성의 생식력을 결정하는 데 중요한 역할을 합니다. 그러나 불임 남성의 약 15%는 정상적인 정자 매개변수를 가지고 있다2. 또한, 일상적인 정액 분석은 정자 기능에 대한 제한된 정보를 제공하며 미묘한 정자 결함을 반영하지 않는다3.
정자 미토콘드리아는 편모 주위에 나선형 덮개로 배열되어 있기 때문에 특별한 구조를 가지고 있습니다. 미토콘드리아 외피는 미토콘드리아 간 링커에 의해 연결되고 외부 미토콘드리아 막 4,5 상의 정렬된 단백질 배열에 의해 세포골격에 고정되는 다양한 수의 미토콘드리아를 포함합니다. 이 구조는 정자 미토콘드리아를 분리하는 것을 특히 어렵게 만듭니다. 따라서 정자 미토콘드리아 기능에 대한 대부분의 연구는 현장 분석 또는 demembranated sperm6을 사용한다.
정자 미토콘드리아 구조 및 기능은 남성 불임과 일관되게 연관되어 있으며, 7,8,9,10,11 이러한 세포 기관의 구조와 기능에 대한 분석이 정자 분석에 포함될 수 있음을 시사합니다.
미토콘드리아는 특히 산소를 사용하여 산화적 인산화(OXPHOS)를 통해 아데노신 삼인산(ATP)을 생성함으로써 세포 에너지 대사에 중요한 역할을 합니다. 특히 정자(spermatozoa)의 경우, ATP(해당과정 대 OXPHOS)의 출처에 대한 논란이 있으며, 많은 데이터가 논란의 여지가 있으며 다른 실험적 접근법에 의존하고있다 4,12,13. 산소 측정에 의한 호흡 측정은 미토콘드리아 호흡 능력, 미토콘드리아 무결성 및 세포의 에너지 대사에 대한 중요한 통찰력을 제공합니다14,15,16. 전통적으로 이 기술은 50년 이상 미토콘드리아 호흡을 측정하는 데 사용되어 온 기기인 Clark 산소 전극을 사용하여 수행되었습니다17,18. 또한, 정자 미토콘드리아 산소 소비량은 고전적인 Clark 산소 전극 19,20,21을 사용하여 분석되었습니다. 산소 그래프(Oroboros)를 사용하는 고분해능 호흡 측정법(HRR)은 기존의 호흡 측정 장치를 사용하는 것보다 더 높은 감도를 제공한다22. 산소 그래프는 주입 포트가 있는 두 개의 챔버로 구성되며 각 챔버에는 폴라로그래픽 산소 센서가 있습니다. 이 기술을 사용하면 조직 슬라이드, 세포 및 분리된 미토콘드리아 현탁액을 분석할 수 있습니다. 표본은 챔버에서 지속적으로 교반되고 실험 중에 산소 소비량이 측정되고 특정 소프트웨어를 사용하여 산소 비율이 계산됩니다. 챔버는 감소된 산소 누출을 보여주는데, 이는 종래의 산소 전극 장치(14,23)에 비해 장점이다.
다른 세포와 마찬가지로 정자의 경우 HRR 장비의 감도가 기존 호흡기 측정보다 높기 때문에 HRR 장비는 제한된 수의 온전하거나 투과된 정자 세포의 분석에 사용할 수 있습니다. HRR에 의한 정자 미토콘드리아 기능 평가에는 두 가지 주요 전략이 있습니다: (a) 포도당과 같은 기질을 포함하는 배지에서 호흡 기능을 재현하는 온전한 세포의 산소 소비량을 측정하거나, (b) 각 기능을 개별적으로 모니터링하기 위해 특정 기질을 추가하여 OXPHOS 복합체 중 하나를 사용하여 투과된 세포의 산소 소비량을 측정합니다.
본 연구에서는 인간 정자 세포의 미토콘드리아 호흡을 결정하기 위해 HRR을 사용하는 방법을 설명합니다.
프로토콜
실험은 우루과이 몬테비데오에 있는 Facultad de Medicina de la Universidad de la República의 윤리 위원회의 승인을 받았습니다.
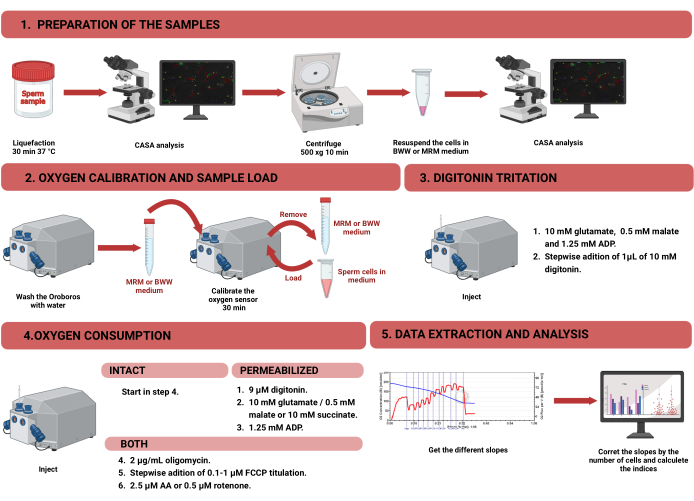
그림 1: 온전하고 투과된 인간 정자의 미토콘드리아 기능을 평가하기 위한 고분해능 호흡 측정법의 워크플로우. 프로토콜은 1) 샘플 준비, 2) Oroboros 기기에서의 산소 보정, 3) 온전한 세포와 투과된 세포에 대한 산소 소비량 측정, 4) 장비에서 데이터 추출 및 분석의 네 가지 단계로 나뉩니다. 약어: CASA = 컴퓨터 보조 정자 분석; BWW = Biggers Whitten Whittingham 미디엄; MRM = 미토콘드리아 호흡 배지; ADP = 아데노신 이인산; FCCP = 카르보닐 시안화물 -p-트리플루오로메톡시페닐히드라존; AA = antimycin A. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
참고: HRR을 사용하여 정자 세포의 산소 소비량을 측정하는 작업 흐름은 그림 1에 나와 있습니다. 프로토콜에 사용된 재료, 장비 및 시약에 대한 정보는 재료 표에 나와 있습니다.
1. 샘플 준비
- 시료 채취
- 멸균 플라스틱 용기에 권장 3 일 금욕 후 자위로 갓 사정 한 인간의 정액을 수집하십시오. 샘플을 즉시 실험실로 운반하십시오.
- 샘플을 실온(RT)에서 30-60분 동안 배양하여 완전히 액화시킵니다24.
- 액화 후 실험이 시작될 때까지 샘플을 37°C에서 보관합니다.
- CASA(Computer-Aided Sperm Analysis)를 통한 정자 평가
- 샘플을 혼합하고 7μL를 예열된 정자 계수 챔버에 넣습니다.
- 챔버를 예열된(37°C) s에 놓습니다.tage 직사광 현미경의.
- 컴퓨터 정자 분석 소프트웨어를 열고 운동성 및 농도 모듈로 들어갑니다( Mot 클릭).
- 인간의 정자 조건에 해당하는 구성을 선택합니다.
알림: 구성은 챔버의 유형과 깊이뿐만 아니라 샘플 종 및 시스템 CASA에 맞게 조정되어야 합니다. - Analyze 버튼을 클릭하여 챔버당 10개의 다른 필드를 무작위로 분석합니다.
- Results( 결과 )를 클릭하여 시료 농도와 운동성을 구합니다.
- 세포 준비
알림: HRR이 보정되지 않은 경우 셀을 준비하기 전에 2.1-2.2단계부터 시작하십시오(1.3단계). 정자 세포가 배지에 재현탁될 때 즉시 산소 소비량을 측정하는 것이 중요합니다.- 샘플을 400 x g 에서 RT에서 10분 동안 원심분리합니다.
- 정액 혈장을 제거하고 온전한 세포를 사용한 실험의 경우 Biggers Whitten Whittingham(BWW) 2mL에 정자를 재현탁시키거나 투과된 세포를 사용한 연구를 위한 미토콘드리아 호흡 배지(MRM)를 재현탁합니다. 매체의 조성은 표 1에 나타내었다.
- 정자 농도 연구를 위해 1.2단계에서 설명한 단계를 반복합니다.
2. 고해상도 호흡 측정: OXPHOS 분석
참고: HRR은 고감도 산소 그래프(Oxygraph-2 K; Oroboros Instruments GmbH, Innsbruck, Austria) 및 소프트웨어(DatLab, 버전 4.2; Oroboros Instruments GmbH)를 참조하십시오. 실험 데이터는 산소 농도 대 시간(O2/106 세포·min−1의 pmol)과 이러한 데이터의 실시간 변환으로 표시되므로 실험자가 실험이 진행되는 동안 생물학적 및 생화학적 샘플의 호흡(산소 소비량, 산소 플럭스)을 추적할 수 있습니다. HRR은 살아있는 세포와 운동성 세포의 호흡을 추적하는 데 사용할 수 있으며, 이는 운동성이 정자의 품질 및 생식력 잠재력과 관련이 있는 정자에 특히 유용합니다. 실험실은 두 개의 챔버가 있는 HRR Oroboros Oxygraph2-k, Oroboros Instruments를 사용합니다. 이 프로토콜에 설명된 단계는 두 2mL 챔버 모두에 대해 독립적으로 수행해야 합니다.
- 장비 준비
- HRR을 켜고 데이터 수집 및 분석을 위해 호흡 측정 소프트웨어(DatLab)에 연결합니다.
- 산소 그래프 챔버의 70% 에탄올을 ddH2O로 교체하고 750rpm에서 챔버의 자석 교반 막대로 계속 저어줍니다. 10분 동안 그대로 두었다가 나중에 이중 증류된(dd) H2O를 흡인합니다.
- 챔버를 ddH2O로 매번 5분 동안 세 번 세척합니다.
알림: 이 단계는 챔버에서 남아 있는 에탄올을 제거하는 데 필요합니다. 정자 세포는 에탄올에 매우 민감합니다. 이 단계를 생략하면 기록이 손상될 수 있습니다.
- 산소 센서의 교정
알림: 교정 절차는 기기에 따라 약간 다릅니다. 제조업체25에서 설명한 대로 폴라로그래픽 산소 센서의 공기 보정을 수행합니다. 이 섹션에서는 교정 프로토콜에 대해 간략하게 설명합니다.- ddH 2O를 제거하고 세포 준비에 사용된 것과 동일한 배지2mL를 챔버로 피펫팅합니다. 공기 교환 기포를 남기고 스토퍼를 놓습니다.
알림: 필요한 매체의 정확한 부피를 결정하기 위해 챔버의 부피를 아는 것이 중요합니다. - 산소 교정 값을 기록하고( 레이아웃 > 01 교정 Exp. Gr3-Temp 클릭) 37°C에서 최소 30분 동안 750rpm의 교반 막대로 매체를 교반하여 센서 멤브레인의 성능을 모니터링합니다. 언급 된대로 다른 설정을 사용하십시오 : 센서 게인 : 2; 분극 전압: 800mV; 데이터 기록 간격: 2.0초.
알림: 폴라로그래픽 센서의 안정적인 신호로 ±2pmol∙s−1∙mL−1 내에서 수정되지 않은 O2 기울기(빨간색 선)를 얻을 것으로 예상됩니다. - 마우스 왼쪽 버튼과 Shift 키를 누른 상태에서 마우스를 드래그하여 산소 농도 변화(Y1 O2 농도, 파란색 선)가 안정적인 영역을 선택합니다.
- O2 교정 창을 엽니다(Oxygraph > O2 교정 클릭). Air Calibration(공기 보정)에서 선택한 표시를 2.2.3단계에서 선택한 영역으로 변경합니다. Calibrate and Copy to Clipboard(보정 및 클립보드에 복사)를 클릭하여 완료합니다.
- 녹음을 중지하고 Oxygraph > Ok Control > Save and Disconnect를 클릭하여 저장합니다.
참고: 이 데이터 세트는 그날의 모든 실험에 사용할 수 있도록 저장해야 합니다. 보정은 각 매체에 대해 하루에 한 번만 수행됩니다.
- ddH 2O를 제거하고 세포 준비에 사용된 것과 동일한 배지2mL를 챔버로 피펫팅합니다. 공기 교환 기포를 남기고 스토퍼를 놓습니다.
- 디지토닌 투과화 적정
- 챔버를 열고 내부의 배지를 흡입합니다.
- 챔버에 최소 24 x 10 6 및 70 x 106 이하의 정자 세포를 2mL의 MRM의 최종 부피에 로드합니다.
알림: 실험이 끝날 때 산소 소비량을 조정하기 위해 챔버의 세포 수를 측정하는 것이 중요합니다. 권장되는 것보다 적은 수의 셀은 측정할 수 없습니다. - 스토퍼를 끝까지 밀어 넣어 챔버를 닫고 상단에 남아 있는 액체를 흡입합니다. 보정과 동일한 설정으로 실험을 시작합니다. 교반 속도: 750rpm; 온도: 37 °C; 센서 이득 : 2; 분극 전압: 800mV; 및 데이터 기록 간격: 2.0초.
- 캘리브레이션을 로드하려면 하단 모서리에 있는 Pos Calib 상자를 두 번 클릭합니다. 2.2단계에서 수행한 보정을 열고( Oxygraph > O2 보정 > 파일에서 복사 클릭) 보정 및 클립보드에 복사를 클릭합니다.
알림: POS 보정 상자가 노란색에서 녹색으로 바뀝니다. 데이터는 부피 차트별로 수정된 산소 흐름으로 표시됩니다(레이아웃 05 부피당 플럭스가 수정되지 않음). Oxygraph > Layout에서 다양한 레이아웃을 사용할 수 있습니다. - 5μL의 0.5M 아데노신 이인산염(ADP), 10μL의 2M 글루타메이트, 2.5μL의 0.4M 말레이트(최종 농도: 1.25mM, 10mM 및 0.5mM)를 추가합니다. 신호가 안정화될 때까지 산소 소비량을 측정합니다.
참고: Precision Hamilton 마이크로 시린지는 스토퍼의 로딩 포트를 통해 주입하는 데 사용됩니다. 교차 오염을 방지하기 위해 약물당 하나의 주사기를 사용하십시오. F4 를 클릭하여 등록하고 치료가 추가되면 산소 레지스터에 표시하십시오.
참고: 기판은 초순수에서 제조되고 -20°C에서 3개월 동안 보관됩니다. - 산소 소비량이 최대 수준에 도달할 때까지 10mM 디지토닌 1μL를 연속적으로 첨가하여 트리테이트합니다.
알림: 같은 날 두 실험에 동일한 챔버를 사용하는 경우 물, 70% 에탄올 및 100% 에탄올로 철저히 세척하는 것이 필수적입니다.
참고: 디지토닌은 초순수에서 제조되어 -20°C에서 3개월 동안 보관됩니다.
- 온전하고 투과된 정자 세포(복합체 I 또는 복합체 II)에 대한 일상적인 호흡 평가 프로토콜
- 챔버를 열고 내부의 배지를 흡입합니다.
- 챔버에 적어도 24 x 10 6 및 70 x 106 이하의 정자 세포를 2 mL의 BWW (원형) 또는 MRM (투과화 세포 분석)의 최종 부피에 로드합니다.
- 보정과 동일한 설정으로 실험을 시작합니다(2.3.3단계에서 설명).
- 2.2단계에서 설명한 대로 2.3.4단계에서 수행된 보정을 로드합니다.
- 안정적인 신호를 얻을 때까지 최소 5분 동안 세포의 호흡을 기록합니다. 이 측정은 온전한 세포의 기초 호흡에 해당합니다.
- 온전한 세포를 사용하여 실험하는 경우 2.4.9단계로 진행합니다. 투과성 세포의 경우 4.5μL의 10mM 디지토닌(최종 농도: 22.5μM)을 주입합니다. 5분 동안 세포를 투과시킵니다.
- 복합체 I의 경우 2M 글루타메이트 10μL와 0.4M 말레이트 2.5μL(최종 농도: 각각 10mM 및 0.5mM) 또는 복합체 II의 경우 1M 숙시네이트 20μL(최종 농도: 10mM)를 추가합니다. 신호가 증가하고 안정화될 때까지 산소 소비량을 측정합니다. 이것은 상태 4이며, 이는 ADP가 없는 경우 기저 복합체 I 또는 기저 복합체 II 지원 호흡을 의미합니다.
참고: 기판은 초순수에서 제조되고 -20°C에서 3개월 동안 보관됩니다. - 0.5M ADP 5μL(최종 농도: 1.25mM)를 주입합니다. 신호가 증가하고 안정화될 때까지 산소 소비량을 측정합니다. ADP를 추가하면 복합체 I 또는 복합체 II(투과화 세포에서 상태 3)를 통해 최대 산소 소비량에 해당하는 신호가 증가합니다.
- ATP 합성효소 억제제인 4mg/mL 올리고마이신(최종 농도: 2μg/mL) 1μL를 추가합니다. 신호가 감소하고 안정화될 때까지 산소 소비량을 측정합니다.
참고: 올리고마이신은 에탄올로 제조되고 -20°C에서 3개월 동안 보관됩니다. - 최대 비결합 호흡수에 도달할 때까지 1mM 카르보닐 시안화물-P-트리플루오로메톡시-페닐히드라존(FCCP)에 1μL의 0.1mM을 연속적으로 첨가하여 적정합니다. 신호가 증가하고 안정화될 때까지 산소 소비량을 측정합니다.
참고: FCCP는 에탄올로 제조되어 -20°C에서 3개월 동안 보관됩니다. - FCCP의 최종 농도는 샘플에 따라 다릅니다. 산소 소비량이 감소하기 시작하면 약물 주입을 중단하십시오.
- 마지막으로 1μL의 5mM 안티마이신 A(2.5μM 최종 농도)를 주입합니다. 이것은 미토콘드리아 및 잔류 산소 소비량(비미토콘드리아 호흡)을 구별하는 복합 III 억제제입니다. 복합체 I 분석을 위해 AA 대신 이 복합체의 억제제인 1mM 로테논(0.5μM 최종 농도) 1μL를 추가합니다. 신호가 감소하고 안정화될 때까지 산소 소비량을 측정합니다.
참고: 약물은 에탄올로 제조되고 -20°C에서 3개월 동안 보관됩니다.
3. 데이터 추출 및 분석
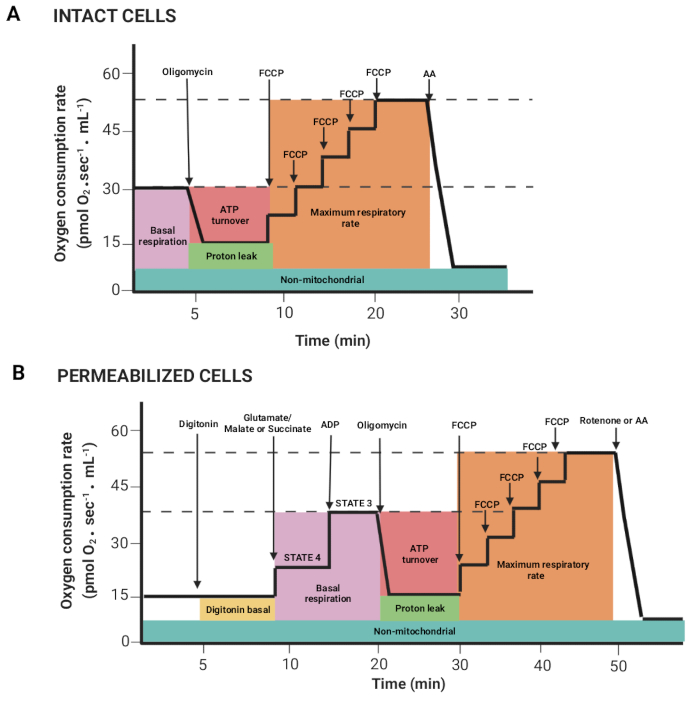
그림 2: 고분해능 호흡 측정 실험에서 호흡 파라미터 획득. (A,B) 그림 1에 설명된 대로 각각 온전한 세포와 투과된 세포에 대해 얻은 그래프의 개략적인 표현. 이들 파라미터들은 이전에 설명되었다15. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 마우스 왼쪽 버튼과 Shift 키를 눌러 마우스를 드래그하여 기판 또는 억제제 주입 후 부피당 산소 플럭스가 상관 관계가 있는 영역(Y2 O2 기울기 불일치, 빨간색 선)을 선택합니다. 도 2 는 앞서 설명한 레지스터로부터 얻어진 상이한 파라미터들을 도시한다(15).
참고: 매개변수는 실험에 따라 다릅니다. 이들 모두는 다음과 같습니다: 온전한 세포에서의 기초 호흡 및 글루타메이트/말레이트 또는 숙시네이트(상태 4), ADP(상태 3), 올리고마이신(양성자 누출), FCCP(최대 호흡수), 로테논/AA(비미토콘드리아 호흡). 투과된 세포에서 기초 호흡은 상태 3에 해당합니다. - Marks > Statistics 창을 클릭하고 데이터를 내보냅니다.
- 정자 세포 100만 개당 얻은 데이터를 정규화합니다. 기울기의 단위는 pmolO2·s−1·mL−1·10−6 셀입니다.
- 지수를 계산하기 전에 모든 값에서 비미토콘드리아 산소 소비량을 뺍니다.
- 이전에 설명한 다양한 방정식을 사용하여 지수를 계산합니다15:

결과
정자 세포에서 디지토닌의 최적 농도 결정
이 프로토콜에서는 인간 정자 세포에서 OXPHOS의 실시간 변화를 모니터링하기 위해 HRR을 사용하는 방법을 제시합니다. 이 방법은 온전한 정자 또는 디지토닌 투과화된 정자를 분석하는 데 사용할 수 있기 때문에 먼저 정자 세포를 투과시키는 데 필요한 디지토닌 농도의 표준화를 제시합니다(그림 3).
토론
HRR은 (a) 장비 유지보수, (b) 산소 센서의 정확한 교정, (c) 언커플러 적정(26), 그리고 마지막으로 (d) 미토콘드리아 기능을 나타내는 지수의 적절한 사용과 같은 몇 가지 단계에 따라 결정적으로 달라집니다. 장비 유지 보수는 매우 중요합니다. 폴라로그래픽 산소 센서의 멤브레인을 정기적으로 교체하고 기기 배경을 수정하는 것이 좋습니다. 챔버에서 정자를 채취 한 후 광범위한 ?...
공개
저자는 공개할 것이 없습니다.
감사의 말
기증자를 만날 수 있게 해주신 Fertilab Andrology 클리닉, 특히 José María Montes와 Andrea Torrents에게 감사드립니다. 자금 지원: A.C.는 Universidad de la República(CSIC_2018, Espacio Interdisciplinario_2021)의 보조금으로 지원됩니다. 추가 자금은 Programa de Desarrollo de Ciencias Básicas(우루과이 PEDECIBA)에서 받았습니다. PI 및 RS 지원은 Universidad de la República (I+D, CSIC 2014; I+D, CSIC 2016, Iniciación a la Investigación, CSIC 2019 및 FMV_1_2017_1_136490 ANII- 우루과이). PI는 POS_FMV_2018_1_1007814 및 CAP-UDELAR 2020에서 지원됩니다. 수치는 Biorender.com 를 사용하여 설명되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Acid free- Bovine serum albumine | Sigma Aldrich | A8806 | |
| Adenosine 5'-diphosphate monopotassium salt dihydrate | Sigma Aldrich | A5285 | |
| Animycin A from streptomyces sp. | Sigma Aldrich | A8674 | |
| Calcium chloride | Sigma Aldrich | C4901 | |
| carbonyl cyanide-P- trifluoromethoxy-phenylhydrazone | Sigma Aldrich | C2920 | |
| DatLab sofware version 4,2 | Oroboros Instruments GmbH | N/A | |
| D-glucose | Sigma Aldrich | G7021 | |
| Digitonin | Sigma Aldrich | D141 | |
| EGTA | Sigma Aldrich | E4378 | |
| HEPES | Sigma Aldrich | H3375 | |
| L glutamic acid | Sigma Aldrich | G1251 | |
| L malic acid | Sigma Aldrich | M1000 | |
| Magnesium sulphate | Sigma Aldrich | M7506 | |
| Microliter Syringes | Hamilton | 87900 or 80400 | |
| Microscope camera | Basler | acA780-75gc | |
| Microscope Eclipse E200 with phase contrast 10X Ph+ | Nikon | N/A | |
| Monopotassium phosphate | Sigma Aldrich | P5655 | |
| MOPS | Sigma Aldrich | M1254 | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Oxygraph-2 K | Oroboros Instruments GmbH | N/A | |
| Potassium chloride | Sigma Aldrich | P3911 | |
| Power O2k-Respirometer | Oroboros Intruments | 10033-01 | |
| Rotenone | Sigma Aldrich | R8875 | |
| Saccharose | Sigma Aldrich | S0389 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium lactate | Sigma Aldrich | L7022 | |
| Sodium pyruvate | Sigma Aldrich | P2256 | |
| Sperm class analyzer 6.3.0.59 Evolution-SCA Research | Microptic | N/A | |
| Sperm Counting Chamber DRM-600 | Millennium Sciences CELL-VU | N/A | |
| Succinate disodium salt | Sigma Aldrich | W327700 |
참고문헌
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13, 37 (2015).
- Guzick, D. S., et al. Sperm morphology, motility, and concentration in fertile and infertile men. The New England Journal of Medicine. 345 (19), 1388-1393 (2001).
- Wang, C., Swerdloff, R. S. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertility and Sterility. 102 (6), 1502-1507 (2014).
- Amaral, A. Energy metabolism in mammalian sperm motility. WIREs Mechanisms of Disease. 14 (5), e1569 (2022).
- Leung, M. R., et al. In-cell structures of conserved supramolecular protein arrays at the mitochondria-cytoskeleton interface in mammalian sperm. Proceedings of the National Academy of Sciences of the United States of America. 118 (45), e2110996118 (2021).
- Moraes, C. R., Meyers, S. The sperm mitochondrion: Organelle of many functions. Animal Reproduction Science. 194, 71-80 (2018).
- Cassina, A., et al. Defective human sperm cells are associated with mitochondrial dysfunction and oxidant production. Biology of Reproduction. 93 (5), 119 (2015).
- Marchetti, C., Obert, G., Deffosez, A., Formstecher, P., Marchetti, P. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm. Human Reproduction. 17 (5), 1257-1265 (2002).
- Amaral, A., Lourenço, B., Marques, M., Ramalho-Santos, J. Mitochondria functionality and sperm quality. Reproduction. 146 (5), R163-R174 (2013).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), e13666 (2021).
- Uribe, P., et al. Use of the fluorescent dye tetramethylrhodamine methyl ester perchlorate for mitochondrial membrane potential assessment in human spermatozoa. Andrologia. 49 (9), e12753 (2017).
- Storey, B. T. Mammalian sperm metabolism: Oxygen and sugar, friend and foe. The International Journal of Developmental Biology. 52 (5-6), 427-437 (2008).
- Tourmente, M., Sansegundo, E., Rial, E., Roldan, E. R. S. Capacitation promotes a shift in energy metabolism in murine sperm. Frontiers in Cell and Developmental Biology. 10, 950979 (2022).
- Gnaiger, E., Dykens, J. A., Will, Y. Chapter 12 - Polarographic oxygen sensors, the oxygraph, and high-resolution respirometry to assess mitochondrial function. Drug-Induced Mitochondrial Dysfunction. , 325-352 (2008).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Awadhpersad, R., Jackson, C. B. High-resolution respirometry to assess bioenergetics in cells and tissues using chamber- and plate-based respirometers. Journal of Visualized Experiments: JoVE. (176), e63000 (2021).
- Chance, B., Williams, G. R. A simple and rapid assay of oxidative phosphorylation. Nature. 175 (4469), 1120-1121 (1955).
- Li, Z., Graham, B. H. Measurement of mitochondrial oxygen consumption using a Clark electrode. Methods in Molecular Biology. 837, 63-72 (2012).
- Stendardi, A., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. International Journal of Andrology. 34 (3), 247-255 (2011).
- Ferramosca, A., Focarelli, R., Piomboni, P., Coppola, L., Zara, V. Oxygen uptake by mitochondria in demembranated human spermatozoa: A reliable tool for the evaluation of sperm respiratory efficiency. International Journal of Andrology. 31 (3), 337-345 (2008).
- Ferramosca, A., et al. Modulation of human sperm mitochondrial respiration efficiency by plant polyphenols. Antioxidants. 10 (2), 217 (2021).
- Gnaiger, E., Steinlechner-Maran, R., Méndez, G., Eberl, T., Margreiter, R. Control of mitochondrial and cellular respiration by oxygen. Journal of Bioenergetics and Biomembranes. 27 (6), 583-596 (1995).
- . O2k Quality Control 1: Polarographic oxygen sensors and accuracy of calibration Available from: https://www.bioblst.at/images/archive/7/77/20210819114548%21MiPNet06.03_POS-Calibration-SOP.pdf (2020)
- WHO Laboratory Manual for the Examination and Processing of Human Semen. World Health Organization Available from: https://www.who.int/publications/i/item/9789240030787 (2010)
- . O2k-protocols SOP: O2k quality control 1 Available from: https://www.bioblast.at/images/9/9c/MiPNet06.03_POS-Calibration-SOP_DatLab8.pdf (2021)
- Gnaiger, E. . Mitochondrial Pathways and Respiratory Control. , (2012).
- Steinlechner-Maran, R., Eberl, T., Kunc, M., Margreiter, R., Gnaiger, E. Oxygen dependence of respiration in coupled and uncoupled endothelial cells. The American Journal of Physiology. 271, C2053-C2061 (1996).
- Holt, W. V., Van Look, K. J. W. Concepts in sperm heterogeneity, sperm selection and sperm competition as biological foundations for laboratory tests of semen quality. Reproduction. 127 (5), 527-535 (2004).
- Sousa, A. P., et al. Not all sperm are equal: Functional mitochondria characterize a subpopulation of human sperm with better fertilization potential. PloS One. 6 (3), e18112 (2011).
- Moscatelli, N., et al. Single-cell-based evaluation of sperm progressive motility via fluorescent assessment of mitochondria membrane potential. Scientific Reports. 7, 17931 (2017).
- Ferreira, J. J., et al. Increased mitochondrial activity upon CatSper channel activation is required for mouse sperm capacitation. Redox Biology. 48, 102176 (2021).
- Irigoyen, P., et al. Mitochondrial metabolism determines the functional status of human sperm and correlates with semen parameters. Frontiers in Cell and Developmental Biology. 10, 926684 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유