É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Respirometria de Alta Resolução para Avaliação da Função Mitocondrial em Espermatozoides Humanos
Neste Artigo
Resumo
A análise da função mitocondrial espermática por respirometria de alta resolução permite medir o consumo de oxigênio de espermatozoides que se movem livremente em um sistema de câmara fechada. A técnica pode ser aplicada para medir a respiração em espermatozoides humanos, o que fornece informações sobre as características mitocondriais e integridade dos espermatozoides.
Resumo
A qualidade do sêmen é frequentemente estudada pela análise seminal de rotina, que é descritiva e muitas vezes inconclusiva. A infertilidade masculina está associada à atividade mitocondrial alterada dos espermatozoides, de modo que a medição da função mitocondrial dos espermatozoides é um indicador da qualidade dos espermatozoides. A respirometria de alta resolução é um método de medir o consumo de oxigênio de células ou tecidos em um sistema de câmara fechada. Esta técnica pode ser implementada para medir a respiração em espermatozoides humanos e fornece informações sobre a qualidade e integridade das mitocôndrias espermáticas. A respirometria de alta resolução permite que as células se movam livremente, o que é uma vantagem a priori no caso dos espermatozoides. Esta técnica pode ser aplicada com espermatozoides intactos ou permeabilizados e permite o estudo da função mitocondrial intacta dos espermatozoides e da atividade de complexos de cadeias respiratórias individuais. O instrumento de oxigrafia de alta resolução usa sensores para medir a concentração de oxigênio juntamente com um software sensível para calcular o consumo de oxigênio. Os dados são usados para calcular índices respiratórios com base nas razões de consumo de oxigênio. Consequentemente, os índices são as proporções de duas taxas de consumo de oxigênio e são normalizados internamente para o número celular ou massa proteica. Os índices respiratórios são um indicador da função e disfunção mitocondrial dos espermatozoides.
Introdução
Estima-se que a infertilidade masculina seja responsável por 40%-50% de todos os casos de infertilidade em casais1. A análise seminal convencional desempenha um papel crucial na determinação da fertilidade masculina; no entanto, aproximadamente 15% dos homens inférteis apresentam parâmetros espermáticos normais2. Além disso, a análise seminal de rotina fornece informações limitadas sobre a função espermática e não reflete defeitos sutis espermáticos3.
As mitocôndrias espermáticas têm uma estrutura especial, pois estão dispostas como uma bainha helicoidal ao redor dos flagelos. A bainha mitocondrial contém um número variável de mitocôndrias conectadas por ligantes intermitocondriais e ancoradas ao citoesqueleto por arranjos proteicos ordenados na membrana mitocondrial externa 4,5. Esta estrutura torna particularmente difícil isolar as mitocôndrias dos espermatozoides. Portanto, a maioria dos estudos sobre a função mitocondrial dos espermatozoides utiliza análises in situ ou espermatozoides desembrandados6.
A estrutura e a função mitocondrial espermática têm sido consistentemente associadas à infertilidade masculina 7,8,9,10,11, sugerindo que a análise da estrutura e função dessas organelas pode ser uma boa candidata para inclusão na análise espermática.
As mitocôndrias desempenham um papel importante no metabolismo energético celular, particularmente usando oxigênio para produzir trifosfato de adenosina (ATP) através da fosforilação oxidativa (OXPHOS). Nos espermatozoides, em particular, a fonte de ATP (glicólise vs. OXPHOS) é contestada, e muitos dos dados permanecem controversos e dependem de diferentes abordagens experimentais4,12,13. Medidas da respiração por oximetria oferecem informações significativas sobre a capacidade respiratória mitocondrial, integridade mitocondrial e metabolismo energético da célula14,15,16. Tradicionalmente, essa técnica tem sido realizada com o eletrodo de oxigênio de Clark, instrumento utilizado para medir a respiração mitocondrial há mais de 50 anos17,18. Além disso, o consumo de oxigênio mitocondrial dos espermatozoides foi analisado utilizando-se o clássico eletrodo de oxigênio de Clark 19,20,21. A respirometria de alta resolução (FCR) utilizando oxígrafos (Oroboros) fornece maior sensibilidade do que usando os aparelhos de respirometria clássica22. Os oxígrafos são compostos por duas câmaras com portas de injeção, e cada câmara possui um sensor polarográfico de oxigênio. Com essa técnica, é possível analisar lâminas teciduais, células e suspensões mitocondriais isoladas. O espécime é continuamente agitado na câmara e, durante o experimento, o consumo de oxigênio é medido e as taxas de oxigênio são calculadas usando um software específico. As câmaras apresentam menor extravasamento de oxigênio, o que é uma vantagem sobre os aparelhos convencionais de eletrodos de oxigênio14,23.
Como acontece com outras células, no caso dos espermatozoides, a sensibilidade do equipamento HRR é maior do que para a respirometria convencional, o que significa que o equipamento HRR pode ser usado para a análise de um número limitado de espermatozoides intactos ou permeabilizados. Existem duas estratégias principais para avaliar a função mitocondrial espermática pela HRR: (a) medir o consumo de oxigênio em células intactas, que envolve a reprodução da função respiratória em um meio contendo substratos como glicose, ou (b) medir o consumo de oxigênio em células permeabilizadas usando um dos complexos de OXFOS, com a adição de substratos específicos para monitorar cada função separadamente.
No presente estudo, descrevemos o uso da HRR para determinar a respiração mitocondrial em espermatozoides humanos.
Protocolo
Os experimentos foram aprovados pelo Comitê de Ética da Faculdade de Medicina da Universidade da República, Montevidéu, Uruguai.
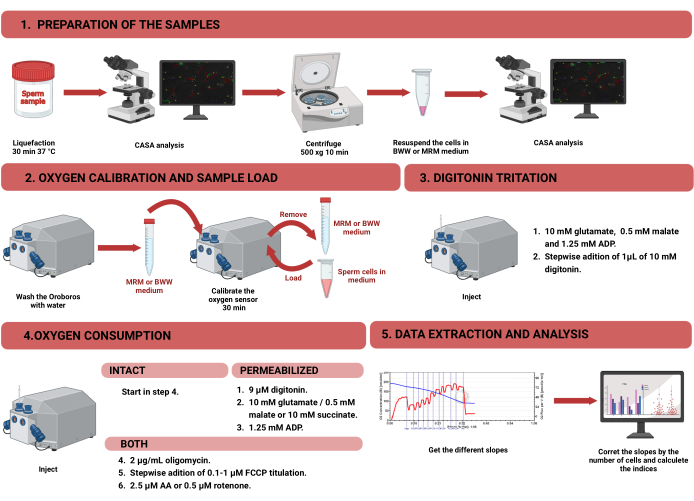
Figura 1: Fluxo de trabalho para respirometria de alta resolução para avaliar a função mitocondrial em espermatozoides humanos intactos e permeabilizados. O protocolo foi dividido em quatro etapas distintas: 1) preparação da amostra, 2) calibração do oxigênio no instrumento Oroboros, 3) medição do consumo de oxigênio para células intactas e permeabilizadas e 4) extração dos dados do equipamento e análise. Abreviações: CASA = análise espermática assistida por computador; BWW = Biggers Whitten Whittingham médio; MRM = meio de respiração mitocondrial; ADP = difosfato de adenosina; FCCP = cianeto de carbonila -p- trifluorometoxifenilhidrazona; AA = antimicina A. Clique aqui para ver uma versão maior desta figura.
NOTA: O fluxo de trabalho para medir o consumo de oxigênio em células espermáticas usando HRR é mostrado na Figura 1. As informações sobre os materiais, equipamentos e reagentes utilizados no protocolo são apresentadas na Tabela de Materiais.
1. Preparação da amostra
- Coleta de amostras
- Coletar sêmen humano recém-ejaculado por masturbação após uma abstinência recomendada de 3 dias em um recipiente plástico estéril. Transportar as amostras imediatamente para o laboratório.
- Incubar as amostras por 30-60 min à temperatura ambiente (TR) para liquefazer completamente24.
- Após liquefação, armazenar as amostras a 37 °C até ao início da experiência.
- Avaliação espermática com análise espermática auxiliada por computador (CASA)
- Misture a amostra e carregue 7 μL em uma câmara de contagem de espermatozoides pré-aquecida.
- Coloque a câmara no estágio pré-aquecido (37 °C) de um microscópio de luz direta.
- Abra o software computadorizado de análise de espermatozoides e, entre no módulo de motilidade e concentração (clique em Mot).
- Selecione a configuração que corresponde às condições do esperma humano.
NOTA: A configuração deve ser adaptada ao tipo e profundidade da câmara, bem como à espécie de amostra e ao sistema CASA. - Analise aleatoriamente 10 campos diferentes por câmara clicando no botão Analisar .
- Clique em Resultados para obter a concentração e motilidade da amostra.
- Preparação celular
NOTA: Se a HRR não estiver calibrada, comece com os passos 2.1-2.2 antes de preparar as células (passo 1.3). É importante medir o consumo de oxigênio imediatamente quando os espermatozoides são ressuspensos no meio.- Centrifugar as amostras a 400 x g durante 10 min em RT.
- Remover o plasma seminal e ressuspender os espermatozoides em 2 mL de Biggers Whitten Whittingham (BWW) para experimentos com células intactas ou meio respiratório mitocondrial (MRM) para estudos com células permeabilizadas. As composições das mídias são mostradas na Tabela 1.
- Repita os passos descritos no passo 1.2 para estudos de concentração de espermatozoides.
2. Respirometria de alta resolução: análise de OXPHOS
NOTA: HRR integra oxigrafias altamente sensíveis (Oxygraph-2 K; Oroboros Instruments GmbH, Innsbruck, Áustria) com software (DatLab, versão 4.2; Oroboros Instruments GmbH). Os dados experimentais são apresentados como a concentração de oxigênio versus o tempo (como pmol de O2/106 células·min−1) e como transformações em tempo real desses dados, permitindo ao experimentador rastrear a respiração (consumo de oxigênio, fluxo de oxigênio) de amostras biológicas e bioquímicas enquanto o experimento ainda está em execução. A HRR pode ser usada para acompanhar a respiração de células vivas e móveis, o que é particularmente útil para espermatozoides, cuja motilidade está associada à qualidade espermática e potencial de fertilidade. O laboratório utiliza um HRR Oroboros Oxygraph2-k, Oroboros Instruments, com duas câmaras. As etapas descritas neste protocolo devem ser realizadas independentemente para ambas as câmaras de 2 mL.
- Preparação do equipamento
- Ligue o HRR e conecte-o ao software de respirometria (DatLab) para aquisição e análise de dados.
- Substitua o etanol a 70% na câmara oxigráfica por ddH2O. Agite-o continuamente com a barra de agitação magnética na câmara a 750 rpm. Deixe descansar por 10 min, e aspirar o bidestilado (dd) H2O depois.
- Lave a câmara três vezes com ddH2O por 5 min cada vez.
NOTA: Esta etapa é necessária para remover o etanol restante das câmaras. Os espermatozoides são muito sensíveis ao etanol. A gravação pode ser comprometida se essa etapa for omitida.
- Calibração dos sensores de oxigênio
NOTA: O procedimento de calibração varia ligeiramente dependendo do instrumento. Efectuar uma calibração do ar do sensor polarográfico de oxigénio conforme descrito pelo fabricante25. Nesta seção, o protocolo de calibração é explicado brevemente.- Retirar o ddH 2 O e pipetar2mL do mesmo meio utilizado para o preparo celular para a câmara. Coloque as rolhas, deixando uma bolha de troca de ar.
NOTA: É importante saber o volume da câmara para determinar o volume exato de meio necessário. - Registre os valores de calibração de oxigênio (clique em Layout > 01 Calibração Exp. Gr3-Temp) para monitorar o desempenho da membrana do sensor agitando o meio com a barra de agitação a 750 rpm por pelo menos 30 min a 37 °C. Use as outras configurações como mencionado: ganho para sensor: 2; tensão de polarização: 800 mV; Intervalo de gravação de dados: 2,0 s.
NOTA: Espera-se obter uma inclinação O 2 não corrigida (linha vermelha) dentro de ±2 pmol∙s−1∙mL−1 com um sinal estável do sensor polarográfico. - Arraste o mouse enquanto mantém pressionado o botão esquerdo do mouse e a tecla shift para selecionar uma área onde a mudança na concentração de oxigênio (Concentração de O2 Y1, linha azul) é estável.
- Abra a janela Calibração do O2 (clique em Oxigrafo > Calibração do O2). Em Calibração do ar, altere a marca selecionada para a região selecionada na etapa 2.2.3. Termine clicando em Calibrar e Copiar para a Área de Transferência.
- Pare a gravação e salve clicando em Oxygraph > Ok Control > Save and Disconnect.
Observação : esse conjunto de dados deve ser salvo para que ele possa ser usado em todos os experimentos do dia. A calibração é realizada apenas uma vez ao dia para cada meio.
- Retirar o ddH 2 O e pipetar2mL do mesmo meio utilizado para o preparo celular para a câmara. Coloque as rolhas, deixando uma bolha de troca de ar.
- Titulação digitonina-permeabilização
- Abra a câmara e aspirar o meio para dentro.
- Carregar na câmara pelo menos 24 x 10 6 e não mais do que 70 x 106 espermatozoides em um volume final de 2 mL de MRM.
NOTA: É importante medir o número de células na câmara para ajustar o consumo de oxigênio ao final do experimento. Um número menor de células do que o recomendado não pode ser medido. - Feche a câmara empurrando as rolhas até o fim e aspirar o líquido restante na parte superior. Inicie o experimento com as mesmas configurações da calibração: velocidade de agitação: 750 rpm; temperatura: 37 °C; ganho para sensor: 2; tensão de polarização: 800 mV; e intervalo de registro dos dados: 2,0 s.
- Para carregar a calibração, clique duas vezes na caixa Pos Calib no canto inferior. Abra a calibração realizada na etapa 2.2 (clique em Oxygraph > O2 Calibration > Copy from File), e clique em Calibrar e Copy to Clipboard.
NOTA: A caixa POS Calib mudará de amarelo para verde. Os dados são exibidos em gráficos de fluxo de oxigênio corrigido por volume (Layout 05 Fluxo por Volume não corrigido). Diferentes layouts estão disponíveis no Oxygraph > Layout. - Adicionar 5 μL de difosfato de adenosina 0,5 M (ADP), 10 μL de glutamato 2 M e 2,5 μL de malato 0,4 M (concentrações finais: 1,25 mM, 10 mM e 0,5 mM). Meça o consumo de oxigênio até que o sinal se estabilize.
NOTA: As microseringas Hamilton de precisão são utilizadas para injeção através da porta de carregamento na rolha. Use uma seringa por medicamento para evitar contaminação cruzada. Clique em F4 para se registrar e marcar no registro de oxigênio quando um tratamento é adicionado.
NOTA: Os substratos são preparados em água ultrapura e armazenados a −20 °C por 3 meses. - Tritato adicionando 1 μL de digitonina 10 mM em etapas sucessivas até que o consumo de oxigênio atinja um nível máximo.
NOTA: A lavagem completa com água, etanol 70% e etanol 100% é essencial se a mesma câmara for usada para dois experimentos no mesmo dia.
NOTA: Digitonin é preparado em água ultrapura e armazenado a -20 °C por 3 meses.
- Protocolo de rotina de avaliação respiratória de espermatozoides intactos e permeabilizados (complexo I ou complexo II)
- Abra a câmara e aspirar o meio para dentro.
- Carregar na câmara pelo menos 24 x 10 6 e não mais do que 70 x 106 espermatozoides em um volume final de 2 mL de BWW (análise de células intactas) ou MRM (análise de células permeabilizadas).
- Iniciar a experiência com as mesmas definições da calibração (isto é descrito no passo 2.3.3).
- Carregue a calibração efectuada no passo 2.2 conforme descrito no passo 2.3.4.
- Registrar a respiração das células por pelo menos 5 min até que um sinal estável seja obtido. Essa medida corresponde à respiração basal em células intactas.
- Se a experiência for com células intactas, avance para o passo 2.4.9. Para células permeabilizadas, injetar 4,5 μL de digitonina 10 mM (concentração final: 22,5 μM). Permeabilizar as células por 5 min.
- Adicionar os substratos: 10 μL de glutamato 2 M e 2,5 μL de malato 0,4 M (concentrações finais: 10 mM e 0,5 mM, respectivamente) para o complexo I ou 20 μL de succinato 1 M (concentração final: 10 mM) para o complexo II. Meça o consumo de oxigênio até que o sinal aumente e se estabilize. Este é o estado 4, que significa respiração suportada pelo complexo basal I ou complexo basal II na ausência de ADP.
NOTA: Os substratos são preparados em água ultrapura e armazenados a −20 °C por 3 meses. - Injetar 5 μL de ADP 0,5 M (concentração final: 1,25 mM). Meça o consumo de oxigênio até que o sinal aumente e se estabilize. A adição de ADP aumenta o sinal correspondente ao consumo máximo de oxigênio através do complexo I ou complexo II (estado 3, em células permeabilizadas).
- Adicionar 1 μL de 4 mg/mL de oligomicina (concentração final: 2 μg/mL), um inibidor da ATP sintetase. Meça o consumo de oxigênio até que o sinal diminua e se estabilize.
NOTA: A oligomicina é preparada em etanol e armazenada a -20 °C durante 3 meses. - Titular adicionando 1 μL de 0,1 mM a 1 mM de cianeto de carbonila-P-trifluorometoxi-fenilhidrazona (FCCP) em etapas sucessivas até atingir uma taxa máxima de respiração desacoplado. Meça o consumo de oxigênio até que o sinal aumente e se estabilize.
NOTA: O FCCP é preparado em etanol e armazenado a -20 °C durante 3 meses. - A concentração final de FCCP é dependente da amostra. Pare de injetar a droga quando o consumo de oxigênio começa a diminuir.
- Finalmente, injetar 1 μL de antimicina A 5 mM (concentração final de 2,5 μM). Trata-se de um inibidor do complexo III para discriminar o consumo mitocondrial e o consumo residual de oxigênio (respiração não mitocondrial). Para a análise do complexo I, adicionar 1 μL de rotenona 1 mM (concentração final de 0,5 μM), um inibidor desse complexo, em vez de AA. Meça o consumo de oxigênio até que o sinal diminua e se estabilize.
NOTA: Os medicamentos são preparados em etanol e armazenados a -20 °C por 3 meses.
3. Extração e análise dos dados
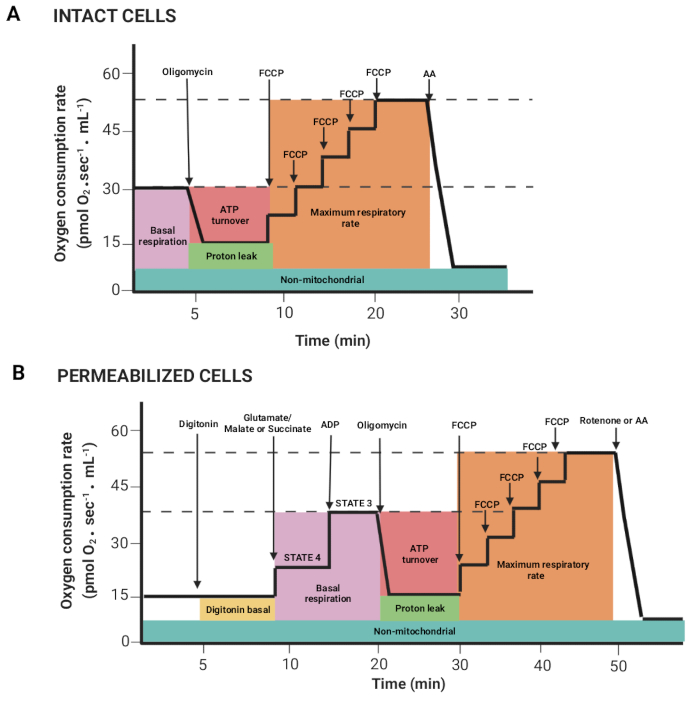
Figura 2: Aquisição dos parâmetros respiratórios de um experimento de respirometria de alta resolução. (A,B) Representações esquemáticas dos gráficos obtidos, conforme descrito na Figura 1, para células intactas e permeabilizadas, respectivamente. Esses parâmetros foram descritospreviamente15. Clique aqui para ver uma versão maior desta figura.
- Arraste o mouse pressionando o botão esquerdo do mouse e a tecla Shift para selecionar regiões onde o fluxo de oxigênio por volume correlacionado (inclinação Y2 O2 uncorr., linha vermelha) é estável após a injeção de um substrato ou inibidor. A Figura 2 mostra os diferentes parâmetros obtidos a partir do registro descritoanteriormente15.
NOTA: Os parâmetros dependem do experimento; todos eles: respiração basal em células intactas e respiração na presença de glutamato/malato ou succinato (estado 4), ADP (estado 3), oligomicina (vazamento de prótons), FCCP (taxa respiratória máxima), rotenona/AA (respiração não mitocondrial). Nas células permeabilizadas, a respiração basal corresponde ao estado 3. - Clique nas janelas Marcas > Estatísticas e exporte os dados.
- Normalizar os dados obtidos por 1 milhão de espermatozoides. As unidades das encostas são células pmolO2·s−1·mL−1·10−6.
- Subtrair o consumo de oxigênio não mitocondrial de todos os valores antes de calcular os índices.
- Calcule os índices usando as várias equações descritas anteriormente15:

Resultados
Determinação da concentração ótima de digitonina em espermatozoides
Neste protocolo, apresentamos o uso da HRR para monitorar em tempo real as mudanças no OXPHOS em espermatozoides humanos. Uma vez que o método pode ser usado para analisar espermatozoides intactos ou permeabilizados por digitonina, apresentamos primeiramente a padronização da concentração de digitonina necessária para permeabilizar os espermatozoides (Figura 3).
A d...
Discussão
A HRR depende criticamente de várias etapas: (a) a manutenção do equipamento, (b) a calibração precisa dos sensores de oxigênio, (c) a titulação do desacoplador26 e, finalmente, (d) o uso adequado de índices que representem a função mitocondrial. A manutenção do equipamento é fundamental. Recomenda-se substituir as membranas do sensor polarográfico de oxigênio regularmente e corrigir o fundo instrumental. A lavagem extensiva após a coleta de espermatozoides das câmaras é essenci...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer à clínica de Andrologia Fertilab, especialmente José María Montes e Andrea Torrents, por nos permitir o acesso aos doadores. Financiamento: A.C. é apoiado por bolsas da Universidad de la República (CSIC_2018, Espacio Interdisciplinario_2021). Financiamento adicional foi obtido do Programa de Desarrollo de Ciencias Básicas (PEDECIBA, Uruguai). P.I. e R.S. são apoiados pela Universidad de la República (I+D, CSIC 2014; I+D, CSIC 2016, Iniciación a la Investigación, CSIC 2019 e FMV_1_2017_1_136490 ANII- Uruguai). P.I. é apoiado pelo POS_FMV_2018_1_1007814 e CAP-UDELAR 2020. As figuras foram ilustradas com Biorender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| Acid free- Bovine serum albumine | Sigma Aldrich | A8806 | |
| Adenosine 5'-diphosphate monopotassium salt dihydrate | Sigma Aldrich | A5285 | |
| Animycin A from streptomyces sp. | Sigma Aldrich | A8674 | |
| Calcium chloride | Sigma Aldrich | C4901 | |
| carbonyl cyanide-P- trifluoromethoxy-phenylhydrazone | Sigma Aldrich | C2920 | |
| DatLab sofware version 4,2 | Oroboros Instruments GmbH | N/A | |
| D-glucose | Sigma Aldrich | G7021 | |
| Digitonin | Sigma Aldrich | D141 | |
| EGTA | Sigma Aldrich | E4378 | |
| HEPES | Sigma Aldrich | H3375 | |
| L glutamic acid | Sigma Aldrich | G1251 | |
| L malic acid | Sigma Aldrich | M1000 | |
| Magnesium sulphate | Sigma Aldrich | M7506 | |
| Microliter Syringes | Hamilton | 87900 or 80400 | |
| Microscope camera | Basler | acA780-75gc | |
| Microscope Eclipse E200 with phase contrast 10X Ph+ | Nikon | N/A | |
| Monopotassium phosphate | Sigma Aldrich | P5655 | |
| MOPS | Sigma Aldrich | M1254 | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Oxygraph-2 K | Oroboros Instruments GmbH | N/A | |
| Potassium chloride | Sigma Aldrich | P3911 | |
| Power O2k-Respirometer | Oroboros Intruments | 10033-01 | |
| Rotenone | Sigma Aldrich | R8875 | |
| Saccharose | Sigma Aldrich | S0389 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium lactate | Sigma Aldrich | L7022 | |
| Sodium pyruvate | Sigma Aldrich | P2256 | |
| Sperm class analyzer 6.3.0.59 Evolution-SCA Research | Microptic | N/A | |
| Sperm Counting Chamber DRM-600 | Millennium Sciences CELL-VU | N/A | |
| Succinate disodium salt | Sigma Aldrich | W327700 |
Referências
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13, 37 (2015).
- Guzick, D. S., et al. Sperm morphology, motility, and concentration in fertile and infertile men. The New England Journal of Medicine. 345 (19), 1388-1393 (2001).
- Wang, C., Swerdloff, R. S. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertility and Sterility. 102 (6), 1502-1507 (2014).
- Amaral, A. Energy metabolism in mammalian sperm motility. WIREs Mechanisms of Disease. 14 (5), e1569 (2022).
- Leung, M. R., et al. In-cell structures of conserved supramolecular protein arrays at the mitochondria-cytoskeleton interface in mammalian sperm. Proceedings of the National Academy of Sciences of the United States of America. 118 (45), e2110996118 (2021).
- Moraes, C. R., Meyers, S. The sperm mitochondrion: Organelle of many functions. Animal Reproduction Science. 194, 71-80 (2018).
- Cassina, A., et al. Defective human sperm cells are associated with mitochondrial dysfunction and oxidant production. Biology of Reproduction. 93 (5), 119 (2015).
- Marchetti, C., Obert, G., Deffosez, A., Formstecher, P., Marchetti, P. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm. Human Reproduction. 17 (5), 1257-1265 (2002).
- Amaral, A., Lourenço, B., Marques, M., Ramalho-Santos, J. Mitochondria functionality and sperm quality. Reproduction. 146 (5), R163-R174 (2013).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), e13666 (2021).
- Uribe, P., et al. Use of the fluorescent dye tetramethylrhodamine methyl ester perchlorate for mitochondrial membrane potential assessment in human spermatozoa. Andrologia. 49 (9), e12753 (2017).
- Storey, B. T. Mammalian sperm metabolism: Oxygen and sugar, friend and foe. The International Journal of Developmental Biology. 52 (5-6), 427-437 (2008).
- Tourmente, M., Sansegundo, E., Rial, E., Roldan, E. R. S. Capacitation promotes a shift in energy metabolism in murine sperm. Frontiers in Cell and Developmental Biology. 10, 950979 (2022).
- Gnaiger, E., Dykens, J. A., Will, Y. Chapter 12 - Polarographic oxygen sensors, the oxygraph, and high-resolution respirometry to assess mitochondrial function. Drug-Induced Mitochondrial Dysfunction. , 325-352 (2008).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Awadhpersad, R., Jackson, C. B. High-resolution respirometry to assess bioenergetics in cells and tissues using chamber- and plate-based respirometers. Journal of Visualized Experiments: JoVE. (176), e63000 (2021).
- Chance, B., Williams, G. R. A simple and rapid assay of oxidative phosphorylation. Nature. 175 (4469), 1120-1121 (1955).
- Li, Z., Graham, B. H. Measurement of mitochondrial oxygen consumption using a Clark electrode. Methods in Molecular Biology. 837, 63-72 (2012).
- Stendardi, A., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. International Journal of Andrology. 34 (3), 247-255 (2011).
- Ferramosca, A., Focarelli, R., Piomboni, P., Coppola, L., Zara, V. Oxygen uptake by mitochondria in demembranated human spermatozoa: A reliable tool for the evaluation of sperm respiratory efficiency. International Journal of Andrology. 31 (3), 337-345 (2008).
- Ferramosca, A., et al. Modulation of human sperm mitochondrial respiration efficiency by plant polyphenols. Antioxidants. 10 (2), 217 (2021).
- Gnaiger, E., Steinlechner-Maran, R., Méndez, G., Eberl, T., Margreiter, R. Control of mitochondrial and cellular respiration by oxygen. Journal of Bioenergetics and Biomembranes. 27 (6), 583-596 (1995).
- . O2k Quality Control 1: Polarographic oxygen sensors and accuracy of calibration Available from: https://www.bioblst.at/images/archive/7/77/20210819114548%21MiPNet06.03_POS-Calibration-SOP.pdf (2020)
- WHO Laboratory Manual for the Examination and Processing of Human Semen. World Health Organization Available from: https://www.who.int/publications/i/item/9789240030787 (2010)
- . O2k-protocols SOP: O2k quality control 1 Available from: https://www.bioblast.at/images/9/9c/MiPNet06.03_POS-Calibration-SOP_DatLab8.pdf (2021)
- Gnaiger, E. . Mitochondrial Pathways and Respiratory Control. , (2012).
- Steinlechner-Maran, R., Eberl, T., Kunc, M., Margreiter, R., Gnaiger, E. Oxygen dependence of respiration in coupled and uncoupled endothelial cells. The American Journal of Physiology. 271, C2053-C2061 (1996).
- Holt, W. V., Van Look, K. J. W. Concepts in sperm heterogeneity, sperm selection and sperm competition as biological foundations for laboratory tests of semen quality. Reproduction. 127 (5), 527-535 (2004).
- Sousa, A. P., et al. Not all sperm are equal: Functional mitochondria characterize a subpopulation of human sperm with better fertilization potential. PloS One. 6 (3), e18112 (2011).
- Moscatelli, N., et al. Single-cell-based evaluation of sperm progressive motility via fluorescent assessment of mitochondria membrane potential. Scientific Reports. 7, 17931 (2017).
- Ferreira, J. J., et al. Increased mitochondrial activity upon CatSper channel activation is required for mouse sperm capacitation. Redox Biology. 48, 102176 (2021).
- Irigoyen, P., et al. Mitochondrial metabolism determines the functional status of human sperm and correlates with semen parameters. Frontiers in Cell and Developmental Biology. 10, 926684 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados