Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Respirometría de alta resolución para evaluar la función mitocondrial en espermatozoides humanos
En este artículo
Resumen
El análisis de la función mitocondrial de los espermatozoides mediante respirometría de alta resolución permite medir el consumo de oxígeno de los espermatozoides que se mueven libremente en un sistema de cámara cerrada. La técnica se puede aplicar para medir la respiración en los espermatozoides humanos, lo que proporciona información sobre las características mitocondriales y la integridad de los espermatozoides.
Resumen
La calidad del semen a menudo se estudia mediante análisis de semen de rutina, que es descriptivo y a menudo no concluyente. La infertilidad masculina se asocia con una alteración de la actividad mitocondrial de los espermatozoides, por lo que la medición de la función mitocondrial de los espermatozoides es un indicador de la calidad del esperma. La respirometría de alta resolución es un método para medir el consumo de oxígeno de células o tejidos en un sistema de cámara cerrada. Esta técnica se puede implementar para medir la respiración en espermatozoides humanos y proporciona información sobre la calidad e integridad de las mitocondrias de los espermatozoides. La respirometría de alta resolución permite que las células se muevan libremente, lo que supone una ventaja a priori en el caso de los espermatozoides. Esta técnica se puede aplicar con espermatozoides intactos o permeabilizados y permite el estudio de la función mitocondrial de los espermatozoides intactos y la actividad de los complejos de cadenas respiratorias individuales. El instrumento oxígrafo de alta resolución utiliza sensores para medir la concentración de oxígeno junto con un software sensible para calcular el consumo de oxígeno. Los datos se utilizan para calcular los índices respiratorios en función de los índices de consumo de oxígeno. En consecuencia, los índices son las proporciones de dos tasas de consumo de oxígeno y se normalizan internamente al número de células o masa proteica. Los índices respiratorios son un indicador de la función y disfunción mitocondrial de los espermatozoides.
Introducción
Se estima que la infertilidad masculina representa entre el 40% y el 50% de todos los casos de infertilidad en las parejas1. El análisis de semen convencional juega un papel crucial en la determinación de la fertilidad masculina; sin embargo, aproximadamente el 15% de los hombres infértiles tienen parámetros espermatozoides normales2. Además, el análisis rutinario del semen proporciona información limitada sobre la función de los espermatozoides y no refleja defectos sutiles de los espermatozoides3.
Las mitocondrias de los espermatozoides tienen una estructura especial, ya que están dispuestas como una vaina helicoidal alrededor de los flagelos. La vaina mitocondrial contiene un número variable de mitocondrias conectadas por enlazadores intermitocondriales y ancladas al citoesqueleto mediante disposiciones proteicas ordenadas en la membrana mitocondrial externa 4,5. Esta estructura hace que sea particularmente difícil aislar las mitocondrias de los espermatozoides. Por lo tanto, la mayoría de los estudios de la función mitocondrial de los espermatozoides utilizan análisis in situ o espermatozoides desembranados6.
La estructura y función mitocondrial de los espermatozoides se ha relacionado consistentemente con la infertilidad masculina 7,8,9,10,11, lo que sugiere que el análisis de la estructura y función de estos orgánulos puede ser un buen candidato para su inclusión en el análisis de espermatozoides.
Las mitocondrias desempeñan un papel importante en el metabolismo energético celular, en particular mediante el uso de oxígeno para producir trifosfato de adenosina (ATP) a través de la fosforilación oxidativa (OXPHOS). En los espermatozoides, en particular, la fuente de ATP (glucólisis vs. OXPHOS) es discutida, y gran parte de los datos siguen siendo controvertidos y dependen de diferentes enfoques experimentales 4,12,13. Las mediciones de la respiración por oximetría ofrecen información significativa sobre la capacidad respiratoria mitocondrial, la integridad mitocondrial y el metabolismo energético de la célula14,15,16. Tradicionalmente, esta técnica se ha realizado utilizando el electrodo de oxígeno Clark, un instrumento que se ha utilizado para medir la respiración mitocondrial durante más de 50 años17,18. Además, se ha analizado el consumo de oxígeno mitocondrial de los espermatozoides utilizando el electrodo de oxígeno clásico de Clark 19,20,21. La respirometría de alta resolución (HRR) con oxígrafos (Oroboros) proporciona una mayor sensibilidad que con los dispositivos de respirometría clásicos22. Los oxígrafos están compuestos por dos cámaras con puertos de inyección, y cada cámara tiene un sensor polarográfico de oxígeno. Con esta técnica, es posible analizar portaobjetos de tejidos, células y suspensiones mitocondriales aisladas. La muestra se agita continuamente en la cámara y, durante el experimento, se mide el consumo de oxígeno y se calculan las tasas de oxígeno utilizando un software específico. Las cámaras muestran una fuga de oxígeno reducida, lo que es una ventaja sobre los dispositivos convencionales de electrodos de oxígeno14,23.
Al igual que ocurre con otras células, en el caso de los espermatozoides, la sensibilidad de los equipos de HRR es mayor que la de la respirometría convencional, por lo que los equipos de HRR pueden utilizarse para el análisis de un número limitado de espermatozoides intactos o permeabilizados. Existen dos estrategias principales para evaluar la función mitocondrial de los espermatozoides mediante HRR: (a) medir el consumo de oxígeno en células intactas, lo que implica reproducir la función respiratoria en un medio que contiene sustratos como la glucosa, o (b) medir el consumo de oxígeno en células permeabilizadas utilizando uno de los complejos OXPHOS, con la adición de sustratos específicos para monitorizar cada función por separado.
En el presente estudio, describimos el uso de HRR para determinar la respiración mitocondrial en espermatozoides humanos.
Protocolo
Los experimentos fueron aprobados por el Comité de Ética de la Facultad de Medicina de la Universidad de la República, Montevideo, Uruguay.
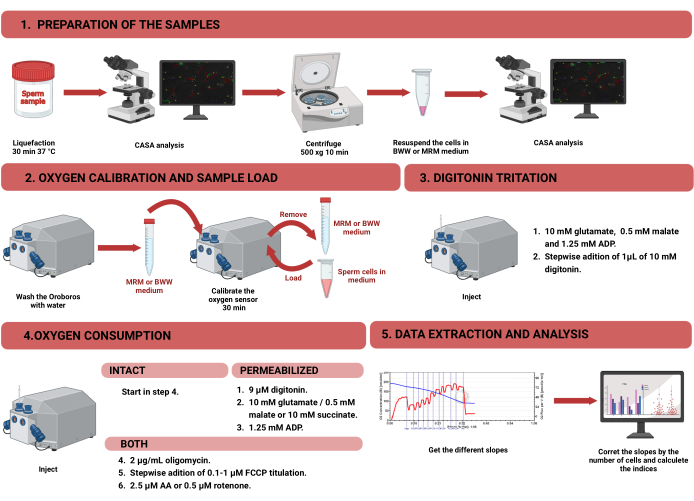
Figura 1: Flujo de trabajo para la respirometría de alta resolución para evaluar la función mitocondrial en espermatozoides humanos intactos y permeabilizados. El protocolo se dividió en cuatro pasos diferentes: 1) preparación de la muestra, 2) calibración de oxígeno en el instrumento Oroboros, 3) medición del consumo de oxígeno para células intactas y permeabilizadas, y 4) extracción de datos del equipo y análisis. Abreviaturas: CASA = análisis de espermatozoides asistido por computadora; BWW = Biggers Whitten Whittingham medio; MRM = medio respiratorio mitocondrial; ADP = difosfato de adenosina; FCCP = cianuro de carbonilo -p- trifluorometoxifenilhidrazona; AA = antimicina A. Haga clic aquí para ver una versión más grande de esta figura.
NOTA: El flujo de trabajo para medir el consumo de oxígeno en los espermatozoides mediante HRR se muestra en la Figura 1. La información sobre los materiales, equipos y reactivos utilizados en el protocolo se presenta en la Tabla de Materiales.
1. Preparación de la muestra
- Recogida de muestras
- Recoja semen humano recién eyaculado mediante masturbación después de una abstinencia recomendada de 3 días en un recipiente de plástico estéril. Transportar las muestras inmediatamente al laboratorio.
- Incubar las muestras durante 30-60 min a temperatura ambiente (RT) para licuarlas completamente24.
- Después de la licuefacción, almacenar las muestras a 37 °C hasta que comience el experimento.
- Evaluación de espermatozoides con análisis de espermatozoides asistido por ordenador (CASA)
- Mezcle la muestra y cargue 7 μL en una cámara de recuento de espermatozoides precalentada.
- Coloque la cámara en la platina precalentada (37 °C) de un microscopio de luz directa.
- Abra el software de análisis de espermatozoides computarizado e ingrese al módulo de motilidad y concentración (haga clic en Mot).
- Seleccione la configuración que corresponda a las condiciones de los espermatozoides humanos.
NOTA: La configuración debe adaptarse al tipo y profundidad de la cámara, así como a la especie de muestra y al sistema CASA. - Analice aleatoriamente 10 campos diferentes por cámara haciendo clic en el botón Analizar .
- Haga clic en Resultados para obtener la concentración y la motilidad de la muestra.
- Preparación celular
NOTA: Si el HRR no está calibrado, comience con los pasos 2.1-2.2 antes de preparar las celdas (paso 1.3). Es importante medir el consumo de oxígeno inmediatamente cuando los espermatozoides se resuspenden en el medio.- Centrifugar las muestras a 400 x g durante 10 min a RT.
- Extraer el plasma seminal y resuspender los espermatozoides en 2 ml de Biggers Whitten Whittingham (BWW) para experimentos con células intactas o medio de respiración mitocondrial (MRM) para estudios con células permeabilizadas. Las composiciones de los medios se muestran en la Tabla 1.
- Repita los pasos descritos en el paso 1.2 para los estudios de concentración de espermatozoides.
2. Respirometría de alta resolución: análisis OXPHOS
NOTA: HRR integra oxígrafos de alta sensibilidad (Oxygraph-2 K; Oroboros Instruments GmbH, Innsbruck, Austria) con software (DatLab, versión 4.2; Oroboros Instruments GmbH). Los datos experimentales se muestran como la concentración de oxígeno en función del tiempo (como pmol de O2/106 células·min−1) y como transformaciones en tiempo real de estos datos, lo que permite al experimentador realizar un seguimiento de la respiración (consumo de oxígeno, flujo de oxígeno) de muestras biológicas y bioquímicas mientras el experimento aún está en marcha. La HRR se puede utilizar para seguir la respiración de las células vivas y móviles, lo que es particularmente útil para los espermatozoides, cuya motilidad está asociada con la calidad del esperma y el potencial de fertilidad. El laboratorio utiliza un HRR Oroboros Oxygraph2-k, Oroboros Instruments, con dos cámaras. Los pasos descritos en este protocolo deben realizarse de forma independiente para ambas cámaras de 2 ml.
- Preparación del equipo
- Encienda el HRR y conéctelo al software de respirometría (DatLab) para la adquisición y el análisis de datos.
- Reemplace el etanol al 70% en la cámara del oxígrafo con ddH2O. Remuévalo continuamente con la barra de agitación magnética en la cámara a 750 rpm. Déjalo reposar durante 10 minutos y luego aspira el H2O de doble destilación (dd).
- Lave la cámara tres veces con ddH2O durante 5 minutos cada vez.
NOTA: Este paso es necesario para eliminar el etanol restante de las cámaras. Los espermatozoides son muy sensibles al etanol. La grabación podría verse comprometida si se omite este paso.
- Calibración de los sensores de oxígeno
NOTA: El procedimiento de calibración varía ligeramente según el instrumento. Realice una calibración de aire del sensor polarográfico de oxígeno como lo describe el fabricante25. En esta sección, se explica brevemente el protocolo de calibración.- Retire el ddH 2 O y pipetee2ml del mismo medio utilizado para la preparación celular en la cámara. Coloque los tapones, dejando una burbuja de intercambio de aire.
NOTA: Es importante conocer el volumen de la cámara para determinar el volumen exacto de medio necesario. - Registre los valores de calibración de oxígeno (haga clic en Layout > 01 Calibration Exp. Gr3-Temp) para controlar el rendimiento de la membrana del sensor agitando el medio con la barra de agitación a 750 rpm durante al menos 30 minutos a 37 °C. Utilice los otros ajustes mencionados: ganancia para el sensor: 2; voltaje de polarización: 800 mV; Intervalo de registro de datos: 2,0 s.
NOTA: Se espera obtener una pendiente de O 2 no corregida (línea roja) dentro de ±2 pmol∙s−1∙mL−1 con una señal estable del sensor polarográfico. - Arrastre el ratón mientras mantiene pulsado el botón izquierdo del ratón y la tecla Mayús para seleccionar un área en la que el cambio en la concentración de oxígeno (Concentración de O2 Y1, línea azul) sea estable.
- Abra la ventana Calibración de Ø2 (haga clic en Oxígrafo > Calibración de O2). En Calibración de aire, cambie la marca seleccionada a la región seleccionada en el paso 2.2.3. Termine haciendo clic en Calibrar y copiar al portapapeles.
- Detenga la grabación y guárdela haciendo clic en Oxygraph > Ok Control > Guardar y Desconectar.
NOTA: Este conjunto de datos debe guardarse para que se pueda utilizar en todos los experimentos del día. La calibración solo se realiza una vez al día para cada medio.
- Retire el ddH 2 O y pipetee2ml del mismo medio utilizado para la preparación celular en la cámara. Coloque los tapones, dejando una burbuja de intercambio de aire.
- Valoración de la permeabilización de la digitonina
- Abra la cámara y aspire el medio en el interior.
- Cargue en la cámara al menos 24 x 10 6 y no más de 70 x 106 espermatozoides en un volumen final de 2 ml de MRM.
NOTA: Es importante medir el número de células en la cámara para ajustar el consumo de oxígeno al final del experimento. No se puede medir un número de celdas inferior al recomendado. - Cierre la cámara empujando los tapones hasta el fondo y aspire el líquido restante en la parte superior. Inicie el experimento con los mismos ajustes que para la calibración: velocidad de agitación: 750 rpm; temperatura: 37 °C; ganancia para el sensor: 2; voltaje de polarización: 800 mV; e intervalo de registro de datos: 2,0 s.
- Para cargar la calibración, haga doble clic en el cuadro Pos Calib en la esquina inferior. Abra la calibración realizada en el paso 2.2 (haga clic en Oxígrafo > Calibración de O2 > Copiar desde archivo) y haga clic en Calibrar y copiar al portapapeles.
NOTA: La caja POS Calib cambiará de amarillo a verde. Los datos se muestran en gráficos de flujo de oxígeno corregido por volumen (Diseño 05 Flujo por volumen sin corregir). Hay diferentes diseños disponibles en Oxygraph > Layout. - Añadir 5 μL de difosfato de adenosina (ADP) 0,5 M, 10 μL de glutamato 2 M y 2,5 μL de malato 0,4 M (concentraciones finales: 1,25 mM, 10 mM y 0,5 mM). Mida el consumo de oxígeno hasta que la señal se estabilice.
NOTA: Las microjeringas Hamilton de precisión se utilizan para la inyección a través del puerto de carga en el tapón. Use una jeringa por medicamento para evitar la contaminación cruzada. Haga clic en F4 para registrarse y marque en el registro de oxígeno cuando se agregue un tratamiento.
NOTA: Los sustratos se preparan en agua ultrapura y se almacenan a -20 °C durante 3 meses. - Tritato añadiendo 1 μL de 10 mM de digitonina en pasos sucesivos hasta que el consumo de oxígeno alcance un nivel máximo.
NOTA: El lavado a fondo con agua, 70% de etanol y 100% de etanol es esencial si se utiliza la misma cámara para dos experimentos en el mismo día.
NOTA: La digitonina se prepara en agua ultrapura y se almacena a -20 °C durante 3 meses.
- Protocolo de valoración respiratoria rutinaria de espermatozoides intactos y permeabilizados (complejo I o complejo II)
- Abra la cámara y aspire el medio en el interior.
- Cargue en la cámara al menos 24 x 10 6 y no más de 70 x 106 espermatozoides en un volumen final de 2 ml de BWW (análisis de células intactas) o MRM (análisis de células permeabilizadas).
- Inicie el experimento con la misma configuración que para la calibración (esto se describe en el paso 2.3.3).
- Cargue la calibración realizada en el paso 2.2 como se describe en el paso 2.3.4.
- Registre la respiración de las células durante al menos 5 minutos hasta obtener una señal estable. Esta medida corresponde a la respiración basal en células intactas.
- Si el experimento es con células intactas, continúe con el paso 2.4.9. Para células permeabilizadas, inyectar 4,5 μL de digitonina 10 mM (concentración final: 22,5 μM). Permeabilizar las células durante 5 min.
- Añadir los sustratos: 10 μL de glutamato 2 M y 2,5 μL de malato 0,4 M (concentraciones finales: 10 mM y 0,5 mM, respectivamente) para el complejo I o 20 μL de succinato 1 M (concentración final: 10 mM) para el complejo II. Mida el consumo de oxígeno hasta que la señal aumente y se estabilice. Este es el estado 4, que significa respiración apoyada por el complejo basal I o el complejo basal II en ausencia de ADP.
NOTA: Los sustratos se preparan en agua ultrapura y se almacenan a -20 °C durante 3 meses. - Inyectar 5 μL de 0,5 M de ADP (concentración final: 1,25 mM). Mida el consumo de oxígeno hasta que la señal aumente y se estabilice. La adición de ADP aumenta la señal correspondiente al consumo máximo de oxígeno a través del complejo I o del complejo II (estado 3, en células permeabilizadas).
- Añadir 1 μL de 4 mg/mL de oligomicina (concentración final: 2 μg/mL), un inhibidor de la ATP sintetasa. Mida el consumo de oxígeno hasta que la señal disminuya y se estabilice.
NOTA: La oligomicina se prepara en etanol y se almacena a -20 °C durante 3 meses. - Valorar añadiendo 1 μL de 0,1 mM a 1 mM de cianuro de carbonilo-P-trifluorometoxi-fenilhidrazona (FCCP) en pasos sucesivos hasta alcanzar una tasa respiratoria desacoplada máxima. Mida el consumo de oxígeno hasta que la señal aumente y se estabilice.
NOTA: El FCCP se prepara en etanol y se almacena a -20 °C durante 3 meses. - La concentración final de FCCP depende de la muestra. Deje de inyectarse la droga cuando el consumo de oxígeno comience a disminuir.
- Por último, inyectar 1 μL de 5 mM de antimicina A (concentración final de 2,5 μM). Se trata de un inhibidor del complejo III para discriminar entre el consumo de oxígeno mitocondrial y residual (respiración no mitocondrial). Para el análisis del complejo I, añadir 1 μL de 1 mM de rotenona (0,5 μM de concentración final), un inhibidor de este complejo, en lugar de AA. Mida el consumo de oxígeno hasta que la señal disminuya y se estabilice.
NOTA: Los medicamentos se preparan en etanol y se almacenan a -20 °C durante 3 meses.
3. Extracción y análisis de datos
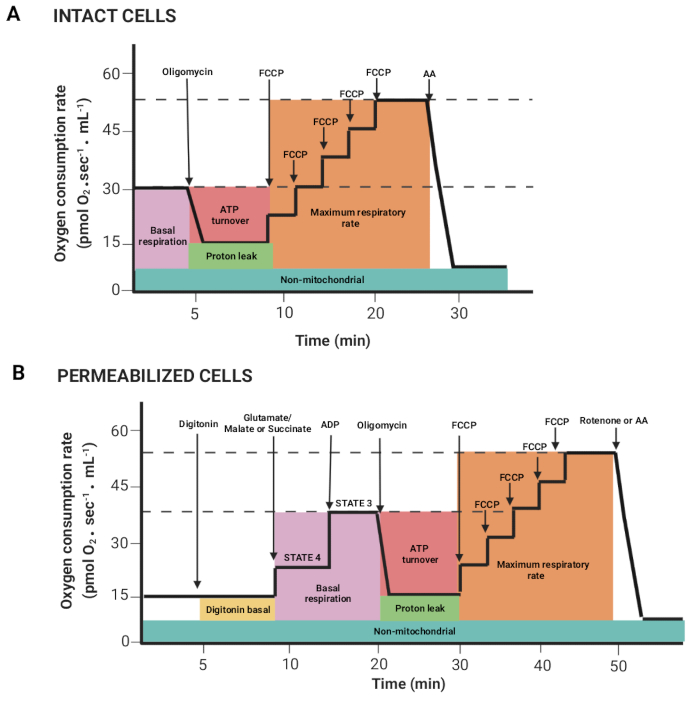
Figura 2: Adquisición de parámetros respiratorios a partir de un experimento de respirometría de alta resolución. (A,B) Representaciones esquemáticas de los gráficos obtenidos, como se describe en la Figura 1, para células intactas y permeabilizadas, respectivamente. Estos parámetros han sido descritos previamente15. Haga clic aquí para ver una versión más grande de esta figura.
- Arrastre el ratón pulsando el botón izquierdo del ratón y la tecla Mayús para seleccionar las regiones en las que el flujo de oxígeno por volumen correlacionado (pendiente Y2 O2, línea roja) es estable después de la inyección de un sustrato o inhibidor. En la Figura 2 se muestran los diferentes parámetros obtenidos del registro anteriormente descrito15.
NOTA: Los parámetros dependen del experimento; todos ellos son los siguientes: respiración basal en células intactas y respiración en presencia de glutamato/malato o succinato (estado 4), ADP (estado 3), oligomicina (fuga de protones), FCCP (frecuencia respiratoria máxima), rotenona/AA (respiración no mitocondrial). En las células permeabilizadas, la respiración basal corresponde al estado 3. - Haga clic en las ventanas Marcas > Estadísticas y exporte los datos.
- Normalizar los datos obtenidos por 1 millón de espermatozoides. Las unidades de las pendientes son pmolO2·s−1·mL−1·10−6 células.
- Reste el consumo de oxígeno no mitocondrial de todos los valores antes de calcular los índices.
- Calcule los índices utilizando las diversas ecuaciones descritas anteriormente15:

Resultados
Determinación de la concentración óptima de digitonina en los espermatozoides
En este protocolo, presentamos el uso de HRR para monitorizar en tiempo real los cambios en OXPHOS en espermatozoides humanos. Dado que el método se puede utilizar para analizar espermatozoides intactos o permeabilizados con digitonina, primero presentamos la estandarización de la concentración de digitonina necesaria para permeabilizar los espermatozoides (Figura 3).
Discusión
La HRR depende críticamente de varios pasos: (a) el mantenimiento del equipo, (b) la calibración precisa de los sensores de oxígeno, (c) la valoración del desacoplador26 y, finalmente, (d) el uso adecuado de índices representativos de la función mitocondrial. El mantenimiento del equipo es crucial. Se recomienda reemplazar las membranas del sensor polarográfico de oxígeno con regularidad y corregir el fondo instrumental. El lavado exhaustivo después de la recolección de espermatozoides d...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Queremos agradecer a la clínica de Andrología Fertilab, especialmente a José María Montes y Andrea Torrents, por permitirnos el acceso a los donantes. Financiamiento: A.C. cuenta con el apoyo de becas de la Universidad de la República (CSIC_2018, Espacio Interdisciplinario_2021). Se obtuvo financiamiento adicional del Programa de Desarrollo de Ciencias Básicas (PEDECIBA, Uruguay). P.I. y R.S. cuentan con el apoyo de la Universidad de la República (I+D, CSIC 2014; I+D, CSIC 2016, Iniciación a la Investigación, CSIC 2019 y FMV_1_2017_1_136490 ANII- Uruguay). P.I. cuenta con el apoyo de POS_FMV_2018_1_1007814 y CAP-UDELAR 2020. Las figuras se ilustraron con Biorender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| Acid free- Bovine serum albumine | Sigma Aldrich | A8806 | |
| Adenosine 5'-diphosphate monopotassium salt dihydrate | Sigma Aldrich | A5285 | |
| Animycin A from streptomyces sp. | Sigma Aldrich | A8674 | |
| Calcium chloride | Sigma Aldrich | C4901 | |
| carbonyl cyanide-P- trifluoromethoxy-phenylhydrazone | Sigma Aldrich | C2920 | |
| DatLab sofware version 4,2 | Oroboros Instruments GmbH | N/A | |
| D-glucose | Sigma Aldrich | G7021 | |
| Digitonin | Sigma Aldrich | D141 | |
| EGTA | Sigma Aldrich | E4378 | |
| HEPES | Sigma Aldrich | H3375 | |
| L glutamic acid | Sigma Aldrich | G1251 | |
| L malic acid | Sigma Aldrich | M1000 | |
| Magnesium sulphate | Sigma Aldrich | M7506 | |
| Microliter Syringes | Hamilton | 87900 or 80400 | |
| Microscope camera | Basler | acA780-75gc | |
| Microscope Eclipse E200 with phase contrast 10X Ph+ | Nikon | N/A | |
| Monopotassium phosphate | Sigma Aldrich | P5655 | |
| MOPS | Sigma Aldrich | M1254 | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Oxygraph-2 K | Oroboros Instruments GmbH | N/A | |
| Potassium chloride | Sigma Aldrich | P3911 | |
| Power O2k-Respirometer | Oroboros Intruments | 10033-01 | |
| Rotenone | Sigma Aldrich | R8875 | |
| Saccharose | Sigma Aldrich | S0389 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium lactate | Sigma Aldrich | L7022 | |
| Sodium pyruvate | Sigma Aldrich | P2256 | |
| Sperm class analyzer 6.3.0.59 Evolution-SCA Research | Microptic | N/A | |
| Sperm Counting Chamber DRM-600 | Millennium Sciences CELL-VU | N/A | |
| Succinate disodium salt | Sigma Aldrich | W327700 |
Referencias
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13, 37 (2015).
- Guzick, D. S., et al. Sperm morphology, motility, and concentration in fertile and infertile men. The New England Journal of Medicine. 345 (19), 1388-1393 (2001).
- Wang, C., Swerdloff, R. S. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertility and Sterility. 102 (6), 1502-1507 (2014).
- Amaral, A. Energy metabolism in mammalian sperm motility. WIREs Mechanisms of Disease. 14 (5), e1569 (2022).
- Leung, M. R., et al. In-cell structures of conserved supramolecular protein arrays at the mitochondria-cytoskeleton interface in mammalian sperm. Proceedings of the National Academy of Sciences of the United States of America. 118 (45), e2110996118 (2021).
- Moraes, C. R., Meyers, S. The sperm mitochondrion: Organelle of many functions. Animal Reproduction Science. 194, 71-80 (2018).
- Cassina, A., et al. Defective human sperm cells are associated with mitochondrial dysfunction and oxidant production. Biology of Reproduction. 93 (5), 119 (2015).
- Marchetti, C., Obert, G., Deffosez, A., Formstecher, P., Marchetti, P. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm. Human Reproduction. 17 (5), 1257-1265 (2002).
- Amaral, A., Lourenço, B., Marques, M., Ramalho-Santos, J. Mitochondria functionality and sperm quality. Reproduction. 146 (5), R163-R174 (2013).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), e13666 (2021).
- Uribe, P., et al. Use of the fluorescent dye tetramethylrhodamine methyl ester perchlorate for mitochondrial membrane potential assessment in human spermatozoa. Andrologia. 49 (9), e12753 (2017).
- Storey, B. T. Mammalian sperm metabolism: Oxygen and sugar, friend and foe. The International Journal of Developmental Biology. 52 (5-6), 427-437 (2008).
- Tourmente, M., Sansegundo, E., Rial, E., Roldan, E. R. S. Capacitation promotes a shift in energy metabolism in murine sperm. Frontiers in Cell and Developmental Biology. 10, 950979 (2022).
- Gnaiger, E., Dykens, J. A., Will, Y. Chapter 12 - Polarographic oxygen sensors, the oxygraph, and high-resolution respirometry to assess mitochondrial function. Drug-Induced Mitochondrial Dysfunction. , 325-352 (2008).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Awadhpersad, R., Jackson, C. B. High-resolution respirometry to assess bioenergetics in cells and tissues using chamber- and plate-based respirometers. Journal of Visualized Experiments: JoVE. (176), e63000 (2021).
- Chance, B., Williams, G. R. A simple and rapid assay of oxidative phosphorylation. Nature. 175 (4469), 1120-1121 (1955).
- Li, Z., Graham, B. H. Measurement of mitochondrial oxygen consumption using a Clark electrode. Methods in Molecular Biology. 837, 63-72 (2012).
- Stendardi, A., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. International Journal of Andrology. 34 (3), 247-255 (2011).
- Ferramosca, A., Focarelli, R., Piomboni, P., Coppola, L., Zara, V. Oxygen uptake by mitochondria in demembranated human spermatozoa: A reliable tool for the evaluation of sperm respiratory efficiency. International Journal of Andrology. 31 (3), 337-345 (2008).
- Ferramosca, A., et al. Modulation of human sperm mitochondrial respiration efficiency by plant polyphenols. Antioxidants. 10 (2), 217 (2021).
- Gnaiger, E., Steinlechner-Maran, R., Méndez, G., Eberl, T., Margreiter, R. Control of mitochondrial and cellular respiration by oxygen. Journal of Bioenergetics and Biomembranes. 27 (6), 583-596 (1995).
- . O2k Quality Control 1: Polarographic oxygen sensors and accuracy of calibration Available from: https://www.bioblst.at/images/archive/7/77/20210819114548%21MiPNet06.03_POS-Calibration-SOP.pdf (2020)
- WHO Laboratory Manual for the Examination and Processing of Human Semen. World Health Organization Available from: https://www.who.int/publications/i/item/9789240030787 (2010)
- . O2k-protocols SOP: O2k quality control 1 Available from: https://www.bioblast.at/images/9/9c/MiPNet06.03_POS-Calibration-SOP_DatLab8.pdf (2021)
- Gnaiger, E. . Mitochondrial Pathways and Respiratory Control. , (2012).
- Steinlechner-Maran, R., Eberl, T., Kunc, M., Margreiter, R., Gnaiger, E. Oxygen dependence of respiration in coupled and uncoupled endothelial cells. The American Journal of Physiology. 271, C2053-C2061 (1996).
- Holt, W. V., Van Look, K. J. W. Concepts in sperm heterogeneity, sperm selection and sperm competition as biological foundations for laboratory tests of semen quality. Reproduction. 127 (5), 527-535 (2004).
- Sousa, A. P., et al. Not all sperm are equal: Functional mitochondria characterize a subpopulation of human sperm with better fertilization potential. PloS One. 6 (3), e18112 (2011).
- Moscatelli, N., et al. Single-cell-based evaluation of sperm progressive motility via fluorescent assessment of mitochondria membrane potential. Scientific Reports. 7, 17931 (2017).
- Ferreira, J. J., et al. Increased mitochondrial activity upon CatSper channel activation is required for mouse sperm capacitation. Redox Biology. 48, 102176 (2021).
- Irigoyen, P., et al. Mitochondrial metabolism determines the functional status of human sperm and correlates with semen parameters. Frontiers in Cell and Developmental Biology. 10, 926684 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados