Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Respirométrie à haute résolution pour évaluer la fonction mitochondriale chez les spermatozoïdes humains
Dans cet article
Résumé
L’analyse de la fonction mitochondriale des spermatozoïdes par respirométrie à haute résolution permet de mesurer la consommation d’oxygène des spermatozoïdes se déplaçant librement dans un système à chambre fermée. La technique peut être appliquée pour mesurer la respiration dans les spermatozoïdes humains, ce qui fournit des informations sur les caractéristiques et l’intégrité mitochondriales des spermatozoïdes.
Résumé
La qualité du sperme est souvent étudiée par une analyse de routine du sperme, qui est descriptive et souvent peu concluante. L’infertilité masculine est associée à une altération de l’activité mitochondriale des spermatozoïdes, de sorte que la mesure de la fonction mitochondriale des spermatozoïdes est un indicateur de la qualité du sperme. La respirométrie à haute résolution est une méthode de mesure de la consommation d’oxygène des cellules ou des tissus dans un système à chambre fermée. Cette technique peut être mise en œuvre pour mesurer la respiration dans les spermatozoïdes humains et fournit des informations sur la qualité et l’intégrité des mitochondries des spermatozoïdes. La respirométrie à haute résolution permet aux cellules de se déplacer librement, ce qui est un avantage a priori dans le cas des spermatozoïdes. Cette technique peut être appliquée avec des spermatozoïdes intacts ou perméabilisés et permet d’étudier la fonction mitochondriale intacte des spermatozoïdes et l’activité des complexes de chaînes respiratoires individuels. L’instrument oxygraphe haute résolution utilise des capteurs pour mesurer la concentration d’oxygène couplés à un logiciel sensible pour calculer la consommation d’oxygène. Les données sont utilisées pour calculer les indices respiratoires en fonction des ratios de consommation d’oxygène. Par conséquent, les indices sont les proportions de deux taux de consommation d’oxygène et sont normalisés en interne au nombre de cellules ou à la masse protéique. Les indices respiratoires sont un indicateur de la fonction et du dysfonctionnement des mitochondries des spermatozoïdes.
Introduction
On estime que l’infertilité masculine représente 40 à 50 % de tous les cas d’infertilité chez les couples1. L’analyse conventionnelle du sperme joue un rôle crucial dans la détermination de la fertilité masculine ; Cependant, environ 15 % des hommes infertiles ont des paramètres de sperme normaux2. De plus, l’analyse de routine du sperme fournit des informations limitées sur la fonction des spermatozoïdes et ne reflète pas les défauts subtils des spermatozoïdes3.
Les mitochondries des spermatozoïdes ont une structure particulière, car elles sont disposées comme une gaine hélicoïdale autour des flagelles. La gaine mitochondriale contient un nombre variable de mitochondries reliées par des liants intermitochondriaux et ancrées au cytosquelette par des arrangements protéiques ordonnés sur la membrane mitochondriale externe 4,5. Cette structure rend particulièrement difficile l’isolement des mitochondries des spermatozoïdes. Par conséquent, la plupart des études sur la fonction mitochondriale des spermatozoïdes utilisent des analyses in situ ou des spermatozoïdes démembranés6.
La structure et la fonction mitochondriales des spermatozoïdes ont été systématiquement liées à l’infertilité masculine 7,8,9,10,11, ce qui suggère que l’analyse de la structure et de la fonction de ces organites peut être un bon candidat pour l’inclusion dans l’analyse du sperme.
Les mitochondries jouent un rôle important dans le métabolisme énergétique cellulaire, notamment en utilisant l’oxygène pour produire de l’adénosine triphosphate (ATP) par phosphorylation oxydative (OXPHOS). Chez les spermatozoïdes, en particulier, la source de l’ATP (glycolyse vs. OXPHOS) est contestée, et une grande partie des données reste controversée et dépend de différentes approches expérimentales 4,12,13. Les mesures de la respiration par oxymétrie offrent des informations significatives sur la capacité respiratoire mitochondriale, l’intégrité mitochondriale et le métabolisme énergétique de la cellule14,15,16. Traditionnellement, cette technique a été réalisée à l’aide de l’électrode à oxygène de Clark, un instrument utilisé pour mesurer la respiration mitochondriale depuis plus de 50 ans17,18. De plus, la consommation d’oxygène mitochondrial des spermatozoïdes a été analysée à l’aide de l’électrode à oxygène Clark classique 19,20,21. La respirométrie à haute résolution (HRR) à l’aide d’oxygraphes (Oroboros) offre une sensibilité plus élevée que l’utilisation d’appareils de respirométrie classiques22. Les oxygraphes sont composés de deux chambres avec orifices d’injection, et chaque chambre dispose d’un capteur d’oxygène polarographique. Avec cette technique, il est possible d’analyser des lames de tissus, des cellules et des suspensions mitochondriales isolées. L’échantillon est agité en continu dans la chambre, et pendant l’expérience, la consommation d’oxygène est mesurée et les taux d’oxygène sont calculés à l’aide d’un logiciel spécifique. Les chambres présentent une réduction des fuites d’oxygène, ce qui constitue un avantage par rapport aux électrodes d’oxygène conventionnelles14,23.
Comme pour les autres cellules, dans le cas des spermatozoïdes, la sensibilité de l’équipement HRR est plus élevée que celle de la respirométrie conventionnelle, ce qui signifie que l’équipement HRR peut être utilisé pour l’analyse d’un nombre limité de spermatozoïdes intacts ou perméabilisés. Il existe deux stratégies principales pour évaluer la fonction mitochondriale des spermatozoïdes par HRR : (a) mesurer la consommation d’oxygène dans les cellules intactes, ce qui implique de reproduire la fonction respiratoire dans un milieu contenant des substrats tels que le glucose, ou (b) mesurer la consommation d’oxygène dans les cellules perméabilisées à l’aide de l’un des complexes OXPHOS, avec l’ajout de substrats spécifiques pour surveiller chaque fonction séparément.
Dans la présente étude, nous décrivons l’utilisation de la HRR pour déterminer la respiration mitochondriale dans les spermatozoïdes humains.
Protocole
Les expériences ont été approuvées par le Comité d’éthique de la Faculté de médecine de l’Université de la République de Montevideo, en Uruguay.
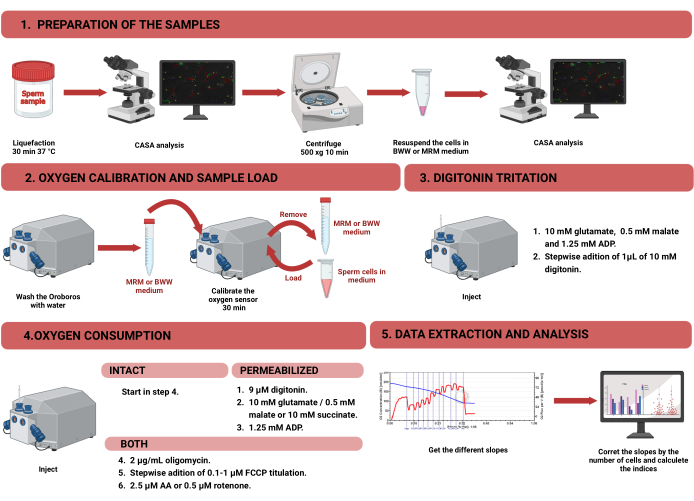
Figure 1 : Flux de travail pour la respirométrie à haute résolution afin d’évaluer la fonction mitochondriale dans les spermatozoïdes humains intacts et perméabilisés. Le protocole a été divisé en quatre étapes différentes : 1) la préparation de l’échantillon, 2) l’étalonnage de l’oxygène dans l’instrument Oroboros, 3) la mesure de la consommation d’oxygène pour les cellules intactes et perméabilisées, et 4) l’extraction des données de l’équipement et l’analyse. Abréviations : CASA = analyse de sperme assistée par ordinateur ; BWW = Biggers Whitten Whittingham moyen ; MRM = milieu respiratoire mitochondrial ; ADP = adénosine diphosphate ; FCCP = cyanure de carbonyle -p- trifluorométhoxyphénylhydrazone ; AA = antimycine A. Veuillez cliquer ici pour voir une version agrandie de cette figure.
REMARQUE : Le flux de travail pour mesurer la consommation d’oxygène dans les spermatozoïdes à l’aide de la HRR est illustré à la figure 1. Des informations sur les matériaux, l’équipement et les réactifs utilisés dans le protocole sont présentées dans le tableau des matériaux.
1. Préparation de l’échantillon
- Prélèvement d’échantillons
- Recueillir le sperme humain fraîchement éjaculé par masturbation après une abstinence recommandée de 3 jours dans un récipient en plastique stérile. Transportez immédiatement les échantillons au laboratoire.
- Incuber les échantillons pendant 30 à 60 minutes à température ambiante (RT) pour qu’ils se liquéfient complètement24.
- Après liquéfaction, conserver les échantillons à 37 °C jusqu’au début de l’expérience.
- Évaluation des spermatozoïdes avec analyse assistée par ordinateur (CASA)
- Mélangez l’échantillon et chargez 7 μL dans une chambre de comptage des spermatozoïdes préchauffée.
- Placez la chambre sur la platine préchauffée (37 °C) d’un microscope à lumière directe.
- Ouvrez le logiciel informatisé d’analyse des spermatozoïdes et entrez dans le module de motilité et de concentration (cliquez sur Mot).
- Sélectionnez la configuration qui correspond aux conditions du sperme humain.
REMARQUE : La configuration doit être adaptée au type et à la profondeur de la chambre ainsi qu’à l’espèce d’échantillon et au système CASA. - Analysez au hasard 10 champs différents par chambre en cliquant sur le bouton Analyser .
- Cliquez sur Résultats pour obtenir la concentration et la motilité de l’échantillon.
- Préparation des cellules
REMARQUE : Si le HRR n’est pas calibré, commencez par les étapes 2.1-2.2 avant de préparer les cellules (étape 1.3). Il est important de mesurer la consommation d’oxygène immédiatement lorsque les spermatozoïdes sont remis en suspension dans le milieu.- Centrifuger les échantillons à 400 x g pendant 10 min à RT.
- Retirer le plasma séminal et remettre les spermatozoïdes en suspension dans 2 mL de Biggers Whitten Whittingham (BWW) pour des expériences avec des cellules intactes ou un milieu respiratoire mitochondrial (MRM) pour des études avec des cellules perméabilisées. Les compositions des médias sont présentées dans le tableau 1.
- Répétez les étapes décrites à l’étape 1.2 pour les études de concentration de spermatozoïdes.
2. Respirométrie à haute résolution : analyse OXPHOS
REMARQUE : HRR intègre des oxygraphes très sensibles (Oxygraph-2 K ; Oroboros Instruments GmbH, Innsbruck, Autriche) avec logiciel (DatLab, version 4.2 ; Oroboros Instruments GmbH). Les données expérimentales sont affichées sous forme de concentration d’oxygène en fonction du temps (en pmol de O2/106 cellules·min−1) et sous forme de transformations en temps réel de ces données, ce qui permet à l’expérimentateur de suivre la respiration (consommation d’oxygène, flux d’oxygène) d’échantillons biologiques et biochimiques pendant que l’expérience est toujours en cours. La HRR peut être utilisée pour suivre la respiration des cellules vivantes et mobiles, ce qui est particulièrement utile pour les spermatozoïdes, dont la motilité est associée à la qualité des spermatozoïdes et au potentiel de fertilité. Le laboratoire utilise un HRR Oroboros Oxygraph2-k, Oroboros Instruments, avec deux chambres. Les étapes décrites dans ce protocole doivent être effectuées indépendamment pour les deux chambres de 2 mL.
- Préparation de l’équipement
- Allumez le HRR et connectez-le au logiciel de respirométrie (DatLab) pour l’acquisition et l’analyse des données.
- Remplacez l’éthanol à 70 % dans la chambre de l’oxygraphe par du ddH2O. Remuez-le continuellement avec la barre d’agitation magnétique dans la chambre à 750 tr/min. Laisser reposer pendant 10 min, puis aspirer le H2O doublement distillé (dd).
- Lavez la chambre trois fois avec du ddH2O pendant 5 min à chaque fois.
REMARQUE : Cette étape est nécessaire pour retirer l’éthanol restant des chambres. Les spermatozoïdes sont très sensibles à l’éthanol. L’enregistrement pourrait être compromis si cette étape est omise.
- Calibrage des capteurs d’oxygène
REMARQUE : La procédure d’étalonnage varie légèrement en fonction de l’instrument. Effectuez un étalonnage de l’air du capteur d’oxygène polarographique tel que décrit par le fabricant25. Dans cette section, le protocole d’étalonnage est brièvement expliqué.- Retirez le ddH 2 O et pipetez2mL du même milieu que celui utilisé pour la préparation des cellules dans la chambre. Placez les bouchons en laissant une bulle d’échange d’air.
REMARQUE : Il est important de connaître le volume de la chambre pour déterminer le volume exact de fluide nécessaire. - Enregistrez les valeurs d’étalonnage de l’oxygène (cliquez sur Layout > 01 Calibration Exp. Gr3-Temp) pour surveiller les performances de la membrane du capteur en agitant le fluide avec la barre d’agitation à 750 tr/min pendant au moins 30 min à 37 °C. Utilisez les autres réglages mentionnés : gain pour le capteur : 2 ; tension de polarisation : 800 mV ; Intervalle d’enregistrement des données : 2,0 s.
NOTA : On s’attend à obtenir une pente de O 2 non corrigée (ligne rouge) à moins de ±2 pmol∙s−1∙mL−1 avec un signal stable du capteur polarographique. - Faites glisser la souris tout en maintenant le bouton gauche de la souris et la touche Maj enfoncés pour sélectionner une zone où le changement de concentration en oxygène (Concentration Y1 O2, ligne bleue) est stable.
- Ouvrez la fenêtre O2 Calibration (cliquez sur Oxygraph > O2 Calibration). Dans Étalonnage de l’air, remplacez le repère sélectionné par la région sélectionnée à l’étape 2.2.3. Terminez en cliquant sur Calibrer et Copier dans le presse-papiers.
- Arrêtez l’enregistrement et enregistrez en cliquant sur Oxygraph > Ok Control > Enregistrer et déconnecter.
REMARQUE : Ce jeu de données doit être enregistré afin de pouvoir être utilisé dans toutes les expériences de la journée. L’étalonnage n’est effectué qu’une fois par jour pour chaque milieu.
- Retirez le ddH 2 O et pipetez2mL du même milieu que celui utilisé pour la préparation des cellules dans la chambre. Placez les bouchons en laissant une bulle d’échange d’air.
- Titrage par perméabilisation à la digitonine
- Ouvrez la chambre et aspirez le milieu à l’intérieur.
- Charger dans la chambre au moins 24 x 10 6 et pas plus de 70 x 106 spermatozoïdes dans un volume final de 2 mL de MRM.
REMARQUE : Il est important de mesurer le nombre de cellules dans la chambre afin d’ajuster la consommation d’oxygène à la fin de l’expérience. Un nombre de cellules inférieur à celui recommandé ne peut pas être mesuré. - Fermez la chambre en poussant les bouchons à fond et aspirez le liquide restant par le haut. Commencer l’expérience avec les mêmes réglages que pour l’étalonnage : vitesse d’agitation : 750 tr/min ; température : 37 °C ; gain pour le capteur : 2 ; tension de polarisation : 800 mV ; et intervalle d’enregistrement des données : 2,0 s.
- Pour charger l’étalonnage, double-cliquez sur la case Pos Calib dans le coin inférieur. Ouvrez l’étalonnage effectué à l’étape 2.2 (cliquez sur Oxygraph > O2 Calibration > Copier à partir d’un fichier), puis cliquez sur Calibrer et Copier dans le presse-papiers.
REMARQUE : La boîte POS Calib passera du jaune au vert. Les données sont affichées dans des graphiques de débit d’oxygène corrigé par volume (Schéma 05 Flux par volume non corrigé). Différentes mises en page sont disponibles dans Oxygraph > Layout. - Ajouter 5 μL d’adénosine diphosphate (ADP) à 0,5 M, 10 μL de glutamate à 2 M et 2,5 μL de malate à 0,4 M (concentrations finales : 1,25 mM, 10 mM et 0,5 mM). Mesurez la consommation d’oxygène jusqu’à ce que le signal se stabilise.
REMARQUE : Les micro-seringues Hamilton de précision sont utilisées pour l’injection à travers l’orifice de chargement dans le bouchon. Utilisez une seringue par médicament pour éviter la contamination croisée. Cliquez sur F4 pour vous inscrire, et marquez dans le registre de l’oxygène lorsqu’un traitement est ajouté.
REMARQUE : Les substrats sont préparés dans de l’eau ultra-pure et stockés à −20 °C pendant 3 mois. - Tritate en ajoutant 1 μL de digitonine de 10 mM par étapes successives jusqu’à ce que la consommation d’oxygène atteigne un niveau maximal.
REMARQUE : Un lavage minutieux avec de l’eau, de l’éthanol à 70 % et de l’éthanol à 100 % est essentiel si la même chambre est utilisée pour deux expériences le même jour.
REMARQUE : La digatonine est préparée dans de l’eau ultra-pure et stockée à −20 °C pendant 3 mois.
- Protocole d’évaluation respiratoire de routine pour les spermatozoïdes intacts et perméabilisés (complexe I ou complexe II)
- Ouvrez la chambre et aspirez le milieu à l’intérieur.
- Charger dans la chambre au moins 24 x 10 6 et pas plus de 70 x 106 spermatozoïdes dans un volume final de 2 mL de BWW (analyse de cellules intactes) ou MRM (analyse de cellules perméabilisées).
- Démarrez l’expérience avec les mêmes paramètres que pour l’étalonnage (ceci est décrit à l’étape 2.3.3).
- Chargez l’étalonnage effectué à l’étape 2.2 comme décrit à l’étape 2.3.4.
- Enregistrez la respiration des cellules pendant au moins 5 min jusqu’à l’obtention d’un signal stable. Cette mesure correspond à la respiration basale dans les cellules intactes.
- Si l’expérience porte sur des cellules intactes, passez à l’étape 2.4.9. Pour les cellules perméabilisées, injecter 4,5 μL de digitonine 10 mM (concentration finale : 22,5 μM). Perméabiliser les cellules pendant 5 min.
- Ajouter les substrats : 10 μL de glutamate 2 M et 2,5 μL de malate 0,4 M (concentrations finales : 10 mM et 0,5 mM, respectivement) pour le complexe I ou 20 μL de succinate 1 M (concentration finale : 10 mM) pour le complexe II. Mesurez la consommation d’oxygène jusqu’à ce que le signal augmente et se stabilise. Il s’agit de l’état 4, ce qui signifie que la respiration du complexe basal I ou du complexe basal II est soutenue en l’absence d’ADP.
REMARQUE : Les substrats sont préparés dans de l’eau ultra-pure et stockés à −20 °C pendant 3 mois. - Injecter 5 μL d’ADP 0,5 M (concentration finale : 1,25 mM). Mesurez la consommation d’oxygène jusqu’à ce que le signal augmente et se stabilise. L’ajout d’ADP augmente le signal correspondant à la consommation maximale d’oxygène à travers le complexe I ou le complexe II (état 3, dans les cellules perméabilisées).
- Ajouter 1 μL d’oligomycine à 4 mg/mL (concentration finale : 2 μg/mL), un inhibiteur de l’ATP synthétase. Mesurez la consommation d’oxygène jusqu’à ce que le signal diminue et se stabilise.
REMARQUE : L’oligomycine est préparée dans de l’éthanol et stockée à −20 °C pendant 3 mois. - Titrer en ajoutant 1 μL de 0,1 mM à 1 mM de cyanure de carbonyle-P-trifluorométhoxy-phénylhydrazone (FCCP) par étapes successives jusqu’à ce qu’une fréquence respiratoire maximale non couplée soit atteinte. Mesurez la consommation d’oxygène jusqu’à ce que le signal augmente et se stabilise.
REMARQUE : Le FCCP est préparé dans de l’éthanol et stocké à −20 °C pendant 3 mois. - La concentration finale de FCCP dépend de l’échantillon. Arrêtez d’injecter le médicament lorsque la consommation d’oxygène commence à diminuer.
- Enfin, injecter 1 μL d’antimycine A à 5 mM (concentration finale de 2,5 μM). Il s’agit d’un inhibiteur du complexe III pour discriminer entre la consommation mitochondriale et la consommation résiduelle d’oxygène (respiration non mitochondriale). Pour l’analyse du complexe I, ajouter 1 μL de roténone 1 mM (concentration finale de 0,5 μM), un inhibiteur de ce complexe, à la place de AA. Mesurez la consommation d’oxygène jusqu’à ce que le signal diminue et se stabilise.
REMARQUE : Les médicaments sont préparés dans de l’éthanol et conservés à −20 °C pendant 3 mois.
3. Extraction et analyse des données
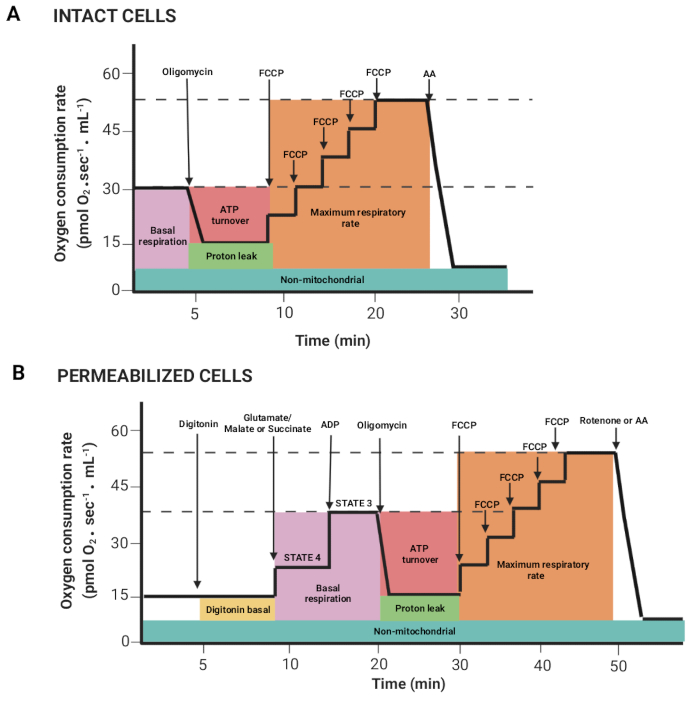
Figure 2 : Acquisition des paramètres respiratoires à partir d’une expérience de respirométrie à haute résolution. (A,B) Représentations schématiques des graphiques obtenus, tels que décrits à la figure 1, pour les cellules intactes et perméabilisées, respectivement. Ces paramètres ont déjà été décrits15. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Faites glisser la souris en appuyant sur le bouton gauche de la souris et la touche majuscule pour sélectionner les régions où le flux d’oxygène par volume corrélé (Y2 O2 pente uncorr., ligne rouge) est stable après l’injection d’un substrat ou d’un inhibiteur. La figure 2 montre les différents paramètres obtenus à partir du registre décrit précédemment15.
REMARQUE : Les paramètres dépendent de l’expérience ; tous sont les suivants : respiration basale dans les cellules intactes et respiration en présence de glutamate/malate ou de succinate (état 4), ADP (état 3), oligomycine (fuite de protons), FCCP (fréquence respiratoire maximale), roténone/AA (respiration non mitochondriale). Dans les cellules perméabilisées, la respiration basale correspond à l’état 3. - Cliquez sur les fenêtres Repères > Statistiques et exportez les données.
- Normaliser les données obtenues pour 1 million de spermatozoïdes. Les unités des pentes sont pmolO2·s−1·mL−1·10−6 cellules.
- Soustrayez la consommation d’oxygène non mitochondrial de toutes les valeurs avant de calculer les indices.
- Calculer les indices à l’aide des différentes équations décrites ci-dessus15 :

Résultats
Détermination de la concentration optimale de digitonine dans les spermatozoïdes
Dans ce protocole, nous présentons l’utilisation de la HRR pour surveiller en temps réel les changements d’OXPHOS dans les spermatozoïdes humains. Étant donné que la méthode peut être utilisée pour analyser des spermatozoïdes intacts ou perméabilisés à la digitonine, nous présentons d’abord la standardisation de la concentration de digitonine nécessaire pour perméabiliser les spermatozoïdes (
Discussion
La HRR dépend de plusieurs étapes : (a) l’entretien de l’équipement, (b) l’étalonnage précis des capteurs d’oxygène, (c) le titrage du découpleur26, et enfin, (d) l’utilisation adéquate d’indices représentant la fonction mitochondriale. L’entretien de l’équipement est crucial. Il est recommandé de remplacer régulièrement les membranes du capteur d’oxygène polarographique et de corriger le fond instrumental. Un lavage approfondi après le prélèvement des spermatozo...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier la clinique d’andrologie Fertilab, en particulier José María Montes et Andrea Torrents, de nous avoir permis d’avoir accès à des donneurs. Financement : A.C. est soutenu par des subventions de l’Universidad de la República (CSIC_2018, Espacio Interdisciplinario_2021). Un financement supplémentaire a été obtenu du Programa de Desarrollo de Ciencias Básicas (PEDECIBA, Uruguay). P.I. et R.S. sont soutenus par l’Universidad de la República (I+D, CSIC 2014 ; I+D, CSIC 2016, Iniciación a la Investigación, CSIC 2019 et FMV_1_2017_1_136490 ANII- Uruguay). P.I. est soutenu par POS_FMV_2018_1_1007814 et CAP-UDELAR 2020. Les figures ont été illustrées à l’aide de Biorender.com.
matériels
| Name | Company | Catalog Number | Comments |
| Acid free- Bovine serum albumine | Sigma Aldrich | A8806 | |
| Adenosine 5'-diphosphate monopotassium salt dihydrate | Sigma Aldrich | A5285 | |
| Animycin A from streptomyces sp. | Sigma Aldrich | A8674 | |
| Calcium chloride | Sigma Aldrich | C4901 | |
| carbonyl cyanide-P- trifluoromethoxy-phenylhydrazone | Sigma Aldrich | C2920 | |
| DatLab sofware version 4,2 | Oroboros Instruments GmbH | N/A | |
| D-glucose | Sigma Aldrich | G7021 | |
| Digitonin | Sigma Aldrich | D141 | |
| EGTA | Sigma Aldrich | E4378 | |
| HEPES | Sigma Aldrich | H3375 | |
| L glutamic acid | Sigma Aldrich | G1251 | |
| L malic acid | Sigma Aldrich | M1000 | |
| Magnesium sulphate | Sigma Aldrich | M7506 | |
| Microliter Syringes | Hamilton | 87900 or 80400 | |
| Microscope camera | Basler | acA780-75gc | |
| Microscope Eclipse E200 with phase contrast 10X Ph+ | Nikon | N/A | |
| Monopotassium phosphate | Sigma Aldrich | P5655 | |
| MOPS | Sigma Aldrich | M1254 | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Oxygraph-2 K | Oroboros Instruments GmbH | N/A | |
| Potassium chloride | Sigma Aldrich | P3911 | |
| Power O2k-Respirometer | Oroboros Intruments | 10033-01 | |
| Rotenone | Sigma Aldrich | R8875 | |
| Saccharose | Sigma Aldrich | S0389 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium lactate | Sigma Aldrich | L7022 | |
| Sodium pyruvate | Sigma Aldrich | P2256 | |
| Sperm class analyzer 6.3.0.59 Evolution-SCA Research | Microptic | N/A | |
| Sperm Counting Chamber DRM-600 | Millennium Sciences CELL-VU | N/A | |
| Succinate disodium salt | Sigma Aldrich | W327700 |
Références
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13, 37 (2015).
- Guzick, D. S., et al. Sperm morphology, motility, and concentration in fertile and infertile men. The New England Journal of Medicine. 345 (19), 1388-1393 (2001).
- Wang, C., Swerdloff, R. S. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertility and Sterility. 102 (6), 1502-1507 (2014).
- Amaral, A. Energy metabolism in mammalian sperm motility. WIREs Mechanisms of Disease. 14 (5), e1569 (2022).
- Leung, M. R., et al. In-cell structures of conserved supramolecular protein arrays at the mitochondria-cytoskeleton interface in mammalian sperm. Proceedings of the National Academy of Sciences of the United States of America. 118 (45), e2110996118 (2021).
- Moraes, C. R., Meyers, S. The sperm mitochondrion: Organelle of many functions. Animal Reproduction Science. 194, 71-80 (2018).
- Cassina, A., et al. Defective human sperm cells are associated with mitochondrial dysfunction and oxidant production. Biology of Reproduction. 93 (5), 119 (2015).
- Marchetti, C., Obert, G., Deffosez, A., Formstecher, P., Marchetti, P. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm. Human Reproduction. 17 (5), 1257-1265 (2002).
- Amaral, A., Lourenço, B., Marques, M., Ramalho-Santos, J. Mitochondria functionality and sperm quality. Reproduction. 146 (5), R163-R174 (2013).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), e13666 (2021).
- Uribe, P., et al. Use of the fluorescent dye tetramethylrhodamine methyl ester perchlorate for mitochondrial membrane potential assessment in human spermatozoa. Andrologia. 49 (9), e12753 (2017).
- Storey, B. T. Mammalian sperm metabolism: Oxygen and sugar, friend and foe. The International Journal of Developmental Biology. 52 (5-6), 427-437 (2008).
- Tourmente, M., Sansegundo, E., Rial, E., Roldan, E. R. S. Capacitation promotes a shift in energy metabolism in murine sperm. Frontiers in Cell and Developmental Biology. 10, 950979 (2022).
- Gnaiger, E., Dykens, J. A., Will, Y. Chapter 12 - Polarographic oxygen sensors, the oxygraph, and high-resolution respirometry to assess mitochondrial function. Drug-Induced Mitochondrial Dysfunction. , 325-352 (2008).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Awadhpersad, R., Jackson, C. B. High-resolution respirometry to assess bioenergetics in cells and tissues using chamber- and plate-based respirometers. Journal of Visualized Experiments: JoVE. (176), e63000 (2021).
- Chance, B., Williams, G. R. A simple and rapid assay of oxidative phosphorylation. Nature. 175 (4469), 1120-1121 (1955).
- Li, Z., Graham, B. H. Measurement of mitochondrial oxygen consumption using a Clark electrode. Methods in Molecular Biology. 837, 63-72 (2012).
- Stendardi, A., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. International Journal of Andrology. 34 (3), 247-255 (2011).
- Ferramosca, A., Focarelli, R., Piomboni, P., Coppola, L., Zara, V. Oxygen uptake by mitochondria in demembranated human spermatozoa: A reliable tool for the evaluation of sperm respiratory efficiency. International Journal of Andrology. 31 (3), 337-345 (2008).
- Ferramosca, A., et al. Modulation of human sperm mitochondrial respiration efficiency by plant polyphenols. Antioxidants. 10 (2), 217 (2021).
- Gnaiger, E., Steinlechner-Maran, R., Méndez, G., Eberl, T., Margreiter, R. Control of mitochondrial and cellular respiration by oxygen. Journal of Bioenergetics and Biomembranes. 27 (6), 583-596 (1995).
- . O2k Quality Control 1: Polarographic oxygen sensors and accuracy of calibration Available from: https://www.bioblst.at/images/archive/7/77/20210819114548%21MiPNet06.03_POS-Calibration-SOP.pdf (2020)
- WHO Laboratory Manual for the Examination and Processing of Human Semen. World Health Organization Available from: https://www.who.int/publications/i/item/9789240030787 (2010)
- . O2k-protocols SOP: O2k quality control 1 Available from: https://www.bioblast.at/images/9/9c/MiPNet06.03_POS-Calibration-SOP_DatLab8.pdf (2021)
- Gnaiger, E. . Mitochondrial Pathways and Respiratory Control. , (2012).
- Steinlechner-Maran, R., Eberl, T., Kunc, M., Margreiter, R., Gnaiger, E. Oxygen dependence of respiration in coupled and uncoupled endothelial cells. The American Journal of Physiology. 271, C2053-C2061 (1996).
- Holt, W. V., Van Look, K. J. W. Concepts in sperm heterogeneity, sperm selection and sperm competition as biological foundations for laboratory tests of semen quality. Reproduction. 127 (5), 527-535 (2004).
- Sousa, A. P., et al. Not all sperm are equal: Functional mitochondria characterize a subpopulation of human sperm with better fertilization potential. PloS One. 6 (3), e18112 (2011).
- Moscatelli, N., et al. Single-cell-based evaluation of sperm progressive motility via fluorescent assessment of mitochondria membrane potential. Scientific Reports. 7, 17931 (2017).
- Ferreira, J. J., et al. Increased mitochondrial activity upon CatSper channel activation is required for mouse sperm capacitation. Redox Biology. 48, 102176 (2021).
- Irigoyen, P., et al. Mitochondrial metabolism determines the functional status of human sperm and correlates with semen parameters. Frontiers in Cell and Developmental Biology. 10, 926684 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon