このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト精子のミトコンドリア機能を評価するための高分解能肺活法
要約
精子のミトコンドリア機能を高分解能肺活法で解析することで、密閉室系で自由に動く精子の酸素消費量を測定することができます。この技術は、精子のミトコンドリアの特徴と完全性に関する情報を提供するヒト精子の呼吸の測定に適用できます。
要約
精液の質は、ルーチンの精液分析によって研究されることが多いが、これは記述的であり、しばしば決定的ではない。男性不妊症は精子のミトコンドリア活動の変化と関連しているため、精子のミトコンドリア機能の測定は精子の質の指標です。高分解能肺活量測定は、密閉チャンバーシステム内の細胞または組織の酸素消費量を測定する方法です。この技術は、ヒト精子の呼吸を測定するために実装することができ、精子ミトコンドリアの品質と完全性に関する情報を提供します。高解像度の肺活法により、細胞は自由に動くことができ、これは精子の場合の 先験的な 利点です。この技術は、無傷または透過処理された精子に適用でき、無傷の精子のミトコンドリア機能および個々の呼吸鎖複合体の活性の研究を可能にします。高解像度の酸素写真機器は、センサーを使用して酸素濃度を測定し、高感度のソフトウェアを組み合わせて酸素消費量を計算します。このデータは、酸素消費比に基づいて呼吸指数を計算するために使用されます。したがって、指数は2つの酸素消費率の比率であり、細胞数またはタンパク質量に内部的に正規化されます。呼吸指数は、精子のミトコンドリア機能と機能障害の指標です。
概要
男性不妊症は、カップルの不妊症の全症例の40%〜50%を占めると推定されています1。従来の精液分析は、男性の生殖能力を決定する上で重要な役割を果たします。しかし、不妊症の男性の約15%は正常な精子パラメータを持っています2。さらに、ルーチンの精液分析では、精子の機能に関する情報は限られており、精子の微妙な欠損は反映されません3。
精子のミトコンドリアは、べん毛の周りにらせん状の鞘として配置されているため、特別な構造をしています。ミトコンドリア鞘は、ミトコンドリア間リンカーによって連結され、ミトコンドリアの外側膜上の規則正しいタンパク質配列によって細胞骨格に固定された可変数のミトコンドリアを含む4,5。この構造により、精子のミトコンドリアを単離することが特に困難になります。したがって、精子のミトコンドリア機能に関するほとんどの研究は、in situ分析または脱膜精子を使用しています6。
精子のミトコンドリアの構造と機能は、一貫して男性不妊症に関連しており7,8,9,10,11、これらの細胞小器官の構造と機能の分析は、精子分析に含めるための良い候補である可能性があることを示唆しています。
ミトコンドリアは、特に酸素を使用して酸化的リン酸化(OXPHOS)を介してアデノシン三リン酸(ATP)を生成することにより、細胞のエネルギー代謝に重要な役割を果たします。特に精子では、ATPの供給源(解糖系対OXPHOS)が論争されており、データの多くは議論の余地があり、さまざまな実験的アプローチに依存しています4,12,13。酸素濃度測定による呼吸の測定は、ミトコンドリアの呼吸能力、ミトコンドリアの完全性、および細胞のエネルギー代謝に関する重要な洞察を提供します14,15,16。伝統的に、この技術は、50年以上にわたってミトコンドリア呼吸を測定するために使用されてきた機器であるクラーク酸素電極を使用して行われてきました17,18。さらに、精子のミトコンドリア酸素消費量は、古典的なクラーク酸素電極19,20,21を使用して分析されています。オキシグラフ(オロボロス)を用いた高分解能肺活量測定(HRR)は、従来の肺活量測定装置を使用するよりも高い感度を提供する22。オキシグラフは注入ポートを備えた2つのチャンバーで構成されており、各チャンバーにはポーラログラフ式酸素センサーがあります。この技術により、組織スライド、細胞、および単離されたミトコンドリア懸濁液を分析することができます。試料をチャンバー内で連続的に攪拌し、実験中に酸素消費量を測定し、特定のソフトウェアを使用して酸素率を計算します。チャンバは酸素漏れの低減を示し、これは従来の酸素電極デバイス14,23に対する利点である。
他の細胞と同様に、精子の場合、HRR装置の感度は従来の肺活法よりも高いため、HRR装置は限られた数の無傷または透過処理された精子細胞の分析に使用できます。HRRによる精子のミトコンドリア機能の評価には、主に2つの戦略があります:(a)グルコースなどの基質を含む培地で呼吸機能を再現することを含む無傷細胞内の酸素消費量を測定すること、または(b)OXPHOS複合体の1つを使用して透過処理細胞内の酸素消費量を測定し、特定の基質を追加して各機能を個別に監視します。
本研究では、ヒト精子細胞におけるミトコンドリア呼吸を決定するためのHRRの使用について説明します。
プロトコル
この実験は、ウルグアイのモンテビデオにあるFacultad de Medicina de la Universidad de la Repúblicaの倫理委員会によって承認されました。
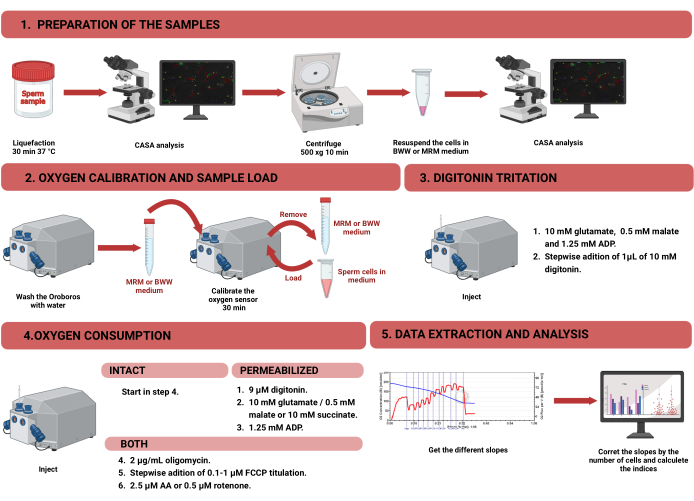
図1:無傷および透過処理されたヒト精子のミトコンドリア機能を評価するための高分解能肺活量測定のワークフロー。 プロトコルは、1)サンプルの調製、2)オロボロス装置での酸素キャリブレーション、3)インタクトおよび透過処理された細胞の酸素消費量測定、および4)装置からのデータ抽出と分析の4つの異なるステップに分かれています。略語:CASA =コンピューター支援精子分析。BWW = ビガーズ・ウィッテン・ウィッティンガム・ミディアム;MRM = ミトコンドリア呼吸媒体;ADP = アデノシン二リン酸;FCCP = シアン化カルボニル-p-トリフルオロメトキシフェニルヒドラゾン;AA = 抗マイシン A. この図の拡大版を見るには、ここをクリックしてください。
注:HRRを使用して精子細胞の酸素消費量を測定するためのワークフローを 図1に示します。プロトコルで使用される材料、機器、および試薬に関する情報は、 材料表に記載されています。
1. サンプル調製
- サンプル収集
- 無菌プラスチック容器に推奨される3日間の禁欲の後、マスターベーションによって射精したばかりの人間の精液を収集します。サンプルはすぐにラボに輸送します。
- サンプルを室温(RT)で30〜60分間インキュベートして、完全に液化させます24。
- 液化後、実験が始まるまで37°Cで保存してください。
- コンピュータ支援精子分析(CASA)による精子評価
- サンプルを混合し、予め温めた精子計数チャンバーに7μLをロードします。
- チャンバーを直射光顕微鏡の予熱(37°C)ステージに置きます。
- コンピュータ化された精子分析ソフトウェアを開き、運動性と濃度モジュールを入力します( Motをクリックします)。
- ヒトの精子の状態に対応する構成を選択します。
注:構成は、チャンバーの種類と深さ、およびサンプル種とシステムCASAに適合させる必要があります。 - チャンバーごとに10種類のフィールドをランダムに分析するには、 Analyze ボタンをクリックします。
- [結果]をクリックして、サンプルの濃度と運動性を取得します。
- 細胞調製
注意: HRRが校正されていない場合は、セルを準備する前に、手順2.1〜2.2から開始してください(手順1.3)。精子細胞が培地に再懸濁されたら、すぐに酸素消費量を測定することが重要です。- サンプルを 400 x g で 10 分間遠心分離します。
- 精漿を除去し、精子を2 mLのBiggers Whitten Whittingham(BWW)に再懸濁し、無傷の細胞を用いた実験用、または透過処理細胞を用いた研究用のミトコンドリア呼吸培地(MRM)に再懸濁します。培地の組成を 表1に示す。
- 精子濃度研究のステップ1.2で説明した手順を繰り返します。
2. 高分解能スピロメトリー:OXPHOS分析
注:HRRは高感度オキシグラフ(Oxygraph-2 K;Oroboros Instruments GmbH, Innsbruck, Austria)とソフトウェア(DatLab、バージョン4.2;Gmbh Oroboros Instruments)。実験データは、酸素濃度対時間(O2/106 cells·min-1のpmolとして)およびこれらのデータのリアルタイム変換として表示されるため、実験者は実験中に生物学的および生化学的サンプルの呼吸(酸素消費量、酸素流束)を追跡できます。HRRは、生きた細胞や運動性細胞の呼吸を追跡するために使用でき、その運動性が精子の質と生殖能力に関連している精子に特に有用です。研究室では、2つのチャンバーを備えたHRR Oroboros Oxygraph2-k、Oroboros Instrumentsを使用しています。このプロトコルに記載されている手順は、両方の 2 mL チャンバーに対して独立して実行する必要があります。
- 機器の準備
- HRRをオンにし、データの取得と分析のために呼吸測定ソフトウェア(DatLab)に接続します。
- オキシグラフチャンバー内の70%エタノールをddH2Oに置き換え、チャンバー内の磁気攪拌子で750rpmで連続的に攪拌します。10分間放置し、その後、二重蒸留(dd)H2Oを吸引する。
- チャンバーをddH2Oで3回、毎回5分間洗浄します。
注:このステップは、チャンバーから残りのエタノールを除去するために必要です。精子細胞はエタノールに非常に敏感です。この手順を省略すると、記録が損なわれる可能性があります。
- 酸素センサーの校正
注意: 校正手順は、機器によって若干異なります。ポーラログラフ式酸素センサーの空気校正は、メーカー25の記載に従って行う。このセクションでは、校正プロトコルについて簡単に説明します。- ddH2Oを取り出し、細胞調製に用いたのと同じ培地2mLをチャンバーにピペットで移す。ストッパーを配置し、空気交換気泡を残します。
注意: 必要な培地の正確な容量を決定するには、チャンバーの容量を知ることが重要です。 - 酸素キャリブレーション値を記録し( Layout > 01 Calibration Exp. Gr3-Tempをクリック)、37°Cで750rpmの攪拌子で培地を少なくとも30分間攪拌することにより、センサーメンブレンの性能を監視します。 前述のように他の設定を使用します:センサーのゲイン:2;分極電圧:800mV;データ記録間隔:2.0秒。
注:ポーラログラフセンサーからの安定した信号により、±2 pmol・s-1∙mL-1以内の未補正(赤線)のO2傾きが得られることが期待されます。 - マウスの左ボタンとShiftキーを押しながらマウスをドラッグし、酸素濃度の変化が安定している領域(Y1 O2濃度、青線)を選択します。
- [O2 Calibration]ウィンドウを開きます([Oxygraph]>[O2 Calibration]をクリックします)。[空気キャリブレーション]で、選択したマークを手順2.2.3で選択した領域に変更します。[Calibrate and Copy to Clipboard]をクリックして終了します。
- 記録を停止し、[Oxygraph] > [ Ok Control] > [Save and Disconnect] をクリックして保存します。
注: このデータセットは、その日のすべての実験で使用できるように保存する必要があります。キャリブレーションは、各媒体について1日1回のみ実行されます。
- ddH2Oを取り出し、細胞調製に用いたのと同じ培地2mLをチャンバーにピペットで移す。ストッパーを配置し、空気交換気泡を残します。
- ジギトニン透過滴定
- チャンバーを開き、内部の培地を吸引します。
- チャンバー内に、少なくとも24 x 10 6および70 x 106以下の精子細胞を、最終容量2 mLのMRMにロードします。
注:実験終了時の酸素消費量を調整するために、チャンバー内の細胞数を測定することが重要です。推奨値より少ないセル数は測定できません。 - ストッパーを奥まで押し込んでチャンバーを閉じ、上部に残った液体を吸引します。キャリブレーションと同じ設定で実験を開始します:攪拌速度:750 rpm。温度: 37 °C;センサーのゲイン:2;分極電圧:800mV;データ記録間隔:2.0秒。
- キャリブレーションをロードするには、下隅にある Pos Calib ボックスをダブルクリックします。手順2.2で実行したキャリブレーションを開き( Oxygraph > O2 Calibration>Copy from Fileをクリック)、[ Calibrate and Copy to Clipboard]をクリックします。
注意: POSキャリブ ボックスが黄色から緑色に変わります。データは、体積ごとに補正された酸素流量チャート(レイアウト05:体積あたりのフラックス未補正)に表示されます。 Oxygraph > Layoutでは、さまざまなレイアウトを使用できます。 - 0.5 M アデノシン二リン酸(ADP)5 μL、2 M グルタミン酸 10 μL、0.4 M リンゴ酸 2.5 μL(最終濃度:1.25 mM、10 mM、0.5 mM)を加えます。信号が安定するまで酸素消費量を測定します。
注:精密ハミルトンマイクロシリンジは、ストッパーのロードポートからの注入に使用されます。クロスコンタミネーションを避けるために、薬剤ごとに1本のシリンジを使用してください。 F4 をクリックして登録し、治療が追加されたときに酸素レジスターにマークを付けます。
注:基板は超純水で調製し、-20°Cで3ヶ月間保存します。 - 酸素消費量が最大レベルに達するまで、1 μL の 10 mM ジギトニンを連続して添加してトリチウム酸塩を添加します。
注:同じチャンバーを同じ日に2つの実験に使用する場合は、水、70%エタノール、および100%エタノールで完全に洗浄することが不可欠です。
注:ジギトニンは超純水で調製し、-20°Cで3ヶ月間保存します。
- 無傷および透過処理された精子細胞(複合体Iまたは複合体II)のルーチン呼吸評価プロトコル
- チャンバーを開き、内部の培地を吸引します。
- チャンバー内に、BWW(インタクト細胞分析)またはMRM(透過処理細胞分析)の最終容量2mLの最終容量に、少なくとも24 x 10 6および70 x 106以下の精子細胞をロードします。
- キャリブレーションと同じ設定で実験を開始します(これについては、手順2.3.3で説明します)。
- ステップ2.3.4の説明に従って、ステップ2.2で実行したキャリブレーションをロードします。
- 安定したシグナルが得られるまで、少なくとも5分間細胞の呼吸を記録します。この測定値は、無傷の細胞における基礎呼吸に相当します。
- 実験が無傷の細胞で行われる場合は、ステップ2.4.9に進みます。透過処理した細胞には、4.5 μL の 10 mM ジギトニンを注入します(最終濃度:22.5 μM)。細胞を5分間透過処理します。
- 基質を添加します:複合体Iの場合は2 Mグルタミン酸10 μL、0.4 Mリンゴ酸2.5 μL(最終濃度:それぞれ10 mMおよび0.5 mM)、複合体IIの場合は1 Mコハク酸(最終濃度:10 mM)20 μL。信号が増加して安定するまで、酸素消費量を測定します。これは状態4であり、ADPの非存在下での基底複合体Iまたは基底複合体IIの支持呼吸を意味します。
注:基板は超純水で調製し、-20°Cで3ヶ月間保存します。 - 5 μL の 0.5 M ADP (最終濃度:1.25 mM) を注入します。信号が増加して安定するまで、酸素消費量を測定します。ADPを添加すると、複合体Iまたは複合体IIを通る最大酸素消費量に対応するシグナルが増加します(状態3、透過処理細胞では)。
- ATP合成酵素阻害剤であるオリゴマイシン(最終濃度:2 μg/mL)を1 μL添加します。信号が減少して安定するまで、酸素消費量を測定します。
注:オリゴマイシンはエタノールで調製し、-20°Cで3ヶ月間保存します。 - 0.1 mMから1 mMのシアン化カルボニル-P-トリフルオロメトキシ-フェニルヒドラゾン(FCCP)を1 μL添加して、最大非共役呼吸数に達するまで連続して滴定します。信号が増加して安定するまで、酸素消費量を測定します。
注:FCCPはエタノールで調製され、-20°Cで3か月間保存されます。 - FCCPの最終濃度はサンプルによって異なります。酸素消費量が減少し始めたら、薬の注射を中止してください。
- 最後に、1 μL の 5 mM 抗マイシン A(最終濃度 2.5 μM)を注入します。これは、ミトコンドリアと残留酸素消費(非ミトコンドリア呼吸)を区別するための複合体III阻害剤です。複合体 I の分析では、AA の代わりに、この複合体の阻害剤である 1 mM ロテノン(最終濃度 0.5 μM)を 1 μL 添加します。信号が減少して安定するまで、酸素消費量を測定します。
注:薬剤はエタノールで調製され、-20°Cで3ヶ月間保存されます。
3. データの抽出と分析
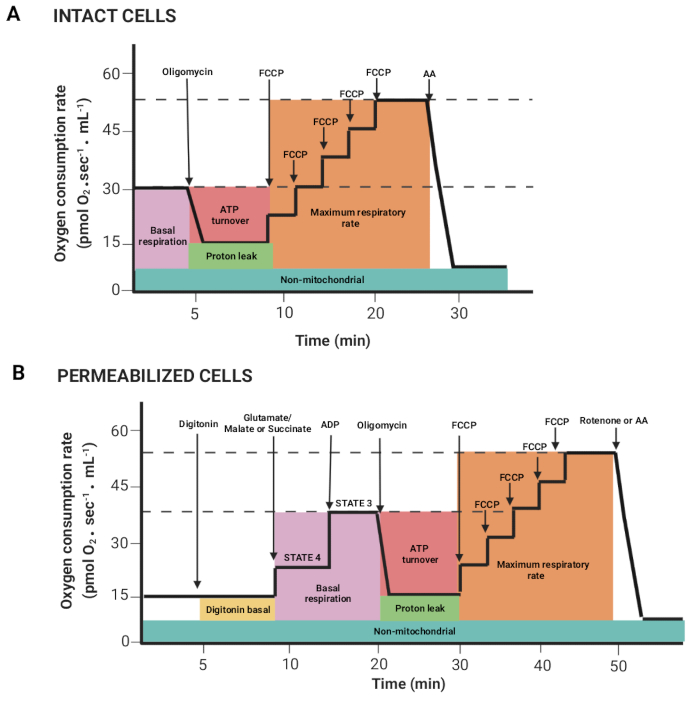
図2:高分解能スピロメトリー実験による呼吸パラメータの取得。 (A,B)図1に示した、インタクト細胞と透過処理細胞について得られたグラフの模式図。これらのパラメータは、前述した15で説明した。この図の拡大版をご覧になるには、ここをクリックしてください。
- マウスの左ボタンとShiftキーを押してマウスをドラッグし、基質または阻害剤の注入後に体積あたりの酸素フラックスが相関している領域(Y2 O2 傾き補正値、赤線)を選択します。 図2 は、先に説明したレジスタ15から得られる異なるパラメータを示す。
注:パラメータは実験によって異なります。それらはすべて次の通りです:無傷の細胞における基礎呼吸とグルタミン酸/リンゴ酸またはコハク酸の存在下での呼吸(状態4)、ADP(状態3)、オリゴマイシン(プロトンリーク)、FCCP(最大呼吸数)、ロテノン/ AA(非ミトコンドリア呼吸)。透過処理された細胞では、基底呼吸は状態3に相当します。 - [マーク] ウィンドウ > [統計] ウィンドウ をクリックし、データをエクスポートします。
- 精子細胞100万個あたりのデータを正規化します。斜面の単位はpmolO2・s−1・mL−1・10−6セルである。
- 指数を計算する前に、すべての値から非ミトコンドリアの酸素消費量を差し引きます。
- 前述のさまざまな式を使用してインデックスを計算します15:

結果
精子細胞におけるジギトニンの最適濃度の決定
このプロトコルでは、ヒト精子細胞におけるOXPHOSのリアルタイム変化を監視するためのHRRの使用方法を紹介します。この分析法は、インタクトまたはジギトニン透過処理された精子の分析に使用できるため、まず、精子細胞の透過処理に必要なジギトニン濃度の標準化について紹介します(図3)。
ディスカッション
HRRは、(a)機器のメンテナンス、(b)酸素センサーの正確な校正、(c)アンカプラー滴定26、そして最後に、(d)ミトコンドリア機能を表す指標の適切な使用といういくつかのステップに決定的に依存します。機器のメンテナンスは非常に重要です。ポーラログラフ式酸素センサーのメンブレンを定期的に交換し、機器のバックグラウンドを修正することをお勧めします。チャンバ?...
開示事項
著者は何も開示していません。
謝辞
ドナーへのアクセスを許可してくれたFertilab Andrologyクリニック、特にJosé María MontesとAndrea Torrentsに感謝します。資金提供:ACは、Universidad de la República(CSIC_2018、Espacio Interdisciplinario_2021)からの助成金によってサポートされています。追加資金は、Programa de Desarrollo de Ciencias Básicas(ウルグアイ、PEDECIBA)から得られました。P.I. と R.S. は Universidad de la República (I+D, CSIC 2014;I+D、CSIC 2016、Iniciación a la Investigación、CSIC 2019、FMV_1_2017_1_136490 ANII-ウルグアイ)。P.I. は POS_FMV_2018_1_1007814 と CAP-UDELAR 2020 でサポートされています。図は Biorender.com を使用して示されました。
資料
| Name | Company | Catalog Number | Comments |
| Acid free- Bovine serum albumine | Sigma Aldrich | A8806 | |
| Adenosine 5'-diphosphate monopotassium salt dihydrate | Sigma Aldrich | A5285 | |
| Animycin A from streptomyces sp. | Sigma Aldrich | A8674 | |
| Calcium chloride | Sigma Aldrich | C4901 | |
| carbonyl cyanide-P- trifluoromethoxy-phenylhydrazone | Sigma Aldrich | C2920 | |
| DatLab sofware version 4,2 | Oroboros Instruments GmbH | N/A | |
| D-glucose | Sigma Aldrich | G7021 | |
| Digitonin | Sigma Aldrich | D141 | |
| EGTA | Sigma Aldrich | E4378 | |
| HEPES | Sigma Aldrich | H3375 | |
| L glutamic acid | Sigma Aldrich | G1251 | |
| L malic acid | Sigma Aldrich | M1000 | |
| Magnesium sulphate | Sigma Aldrich | M7506 | |
| Microliter Syringes | Hamilton | 87900 or 80400 | |
| Microscope camera | Basler | acA780-75gc | |
| Microscope Eclipse E200 with phase contrast 10X Ph+ | Nikon | N/A | |
| Monopotassium phosphate | Sigma Aldrich | P5655 | |
| MOPS | Sigma Aldrich | M1254 | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Oxygraph-2 K | Oroboros Instruments GmbH | N/A | |
| Potassium chloride | Sigma Aldrich | P3911 | |
| Power O2k-Respirometer | Oroboros Intruments | 10033-01 | |
| Rotenone | Sigma Aldrich | R8875 | |
| Saccharose | Sigma Aldrich | S0389 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium lactate | Sigma Aldrich | L7022 | |
| Sodium pyruvate | Sigma Aldrich | P2256 | |
| Sperm class analyzer 6.3.0.59 Evolution-SCA Research | Microptic | N/A | |
| Sperm Counting Chamber DRM-600 | Millennium Sciences CELL-VU | N/A | |
| Succinate disodium salt | Sigma Aldrich | W327700 |
参考文献
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13, 37 (2015).
- Guzick, D. S., et al. Sperm morphology, motility, and concentration in fertile and infertile men. The New England Journal of Medicine. 345 (19), 1388-1393 (2001).
- Wang, C., Swerdloff, R. S. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertility and Sterility. 102 (6), 1502-1507 (2014).
- Amaral, A. Energy metabolism in mammalian sperm motility. WIREs Mechanisms of Disease. 14 (5), e1569 (2022).
- Leung, M. R., et al. In-cell structures of conserved supramolecular protein arrays at the mitochondria-cytoskeleton interface in mammalian sperm. Proceedings of the National Academy of Sciences of the United States of America. 118 (45), e2110996118 (2021).
- Moraes, C. R., Meyers, S. The sperm mitochondrion: Organelle of many functions. Animal Reproduction Science. 194, 71-80 (2018).
- Cassina, A., et al. Defective human sperm cells are associated with mitochondrial dysfunction and oxidant production. Biology of Reproduction. 93 (5), 119 (2015).
- Marchetti, C., Obert, G., Deffosez, A., Formstecher, P., Marchetti, P. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm. Human Reproduction. 17 (5), 1257-1265 (2002).
- Amaral, A., Lourenço, B., Marques, M., Ramalho-Santos, J. Mitochondria functionality and sperm quality. Reproduction. 146 (5), R163-R174 (2013).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), e13666 (2021).
- Uribe, P., et al. Use of the fluorescent dye tetramethylrhodamine methyl ester perchlorate for mitochondrial membrane potential assessment in human spermatozoa. Andrologia. 49 (9), e12753 (2017).
- Storey, B. T. Mammalian sperm metabolism: Oxygen and sugar, friend and foe. The International Journal of Developmental Biology. 52 (5-6), 427-437 (2008).
- Tourmente, M., Sansegundo, E., Rial, E., Roldan, E. R. S. Capacitation promotes a shift in energy metabolism in murine sperm. Frontiers in Cell and Developmental Biology. 10, 950979 (2022).
- Gnaiger, E., Dykens, J. A., Will, Y. Chapter 12 - Polarographic oxygen sensors, the oxygraph, and high-resolution respirometry to assess mitochondrial function. Drug-Induced Mitochondrial Dysfunction. , 325-352 (2008).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Awadhpersad, R., Jackson, C. B. High-resolution respirometry to assess bioenergetics in cells and tissues using chamber- and plate-based respirometers. Journal of Visualized Experiments: JoVE. (176), e63000 (2021).
- Chance, B., Williams, G. R. A simple and rapid assay of oxidative phosphorylation. Nature. 175 (4469), 1120-1121 (1955).
- Li, Z., Graham, B. H. Measurement of mitochondrial oxygen consumption using a Clark electrode. Methods in Molecular Biology. 837, 63-72 (2012).
- Stendardi, A., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. International Journal of Andrology. 34 (3), 247-255 (2011).
- Ferramosca, A., Focarelli, R., Piomboni, P., Coppola, L., Zara, V. Oxygen uptake by mitochondria in demembranated human spermatozoa: A reliable tool for the evaluation of sperm respiratory efficiency. International Journal of Andrology. 31 (3), 337-345 (2008).
- Ferramosca, A., et al. Modulation of human sperm mitochondrial respiration efficiency by plant polyphenols. Antioxidants. 10 (2), 217 (2021).
- Gnaiger, E., Steinlechner-Maran, R., Méndez, G., Eberl, T., Margreiter, R. Control of mitochondrial and cellular respiration by oxygen. Journal of Bioenergetics and Biomembranes. 27 (6), 583-596 (1995).
- . O2k Quality Control 1: Polarographic oxygen sensors and accuracy of calibration Available from: https://www.bioblst.at/images/archive/7/77/20210819114548%21MiPNet06.03_POS-Calibration-SOP.pdf (2020)
- WHO Laboratory Manual for the Examination and Processing of Human Semen. World Health Organization Available from: https://www.who.int/publications/i/item/9789240030787 (2010)
- . O2k-protocols SOP: O2k quality control 1 Available from: https://www.bioblast.at/images/9/9c/MiPNet06.03_POS-Calibration-SOP_DatLab8.pdf (2021)
- Gnaiger, E. . Mitochondrial Pathways and Respiratory Control. , (2012).
- Steinlechner-Maran, R., Eberl, T., Kunc, M., Margreiter, R., Gnaiger, E. Oxygen dependence of respiration in coupled and uncoupled endothelial cells. The American Journal of Physiology. 271, C2053-C2061 (1996).
- Holt, W. V., Van Look, K. J. W. Concepts in sperm heterogeneity, sperm selection and sperm competition as biological foundations for laboratory tests of semen quality. Reproduction. 127 (5), 527-535 (2004).
- Sousa, A. P., et al. Not all sperm are equal: Functional mitochondria characterize a subpopulation of human sperm with better fertilization potential. PloS One. 6 (3), e18112 (2011).
- Moscatelli, N., et al. Single-cell-based evaluation of sperm progressive motility via fluorescent assessment of mitochondria membrane potential. Scientific Reports. 7, 17931 (2017).
- Ferreira, J. J., et al. Increased mitochondrial activity upon CatSper channel activation is required for mouse sperm capacitation. Redox Biology. 48, 102176 (2021).
- Irigoyen, P., et al. Mitochondrial metabolism determines the functional status of human sperm and correlates with semen parameters. Frontiers in Cell and Developmental Biology. 10, 926684 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved