A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصوير الكالسيوم ثنائي الفوتون لنشاط الدماغ الأمامي في تصرف الزرد البالغ
In This Article
Summary
هنا ، نقدم بروتوكولا لإجراء تصوير الكالسيوم ثنائي الفوتون في الدماغ الأمامي الظهري لسمك الزرد البالغ.
Abstract
يظهر الزرد البالغ (Danio rerio) ذخيرة غنية من السلوكيات لدراسة الوظائف المعرفية. لديهم أيضا دماغ مصغر يمكن استخدامه لقياس الأنشطة عبر مناطق الدماغ من خلال طرق التصوير البصري. ومع ذلك ، كانت التقارير حول تسجيل نشاط الدماغ في سلوك الزرد البالغ نادرة. تصف الدراسة الحالية إجراءات إجراء تصوير الكالسيوم ثنائي الفوتون في الدماغ الأمامي الظهري لسمك الزرد البالغ. نحن نركز على خطوات لمنع أسماك الزرد البالغة من تحريك رؤوسها ، مما يوفر الاستقرار الذي يتيح التصوير بالليزر لنشاط الدماغ. يمكن للحيوانات المقيدة الرأس تحريك أجزاء أجسامها بحرية والتنفس دون مساعدات. يهدف الإجراء إلى تقصير وقت جراحة تقييد الرأس ، وتقليل حركة الدماغ ، وزيادة عدد الخلايا العصبية المسجلة. يتم أيضا وصف الإعداد لتقديم بيئة بصرية غامرة أثناء تصوير الكالسيوم هنا ، والذي يمكن استخدامه لدراسة الارتباطات العصبية الكامنة وراء السلوكيات المحفزة بصريا.
Introduction
كان التصوير الفلوري للكالسيوم باستخدام مؤشرات مشفرة وراثيا أو أصباغ اصطناعية طريقة قوية لقياس النشاط العصبي في الحيوانات التي تتصرف ، بما في ذلك الرئيسيات غير البشرية والقوارض والطيور والحشرات1. يمكن قياس نشاط مئات الخلايا ، حتى حوالي 800 ميكرومتر تحت سطح الدماغ ، في وقت واحد باستخدام التصوير متعدد الفوتون 2,3. يمكن أيضا قياس نشاط أنواع معينة من الخلايا عن طريق التعبير عن مؤشرات الكالسيوم في مجموعات الخلايا العصبية المحددة وراثيا. يفتح تطبيق طريقة التصوير لنماذج الفقاريات الصغيرة إمكانيات جديدة في مجال حساب الخلايا العصبية عبر مناطق الدماغ.
الزرد هو نظام نموذجي يستخدم على نطاق واسع في أبحاث علم الأعصاب. تم استخدام يرقات الزرد في حوالي 6 أيام بعد الإخصاب لتصوير الكالسيوم بسبب دماغها المصغر وجسمها الشفاف4. تستخدم أسماك الزرد اليافعة (3-4 أسابيع) أيضا لدراسة الآليات العصبية الكامنة وراء المسارات الحسيةالحركية 5،6. ومع ذلك ، يتم الوصول إلى مستوى الأداء الأقصى للسلوكيات المعقدة ، بما في ذلك التعلم الترابطي والسلوكيات الاجتماعية ، في سنأكبر 7,8. وبالتالي ، يلزم وجود بروتوكول موثوق لدراسة الوظائف المعرفية المتعددة في أدمغة الزرد البالغ باستخدام طرق التصوير. في حين أن يرقة الزرد وصغار الزرد يمكن أن تكون جزءا لا يتجزأ من الأغاروز للتصوير في الجسم الحي ، فإن الزرد البالغ في عمر 2 أشهر أو أكثر يعاني من نقص الأكسجة في مثل هذه الظروف ويكون قويا جسديا بحيث لا يمكن تقييده بواسطة الأغاروز. لذلك ، يلزم إجراء عملية جراحية لتثبيت الدماغ وتمكين الحيوان من التنفس بحرية من خلال الخياشيم.
هنا ، نصف بروتوكول مسند الرأس الذي يتضمن تصميما جديدا لقضيب رأس واحد. وقت الجراحة المنخفض البالغ 25 دقيقة هو ضعف سرعة الطريقة السابقة9. نصف أيضا تصميم غرفة التسجيل (خزان شبه سداسي) ، ومرحلة الرأس وآلية القفل السريع للجمع بين الجزأين9. أخيرا ، يتم أيضا وصف الإعداد لتقديم حافز بصري غامر لدراسة نشاط الدماغ والسلوكيات التي يتم تشغيلها بصريا. بشكل عام ، يمكن استخدام الإجراءات الموضحة هنا لإجراء تصوير الكالسيوم ثنائي الفوتون في مجموعات الخلايا المحددة وراثيا في أسماك الزرد البالغة المقيدة بالرأس ، مما يتيح التحقيق في أنشطة الدماغ خلال النماذج السلوكية المختلفة.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية وتنفيذها وفقا للمبادئ التوجيهية للجنة المؤسسية لرعاية واستخدام الحيوان في Academia Sinica. يمكن العثور على تفاصيل أدوات البحث في جدول المواد.
1. إعداد غرفة التسجيل
- قم بإعداد خزان شبه سداسي ، ولوحة قاعدة ، ومرحلة رأس (الشكل 1 أ ؛ الملفات التكميلية 1-3). تتكون مرحلة الرأس من عمودين معدنيين متصلين بلوحة دائرية. تحتوي اللوحة الدائرية على أخاديد يمكن قفلها على لوحة القاعدة. بعد قفلها معا ، يتم وضع مرحلة الرأس ولوحة القاعدة في الجزء السفلي من الخزان شبه السداسي.
- ضع الخزان شبه السداسي على المنصة التجريبية للمجهر. يجب أن تكون المنصة قادرة على التحرك في الاتجاهين X و Y دون الوصول إلى حد مرحلة الترجمة.
- وجه ضوء الأشعة تحت الحمراء (IR) 810 نانومتر والكاميرا إلى مرحلة الرأس للتسجيل السلوكي. تأكد من أن مجال رؤية الكاميرا كبير بما يكفي لتناسب سمكة الزرد البالغة.
- لمنع الليزر ثنائي الفوتون والتحفيز البصري من التداخل مع التسجيل السلوكي ، قم بإعداد مرشح تمرير قصير 875 نانومتر ومرشح تمرير طويل 700 نانومتر أمام الكاميرا ، على التوالي.
- لتقديم التحفيز البصري ، قم بتوصيل أفلام الإسقاط الخلفي بالجانب الداخلي للجدران الثلاثة للخزان شبه السداسي (الشكل 1 أ).
- صوب أجهزة العرض الثلاثة على الأسطح الثلاثة للخزان. يجب محاذاة الصور الثلاث لتشكيل مشهد مرئي مستمر. لمنع أضواء جهاز العرض من تلويث إشارة مضان الكالسيوم، ضع مرشح كثافة محايد ومرشح أحمر اللون (600 نانومتر، تمرير طويل) أمام كل جهاز عرض، وضع مرشح تمرير النطاق (510/80 نانومتر) أمام أنبوب المضاعف الضوئي (PMT).
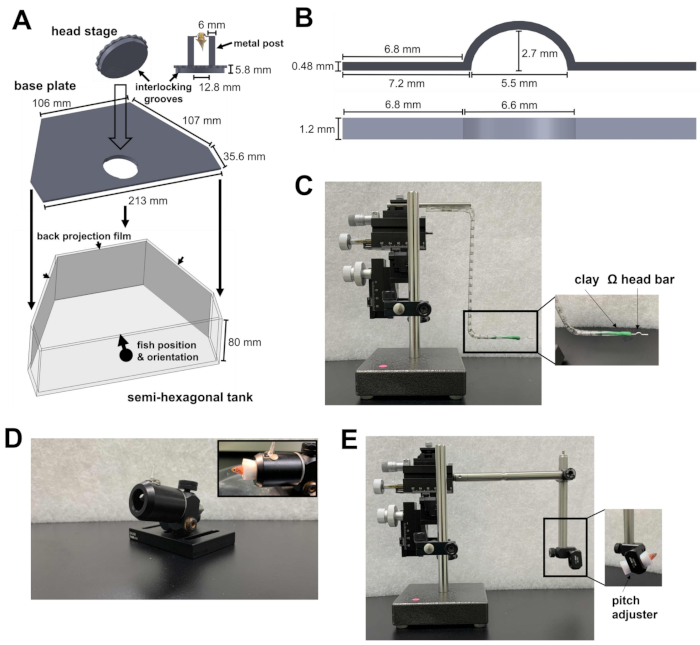
الشكل 1: الأدوات اللازمة لجراحة مسند الرأس. (أ) آلية القفل السريع بين الصفيحة الدائرية لمرحلة الرأس ولوحة القاعدة داخل الخزان شبه السداسي. يمكن العثور على ملفات التصميم بمساعدة الكمبيوتر (CAD) للأجزاء المصنوعة حسب الطلب في الملفات التكميلية 1-4. (ب) قضيب رأس على شكل Ω لمسند الرأس. (ج) المناور الدقيق ثلاثي المحاور المستخدم لوضع قضيب الرأس في موقع الملحق. أقحم: اتجاه شريط الرأس في الطين. د: مدفع لحمل السمكة أثناء الجراحة. أقحم: اتجاه الأسماك داخل المدفع. (ه) وحدة تحميل الأسماك والمناور الدقيق المستخدم لتحميل الأسماك على مرحلة الرأس. أقحم: اتجاه الأسماك داخل الوحدة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. جراحة مسند الرأس
- قم بإعداد قضيب رأس على شكل Ω (الشكل 1 ب ؛ الملف التكميلي 4) لضبط الرأس الزرد. للقيام بذلك ، قم بتوصيل قطعة من طين النمذجة القائم على الزيت بجهاز ميكرومانيكولاتور ثلاثي المحاور. تأكد من أن الطين صلب بما يكفي لتثبيت قضيب الرأس ، ولكنه ناعم بما يكفي للفصل عن قضيب الرأس بعد تثبيت الرأس.
- أدخل ذراع قضيب الرأس في الطين وقم بتوجيه قضيب الرأس أفقيا (الشكل 1C). سيضمن ذلك أن يكون المرفق اللاحق لشريط الرأس على الزرد مستويا.
ملاحظة: يمكن تصنيع قضيب الرأس من التيتانيوم (24 مجم) أو الفولاذ المقاوم للصدأ (43 مجم) ويمكن إعادة استخدامه لإجراء تجارب متعددة. لا تؤثر مادة شريط الرأس على سلوك الزرد البالغ (يتراوح الوزن من 300-1000 مجم) تحت مسند الرأس. - تحضير المدفع ، أنبوب مجوف لتثبيت جسم السمكة في مكانه أثناء الجراحة (الشكل 1 د).
- تحضير 0.03٪ و 0.01٪ ثلاثي كايين ميثان سلفونات (TMS ؛ انظر جدول المواد) في مياه حوض الأسماك. سيتم استخدام هذا لتخدير الأسماك والحفاظ عليها في حالة تخدير أثناء الجراحة.
- قم بإعداد أربع مسحات من الأنسجة لإزالة الجلد الزائد والماء من مواقع التعلق على الجمجمة. لتحضير كل مسحة ، قم بقطع منشفة ورقية إلى مربع 3 سم وقم بطيها على طول قطرها لإنتاج هيكل يشبه الأنبوب. تحريف نهايات الأنبوب إلى نقطة دقيقة. موقع المرفق صغير جدا ، لذا فإن النقطة الدقيقة تسمح بالتحكم الدقيق في المسحة.
- قم بإعداد وحدة تحميل الأسماك للمناولة الدقيقة (الشكل 1E).
ملاحظة: تتكون الوحدة من عمودين فولاذيين مثبتين معا بواسطة مشبك عمود قائم الزاوية. يتم إرفاق أحد الوظائف بالمناور الدقيق ، بينما يحمل العمود الآخر مشبكا دوارا يحمل السمكة. يتم استخدام الوحدة لوضع الأسماك على مرحلة الرأس مع التحكم الدقيق. يعمل مشبك العمود الدوار كضابط للملعب لتغيير زاوية الملعب للسمكة. - تخدير الأسماك بنسبة 0.03٪ TMS في مياه حوض الأسماك. خلال الخطوات التالية ، استخدم حقنة لتوصيل 0.01٪ TMS في ماء حوض الأسماك إلى الفم في نبضات قصيرة كل 90 ثانية. يجب أن يؤدي تدفق المياه من التروية إلى تحفيز حركة الخياشيم. سيسمح ذلك للأسماك بالبقاء على قيد الحياة لأكثر من 40 دقيقة أثناء الجراحة.
ملاحظة: يستخدم Tg[neuroD:GCaMP6f] بسبب تعبيره الواسع عن مؤشر الكالسيوم في الدماغ الأمامي في كل من مراحل اليرقات والبالغين10.
ملاحظة: اختياريا ، استخدم التروية بالجاذبية لتوفير تدفق مستمر للمياه إلى الفم خلال فترات الجراحة حيث تكون كلتا اليدين مشغولتين. - لف السمكة في كبسولة (الشكل 2 أ) تحمل السمكة داخل المدفع.
- لف السمك المخدر في قطعة من الأنسجة الورقية الرطبة بدءا من طرف الذيل إلى حوالي 1 مم ذيلية إلى الخياشيم. تأكد من أن الغلاف محكم لمنع انزلاق الأسماك خارج الأنسجة.
- لف أنبوبا بلاستيكيا ناعما بشق طولي (على سبيل المثال ، أنبوب متوسط الحجم يتقلص بالحرارة مفتوحا) حول المناديل الورقية لتغطية السمكة من نهاية الذيل إلى حوالي 2 مم ذيلية إلى الخيشومية. يضمن الأنبوب بقاء جسم السمكة مستقيما طوال الجراحة.
- لف منشفة ورقية حول الأنبوب بقطر مشابه تقريبا لقطر المدفع.
- لف أنبوبا بلاستيكيا ناعما مقطوعا من لمبة ماصة نقل بلاستيكية حول المنشفة الورقية. هذا يضمن إمكانية تحميل الكبسولة بسلاسة في المدفع.
- تحميل الأسماك في المدفع.
- استخدم مشرطا لإزالة الجلد الذي يغطي مواقع التعلق ، ومنطقتين مثلثتين من الجمجمة rostrolateral إلى المخيخ وفوق الخياشيم (الشكل 2B) ، ثم قم بإزالة الجلد الذي يغطي المنطقة الواقعة بين مواقع التعلق. استخدم مسحات الأنسجة لتجفيف مواقع التعلق وإزالة أي جلد متبقي.
- استخدم منصة قابلة للتعديل لدعم الرأس أثناء إزالة الجلد ، ولكن يجب ألا تلامس المنصة العينين لتجنب إصابة العين أثناء العملية.
ملاحظة: تعد الإزالة الشاملة للجلد في مواقع التعلق أمرا بالغ الأهمية في تقليل آثار الحركة أثناء التصوير.
- استخدم منصة قابلة للتعديل لدعم الرأس أثناء إزالة الجلد ، ولكن يجب ألا تلامس المنصة العينين لتجنب إصابة العين أثناء العملية.
- ضع قطرة من غراء الأنسجة (انظر جدول المواد) في وسط كل موقع ملحق باستخدام طرف ماصة سعة 10 ميكرولتر.
ملاحظة: يغطي غراء الأنسجة مواقع التعلق ويجف بسرعة. يوفر غراء الأنسجة واجهة ربط بين الجمجمة والأسمنت السني المستخدم للصق قضيب الرأس ، ويمنع الماء من الخياشيم من الوصول إلى موقع التعلق. - ضع جسم السمكة في وضع رأسي وضع شريط الرأس أعلى قليلا وذيلية إلى مواقع التعلق استعدادا للصق شريط الرأس.
- قم بإعداد أسمنت الأسنان (انظر جدول المواد) واستخدمه على الفور لصق قضيب الرأس بالجمجمة (الشكل 2 ج). الإجراء حساس للوقت ويجب أن يتم في غضون 45 ثانية.
- امزج ملعقة صغيرة من البوليمر مع أربع قطرات من المونومر السريع وقطرة واحدة من المحفز V. حرك الخليط بالتساوي لمدة 15 ثانية.
- استخدم ماصة صغيرة وطرف ماصة 10 ميكرولتر لتطبيق الخليط على مواقع التعلق والمنطقة بين المواقع. تجنب تغطية الخياشيم والعينين.
- اضغط برفق على قضيب الرأس على الأسمنت باستخدام المعالج الدقيق. قم بتغطية قضيب الرأس بالأسمنت المتبقي.
- انتظر لمدة 12 دقيقة للسماح بمعالجة الأسمنت السني. تجنب ملامسة الماء للأسمنت.
- لتحسين الوصول البصري إلى الدماغ الأمامي لتصوير الكالسيوم ، قم بإزالة الجلد فوق الدماغ الدماغي. يمكن إزالة الجلد في 3 دقائق بخمس جروح باستخدام مشرط (الشكل 2 د). تأكد من إزالة قطرات الدهون الملتصقة بسطح الجماجم.
- بعد المعالجة ، قم بإزالة الطين من شريط الرأس.
- انقل الكبسولة بأكملها من المدفع إلى ضابط الملعب في وحدة تحميل الأسماك في جهاز المعالجة الدقيقة.
- استخدم المناور الدقيق لوضع السمكة. يجب وضع شريط الرأس أعلى الأعمدة المعدنية لمرحلة الرأس. قم بزيادة زاوية الملعب للأسماك قليلا بحيث يمكن محاذاة سطح الدماغ الأمامي بشكل أفضل مع المستوى البصري أثناء التصوير ثنائي الفوتون.
- قم بلصق شريط الرأس على الأعمدة المعدنية باستخدام غراء قابل للشفاء بالأشعة فوق البنفسجية (UV). التعرض للأشعة فوق البنفسجية 15 ثانية يكفي للعلاج.
- اسحب السمكة من الكبسولة وأغلق مرحلة الرأس على لوحة القاعدة داخل الخزان شبه السداسي.
- اغمر الحيوان في ماء حوض السمك. يجب أن تبدأ الأسماك في التنفس وتتعافى من التخدير في غضون 1-2 دقيقة.
ملاحظة: اختياريا ، استخدم تروية المحقنة لتوصيل المياه العذبة إلى الفم.
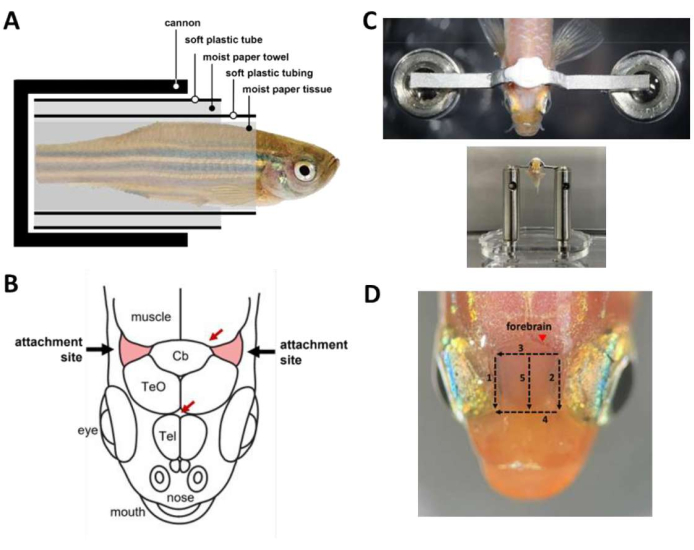
الشكل 2: الخطوات الرئيسية أثناء جراحة تقييد الرأس. أ: تركيب الكبسولة داخل المدفع. ب: مواقع التعلق على الجمجمة (حمراء). تحدد الأسهم الحمراء مواقع الأوعية الدموية. (ج) الجزء العلوي: قضيب رأس متصل بجمجمة السمكة. القاع: الأسماك المحملة على مرحلة الرأس. د: الجروح اللازمة لإزالة الجلد فوق الدماغ الأمامي. تشير الأرقام إلى تسلسل القطع. تجنب إزالة الجلد في الموقع المحدد (رأس السهم) لمنع نزيف الحيوان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. التصوير ثنائي الفوتون
- قم بتشغيل الليزر وانتظر لمدة 30 دقيقة حتى تستقر الطاقة. اضبط الطول الموجي على 920 نانومتر والطاقة على حوالي 50 ميجاوات في العينة.
ملاحظة: يتحرك شعاع الليزر الذي يتم التحكم فيه بواسطة الماسح الضوئي الرنيني ببطء عند نقاط تحول مسار المسح. لمنع تلف الأنسجة ، يتم استخدام خلية Pockels لتقليل طاقة الليزر عند نقاط التحول. - ضع غرفة التسجيل التي تحتوي على سمك الزرد المقيد الرأس على المنصة التجريبية (الشكل 3 أ). يجب أن تكون المنصة قادرة على التحرك في الاتجاهين X و Y دون الوصول إلى حد مرحلة الترجمة.
- ضع العدسة الشيئية في أقرب مكان ممكن من سطح الدماغ الأمامي. يجب أن تستهدف العدسة الموضوعية الحافة الأمامية للتلميذ (الشكل 3 ب).
- افتح مصراع الليزر وقم بتمكين PMT. ارفع العدسة الشيئية تدريجيا (~ 1 مم) حتى يتم الكشف عن الدماغ الأمامي الظهري في صورة التألق (الشكل 3C).
- لزيادة عدد الخلايا العصبية المسجلة ، استخدم مشغل بيزو للحصول على صور على أعماق متعددة (ست طائرات صور ، على بعد 15 ميكرومتر). سيؤدي ذلك إلى زيادة عائد البيانات على حساب معدل الإطارات. قم بتمكين المسح السريع للمحور Z للتحكم في مشغل بيزو (الوضع الموحد ، عدد الشرائح = 6 ، حجم الخطوة = 15 ميكرومتر ، الشكل الموجي = سن المنشار ، وقت الارتداد = 4 مللي ثانية ، تأخر المشغل = 8 مللي ثانية).
- لتسجيل السلوك ، قم بتشغيل مصابيح الأشعة تحت الحمراء (IR) 810 نانومتر على جانبي الخزان. اضبط الزاوية لإضاءة الجسم بالكامل ، والتي يجب أن تكون مرئية بوضوح في الكاميرا.
- قم بتشغيل أجهزة العرض.
- ابدأ تسجيل البيانات.
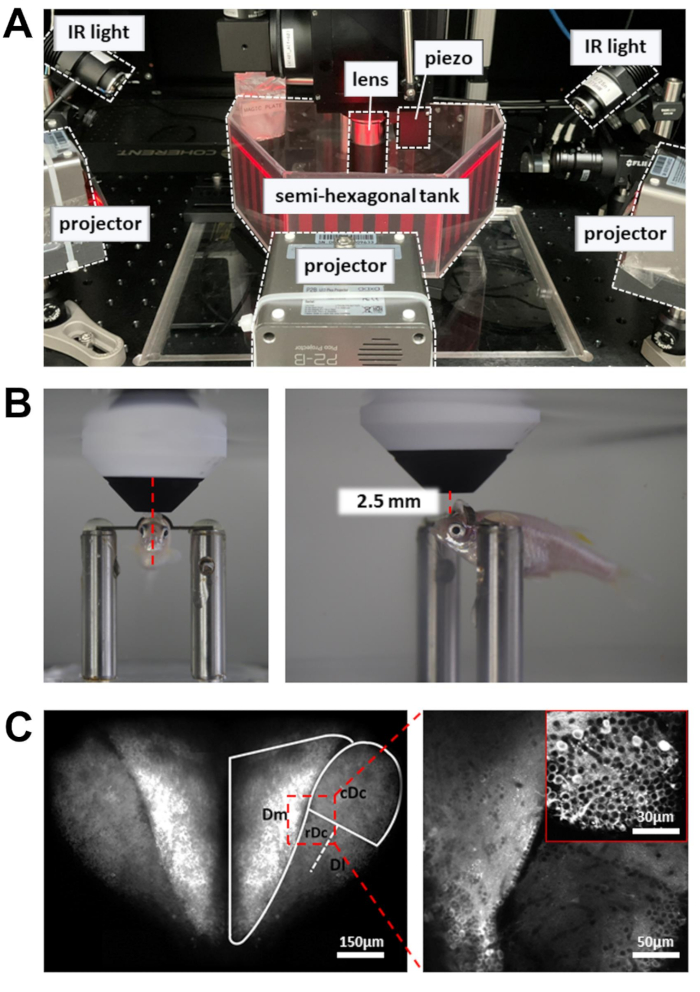
الشكل 3: الإعداد لإجراء تصوير الكالسيوم، وتسجيل السلوك، وعرض المثير البصري . (أ) تقدم ثلاثة أجهزة عرض مثيرا بصريا على جدران الخزان شبه السداسي. تستخدم مصابيح الأشعة تحت الحمراء على الجانب لإضاءة جسم الزرد. (ب) وضع العدسة الموضوعية. اليسار: منظر أمامي. اليمين: منظر جانبي. تبلغ المسافة بين العدسة الشيئية 16x ومنطقة الدماغ المستهدفة حوالي 2.5 مم. (ج) مثال على صورة ثنائية الفوتون. اليسار: أقصى إسقاط للدماغ الأمامي الظهري بأكمله في Tg [neuroD: GCaMP6f]. على اليمين: صورة مكبرة للكشف عن الخلايا العصبية عبر مناطق متعددة من الدماغ. أقحم: تكبير أعلى من منطقة مختلفة من الدماغ. الصور هي متوسطات 10 ثوان من البيانات المسجلة عند 5 هرتز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
يتكون البروتوكول من جزأين: جراحة تقييد الرأس وتصوير الكالسيوم ثنائي الفوتون للأنشطة العصبية في الدماغ الأمامي. يتم تعريف نجاح الجراحة من خلال بقاء الحيوان واستقرار مسند الرأس. يمكن تحسين معدل البقاء على قيد الحياة بشكل كبير عن طريق التروية المتكررة لمحلول TMS بنسبة 0.01٪ عن طريق الفم أثناء ا...
Discussion
هنا ، نصف بروتوكولا مفصلا لتقييد رأس الزرد البالغ لتصوير الكالسيوم ثنائي الفوتون. هناك خطوتان حاسمتان لتحقيق مسند رأس مستقر بدرجة كافية للتصوير بالمسح الضوئي بالليزر. أولا ، يجب لصق شريط الرأس على مواقع التعلق المحددة للجماجم. غالبا ما تكون الأجزاء الأخرى من الجمجمة رقيقة جدا بحيث لا توف?...
Disclosures
ويعلن صاحبا البلاغ أنه ليس لهما مصالح مالية متنافسة.
Acknowledgements
تم دعم هذا العمل من قبل معهد البيولوجيا الجزيئية ، Academia Sinica ، والمجلس الوطني للعلوم والتكنولوجيا ، تايوان. ساعد متجر الآلات في معهد الفيزياء ، أكاديميا سينيكا في تصنيع أجزاء مصممة خصيصا. نود أيضا أن نشكر P. Argast (معهد فريدريش ميشر للبحوث الطبية الحيوية ، بازل ، سويسرا) على تصميم آلية القفل السريع لمرحلة الرأس.
Materials
| Name | Company | Catalog Number | Comments |
| Acquisition card | MBF Bioscience | Vidrio vDAQ | Microscope |
| Back-projection film | Kimoto | Diland screen - GSK | present visual stimulus |
| Band-pass filter (510/80 nm) | Chroma | ET510/80m | Microscope |
| Base plate for the semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Camera filter (<875 nm) | Edmund optics | #86-106 | Behavior recording |
| Camera filter (>700 nm) | Edmund optics | #43-949 | Behavior recording |
| Camera lens | Thorlabs | MVL50M23 | Behavior recording |
| Chameleon Vision-S | Coherent | Vision-S | Laser |
| Circular plate for the head stage | custom made | see supplemental files | recording chamber |
| Controller for piezo actuator | Physik Instrumente | E-665. CR | Microscope |
| Current amplifier | Thorlabs | TIA60 | Microscope |
| Elitedent Q-6 | Rolence Enterprise | Q-6 | Surgery: UV lamp |
| Emission Filter 510/80 nm | Chroma | ET510/80m | Microscope |
| Head bar | custom made | see supplemental files | recording chamber |
| Infrared light | Thorlabs | M810L3 | Behavior recording |
| LED projector | AAXA | P2B LED Pico Projector | present visual stimulus |
| Moist paper tissue (Kimwipe) | Kimtech Science | 34155 | Surgery: moist paper tissue |
| Motorized XY sample stage | Zaber | X-LRM050 | Microscope |
| Neutral Density Filters (50% Transmission) | Thorlabs | NE203B | present visual stimulus |
| Ø1/2" Post Holder | ThorLabs | PH1.5V | Surgery: hollow tube for cannon |
| Ø1/2" Stainless Steel Optical Post | ThorLabs | TR150/M | Surgery: fish loading module |
| Objective lens 16x, 0.8NA | Nikon | CF175 | Microscope |
| Oil-based modeling clay | Ly Hsin Clay | C4086 | Surgery: head bar holder |
| Optical adhesive | Norland Products | NOA68 | Surgery: UV curable glue |
| Photomultiplier tube | Hamamatsu | H11706P-40 | Microscope |
| Piezo actuator | Physik Instrumente | P-725.4CA PIFOC | Microscope |
| Pockels Cell | Conoptics | M350-80-LA-BK-02 | Microscope |
| Red Wratten filter (> 600 nm) | Edmund optics | #53-699 | present visual stimulus |
| Resonant-Galvo Scan System | INSS | RGE-02 | Microscope |
| Right-Angle Clamp for Ø1/2" Post | ThorLabs | RA90/M | Surgery: fish loading module |
| Rotating Clamp for Ø1/2" Post | ThorLabs | SWC/M | Surgery: fish loading module |
| ScanImage | MBF Bioscience | Basic version | Microscope |
| Semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Super-Bond C&B Kit | Sun Medical Co. | Super-Bond C&B | Surgery: dental cement |
| Tricaine methanesulfonate | Sigma Aldrich | E10521 | Surgery: anesthetic |
| USB Camera | FLIR | BFS-U3-13Y3M-C | Behavior recording |
| Vetbond | 3M | 1469SB | Surgery: tissue glue |
References
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit neuroscience in zebrafish. Current Biology. 20 (8), R371-R381 (2010).
- Kappel, J. M., et al. Visual recognition of social signals by a tectothalamic neural circuit. Nature. 608 (7921), 146-152 (2022).
- Bartoszek, E. M., et al. Ongoing habenular activity is driven by forebrain networks and modulated by olfactory stimuli. Current Biology. 31 (17), 3861-3874 (2021).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning & Memory. 19 (4), 170-177 (2012).
- Buske, C., Gerlai, R. Maturation of shoaling behavior is accompanied by changes in the dopaminergic and serotoninergic systems in zebrafish. Developmental Psychobiology. 54 (1), 28-35 (2012).
- Huang, K. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Rupprecht, P., Prendergast, A., Wyart, C., Friedrich, R. W. Remote z-scanning with a macroscopic voice coil motor for fast 3D multiphoton laser scanning microscopy. Biomedical Optics Express. 7 (5), 1656-1671 (2016).
- Papadopoulos, I. N., Jouhanneau, J. -. S., Poulet, J. F. A., Judkewitz, B. Scattering compensation by focus scanning holographic aberration probing (F-SHARP). Nature Photonics. 11 (2), 116-123 (2017).
- Torigoe, M., et al. Zebrafish capable of generating future state prediction error show improved active avoidance behavior in virtual reality. Nature Communications. 12 (1), 5712 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved