Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imágenes de calcio de dos fotones de la actividad del prosencéfalo en peces cebra adultos que se comportan
En este artículo
Resumen
Aquí, presentamos un protocolo para realizar imágenes de calcio de dos fotones en el prosencéfalo dorsal de pez cebra adulto.
Resumen
El pez cebra adulto (Danio rerio) exhibe un rico repertorio de comportamientos para estudiar las funciones cognitivas. También tienen un cerebro en miniatura que se puede utilizar para medir las actividades en todas las regiones del cerebro a través de métodos de imágenes ópticas. Sin embargo, los informes sobre el registro de la actividad cerebral en el pez cebra adulto han sido escasos. El presente estudio describe los procedimientos para realizar imágenes de calcio de dos fotones en el prosencéfalo dorsal del pez cebra adulto. Nos centramos en los pasos para evitar que los peces cebra adultos muevan la cabeza, lo que proporciona una estabilidad que permite la obtención de imágenes de escaneo láser de la actividad cerebral. Los animales con la cabeza sujeta pueden mover libremente las partes de su cuerpo y respirar sin ayudas. El procedimiento tiene como objetivo acortar el tiempo de la cirugía del reposacabezas, minimizar el movimiento del cerebro y maximizar el número de neuronas registradas. Aquí también se describe una configuración para presentar un entorno visual inmersivo durante las imágenes de calcio, que se puede utilizar para estudiar los correlatos neuronales subyacentes a los comportamientos desencadenados visualmente.
Introducción
Las imágenes de fluorescencia de calcio con indicadores codificados genéticamente o colorantes sintéticos han sido un método poderoso para medir la actividad neuronal en animales que se comportan, incluidos primates no humanos, roedores, aves e insectos. La actividad de cientos de células, hasta aproximadamente 800 μm por debajo de la superficie del cerebro, puede medirse simultáneamente utilizando imágenes multifotónicas 2,3. La actividad de tipos celulares específicos también se puede medir mediante la expresión de indicadores de calcio en poblaciones neuronales definidas genéticamente. La aplicación del método de imagen para modelos de pequeños vertebrados abre nuevas posibilidades en el campo de la computación neuronal en todas las regiones cerebrales.
El pez cebra es un sistema modelo ampliamente utilizado en la investigación en neurociencia. Las larvas de pez cebra alrededor de 6 días después de la fertilización se han utilizado para obtener imágenes de calcio debido a su cerebro en miniatura y su cuerpo transparente4. Los peces cebra juveniles (3-4 semanas de edad) también se utilizan para estudiar los mecanismos neuronales que subyacen a las vías sensoriomotoras 5,6. Sin embargo, el nivel máximo de rendimiento para conductas complejas, incluyendo el aprendizaje asociativo y las conductas sociales, se alcanza a una edad más avanzada 7,8. Por lo tanto, se requiere un protocolo confiable para estudiar múltiples funciones cognitivas en el cerebro de peces cebra adultos utilizando métodos de imagen. Mientras que las larvas de pez cebra y los peces cebra juveniles pueden incluirse en agarosa para obtener imágenes in vivo, los peces cebra adultos a los 2 meses o más sufren de hipoxia en tales condiciones y son físicamente demasiado fuertes para ser restringidos por agarosa. Por lo tanto, se requiere un procedimiento quirúrgico para estabilizar el cerebro y permitir que el animal respire libremente a través de las branquias.
Aquí, describimos un protocolo de reposacabezas que implica un diseño novedoso de una sola barra para la cabeza. El tiempo quirúrgico reducido de 25 min es dos veces más rápido que el método anterior9. También describimos el diseño de la cámara de registro (tanque semihexagonal), la etapa de la cabeza y un mecanismo de bloqueo rápido para combinar las dos partes9. Por último, también se describe la configuración para presentar un estímulo visual inmersivo para estudiar la actividad y los comportamientos cerebrales activados visualmente. En general, los procedimientos descritos aquí se pueden utilizar para realizar imágenes de calcio de dos fotones en poblaciones celulares definidas genéticamente en un pez cebra adulto con la cabeza restringida, lo que permite la investigación de las actividades cerebrales durante varios paradigmas de comportamiento.
Protocolo
Todos los procedimientos con animales fueron aprobados y realizados de acuerdo con los lineamientos del Comité Institucional de Cuidado y Uso de Animales de Academia Sinica. Los detalles de las herramientas de investigación se pueden encontrar en la Tabla de Materiales.
1. Preparación de la cámara de registro
- Prepare un tanque semihexagonal, una placa base y una etapa de cabeza (Figura 1A; Legajos Complementarios 1-3). La etapa principal consta de dos postes metálicos unidos a una placa circular. La placa circular contiene ranuras que se pueden bloquear en la placa base. Después de estar unidas, la etapa principal y la placa base se colocan en el fondo del tanque semihexagonal.
- Coloque el tanque semihexagonal en la plataforma experimental del microscopio. La plataforma debe ser capaz de moverse en las direcciones X e Y sin llegar al límite de la etapa de traducción.
- Apunte la luz infrarroja (IR) de 810 nm y la cámara hacia el escenario de la cabeza para registrar el comportamiento. Asegúrese de que el campo de visión de la cámara sea lo suficientemente grande como para que quepa un pez cebra adulto.
- Para evitar que el láser de dos fotones y el estímulo visual interfieran con el registro del comportamiento, instale un filtro de paso corto de 875 nm y un filtro de paso largo de 700 nm frente a la cámara, respectivamente.
- Para presentar el estímulo visual, coloque películas de retroproyección en el lado interior de las tres paredes del tanque semihexagonal (Figura 1A).
- Apunta los tres proyectores a las tres superficies del tanque. Las tres imágenes deben estar alineadas para formar una escena visual continua. Para evitar que las luces del proyector contaminen la señal de fluorescencia de calcio, coloque un filtro de densidad neutra y un filtro de color rojo (600 nm, paso largo) delante de cada proyector, y coloque un filtro de paso de banda (510/80 nm) delante del tubo fotomultiplicador (PMT).
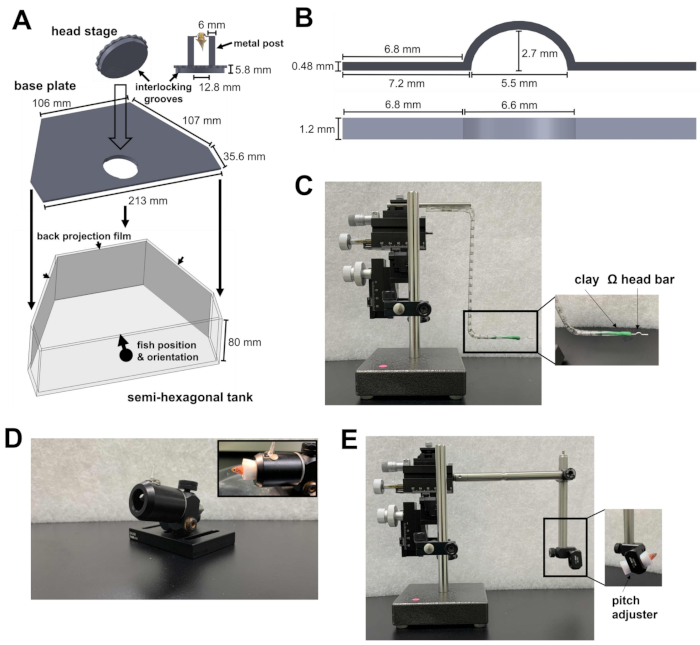
Figura 1: Instrumentos necesarios para la cirugía del reposacabezas. (A) El mecanismo de bloqueo rápido entre la placa circular de la etapa de cabeza y la placa base dentro del tanque semihexagonal. Los archivos de diseño asistido por computadora (CAD) de las piezas hechas a medida se pueden encontrar en los archivos complementarios 1-4. (B) Barra de cabeza en forma de Ω para el reposacabezas. (C) El micromanipulador de tres ejes utilizado para colocar la barra de cabeza en el sitio de fijación. Recuadro: orientación de la barra de cabeza en la arcilla. (D) Cañón para sujetar al pez durante la cirugía. Recuadro: orientación de los peces dentro del cañón. (E) Módulo de carga de pescado y el micromanipulador utilizado para cargar el pescado en la etapa de cabeza. Recuadro: orientación de los peces dentro del módulo. Haga clic aquí para ver una versión más grande de esta figura.
2. Cirugía de reposacabezas
- Prepare una barra de cabeza en forma de Ω (Figura 1B; Expediente Complementario 4) para el reposacabezas del pez cebra. Para hacer esto, adhiera un trozo de arcilla de modelar a base de aceite a un micromanipulador de tres ejes. Asegúrese de que la arcilla sea lo suficientemente sólida como para sostener la barra de la cabeza, pero lo suficientemente suave como para desprenderse de la barra de la cabeza después del reposacabezas.
- Inserte un brazo de la barra de cabeza en la arcilla y oriente la barra de cabeza horizontalmente (Figura 1C). Esto asegurará que la fijación posterior de la barra de cabeza en el pez cebra esté nivelada.
NOTA: La barra de cabeza puede estar hecha de titanio (24 mg) o acero inoxidable (43 mg) y se puede reutilizar para múltiples experimentos. El material de la barra de cabeza no afecta el comportamiento del pez cebra adulto (el peso oscila entre 300 y 1.000 mg) bajo un reposacabezas. - Prepare el cañón, un tubo hueco para mantener el cuerpo del pez en su lugar durante la cirugía (Figura 1D).
- Prepare metanosulfonato de tricaína al 0,03% y al 0,01% (TMS; ver Tabla de Materiales) en agua de pecera. Esto se utilizará para anestesiar y mantener a los peces en un estado de sedación durante la cirugía.
- Prepare cuatro hisopos de tejido para eliminar el exceso de piel y agua de los sitios de unión en el cráneo. Para preparar cada hisopo, corta una toalla de papel en un cuadrado de 3 cm y dóblala a lo largo de su diagonal para producir una estructura similar a un tubo. Retuerce los extremos del tubo en una punta fina. El sitio de fijación es muy pequeño, por lo que una punta fina permite un control más fino del hisopo.
- Prepare un módulo de carga de pescado para el micromanipulador (Figura 1E).
NOTA: El módulo consta de dos postes de acero unidos por una abrazadera de poste en ángulo recto. Un poste se conecta al micromanipulador, mientras que el otro poste sostiene una abrazadera de poste giratoria que transporta el pescado. El módulo se utiliza para colocar el pez en el escenario de la cabeza con un control fino. La abrazadera giratoria del poste sirve como ajustador de cabeceo para cambiar el ángulo de cabeceo del pez. - Anestesiar a los peces con 0,03% de TMS en el agua de la pecera. A lo largo de los siguientes pasos, use una jeringa para administrar 0.01% de TMS en agua de pecera a la boca en pulsos cortos cada 90 s. El flujo de agua de la perfusión debe inducir el movimiento de las branquias. Esto permitirá que los peces sobrevivan durante más de 40 minutos durante la cirugía.
NOTA: Tg[neuroD:GCaMP6f] se utiliza debido a su amplia expresión del indicador de calcio en el prosencéfalo tanto en la etapa larvaria como en la adulta10.
NOTA: Opcionalmente, use la perfusión por gravedad para proporcionar un flujo constante de agua a la boca durante los períodos de cirugía en los que ambas manos están ocupadas. - Envuelva el pez en una cápsula (Figura 2A) que contenga el pez dentro del cañón.
- Envuelva el pescado anestesiado en un trozo de papel húmedo comenzando desde la punta de la cola hasta aproximadamente 1 mm caudal hasta la branquia. Asegúrese de que la envoltura esté apretada para evitar que el pescado se deslice fuera del tejido.
- Envuelva un tubo de plástico blando con una hendidura longitudinal (por ejemplo, un tubo termorretráctil de tamaño mediano abierto) alrededor del pañuelo de papel para cubrir el pescado desde el extremo de la cola hasta unos 2 mm caudal hasta la branquia. El tubo asegura que el cuerpo del pez permanezca recto durante toda la cirugía.
- Envuelve el tubo con una toalla de papel hasta que tenga un diámetro similar al del cañón.
- Envuelva la toalla de papel con un tubo de plástico suave cortado del bulbo de una pipeta de transferencia de plástico. Esto asegura que la cápsula se pueda cargar sin problemas en el cañón.
- Carga el pescado en el cañón.
- Use un bisturí para quitar la piel que cubre los sitios de inserción, dos áreas triangulares del cráneo rostrolateral al cerebelo y por encima de las branquias (Figura 2B), luego retire la piel que cubre la región entre los sitios de inserción. Use hisopos de papel para secar los sitios de adhesión y limpiar cualquier resto de piel.
- Utilice una plataforma ajustable para apoyar la cabeza durante la extracción de la piel, pero la plataforma no debe entrar en contacto con los ojos para evitar lesiones oculares durante la operación.
NOTA: La extracción completa de la piel en los sitios de unión es crucial para reducir los artefactos de movimiento durante la obtención de imágenes.
- Utilice una plataforma ajustable para apoyar la cabeza durante la extracción de la piel, pero la plataforma no debe entrar en contacto con los ojos para evitar lesiones oculares durante la operación.
- Aplique una gota de pegamento para tejidos (consulte la Tabla de materiales) en el centro de cada sitio de fijación con una punta de pipeta de 10 μL.
NOTA: El pegamento para tejidos cubre los sitios de fijación y se seca rápidamente. El pegamento tisular proporciona una interfaz de unión entre el cráneo y el cemento dental utilizado para pegar la barra de la cabeza, y evita que el agua de las branquias llegue al sitio de fijación. - Coloque el cuerpo del pez en posición vertical y coloque la barra de la cabeza ligeramente por encima y caudal a los sitios de fijación en preparación para el pegado de la barra de la cabeza.
- Prepare el cemento dental (ver Tabla de Materiales) y utilícelo inmediatamente para pegar la barra de la cabeza al cráneo (Figura 2C). El procedimiento es urgente y debe realizarse en un plazo de 45 s.
- Mezclar una cucharada pequeña de polímero con cuatro gotas de monómero rápido y una gota de catalizador V. Remover la mezcla uniformemente durante 15 s.
- Utilice una micropipeta y una punta de pipeta de 10 μL para aplicar la mezcla en los sitios de fijación y en la región entre los sitios. Evite cubrir las branquias y los ojos.
- Presione suavemente la barra de cabeza sobre el cemento con el micromanipulador. Cubra la barra de cabeza con el cemento restante.
- Espere 12 minutos para permitir el curado del cemento dental. Evite el contacto del agua con el cemento.
- Para mejorar el acceso óptico al prosencéfalo para obtener imágenes de calcio, retire la piel por encima del telencéfalo. La eliminación de la piel se puede realizar en 3 minutos con cinco cortes con bisturí (Figura 2D). Asegúrese de eliminar las gotas de lípidos adheridas a la superficie de los cráneos.
- Después del curado, retire la arcilla de la barra principal.
- Transfiera toda la cápsula del cañón al ajustador de cabeceo en el módulo de carga de pescado del micromanipulador.
- Usa el micromanipulador para posicionar el pez. La barra de cabeza debe colocarse encima de los postes metálicos de la etapa principal. Aumente ligeramente el ángulo de cabeceo del pez para que la superficie del prosencéfalo pueda alinearse mejor con el plano óptico durante la obtención de imágenes de dos fotones.
- Pegue la barra de la cabeza a los postes de metal con pegamento curable ultravioleta (UV). Una exposición UV de 15 s es suficiente para el curado.
- Saque el pez de la cápsula y bloquee la etapa de la cabeza en la placa base dentro del tanque semihexagonal.
- Sumerge al animal en el agua de la pecera. El pez debe comenzar a respirar y recuperarse de la anestesia en 1-2 minutos.
NOTA: Opcionalmente, use una jeringa de perfusión para llevar agua fresca a la boca.
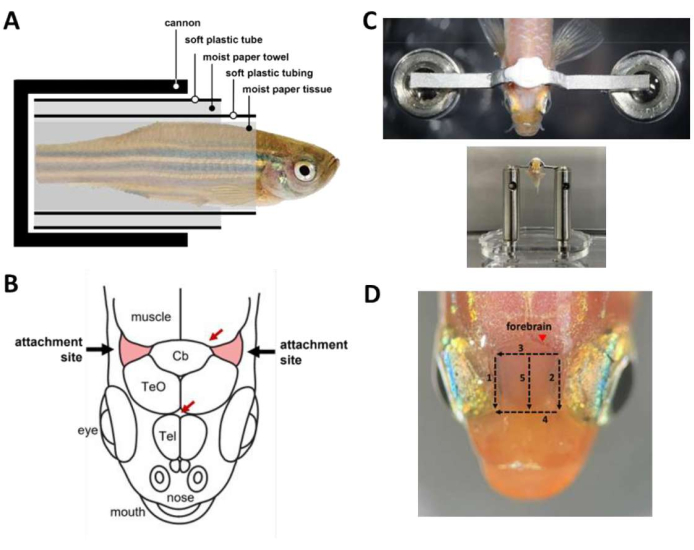
Figura 2: Pasos clave durante la cirugía del reposacabezas . (A) Composición de la cápsula dentro del cañón. (B) Sitios de inserción en el cráneo (rojo). Las flechas rojas especifican los sitios de los vasos sanguíneos. (C) Arriba: barra de cabeza unida al cráneo del pez. Fondo: peces cargados en el escenario de la cabeza. (D) Cortes necesarios para eliminar la piel por encima del prosencéfalo. Los números denotan la secuencia de corte. Evite la extracción de la piel en el sitio marcado (punta de flecha) para evitar el sangrado del animal. Haga clic aquí para ver una versión más grande de esta figura.
3. Imágenes de dos fotones
- Encienda el láser y espere 30 minutos para que la energía se estabilice. Ajuste la longitud de onda a 920 nm y la potencia a unos 50 mW en la muestra.
NOTA: El rayo láser controlado por el escáner resonante se mueve lentamente en los puntos de giro de la trayectoria de escaneo. Para evitar daños en los tejidos, se utiliza una célula de Pockels para reducir la potencia del láser en los puntos de respuesta. - Coloque la cámara de registro que contiene el pez cebra con la cabeza sujeta en la plataforma experimental (Figura 3A). La plataforma debe ser capaz de moverse en las direcciones X e Y sin llegar al límite de la etapa de traducción.
- Coloque la lente del objetivo lo más cerca posible de la superficie del prosencéfalo. La lente del objetivo debe apuntar hacia el borde frontal de la pupila (Figura 3B).
- Abra el obturador láser y habilite el PMT. Eleve gradualmente la lente del objetivo (~1 mm) hasta que el prosencéfalo dorsal se revele en la imagen de fluorescencia (Figura 3C).
- Para aumentar el número de neuronas registradas, utilice un actuador piezoeléctrico para adquirir imágenes a múltiples profundidades (seis planos de imagen, separados por 15 μm). Esto aumentará el rendimiento de los datos a expensas de la velocidad de fotogramas. Habilite el escaneo rápido del eje Z para controlar el actuador piezoeléctrico (modo uniforme, número de cortes = 6, tamaño de paso = 15 μm, forma de onda = diente de sierra, tiempo de retorno = 4 ms, retraso del actuador = 8 ms).
- Para registrar el comportamiento, encienda las luces infrarrojas (IR) de 810 nm a ambos lados del tanque. Ajuste el ángulo para iluminar todo el cuerpo, que debe ser claramente visible en la cámara.
- Encienda los proyectores.
- Comience a registrar datos.
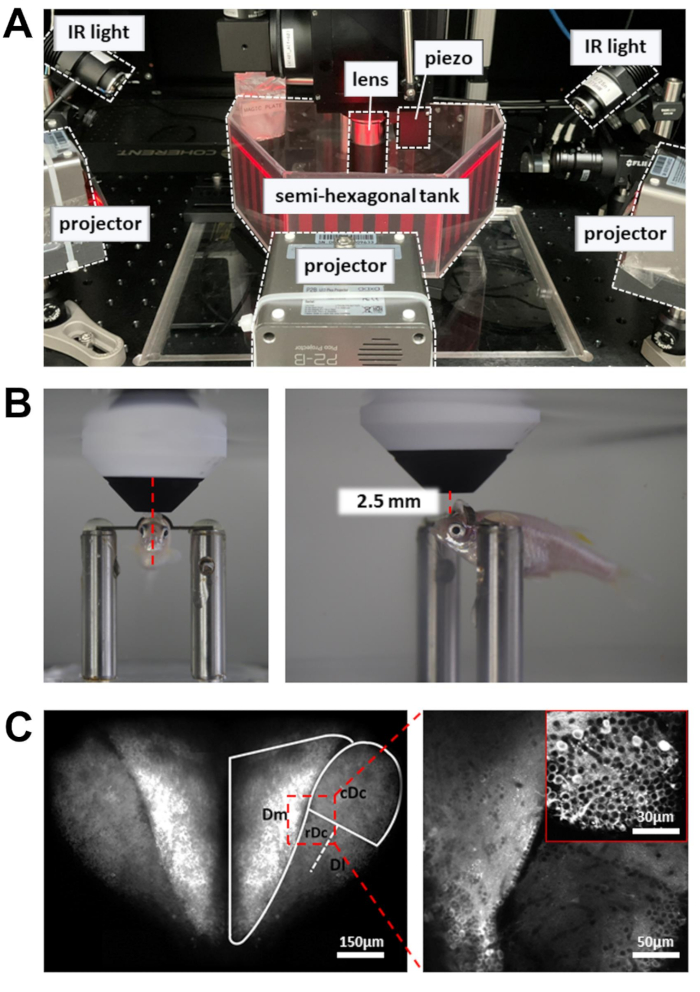
Figura 3: Configuración para realizar imágenes de calcio, registro de comportamiento y visualización de estímulos visuales . (A) Tres proyectores presentan un estímulo visual en las paredes del tanque semihexagonal. Las luces infrarrojas en el lateral se utilizan para iluminar el cuerpo del pez cebra. (B) Posicionamiento de la lente del objetivo. Izquierda: vista frontal. Derecha: vista lateral. La distancia entre la lente del objetivo de 16x y la región del cerebro objetivo es de alrededor de 2,5 mm. (C) Ejemplo de imagen de dos fotones. Izquierda: proyección máxima de todo el prosencéfalo dorsal en Tg[neuroD:GCaMP6f]. Derecha: imagen ampliada para revelar neuronas en múltiples regiones del cerebro. Recuadro: un aumento más alto de una región diferente del cerebro. Las imágenes son promedios de 10 s de datos grabados a 5 Hz. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
El protocolo consta de dos partes: cirugía de reposacabezas e imágenes de calcio de dos fotones de las actividades neuronales en el prosencéfalo. El éxito de la cirugía se define por la supervivencia del animal y la estabilidad del reposacabezas. La tasa de supervivencia puede mejorarse en gran medida mediante la perfusión frecuente de una solución de TMS al 0,01% a través de la boca durante la cirugía. Los peces deben recuperarse de la anestesia y respirar activamente dentro de 1-2 minutos después de sumergirs...
Discusión
Aquí, describimos un protocolo detallado para sujetar la cabeza de un pez cebra adulto para obtener imágenes de calcio de dos fotones. Hay dos pasos críticos para lograr un reposacabezas que sea lo suficientemente estable para las imágenes de escaneo láser. Primero, la barra de la cabeza debe pegarse a los sitios de fijación específicos de los cráneos. Otras partes del cráneo suelen ser demasiado delgadas para proporcionar estabilidad mecánica e incluso pueden fracturarse durante los movimientos fuertes del cue...
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos.
Agradecimientos
Este trabajo contó con el apoyo del Instituto de Biología Molecular, la Academia Sinica y el Consejo Nacional de Ciencia y Tecnología de Taiwán. El Taller de Máquinas del Instituto de Física de la Academia Sinica ayudó a fabricar piezas diseñadas a medida. También queremos agradecer a P. Argast (Instituto Friedrich Miescher de Investigación Biomédica, Basilea, Suiza) por el diseño del mecanismo de bloqueo rápido de la platina de la cabeza.
Materiales
| Name | Company | Catalog Number | Comments |
| Acquisition card | MBF Bioscience | Vidrio vDAQ | Microscope |
| Back-projection film | Kimoto | Diland screen - GSK | present visual stimulus |
| Band-pass filter (510/80 nm) | Chroma | ET510/80m | Microscope |
| Base plate for the semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Camera filter (<875 nm) | Edmund optics | #86-106 | Behavior recording |
| Camera filter (>700 nm) | Edmund optics | #43-949 | Behavior recording |
| Camera lens | Thorlabs | MVL50M23 | Behavior recording |
| Chameleon Vision-S | Coherent | Vision-S | Laser |
| Circular plate for the head stage | custom made | see supplemental files | recording chamber |
| Controller for piezo actuator | Physik Instrumente | E-665. CR | Microscope |
| Current amplifier | Thorlabs | TIA60 | Microscope |
| Elitedent Q-6 | Rolence Enterprise | Q-6 | Surgery: UV lamp |
| Emission Filter 510/80 nm | Chroma | ET510/80m | Microscope |
| Head bar | custom made | see supplemental files | recording chamber |
| Infrared light | Thorlabs | M810L3 | Behavior recording |
| LED projector | AAXA | P2B LED Pico Projector | present visual stimulus |
| Moist paper tissue (Kimwipe) | Kimtech Science | 34155 | Surgery: moist paper tissue |
| Motorized XY sample stage | Zaber | X-LRM050 | Microscope |
| Neutral Density Filters (50% Transmission) | Thorlabs | NE203B | present visual stimulus |
| Ø1/2" Post Holder | ThorLabs | PH1.5V | Surgery: hollow tube for cannon |
| Ø1/2" Stainless Steel Optical Post | ThorLabs | TR150/M | Surgery: fish loading module |
| Objective lens 16x, 0.8NA | Nikon | CF175 | Microscope |
| Oil-based modeling clay | Ly Hsin Clay | C4086 | Surgery: head bar holder |
| Optical adhesive | Norland Products | NOA68 | Surgery: UV curable glue |
| Photomultiplier tube | Hamamatsu | H11706P-40 | Microscope |
| Piezo actuator | Physik Instrumente | P-725.4CA PIFOC | Microscope |
| Pockels Cell | Conoptics | M350-80-LA-BK-02 | Microscope |
| Red Wratten filter (> 600 nm) | Edmund optics | #53-699 | present visual stimulus |
| Resonant-Galvo Scan System | INSS | RGE-02 | Microscope |
| Right-Angle Clamp for Ø1/2" Post | ThorLabs | RA90/M | Surgery: fish loading module |
| Rotating Clamp for Ø1/2" Post | ThorLabs | SWC/M | Surgery: fish loading module |
| ScanImage | MBF Bioscience | Basic version | Microscope |
| Semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Super-Bond C&B Kit | Sun Medical Co. | Super-Bond C&B | Surgery: dental cement |
| Tricaine methanesulfonate | Sigma Aldrich | E10521 | Surgery: anesthetic |
| USB Camera | FLIR | BFS-U3-13Y3M-C | Behavior recording |
| Vetbond | 3M | 1469SB | Surgery: tissue glue |
Referencias
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit neuroscience in zebrafish. Current Biology. 20 (8), R371-R381 (2010).
- Kappel, J. M., et al. Visual recognition of social signals by a tectothalamic neural circuit. Nature. 608 (7921), 146-152 (2022).
- Bartoszek, E. M., et al. Ongoing habenular activity is driven by forebrain networks and modulated by olfactory stimuli. Current Biology. 31 (17), 3861-3874 (2021).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning & Memory. 19 (4), 170-177 (2012).
- Buske, C., Gerlai, R. Maturation of shoaling behavior is accompanied by changes in the dopaminergic and serotoninergic systems in zebrafish. Developmental Psychobiology. 54 (1), 28-35 (2012).
- Huang, K. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Rupprecht, P., Prendergast, A., Wyart, C., Friedrich, R. W. Remote z-scanning with a macroscopic voice coil motor for fast 3D multiphoton laser scanning microscopy. Biomedical Optics Express. 7 (5), 1656-1671 (2016).
- Papadopoulos, I. N., Jouhanneau, J. -. S., Poulet, J. F. A., Judkewitz, B. Scattering compensation by focus scanning holographic aberration probing (F-SHARP). Nature Photonics. 11 (2), 116-123 (2017).
- Torigoe, M., et al. Zebrafish capable of generating future state prediction error show improved active avoidance behavior in virtual reality. Nature Communications. 12 (1), 5712 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados