É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem de cálcio de dois fótons da atividade do prosencéfalo em peixes-zebra adultos com comportamento
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para realizar imagens de cálcio de dois fótons no prosencéfalo dorsal de zebrafish adultos.
Resumo
O peixe-zebra adulto (Danio rerio) exibe um rico repertório de comportamentos para o estudo das funções cognitivas. Eles também têm um cérebro em miniatura que pode ser usado para medir atividades em regiões cerebrais por meio de métodos de imagem óptica. No entanto, relatos sobre o registro da atividade cerebral em peixes-zebra adultos têm sido escassos. O presente estudo descreve procedimentos para a realização de imagens de cálcio de dois fótons no prosencéfalo dorsal de zebrafish adultos. Nós nos concentramos em etapas para impedir que peixes-zebra adultos movam suas cabeças, o que fornece estabilidade que permite imagens de varredura a laser da atividade cerebral. Os animais com a cabeça contida podem mover livremente suas partes do corpo e respirar sem ajudas. O procedimento visa encurtar o tempo da cirurgia de apoio de cabeça, minimizar o movimento cerebral e maximizar o número de neurônios registrados. Uma configuração para apresentar um ambiente visual imersivo durante a imagem de cálcio também é descrita aqui, que pode ser usada para estudar correlatos neurais subjacentes a comportamentos desencadeados visualmente.
Introdução
A imagem por fluorescência do cálcio com indicadores codificados geneticamente ou corantes sintéticos tem sido um poderoso método de medir a atividade neuronal em animais com comportamento, incluindo primatas não humanos, roedores, aves e insetos1. A atividade de centenas de células, até aproximadamente 800 μm abaixo da superfície cerebral, pode ser medida simultaneamente por meio de imagens com múltiplos fótons 2,3. A atividade de tipos celulares específicos também pode ser medida pela expressão de indicadores de cálcio em populações neuronais geneticamente definidas. A aplicação do método de imagem para modelos de pequenos vertebrados abre novas possibilidades no campo da computação neuronal em regiões cerebrais.
O peixe-zebra é um sistema modelo amplamente utilizado em pesquisas em neurociência. Larvas de peixes-zebra em torno de 6 dias pós-fertilização têm sido utilizadas para imagens de cálcio devido ao seu cérebro em miniatura e corpo transparente4. Os peixes-zebra juvenis (3-4 semanas de idade) também são utilizados para estudar os mecanismos neurais subjacentes às vias sensório-motoras5,6. No entanto, o nível máximo de desempenho para comportamentos complexos, incluindo aprendizagem associativa e comportamentos sociais, é alcançado em idade mais avançada 7,8. Assim, um protocolo confiável é necessário para estudar múltiplas funções cognitivas no cérebro de peixes-zebra adultos usando métodos de imagem. Enquanto larvas de peixe-zebra e peixes-zebra juvenis podem ser incorporados em agarose para imagens in vivo, peixes-zebra adultos com 2 meses ou mais sofrem de hipóxia em tais condições e são fisicamente fortes demais para serem contidos pela agarose. Portanto, um procedimento cirúrgico é necessário para estabilizar o cérebro e permitir que o animal respire livremente através das brânquias.
Aqui, descrevemos um protocolo de apoio de cabeça que envolve um novo design de uma única barra de cabeça. O tempo cirúrgico reduzido de 25 min é duas vezes mais rápido que o método anterior9. Descrevemos também o projeto da câmara de gravação (tanque semi-hexagonal), do estágio principal e de um mecanismo de bloqueio rápido para combinar as duas partes9. Finalmente, a configuração para apresentar um estímulo visual imersivo para estudar a atividade e os comportamentos cerebrais desencadeados visualmente também é descrita. Em geral, os procedimentos descritos aqui podem ser usados para realizar imagens de cálcio de dois fótons em populações celulares geneticamente definidas em um peixe-zebra adulto contido na cabeça, permitindo a investigação de atividades cerebrais durante vários paradigmas comportamentais.
Protocolo
Todos os procedimentos com animais foram aprovados e realizados de acordo com as diretrizes do Comitê Institucional de Cuidados e Uso de Animais da Academia Sinica. Detalhes dos instrumentos de pesquisa podem ser encontrados na Tabela de Materiais.
1. Preparação da câmara de gravação
- Prepare um tanque semi-hexagonal, uma placa de base e um estágio de cabeça (Figura 1A; Arquivos complementares 1-3). O estágio principal consiste em dois postes metálicos presos a uma placa circular. A placa circular contém ranhuras que podem ser travadas na placa de base. Depois de serem travados juntos, o estágio da cabeça e a placa de base são colocados no fundo do tanque semi-hexagonal.
- Coloque o tanque semi-hexagonal sobre a plataforma experimental do microscópio. A plataforma deve ser capaz de se mover nas direções X e Y sem atingir o limite do estágio de tradução.
- Aponte a luz infravermelha (IR) de 810 nm e a câmera para o palco principal para gravação comportamental. Certifique-se de que o campo de visão da câmera seja grande o suficiente para caber em um peixe-zebra adulto.
- Para evitar que o laser de dois fótons e o estímulo visual interfiram no registro comportamental, configure um filtro passa-curta de 875 nm e um filtro passa-longa de 700 nm na frente da câmera, respectivamente.
- Para apresentar o estímulo visual, fixar filmes de retroprojeção na face interna das três paredes do tanque semi-hexagonal (Figura 1A).
- Aponte os três projetores para as três superfícies do tanque. As três imagens devem ser alinhadas para formar uma cena visual contínua. Para evitar que as luzes do projetor contaminem o sinal de fluorescência de cálcio, coloque um filtro de densidade neutra e um filtro de cor vermelha (600 nm, passa-longa) na frente de cada projetor e coloque um filtro passa-banda (510/80 nm) na frente do tubo fotomultiplicador (PMT).
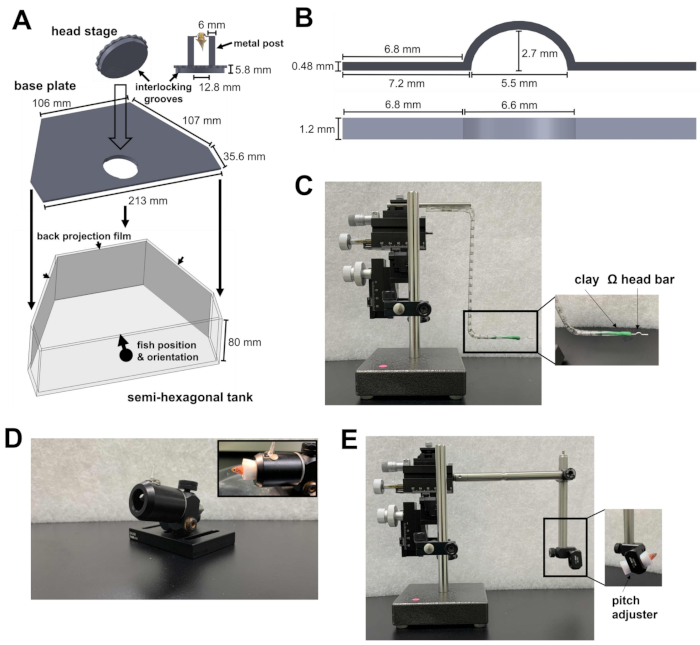
Figura 1: Instrumentos necessários para a cirurgia de apoio de cabeça. (A) O mecanismo de bloqueio rápido entre a placa circular do estágio da cabeça e a placa de base dentro do tanque semi-hexagonal. Arquivos CAD (computer-aided design) das peças personalizadas podem ser encontrados em Arquivos Suplementares 1-4. (B) Barra de cabeça em forma de Ω para o apoio de cabeça. (C) O micromanipulador de três eixos utilizado para posicionar a barra de cabeçote no local de fixação. Inserção: orientação da barra principal na argila. (D) Canhão para segurar o peixe durante a cirurgia. Inset: orientação dos peixes dentro do canhão. (E) Módulo de carregamento de peixes e o micromanipulador usado para carregar os peixes no palco principal. Inset: orientação dos peixes dentro do módulo. Clique aqui para ver uma versão maior desta figura.
2. Cirurgia de apoio de cabeça
- Prepare uma barra de cabeça em forma de Ω (Figura 1B; Arquivo Suplementar 4) para o apoio de cabeça do peixe-zebra. Para fazer isso, anexe um pedaço de argila modeladora à base de óleo a um micromanipulador de três eixos. Certifique-se de que a argila é sólida o suficiente para segurar a barra da cabeça, mas macia o suficiente para se desprender da barra da cabeça após o apoio de cabeça.
- Insira um braço da barra da cabeça na argila e oriente a barra da cabeça horizontalmente (Figura 1C). Isso garantirá que a fixação posterior da barra da cabeça no peixe-zebra seja nivelada.
NOTA: A barra principal pode ser feita de titânio (24 mg) ou aço inoxidável (43 mg) e pode ser reutilizada para múltiplos experimentos. O material da barra de cabeça não afeta o comportamento do peixe-zebra adulto (o peso varia de 300-1.000 mg) sob um apoio de cabeça. - Prepare o canhão, um tubo oco para segurar o corpo do peixe no lugar durante a cirurgia (Figura 1D).
- Preparar 0,03% e 0,01% de metanossulfonato de tricaína (TMS; ver Tabela de Materiais) na água do tanque de peixes. Este será usado para anestesiar e manter os peixes em um estado sedado durante a cirurgia.
- Prepare quatro cotonetes de tecido para remover o excesso de pele e água dos locais de fixação no crânio. Para preparar cada cotonete, corte um papel toalha em um quadrado de 3 cm e dobre ao longo de sua diagonal para produzir uma estrutura semelhante a um tubo. Torça as extremidades do tubo em um ponto fino. O local de fixação é muito pequeno, então um ponto fino permite um controle mais fino do cotonete.
- Preparar um módulo de carregamento de peixes para o micromanipulador (Figura 1E).
NOTA: O módulo consiste em dois postes de aço unidos por uma braçadeira de ângulo reto. Um poste se prende ao micromanipulador, enquanto o outro poste segura uma braçadeira giratória que carrega os peixes. O módulo é usado para posicionar os peixes no palco da cabeça com controle fino. A pinça giratória serve como um ajustador de passo para mudar o ângulo de passo do peixe. - Anestesiar os peixes com 0,03% de EMT em água de tanque de peixes. Ao longo das etapas seguintes, use uma seringa para entregar a EMT a 0,01% na água do tanque de peixes até a boca em pulsos curtos a cada 90 s. O fluxo de água da perfusão deve induzir o movimento branquial. Isso permitirá que os peixes sobrevivam por mais de 40 minutos durante a cirurgia.
NOTA: Tg[neuroD:GCaMP6f] é usado devido à sua ampla expressão do indicador de cálcio no prosencéfalo tanto na fase larval quanto na fase adulta10.
NOTA: Opcionalmente, use a perfusão por gravidade para fornecer fluxo constante de água para a boca durante os períodos em que ambas as mãos estão ocupadas. - Embrulhe o peixe em uma cápsula (Figura 2A) que mantenha o peixe dentro do canhão.
- Embrulhe o peixe anestesiado em um pedaço de papel umedecido começando da ponta da cauda até cerca de 1 mm caudal à guelra. Certifique-se de que o invólucro esteja apertado para evitar o deslizamento do peixe para fora do tecido.
- Enrole um tubo de plástico macio com uma fenda longitudinal (por exemplo, um tubo termoencolhível de tamanho médio cortado aberto) ao redor do tecido de papel para cobrir os peixes desde a extremidade da cauda até cerca de 2 mm caudal à guelra. A tubulação garante que o corpo do peixe permaneça reto durante toda a cirurgia.
- Embrulhe uma toalha de papel ao redor da tubulação até um diâmetro aproximadamente semelhante ao diâmetro do canhão.
- Embrulhe um tubo de plástico macio cortado do bulbo de uma pipeta de transferência de plástico ao redor do papel toalha. Isso garante que a cápsula possa ser carregada suavemente no canhão.
- Coloque o peixe no canhão.
- Utilizar bisturi para retirar a pele que recobre os locais de fixação, duas áreas triangulares do crânio rostrolateral ao cerebelo e acima das brânquias (Figura 2B), retirando em seguida a pele que cobre a região entre os locais de fixação. Use cotonetes de tecido para secar os locais de fixação e limpar qualquer pele restante.
- Use uma plataforma ajustável para apoiar a cabeça durante a remoção da pele, mas a plataforma não deve entrar em contato com os olhos para evitar lesões oculares durante a operação.
NOTA: A remoção completa da pele nos locais de fixação é crucial para reduzir os artefatos de movimento durante a aquisição de imagens.
- Use uma plataforma ajustável para apoiar a cabeça durante a remoção da pele, mas a plataforma não deve entrar em contato com os olhos para evitar lesões oculares durante a operação.
- Aplique uma gota de cola de tecido (ver Tabela de Materiais) no centro de cada local de fixação usando uma ponta de pipeta de 10 μL.
NOTA: A cola de tecido cobre os locais de fixação e seca rapidamente. A cola de tecido fornece uma interface de ligação entre o crânio e o cimento dentário usado para colar a barra da cabeça e impede que a água das brânquias atinja o local de fixação. - Coloque o corpo do peixe na posição ereta e posicione a barra da cabeça ligeiramente acima e caudal aos locais de fixação em preparação para a colagem da barra da cabeça.
- Preparar cimento dentário (ver Tabela de Materiais) e usá-lo imediatamente para colar a barra da cabeça ao crânio (Figura 2C). O procedimento é sensível ao tempo e deve ser feito em até 45 s.
- Misture uma colher pequena de polímero com quatro gotas de monômero rápido e uma gota de catalisador V. Mexa a mistura uniformemente por 15 s.
- Use uma micropipeta e uma ponteira de pipeta de 10 μL para aplicar a mistura nos locais de fixação e na região entre os locais. Evite cobrir as brânquias e os olhos.
- Pressione suavemente a barra da cabeça sobre o cimento usando o micromanipulador. Cubra a barra da cabeça com o cimento restante.
- Aguarde 12 min para permitir a cura do cimento dental. Evite o contato da água com o cimento.
- Para melhorar o acesso óptico ao prosencéfalo para imagens de cálcio, remova a pele acima do telencéfalo. A retirada da pele pode ser feita em 3 min com cinco cortes com bisturi (Figura 2D). Certifique-se de que as gotículas lipídicas aderidas à superfície dos crânios sejam removidas.
- Após a cura, retire a argila da barra da cabeça.
- Transfira toda a cápsula do canhão para o ajustador de passo no módulo de carregamento de peixes do micromanipulador.
- Use o micromanipulador para posicionar o peixe. A barra da cabeça deve ser posicionada no topo dos postes metálicos do palco da cabeça. Aumente ligeiramente o ângulo de inclinação dos peixes para que a superfície do prosencéfalo possa ser melhor alinhada ao plano óptico durante a obtenção de imagens de dois fótons.
- Cole a barra da cabeça nos postes metálicos com cola curável por ultravioleta (UV). Uma exposição UV de 15 s é suficiente para a cura.
- Retire o peixe da cápsula e prenda o estágio da cabeça na placa de base dentro do tanque semi-hexagonal.
- Mergulhe o animal na água do tanque de peixes. Os peixes devem começar a respirar e se recuperar da anestesia dentro de 1-2 minutos.
NOTA: Opcionalmente, use a perfusão da seringa para fornecer água fresca à boca.
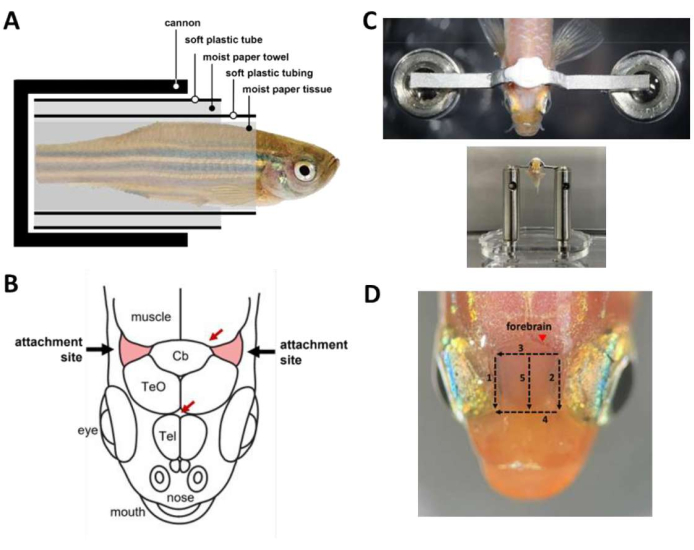
Figura 2: Principais passos durante a cirurgia de apoio de cabeça. (A) Composição da cápsula dentro do canhão. (B) Locais de fixação no crânio (vermelho). As setas vermelhas especificam os locais dos vasos sanguíneos. (C) Superior: barra da cabeça presa ao crânio do peixe. Fundo: peixe carregado no palco da cabeça. (D) Cortes necessários para remover a pele acima do prosencéfalo. Os números denotam a sequência de corte. Evitar a retirada de pele no local marcado (ponta de seta) para evitar sangramento do animal. Clique aqui para ver uma versão maior desta figura.
3. Imagem de dois fótons
- Ligue o laser e aguarde 30 min para que a energia se estabilize. Ajuste o comprimento de onda para 920 nm e a potência para cerca de 50 mW na amostra.
NOTA: O feixe de laser controlado pelo scanner ressonante move-se lentamente nos pontos de retorno do caminho de varredura. Para evitar danos teciduais, uma célula de Pockels é usada para reduzir a potência do laser nos pontos de retorno. - Colocar a câmara de registro contendo o peixe-zebra contido na cabeça na plataforma experimental (Figura 3A). A plataforma deve ser capaz de se mover nas direções X e Y sem atingir o limite do estágio de tradução.
- Coloque a lente objetiva o mais próximo possível da superfície do prosencéfalo. A lente objetiva deve estar voltada para a borda frontal da pupila (Figura 3B).
- Abra o obturador a laser e ative o PMT. Eleve gradualmente a lente objetiva (~1 mm) até que o prosencéfalo dorsal seja revelado na imagem de fluorescência (Figura 3C).
- Para aumentar o número de neurônios registrados, use um atuador piezo para adquirir imagens em múltiplas profundidades (seis planos de imagem, separados por 15 μm). Isso aumentará o rendimento dos dados às custas da taxa de quadros. Habilite a varredura rápida do eixo Z para controlar o atuador piezo (modo uniforme, número de fatias = 6, tamanho do passo = 15 μm, forma de onda = dente de serra, tempo de flyback = 4 ms, atraso do atuador = 8 ms).
- Para gravação de comportamento, ligue as luzes infravermelhas (IR) de 810 nm em ambos os lados do tanque. Ajuste o ângulo para iluminar todo o corpo, que deve ser claramente visível na câmera.
- Ligue os projetores.
- Comece a gravar dados.
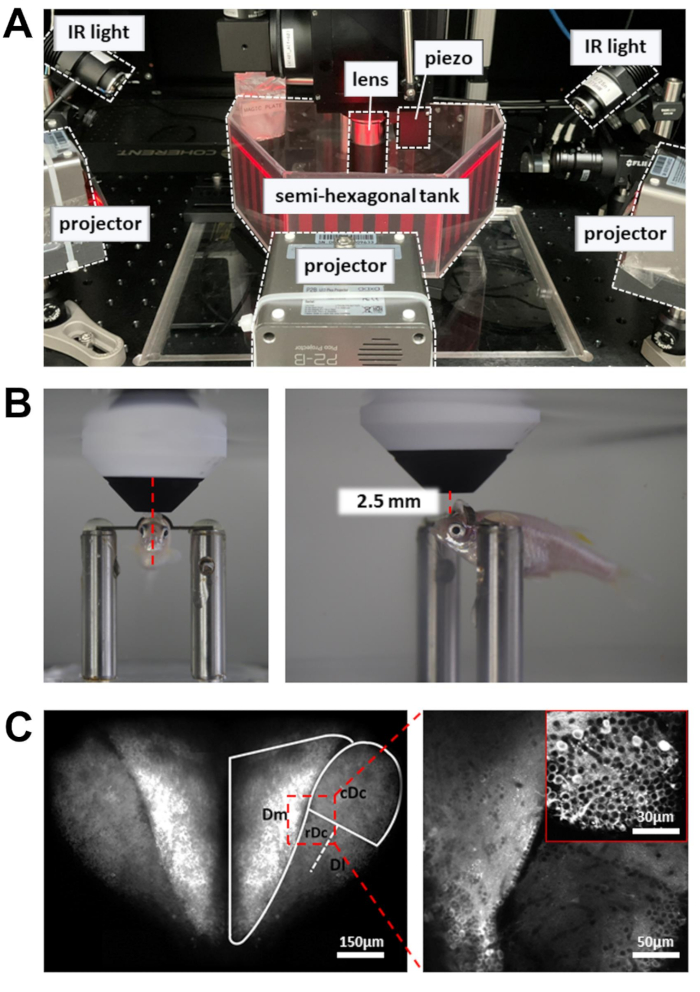
Figura 3: Configuração para realizar imagens de cálcio, gravação comportamental e exibição de estímulos visuais . (A) Três projetores apresentam um estímulo visual nas paredes do tanque semi-hexagonal. Luzes IR na lateral são usadas para iluminar o corpo do peixe-zebra. (B) Posicionamento da lente objetiva. Esquerda: vista frontal. Direita: vista lateral. A distância entre a lente objetiva de 16x e a região do cérebro alvo é de cerca de 2,5 mm. (C) Exemplo de imagem de dois fótons. Esquerda: projeção máxima de todo o prosencéfalo dorsal em Tg[neuroD:GCaMP6f]. Direita: imagem ampliada para revelar neurônios em várias regiões do cérebro. Inset: uma ampliação maior de uma região diferente do cérebro. As imagens são médias de 10 s de dados gravados a 5Hz. Clique aqui para ver uma versão maior desta figura.
Resultados
O protocolo consiste em duas partes: cirurgia de apoio de cabeça e cintilografia de cálcio de dois fótons das atividades neuronais no prosencéfalo. O sucesso da cirurgia é definido pela sobrevivência do animal e pela estabilidade do apoio de cabeça. A taxa de sobrevida pode ser muito melhorada pela perfusão frequente da solução de EMT a 0,01% pela boca durante a cirurgia. Os peixes devem se recuperar da anestesia e respirar ativamente dentro de 1-2 minutos após serem imersos na água do tanque de peixes. A ima...
Discussão
Aqui, descrevemos um protocolo detalhado para conter a cabeça de peixes-zebra adultos para imagens de cálcio de dois fótons. Há duas etapas críticas para obter um apoio de cabeça que seja estável o suficiente para imagens de varredura a laser. Primeiro, a barra da cabeça deve ser colada nos locais de fixação específicos dos crânios. Outras partes do crânio são muitas vezes muito finas para fornecer estabilidade mecânica e podem até ser fraturadas durante movimentos fortes do corpo. Em segundo lugar, a pel...
Divulgações
Os autores declaram não ter interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado pelo Instituto de Biologia Molecular, Academia Sinica, e Conselho Nacional de Ciência e Tecnologia, Taiwan. A Oficina de Máquinas do Instituto de Física, Academia Sinica ajudou a fabricar peças personalizadas. Também queremos agradecer a P. Argast (Friedrich Miescher Institute for Biomedical Research, Basileia, Suíça) pelo projeto do mecanismo de bloqueio rápido do estágio principal.
Materiais
| Name | Company | Catalog Number | Comments |
| Acquisition card | MBF Bioscience | Vidrio vDAQ | Microscope |
| Back-projection film | Kimoto | Diland screen - GSK | present visual stimulus |
| Band-pass filter (510/80 nm) | Chroma | ET510/80m | Microscope |
| Base plate for the semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Camera filter (<875 nm) | Edmund optics | #86-106 | Behavior recording |
| Camera filter (>700 nm) | Edmund optics | #43-949 | Behavior recording |
| Camera lens | Thorlabs | MVL50M23 | Behavior recording |
| Chameleon Vision-S | Coherent | Vision-S | Laser |
| Circular plate for the head stage | custom made | see supplemental files | recording chamber |
| Controller for piezo actuator | Physik Instrumente | E-665. CR | Microscope |
| Current amplifier | Thorlabs | TIA60 | Microscope |
| Elitedent Q-6 | Rolence Enterprise | Q-6 | Surgery: UV lamp |
| Emission Filter 510/80 nm | Chroma | ET510/80m | Microscope |
| Head bar | custom made | see supplemental files | recording chamber |
| Infrared light | Thorlabs | M810L3 | Behavior recording |
| LED projector | AAXA | P2B LED Pico Projector | present visual stimulus |
| Moist paper tissue (Kimwipe) | Kimtech Science | 34155 | Surgery: moist paper tissue |
| Motorized XY sample stage | Zaber | X-LRM050 | Microscope |
| Neutral Density Filters (50% Transmission) | Thorlabs | NE203B | present visual stimulus |
| Ø1/2" Post Holder | ThorLabs | PH1.5V | Surgery: hollow tube for cannon |
| Ø1/2" Stainless Steel Optical Post | ThorLabs | TR150/M | Surgery: fish loading module |
| Objective lens 16x, 0.8NA | Nikon | CF175 | Microscope |
| Oil-based modeling clay | Ly Hsin Clay | C4086 | Surgery: head bar holder |
| Optical adhesive | Norland Products | NOA68 | Surgery: UV curable glue |
| Photomultiplier tube | Hamamatsu | H11706P-40 | Microscope |
| Piezo actuator | Physik Instrumente | P-725.4CA PIFOC | Microscope |
| Pockels Cell | Conoptics | M350-80-LA-BK-02 | Microscope |
| Red Wratten filter (> 600 nm) | Edmund optics | #53-699 | present visual stimulus |
| Resonant-Galvo Scan System | INSS | RGE-02 | Microscope |
| Right-Angle Clamp for Ø1/2" Post | ThorLabs | RA90/M | Surgery: fish loading module |
| Rotating Clamp for Ø1/2" Post | ThorLabs | SWC/M | Surgery: fish loading module |
| ScanImage | MBF Bioscience | Basic version | Microscope |
| Semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Super-Bond C&B Kit | Sun Medical Co. | Super-Bond C&B | Surgery: dental cement |
| Tricaine methanesulfonate | Sigma Aldrich | E10521 | Surgery: anesthetic |
| USB Camera | FLIR | BFS-U3-13Y3M-C | Behavior recording |
| Vetbond | 3M | 1469SB | Surgery: tissue glue |
Referências
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit neuroscience in zebrafish. Current Biology. 20 (8), R371-R381 (2010).
- Kappel, J. M., et al. Visual recognition of social signals by a tectothalamic neural circuit. Nature. 608 (7921), 146-152 (2022).
- Bartoszek, E. M., et al. Ongoing habenular activity is driven by forebrain networks and modulated by olfactory stimuli. Current Biology. 31 (17), 3861-3874 (2021).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning & Memory. 19 (4), 170-177 (2012).
- Buske, C., Gerlai, R. Maturation of shoaling behavior is accompanied by changes in the dopaminergic and serotoninergic systems in zebrafish. Developmental Psychobiology. 54 (1), 28-35 (2012).
- Huang, K. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Rupprecht, P., Prendergast, A., Wyart, C., Friedrich, R. W. Remote z-scanning with a macroscopic voice coil motor for fast 3D multiphoton laser scanning microscopy. Biomedical Optics Express. 7 (5), 1656-1671 (2016).
- Papadopoulos, I. N., Jouhanneau, J. -. S., Poulet, J. F. A., Judkewitz, B. Scattering compensation by focus scanning holographic aberration probing (F-SHARP). Nature Photonics. 11 (2), 116-123 (2017).
- Torigoe, M., et al. Zebrafish capable of generating future state prediction error show improved active avoidance behavior in virtual reality. Nature Communications. 12 (1), 5712 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados