A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדמיית סידן דו-פוטון של פעילות המוח הקדמי בדגי זברה בוגרים
In This Article
Summary
כאן, אנו מציגים פרוטוקול לביצוע הדמיית סידן של שני פוטונים במוח הקדמי הגבי של דגי זברה בוגרים.
Abstract
דגי זברה בוגרים (Danio rerio) מפגינים רפרטואר עשיר של התנהגויות לחקר תפקודים קוגניטיביים. יש להם גם מוח מיניאטורי שיכול לשמש למדידת פעילויות בין אזורי מוח באמצעות שיטות הדמיה אופטית. עם זאת, דיווחים על רישום פעילות מוחית בדגי זברה בוגרים היו נדירים. המחקר הנוכחי מתאר הליכים לביצוע הדמיית סידן של שני פוטונים במוח הקדמי הגבי של דגי זברה בוגרים. אנו מתמקדים בצעדים לריסון דגי זברה בוגרים מלהזיז את ראשם, מה שמספק יציבות המאפשרת הדמיה בלייזר של פעילות המוח. בעלי החיים המרוסנים לראש יכולים להזיז בחופשיות את חלקי גופם ולנשום ללא עזרים. מטרת ההליך היא לקצר את זמן ניתוח ריסון הראש, למזער את תנועת המוח ולמקסם את מספר תאי העצב שנרשמו. כאן מתוארת גם הגדרה להצגת סביבה חזותית אימרסיבית במהלך הדמיית סידן, שניתן להשתמש בה כדי לחקור קורלציות עצביות העומדות בבסיס התנהגויות המופעלות על ידי ראייה.
Introduction
הדמיית סידן פלואורסצנטי עם אינדיקטורים מקודדים גנטית או צבעים סינתטיים הייתה שיטה רבת עוצמה למדידת פעילות עצבית בבעלי חיים מתנהגים, כולל פרימטים לא אנושיים, מכרסמים, ציפורים וחרקים1. את פעילותם של מאות תאים, עד כ-800 מיקרומטר מתחת לפני השטח של המוח, ניתן למדוד בו זמנית באמצעות דימות רב-פוטוני 2,3. ניתן למדוד את פעילותם של סוגי תאים מסוימים גם על ידי ביטוי מדדי סידן באוכלוסיות נוירונים מוגדרות גנטית. יישום שיטת ההדמיה עבור מודלים קטנים של בעלי חוליות פותח אפשרויות חדשות בתחום החישוב העצבי על פני אזורי מוח.
דגי זברה הם מערכת מודל נפוצה במחקר מדעי המוח. דגי זברה זחלים בסביבות 6 ימים לאחר ההפריה שימשו להדמיית סידן בשל מוחם המיניאטורי וגופם השקוף4. דגי זברה צעירים (בני 3-4 שבועות) משמשים גם לחקר המנגנונים העצביים העומדים בבסיס מסלולים סנסומוטוריים 5,6. עם זאת, רמת הביצוע המקסימלית עבור התנהגויות מורכבות, כולל למידה אסוציאטיבית והתנהגויות חברתיות, מושגת בגיל מבוגר יותר 7,8. לפיכך, נדרש פרוטוקול אמין כדי לחקור תפקודים קוגניטיביים מרובים במוחם של דגי זברה בוגרים באמצעות שיטות הדמיה. בעוד שזחלי זברה ודגי זברה צעירים יכולים להיות מוטמעים באגרוז להדמיית in vivo, דגי זברה בוגרים בגיל חודשיים ומעלה סובלים מהיפוקסיה בתנאים כאלה והם חזקים מדי פיזית מכדי להיות מרוסנים על ידי אגרוז. לכן, נדרש הליך כירורגי כדי לייצב את המוח ולאפשר לבעל החיים לנשום בחופשיות דרך הזימים.
כאן, אנו מתארים פרוטוקול ריסון ראש הכולל עיצוב חדשני של מוט ראש יחיד. זמן הניתוח המופחת של 25 דקות מהיר פי שניים מהשיטההקודמת 9. אנו מתארים גם את העיצוב של תא ההקלטה (מיכל חצי משושה), שלב הראש ומנגנון נעילה מהירה לשילוב שני החלקים9. לבסוף, מתואר גם המערך להצגת גירוי חזותי סוחף לחקר פעילות והתנהגויות מוחיות המופעלות על ידי ראייה. באופן כללי, ההליכים המתוארים כאן יכולים לשמש לביצוע דימות סידן של שני פוטונים באוכלוסיות תאים מוגדרות גנטית בדג זברה בוגר מרוסן ראש, המאפשר לחקור פעילויות מוחיות במהלך פרדיגמות התנהגותיות שונות.
Protocol
כל ההליכים בבעלי חיים אושרו ובוצעו בהתאם להנחיות הוועדה המוסדית לטיפול ושימוש בבעלי חיים של האקדמיה סיניקה. פירוט כלי המחקר ניתן למצוא בטבלת החומרים.
1. הכנת תא הקלטה
- הכינו מכל חצי משושה, פלטת בסיס ובמת ראש (איור 1A; קבצים משלימים 1-3). שלב הראש מורכב משני עמודי מתכת המחוברים ללוח עגול. הצלחת העגולה מכילה חריצים שניתן לנעול על לוח הבסיס. לאחר שננעלו יחד, שלב הראש וצלחת הבסיס מונחים בתחתית המיכל המשושה למחצה.
- מניחים את המיכל המשושה למחצה על פלטפורמת הניסוי של המיקרוסקופ. הפלטפורמה אמורה להיות מסוגלת לנוע בכיווני X ו- Y מבלי לפגוע במגבלה של שלב התרגום.
- כוון את אור האינפרא-אדום (IR) ברזולוציית 810 ננומטר ואת המצלמה אל במת הראש לצורך הקלטה התנהגותית. ודא ששדה הראייה של המצלמה גדול מספיק כדי להתאים לדג זברה בוגר.
- כדי למנוע מהלייזר הדו-פוטוני ומהגירוי החזותי להפריע להקלטה התנהגותית, הגדירו מסנן מעבר קצר של 875 ננומטר ומסנן מעבר ארוך של 700 ננומטר מול המצלמה, בהתאמה.
- כדי להציג את הגירוי החזותי, חברו סרטי הקרנה אחוריים לצד הפנימי של שלושת הדפנות של המיכל המשושה-למחצה (איור 1A).
- כוון את שלושת המקרנים לשלושת המשטחים של המיכל. שלוש התמונות צריכות להיות מיושרות ליצירת סצנה חזותית רציפה. כדי למנוע מנורות המקרן לזהם את אות הפלואורסצנטיות של הסידן, מקם מסנן צפיפות נייטרלית ומסנן צבע אדום (600 ננומטר, מעבר ארוך) לפני כל מקרן, והצב מסנן פס (510/80 ננומטר) לפני שפופרת מכפיל האור (PMT).
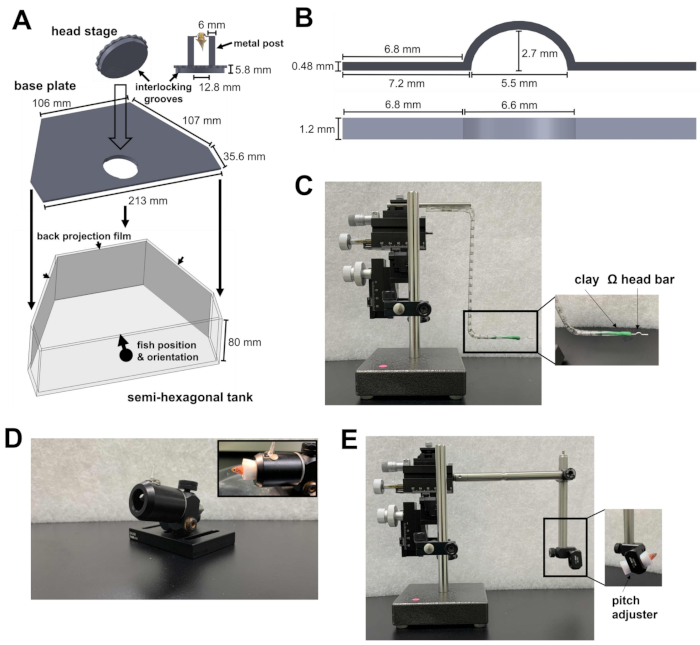
איור 1: מכשירים הדרושים לניתוחי ריסון ראש. (A) מנגנון הנעילה המהירה בין הלוח העגול של שלב הראש לבין לוחית הבסיס בתוך המיכל המשושה למחצה. קבצי תכנון בעזרת מחשב (CAD) של החלקים בהתאמה אישית ניתן למצוא בקבצים משלימים 1-4. (B) מוט ראש בצורת Ω לריסון הראש. (C) המיקרומניפולטור בעל שלושת הצירים המשמש למיקום מוט הראש לאתר החיבור. כניסה: כיוון מוט הראש בחימר. (D) תותח שיחזיק את הדג במהלך הניתוח. כניסה: התמצאות של דגים בתוך התותח. (E) מודול העמסת דגים והמיקרומניפולטור המשמש להעמסת הדג על במת הראש. כניסה: כיוון של דגים בתוך המודול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. ניתוח ריסון ראש
- הכינו מוט ראש בצורת Ω (איור 1B; קובץ משלים 4) לריסון ראש דג הזברה. כדי לעשות זאת, לחבר חתיכת חימר מודל מבוסס שמן מיקרומניפולטור שלושה צירים. ודא שהחימר מוצק מספיק כדי להחזיק את מוט הראש, אך רך מספיק כדי להתנתק ממוט הראש לאחר ריסון הראש.
- הכניסו זרוע של מוט הראש לתוך החימר וכוונו את מוט הראש אופקית (איור 1C). זה יבטיח שהחיבור המאוחר יותר של מוט הראש לדגי הזברה יהיה ישר.
הערה: מוט הראש יכול להיות עשוי מטיטניום (24 מ"ג) או נירוסטה (43 מ"ג) וניתן לעשות בו שימוש חוזר למספר ניסויים. חומר מוט הראש אינו משפיע על התנהגותם של דגי זברה בוגרים (משקל נע בין 300-1,000 מ"ג) תחת משענת ראש. - הכינו את התותח, צינור חלול להחזקת גוף הדג במקומו במהלך הניתוח (איור 1D).
- הכינו 0.03% ו-0.01% טריקאין מתאן-סולפונט (TMS; ראו טבלת חומרים) במי מכלי דגים. זה ישמש כדי להרדים ולשמור על הדג במצב טשטוש במהלך הניתוח.
- הכינו ארבעה מקלוני טישו כדי להסיר עודפי עור ומים מאתרי החיבור בגולגולת. כדי להכין כל מטוש, חותכים מגבת נייר לריבוע של 3 ס"מ ומקפלים לאורך האלכסון שלה כדי ליצור מבנה דמוי צינור. סובבו את קצות הצינור לנקודה עדינה. אתר ההתקשרות קטן מאוד, כך שנקודה עדינה מאפשרת שליטה עדינה יותר במטוש.
- הכינו מודול העמסת דגים עבור המיקרומניפולטור (איור 1E).
הערה: המודול מורכב משני עמודי פלדה המוחזקים יחד על ידי מהדק עמוד ישר זווית. עמדה אחת מתחברת למיקרומניפולטור, ואילו העמדה השנייה מחזיקה מהדק עמוד מסתובב הנושא את הדג. המודול משמש למיקום הדג על במת הראש בשליטה עדינה. מהדק העמוד המסתובב משמש ככוונן גובה כדי לשנות את זווית המגרש של הדג. - מרדימים את הדג עם 0.03% TMS במי מיכל דגים. במהלך השלבים הבאים, השתמש במזרק כדי להעביר 0.01% TMS במי מיכל דגים לפה בפולסים קצרים כל 90 שניות. זרימת המים מהזילוח אמורה לגרום לתנועת זימים. זה יאפשר לדגים לשרוד יותר מ -40 דקות במהלך הניתוח.
הערה: Tg [neuroD:GCaMP6f] משמש בשל הביטוי הרחב של מחוון הסידן במוח הקדמי הן בשלב הזחל והן בשלב הבוגר10.
הערה: לחלופין, השתמש בזילוח כוח הכבידה כדי לספק זרימת מים קבועה לפה בתקופות בניתוח שבהן שתי הידיים תפוסות. - עטפו את הדג לתוך קפסולה (איור 2A) שמחזיקה את הדג בתוך התותח.
- עוטפים את הדג המורדם בפיסת נייר לחה החל מקצה הזנב ועד כ-1 מ"מ קאודלי עד הזמיר. ודאו שהעטיפה הדוקה כדי למנוע החלקה של הדג אל מחוץ לרקמה.
- עטפו צינור פלסטיק רך עם חריץ אורכי (למשל, צינור בינוני מתכווץ חום שנחתך) סביב רקמת הנייר כדי לכסות את הדג מקצה הזנב ועד כ-2 מ"מ קאודלי לזמיר. הצינורית מבטיחה שגוף הדג יישאר ישר לאורך כל הניתוח.
- עוטפים מגבת נייר סביב הצינור לקוטר דומה בערך לקוטר התותח.
- עוטפים צינור פלסטיק רך החתוך מנורה של פיפטת העברת פלסטיק סביב מגבת הנייר. זה מבטיח שניתן לטעון את הקפסולה בצורה חלקה לתוך התותח.
- מעמיסים את הדג לתוך התותח.
- השתמשו באזמל כדי להסיר את העור שמכסה את אתרי החיבור, שני אזורים משולשים של הגולגולת אל המוח הקטן ומעל הזימים (איור 2B), ואז הסירו את העור המכסה את האזור שבין אתרי החיבור. השתמש במקלוני רקמות כדי לייבש את אתרי החיבור ולנקות את העור שנותר.
- השתמש בפלטפורמה מתכווננת לתמיכה בראש במהלך הסרת העור, אך אסור שהפלטפורמה תבוא במגע עם העיניים כדי למנוע פגיעה בעיניים במהלך הניתוח.
הערה: הסרה יסודית של העור באתרי החיבור חיונית להפחתת ארטיפקטים תנועתיים במהלך ההדמיה.
- השתמש בפלטפורמה מתכווננת לתמיכה בראש במהלך הסרת העור, אך אסור שהפלטפורמה תבוא במגע עם העיניים כדי למנוע פגיעה בעיניים במהלך הניתוח.
- יש למרוח טיפת דבק רקמות (ראו טבלת חומרים) במרכז כל אתר חיבור באמצעות קצה פיפטה של 10 μL.
הערה: דבק רקמות מכסה את אתרי הקבצים המצורפים ומתייבש במהירות. דבק הרקמה מספק ממשק מליטה בין הגולגולת לבין הצמנט הדנטלי המשמש להדבקת מוט הראש, ומונע ממים מהזימים להגיע לאתר החיבור. - הניחו את גוף הדג בתנוחה זקופה ומקמו את מוט הראש מעט מעל וקאודלי לאתרי החיבור כהכנה להדבקת מוט הראש.
- הכינו מלט דנטלי (ראו טבלת חומרים) והשתמשו בו מיד כדי להדביק את מוט הראש לגולגולת (איור 2C). ההליך הוא רגיש בזמן ויש לעשות אותו בתוך 45 שניות.
- מערבבים כף קטנה אחת של פולימר עם ארבע טיפות של מונומר מהיר וטיפה אחת של זרז V. מערבבים את התערובת באופן שווה במשך 15 שניות.
- השתמשו במיקרופיפטה ובקצה פיפטה של 10 מיקרוליטר כדי למרוח את התערובת על אתרי החיבור ועל האזור שבין האתרים. הימנעו מכיסוי הזימים והעיניים.
- לחץ בעדינות על מוט הראש על המלט באמצעות המיקרומניפולטור. מכסים את מוט הראש במלט שנותר.
- המתן 12 דקות כדי לאפשר ריפוי של מלט שיניים. יש להימנע ממגע מים עם המלט.
- כדי לשפר את הגישה האופטית למוח הקדמי לצורך הדמיית סידן, הסר את העור מעל הטלנספלון. הסרת עור יכולה להיעשות תוך 3 דקות עם חמישה חתכים באמצעות אזמל (איור 2D). יש להקפיד על הסרת טיפות שומנים הנצמדות לפני השטח של הגולגולות.
- לאחר הריפוי, להסיר את החימר מן מוט הראש.
- מעבירים את כל הקפסולה מהתותח לכוונון המגרש במודול טעינת הדגים של המיקרומניפולטור.
- השתמש micromanipulator כדי למקם את הדג. מוט הראש צריך להיות ממוקם על גבי עמודי המתכת של במת הראש. הגדילו מעט את זווית הגובה של הדג כך שפני השטח של המוח הקדמי יוכלו להיות מיושרים טוב יותר למישור האופטי במהלך דימות של שני פוטונים.
- הדביקו את מוט הראש לעמודי המתכת בדבק אולטרה סגול (UV) הניתן לריפוי. חשיפה של 15 שניות לקרינת UV מספיקה לריפוי.
- מוציאים את הדג מהקפסולה ונועלים את במת הראש על צלחת הבסיס בתוך המיכל המשושה למחצה.
- לטבול את החיה במי מיכל דגים. הדג צריך להתחיל לנשום ולהתאושש מהרדמה תוך 1-2 דקות.
הערה: לחלופין, השתמש בזילוח מזרק כדי לספק מים מתוקים לפה.
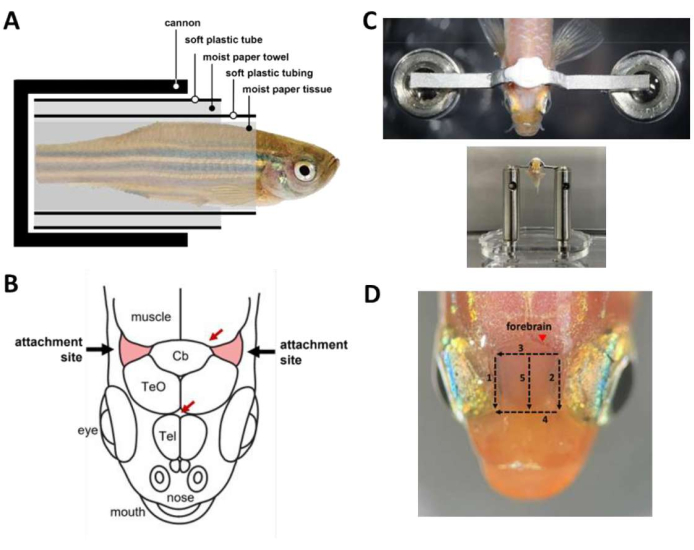
איור 2: שלבים מרכזיים במהלך ניתוח ריסון ראש . (A) הרכב הקפסולה בתוך התותח. (B) אתרי התקשרות על הגולגולת (אדום). חיצים אדומים מציינים אתרי כלי דם. (C) למעלה: מוט ראש המחובר לגולגולת הדג. למטה: דגים טעונים על במת הראש. (D) חתכים הדרושים להסרת העור מעל המוח הקדמי. מספרים מציינים את רצף החיתוך. הימנע מהסרת עור באתר המסומן (ראש החץ) כדי למנוע דימום של החיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. הדמיה של שני פוטונים
- הפעל את הלייזר והמתן 30 דקות עד שהכוח יתייצב. הגדר את אורך הגל ל- 920 ננומטר ואת ההספק לכ- 50 mW בדגימה.
הערה: קרן הלייזר הנשלטת על ידי סורק התהודה נעה באיטיות בנקודות התפנית של נתיב הסריקה. כדי למנוע נזק לרקמות, תא פוקלס משמש להפחתת כוח הלייזר בנקודות המפנה. - הניחו את תא ההקלטה המכיל את דגי הזברה מרוסני הראש על פלטפורמת הניסוי (איור 3A). הפלטפורמה אמורה להיות מסוגלת לנוע בכיווני X ו- Y מבלי לפגוע במגבלה של שלב התרגום.
- מקם את עדשת האובייקט קרוב ככל האפשר לפני השטח של המוח הקדמי. עדשת האובייקט צריכה להיות מכוונת לקצה הקדמי של האישון (איור 3B).
- פתחו את תריס הלייזר והפעילו את ה-PMT. הרימו בהדרגה את עדשת האובייקט (~1 מ"מ) עד שהמוח הקדמי הגבי מתגלה בתמונה הפלואורסצנטית (איור 3C).
- כדי להגדיל את מספר תאי העצב המוקלטים, השתמש במפעיל piezo כדי לקבל תמונות בעומקים מרובים (שישה מישורי תמונה, 15 מיקרומטר זה מזה). זה יגדיל את תפוקת הנתונים על חשבון קצב המסגרות. אפשר סריקה מהירה של ציר Z כדי לשלוט במפעיל piezo (מצב אחיד, מספר פרוסות = 6, גודל צעד = 15 מיקרומטר, צורת גל = שן מסורת, זמן טיסה לאחור = 4 אלפיות השנייה, השהיית מפעיל = 8 אלפיות השנייה).
- להקלטת התנהגות, הפעל את נוריות האינפרא-אדום (IR) של 810 ננומטר משני צידי המיכל. התאם את הזווית כדי להאיר את כל הגוף, אשר צריך להיות גלוי בבירור במצלמה.
- הפעל את המקרנים.
- התחל להקליט נתונים.
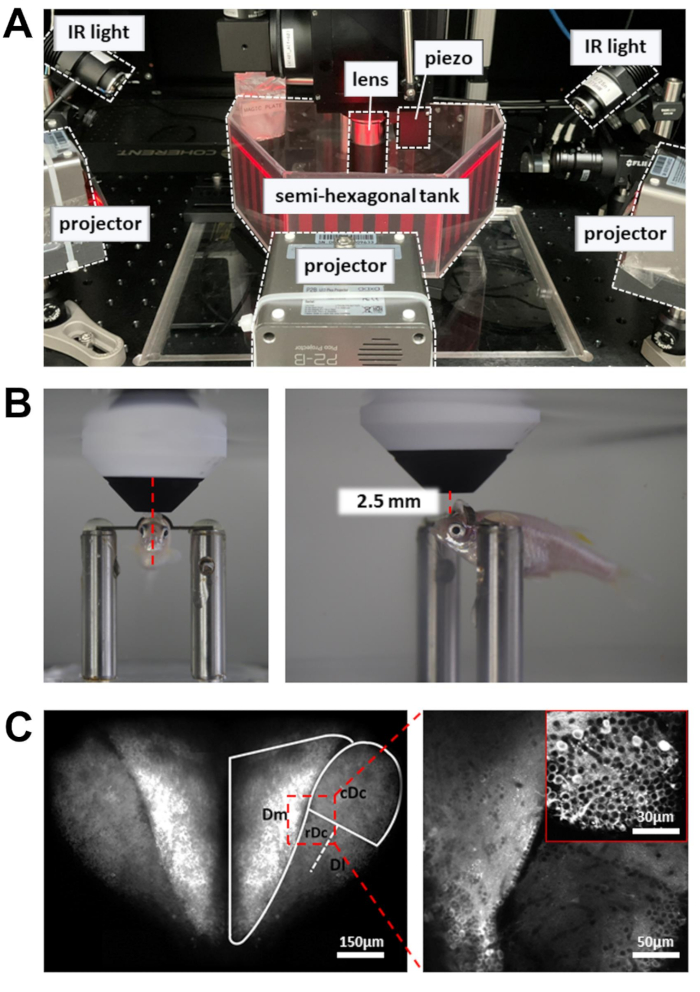
איור 3: הגדרה לביצוע הדמיית סידן, הקלטת התנהגות ותצוגת גירוי חזותי. (A) שלושה מקרנים מציגים גירוי חזותי על דפנות המיכל המשושה למחצה. נורות IR בצד משמשות להאיר את גוף דג הזברה. (B) מיקום העדשה האובייקטיבית. משמאל: מבט קדמי. מימין: מבט מהצד. המרחק בין עדשת האובייקט 16x לבין אזור המטרה במוח הוא בסביבות 2.5 מ"מ. (C) תמונה לדוגמה של שני פוטונים. משמאל: הקרנה מקסימלית של כל המוח הקדמי הגבי ב-Tg [neuroD:GCaMP6f]. מימין: תמונה מוגדלת כדי לחשוף תאי עצב על פני אזורי מוח מרובים. כניסה: הגדלה גבוהה יותר מאזור אחר במוח. תמונות הן ממוצעים של 10 שניות של נתונים שהוקלטו ב- 5Hz. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
הפרוטוקול מורכב משני חלקים: ניתוח ריסון ראש והדמיית סידן בשני פוטונים של פעילות עצבית במוח הקדמי. הצלחת הניתוח מוגדרת על ידי הישרדות החיה ויציבות ריסון הראש. ניתן לשפר מאוד את שיעור ההישרדות על ידי זילוח תכוף של תמיסת TMS 0.01% דרך הפה במהלך הניתוח. דגים צריכים להתאושש מהרדמה ולנשום באופן פעיל...
Discussion
במאמר זה אנו מתארים פרוטוקול מפורט לריסון ראשם של דגי זברה בוגרים לצורך הדמיית סידן של שני פוטונים. ישנם שני שלבים קריטיים להשגת משענת ראש יציבה מספיק להדמיית סריקת לייזר. ראשית, מוט הראש צריך להיות מודבק לאתרי החיבור הספציפיים של הגולגולות. חלקים אחרים של הגולגולת הם לעתים קרובות דקים מכ?...
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי המכון לביולוגיה מולקולרית, האקדמיה סיניקה והמועצה הלאומית למדע וטכנולוגיה, טייוואן. חנות המכונות במכון לפיזיקה, אקדמיה סיניקה סייעה לייצר חלקים שתוכננו בהתאמה אישית. אנו גם רוצים להודות לפ. ארגסט (מכון פרידריך מיישר למחקר ביו-רפואי, בזל, שוויץ) על תכנון מנגנון הנעילה המהירה של שלב הראש.
Materials
| Name | Company | Catalog Number | Comments |
| Acquisition card | MBF Bioscience | Vidrio vDAQ | Microscope |
| Back-projection film | Kimoto | Diland screen - GSK | present visual stimulus |
| Band-pass filter (510/80 nm) | Chroma | ET510/80m | Microscope |
| Base plate for the semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Camera filter (<875 nm) | Edmund optics | #86-106 | Behavior recording |
| Camera filter (>700 nm) | Edmund optics | #43-949 | Behavior recording |
| Camera lens | Thorlabs | MVL50M23 | Behavior recording |
| Chameleon Vision-S | Coherent | Vision-S | Laser |
| Circular plate for the head stage | custom made | see supplemental files | recording chamber |
| Controller for piezo actuator | Physik Instrumente | E-665. CR | Microscope |
| Current amplifier | Thorlabs | TIA60 | Microscope |
| Elitedent Q-6 | Rolence Enterprise | Q-6 | Surgery: UV lamp |
| Emission Filter 510/80 nm | Chroma | ET510/80m | Microscope |
| Head bar | custom made | see supplemental files | recording chamber |
| Infrared light | Thorlabs | M810L3 | Behavior recording |
| LED projector | AAXA | P2B LED Pico Projector | present visual stimulus |
| Moist paper tissue (Kimwipe) | Kimtech Science | 34155 | Surgery: moist paper tissue |
| Motorized XY sample stage | Zaber | X-LRM050 | Microscope |
| Neutral Density Filters (50% Transmission) | Thorlabs | NE203B | present visual stimulus |
| Ø1/2" Post Holder | ThorLabs | PH1.5V | Surgery: hollow tube for cannon |
| Ø1/2" Stainless Steel Optical Post | ThorLabs | TR150/M | Surgery: fish loading module |
| Objective lens 16x, 0.8NA | Nikon | CF175 | Microscope |
| Oil-based modeling clay | Ly Hsin Clay | C4086 | Surgery: head bar holder |
| Optical adhesive | Norland Products | NOA68 | Surgery: UV curable glue |
| Photomultiplier tube | Hamamatsu | H11706P-40 | Microscope |
| Piezo actuator | Physik Instrumente | P-725.4CA PIFOC | Microscope |
| Pockels Cell | Conoptics | M350-80-LA-BK-02 | Microscope |
| Red Wratten filter (> 600 nm) | Edmund optics | #53-699 | present visual stimulus |
| Resonant-Galvo Scan System | INSS | RGE-02 | Microscope |
| Right-Angle Clamp for Ø1/2" Post | ThorLabs | RA90/M | Surgery: fish loading module |
| Rotating Clamp for Ø1/2" Post | ThorLabs | SWC/M | Surgery: fish loading module |
| ScanImage | MBF Bioscience | Basic version | Microscope |
| Semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Super-Bond C&B Kit | Sun Medical Co. | Super-Bond C&B | Surgery: dental cement |
| Tricaine methanesulfonate | Sigma Aldrich | E10521 | Surgery: anesthetic |
| USB Camera | FLIR | BFS-U3-13Y3M-C | Behavior recording |
| Vetbond | 3M | 1469SB | Surgery: tissue glue |
References
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit neuroscience in zebrafish. Current Biology. 20 (8), R371-R381 (2010).
- Kappel, J. M., et al. Visual recognition of social signals by a tectothalamic neural circuit. Nature. 608 (7921), 146-152 (2022).
- Bartoszek, E. M., et al. Ongoing habenular activity is driven by forebrain networks and modulated by olfactory stimuli. Current Biology. 31 (17), 3861-3874 (2021).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning & Memory. 19 (4), 170-177 (2012).
- Buske, C., Gerlai, R. Maturation of shoaling behavior is accompanied by changes in the dopaminergic and serotoninergic systems in zebrafish. Developmental Psychobiology. 54 (1), 28-35 (2012).
- Huang, K. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Rupprecht, P., Prendergast, A., Wyart, C., Friedrich, R. W. Remote z-scanning with a macroscopic voice coil motor for fast 3D multiphoton laser scanning microscopy. Biomedical Optics Express. 7 (5), 1656-1671 (2016).
- Papadopoulos, I. N., Jouhanneau, J. -. S., Poulet, J. F. A., Judkewitz, B. Scattering compensation by focus scanning holographic aberration probing (F-SHARP). Nature Photonics. 11 (2), 116-123 (2017).
- Torigoe, M., et al. Zebrafish capable of generating future state prediction error show improved active avoidance behavior in virtual reality. Nature Communications. 12 (1), 5712 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved