Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Zwei-Photonen-Kalzium-Bildgebung der Vorderhirnaktivität bei sich verhaltenden erwachsenen Zebrafischen
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir ein Protokoll zur Durchführung von Zwei-Photonen-Kalzium-Bildgebung im dorsalen Vorderhirn von erwachsenen Zebrafischen vor.
Zusammenfassung
Ausgewachsene Zebrafische (Danio rerio) weisen ein reiches Repertoire an Verhaltensweisen zur Untersuchung kognitiver Funktionen auf. Sie verfügen auch über ein Miniaturgehirn, mit dem Aktivitäten in verschiedenen Hirnregionen durch optische Bildgebungsverfahren gemessen werden können. Es gibt jedoch nur wenige Berichte über die Aufzeichnung der Gehirnaktivität bei sich verhaltenden erwachsenen Zebrafischen. Die vorliegende Studie beschreibt Verfahren zur Durchführung von Zwei-Photonen-Kalzium-Bildgebung im dorsalen Vorderhirn von adulten Zebrafischen. Wir konzentrieren uns auf Schritte, um erwachsene Zebrafische daran zu hindern, ihren Kopf zu bewegen, was eine Stabilität bietet, die eine Laserscanning-Bildgebung der Gehirnaktivität ermöglicht. Die kopfgefesselten Tiere können ihre Körperteile frei bewegen und ohne Hilfsmittel atmen. Das Verfahren zielt darauf ab, die Zeit der Kopfstützenoperation zu verkürzen, die Gehirnbewegung zu minimieren und die Anzahl der aufgezeichneten Neuronen zu maximieren. Hier wird auch ein Aufbau zur Darstellung einer immersiven visuellen Umgebung während der Kalziumbildgebung beschrieben, der verwendet werden kann, um neuronale Korrelate zu untersuchen, die visuell ausgelösten Verhaltensweisen zugrunde liegen.
Einleitung
Die Kalziumfluoreszenz-Bildgebung mit genetisch kodierten Indikatoren oder synthetischen Farbstoffen ist eine leistungsstarke Methode zur Messung der neuronalen Aktivität bei sich verhaltenden Tieren, einschließlich nichtmenschlicher Primaten, Nagetiere, Vögel und Insekten1. Die Aktivität von Hunderten von Zellen, bis zu etwa 800 μm unter der Gehirnoberfläche, kann gleichzeitig mit Hilfe der Multi-Photonen-Bildgebung gemessenwerden 2,3. Die Aktivität bestimmter Zelltypen kann auch durch die Expression von Kalziumindikatoren in genetisch definierten neuronalen Populationen gemessen werden. Die Anwendung des bildgebenden Verfahrens für kleine Wirbeltiermodelle eröffnet neue Möglichkeiten im Bereich der neuronalen Berechnung über Hirnregionen hinweg.
Zebrafische sind ein weit verbreitetes Modellsystem in der neurowissenschaftlichen Forschung. Zebrafischlarven etwa 6 Tage nach der Befruchtung wurden aufgrund ihres Miniaturgehirns und ihres transparenten Körpers für die Kalziumbildgebung verwendet4. Juvenile Zebrafische (3-4 Wochen alt) werden auch verwendet, um die neuronalen Mechanismen zu untersuchen, die sensomotorischen Bahnen zugrunde liegen 5,6. Das maximale Leistungsniveau für komplexe Verhaltensweisen, einschließlich assoziativem Lernen und sozialem Verhalten, wird jedoch im Alter von 7,8 Jahren erreicht. Daher ist ein zuverlässiges Protokoll erforderlich, um mehrere kognitive Funktionen im Gehirn erwachsener Zebrafische mit bildgebenden Verfahren zu untersuchen. Während Zebrafischlarven und juvenile Zebrafische für die In-vivo-Bildgebung in Agarose eingebettet werden können, leiden erwachsene Zebrafische ab 2 Monaten unter solchen Bedingungen an Hypoxie und sind körperlich zu stark, um durch Agarose zurückgehalten zu werden. Daher ist ein chirurgischer Eingriff erforderlich, um das Gehirn zu stabilisieren und dem Tier die freie Atmung durch die Kiemen zu ermöglichen.
Hier beschreiben wir ein Kopfstützenprotokoll, das ein neuartiges Design eines einzelnen Kopfbügels beinhaltet. Die verkürzte Operationszeit von 25 Minuten ist doppelt so schnell wie bei der bisherigen Methode9. Wir beschreiben auch das Design der Aufnahmekammer (halbsechseckiger Tank), der Kopfstufe und eines Schnellverschlussmechanismus, um die beiden Teile9 zu verbinden. Abschließend wird auch der Aufbau zur Präsentation eines immersiven visuellen Stimulus zur Untersuchung visuell ausgelöster Gehirnaktivität und -verhaltensweisen beschrieben. Insgesamt können die hier beschriebenen Verfahren zur Zwei-Photonen-Kalzium-Bildgebung in genetisch definierten Zellpopulationen in einem kopfgebundenen adulten Zebrafisch verwendet werden, was die Untersuchung von Gehirnaktivitäten während verschiedener Verhaltensparadigmen ermöglicht.
Protokoll
Alle Tierbehandlungen wurden in Übereinstimmung mit den Richtlinien des Institutional Animal Care and Use Committee der Academia Sinica genehmigt und durchgeführt. Details zu den Forschungsinstrumenten finden Sie in der Materialtabelle.
1. Vorbereitung der Aufnahmekammer
- Bereiten Sie einen halbsechseckigen Tank, eine Grundplatte und eine Kopfstufe vor (Abbildung 1A; Ergänzungsakten 1-3). Die Kopfstufe besteht aus zwei Metallpfosten, die an einer kreisförmigen Platte befestigt sind. Die runde Platte enthält Nuten, die auf der Grundplatte arretiert werden können. Nach dem Verriegeln werden die Kopfstufe und die Bodenplatte auf den Boden des halbsechseckigen Tanks gelegt.
- Stellen Sie den halbsechseckigen Tank auf die Versuchsplattform des Mikroskops. Die Plattform sollte in der Lage sein, sich in X- und Y-Richtung zu bewegen, ohne an die Grenzen der Übersetzungsphase zu stoßen.
- Richten Sie das 810-nm-Infrarotlicht (IR) und die Kamera zur Verhaltensaufzeichnung auf die Kopfstufe. Stellen Sie sicher, dass das Sichtfeld der Kamera groß genug ist, um einen ausgewachsenen Zebrafisch aufzunehmen.
- Um zu verhindern, dass der Zwei-Photonen-Laser und der visuelle Reiz die Verhaltensaufzeichnung stören, stellen Sie einen 875-nm-Kurzpassfilter bzw. einen 700-nm-Langpassfilter vor der Kamera auf.
- Um den visuellen Reiz zu präsentieren, werden Rückprojektionsfolien an der Innenseite der drei Wände des halbsechseckigen Tanks angebracht (Abbildung 1A).
- Richte die drei Projektoren auf die drei Oberflächen des Tanks. Die drei Bilder sollten so ausgerichtet werden, dass sie eine zusammenhängende visuelle Szene bilden. Um zu verhindern, dass Projektorlichter das Kalziumfluoreszenzsignal verunreinigen, platzieren Sie einen Neutraldichtefilter und einen roten Farbfilter (600 nm, Langpass) vor jedem Projektor und einen Bandpassfilter (510/80 nm) vor der Photomultiplier-Röhre (PMT).
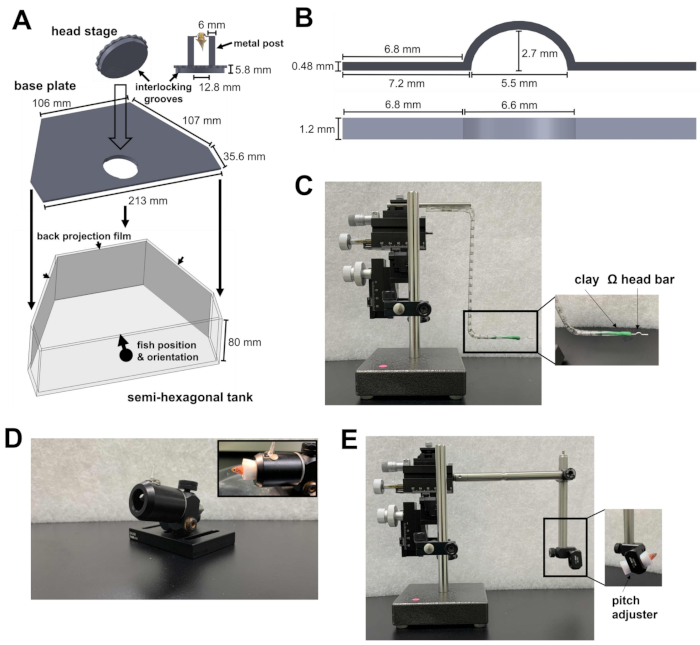
Abbildung 1: Instrumente, die für die Kopfstützenchirurgie erforderlich sind. (A) Der Schnellverschlussmechanismus zwischen der kreisförmigen Platte der Kopfstufe und der Grundplatte im Inneren des halbsechseckigen Tanks. CAD-Dateien (Computer-Aided Design) der Sonderanfertigungen finden Sie in den Ergänzungsdateien 1-4. (B) Ω förmiger Kopfbügel für die Kopfstütze. (C) Der dreiachsige Mikromanipulator, der verwendet wird, um die Kopfstange an der Befestigungsstelle zu positionieren. Einschub: Ausrichtung der Kopfstange im Ton. (D) Kanone, um den Fisch während der Operation zu halten. Einschub: Ausrichtung der Fische innerhalb der Kanone. (E) Fischlademodul und Mikromanipulator, mit dem der Fisch auf die Kopfstufe geladen wird. Einschub: Orientierung der Fische innerhalb des Moduls. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Kopfstützen-Chirurgie
- Bereiten Sie eine Ω förmige Kopfleiste vor (Abbildung 1B; Ergänzungsdatei 4) für die Zebrafisch-Kopfstütze. Befestigen Sie dazu ein Stück Modelliermasse auf Ölbasis an einem dreiachsigen Mikromanipulator. Stellen Sie sicher, dass der Ton fest genug ist, um die Kopfstange zu halten, aber weich genug, um sich nach der Kopfstütze von der Kopfstange zu lösen.
- Stecken Sie einen Arm der Kopfstange in den Ton und richten Sie die Kopfstange horizontal aus (Abbildung 1C). Dadurch wird sichergestellt, dass die spätere Befestigung des Kopfbügels am Zebrafisch waagerecht ist.
HINWEIS: Die Kopfstange kann aus Titan (24 mg) oder Edelstahl (43 mg) bestehen und kann für mehrere Experimente wiederverwendet werden. Das Material der Kopfstange hat keinen Einfluss auf das Verhalten von erwachsenen Zebrafischen (Gewichtsbereiche von 300-1.000 mg) unter einer Kopfstütze. - Bereiten Sie die Kanone vor, ein hohles Rohr, um den Fischkörper während der Operation an Ort und Stelle zu halten (Abbildung 1D).
- 0,03 % und 0,01 % Tricainmethansulfonat (TMS; siehe Materialtabelle) in Aquarienwasser herstellen. Dies wird verwendet, um den Fisch während der Operation zu betäuben und in einem sedierten Zustand zu halten.
- Bereiten Sie vier Gewebeabstriche vor, um überschüssige Haut und Wasser von den Befestigungsstellen am Schädel zu entfernen. Um jeden Tupfer vorzubereiten, schneiden Sie ein Papiertuch in ein 3 cm großes Quadrat und falten Sie es entlang seiner Diagonale, um eine röhrenartige Struktur zu erhalten. Drehen Sie die Enden des Rohres zu einer feinen Spitze. Die Befestigungsstelle ist sehr klein, so dass eine feine Spitze eine feinere Kontrolle des Tupfers ermöglicht.
- Bereiten Sie ein Fischlademodul für den Mikromanipulator vor (Abbildung 1E).
HINWEIS: Das Modul besteht aus zwei Stahlpfosten, die durch eine rechtwinklige Pfostenklemme zusammengehalten werden. Ein Pfosten wird am Mikromanipulator befestigt, während der andere Pfosten eine drehbare Pfostenklemme hält, die den Fisch trägt. Das Modul dient dazu, den Fisch fein gesteuert auf der Kopfstufe zu positionieren. Die drehbare Pfostenklemme dient als Pitch-Einsteller, um den Pitch-Winkel des Fisches zu verändern. - Betäuben Sie die Fische mit 0,03 % TMS im Aquarienwasser. Verwenden Sie bei den folgenden Schritten eine Spritze, um 0,01 % TMS im Aquarienwasser in kurzen Impulsen alle 90 s in den Mund zu geben. Der Wasserfluss aus der Perfusion sollte die Kiemenbewegung induzieren. Dadurch können die Fische während der Operation mehr als 40 Minuten überleben.
HINWEIS: Tg[neuroD:GCaMP6f] wird aufgrund seiner breiten Expression des Kalziumindikators im Vorderhirn sowohl im Larven- als auch im adulten Stadium verwendet10.
HINWEIS: Optional können Sie die Schwerkraftperfusion verwenden, um während der Operation, in denen beide Hände beschäftigt sind, einen konstanten Wasserfluss in den Mund zu gewährleisten. - Wickeln Sie den Fisch in eine Kapsel (Abbildung 2A), die den Fisch in der Kanone hält.
- Wickeln Sie den betäubten Fisch in ein Stück feuchtes Papiertaschentuch, beginnend von der Schwanzspitze bis etwa 1 mm kaudal bis zur Kieme. Achten Sie darauf, dass die Verpackung fest sitzt, um ein Herausrutschen des Fisches aus dem Gewebe zu verhindern.
- Wickeln Sie einen weichen Plastikschlauch mit einem Längsschlitz (z. B. einen mittelgroßen Schrumpfschlauch, der aufgeschnitten wurde) um das Papiertuch, um den Fisch vom Ende des Schwanzes bis etwa 2 mm kaudal bis zur Kieme zu bedecken. Der Schlauch sorgt dafür, dass der Körper des Fisches während der gesamten Operation gerade bleibt.
- Wickle ein Papiertuch um den Schlauch mit einem Durchmesser, der ungefähr dem Durchmesser der Kanone entspricht.
- Wickeln Sie ein weiches Plastikröhrchen, das Sie aus dem Kolben einer Plastiktransferpipette geschnitten haben, um das Papiertuch. Dadurch wird sichergestellt, dass die Kapsel reibungslos in die Kanone geladen werden kann.
- Lade den Fisch in die Kanone.
- Verwenden Sie ein Skalpell, um die Haut zu entfernen, die die Befestigungsstellen bedeckt, zwei dreieckige Bereiche des Schädels rostrolateral zum Kleinhirn und über den Kiemen (Abbildung 2B), und entfernen Sie dann die Haut, die den Bereich zwischen den Befestigungsstellen bedeckt. Verwenden Sie Gewebetupfer, um die Befestigungsstellen auszutrocknen und die verbleibende Haut zu entfernen.
- Verwenden Sie eine verstellbare Plattform, um den Kopf während der Hautentfernung zu stützen, aber die Plattform darf die Augen nicht berühren, um Augenverletzungen während der Operation zu vermeiden.
HINWEIS: Eine gründliche Entfernung der Haut an den Befestigungsstellen ist entscheidend, um Bewegungsartefakte während der Bildgebung zu reduzieren.
- Verwenden Sie eine verstellbare Plattform, um den Kopf während der Hautentfernung zu stützen, aber die Plattform darf die Augen nicht berühren, um Augenverletzungen während der Operation zu vermeiden.
- Tragen Sie mit einer 10-μl-Pipettenspitze einen Tropfen Gewebekleber (siehe Materialtabelle) in die Mitte jeder Befestigungsstelle auf.
HINWEIS: Gewebekleber bedeckt die Befestigungsstellen und trocknet schnell aus. Der Gewebekleber stellt eine Bindungsschnittstelle zwischen dem Schädel und dem Zahnzement dar, der zum Verkleben der Kopfleiste verwendet wird, und verhindert, dass Wasser aus den Kiemen die Befestigungsstelle erreicht. - Bringen Sie den Fischkörper in eine aufrechte Position und positionieren Sie die Kopfstange leicht oberhalb und kaudal zu den Befestigungsstellen, um die Verklebung der Kopfstange vorzubereiten.
- Bereiten Sie Zahnzement vor (siehe Materialtabelle) und verwenden Sie ihn sofort, um den Kopfbügel auf den Schädel zu kleben (Abbildung 2C). Das Verfahren ist zeitkritisch und muss innerhalb von 45 Sekunden durchgeführt werden.
- Mischen Sie einen kleinen Löffel Polymer mit vier Tropfen schnellem Monomer und einem Tropfen Katalysator V. Rühren Sie die Mischung gleichmäßig für 15 Sekunden.
- Verwenden Sie eine Mikropipette und eine 10-μl-Pipettenspitze, um die Mischung auf die Befestigungsstellen und den Bereich zwischen den Stellen aufzutragen. Vermeiden Sie es, die Kiemen und die Augen zu bedecken.
- Drücken Sie die Kopfstange mit dem Mikromanipulator vorsichtig auf den Zement. Den Kopfbügel mit dem restlichen Zement bedecken.
- Warten Sie 12 Minuten, damit der Zahnzement ausgehärtet ist. Vermeiden Sie den Kontakt von Wasser mit dem Zement.
- Um den optischen Zugang zum Vorderhirn für die Kalziumbildgebung zu verbessern, entfernen Sie die Haut oberhalb des Telencephalons. Die Hautentfernung kann in 3 Minuten mit fünf Schnitten mit einem Skalpell durchgeführt werden (Abbildung 2D). Achten Sie darauf, dass Lipidtröpfchen, die an der Oberfläche der Schädel haften, entfernt werden.
- Nach dem Aushärten den Ton von der Kopfleiste entfernen.
- Übertragen Sie die gesamte Kapsel von der Kanone auf den Pitch-Einsteller im Fischlademodul des Mikromanipulators.
- Verwenden Sie den Mikromanipulator, um den Fisch zu positionieren. Die Kopfleiste sollte auf den Metallpfosten der Kopfstufe positioniert werden. Erhöhen Sie den Neigungswinkel des Fisches leicht, damit die Oberfläche des Vorderhirns bei der Zwei-Photonen-Bildgebung besser auf die optische Ebene ausgerichtet werden kann.
- Kleben Sie die Kopfstange mit ultraviolett (UV)-härtendem Kleber auf die Metallpfosten. Für die Aushärtung ist eine UV-Belichtung von 15 s ausreichend.
- Ziehen Sie den Fisch aus der Kapsel und befestigen Sie die Kopfstufe auf der Bodenplatte im halbsechseckigen Tank.
- Tauchen Sie das Tier in Aquarienwasser. Der Fisch sollte innerhalb von 1-2 Minuten mit der Atmung beginnen und sich von der Narkose erholen.
HINWEIS: Verwenden Sie optional eine Spritzenperfusion, um frisches Wasser in den Mund zu geben.
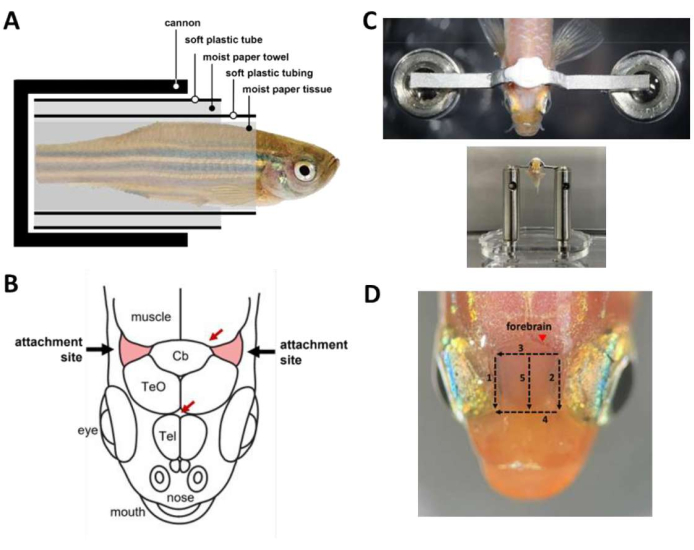
Abbildung 2: Wichtige Schritte während der Kopfstützenoperation . (A) Zusammensetzung der Kapsel im Inneren der Kanone. (B) Befestigungsstellen am Schädel (rot). Rote Pfeile geben die Stellen der Blutgefäße an. (C) Oben: Kopfstange, die am Schädel des Fisches befestigt ist. Unten: Fisch, der auf die Kopfstufe geladen wurde. (D) Schnitte, die benötigt werden, um die Haut über dem Vorderhirn zu entfernen. Zahlen bezeichnen die Schnittreihenfolge. Vermeiden Sie die Hautentfernung an der markierten Stelle (Pfeilspitze), um ein Ausbluten des Tieres zu verhindern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Zwei-Photonen-Bildgebung
- Schalten Sie den Laser ein und warten Sie 30 Minuten, bis sich die Stromversorgung stabilisiert hat. Stellen Sie die Wellenlänge auf 920 nm und die Leistung auf etwa 50 mW an der Probe ein.
HINWEIS: Der vom Resonanzscanner gesteuerte Laserstrahl bewegt sich an den Wendepunkten des Scanpfads langsam. Um Gewebeschäden zu vermeiden, wird eine Pockels-Zelle eingesetzt, um die Laserleistung an den Turnaround-Punkten zu reduzieren. - Platzieren Sie die Aufzeichnungskammer mit dem am Kopf gefesselten Zebrafisch auf der Versuchsplattform (Abbildung 3A). Die Plattform sollte in der Lage sein, sich in X- und Y-Richtung zu bewegen, ohne an die Grenzen der Übersetzungsphase zu stoßen.
- Platzieren Sie die Objektivlinse so nah wie möglich an der Oberfläche des Vorderhirns. Die Objektivlinse sollte auf den vorderen Rand der Pupille gerichtet sein (Abbildung 3B).
- Öffnen Sie den Laserverschluss und aktivieren Sie die PMT. Heben Sie die Objektivlinse allmählich an (~1 mm), bis das dorsale Vorderhirn im Fluoreszenzbild sichtbar ist (Abbildung 3C).
- Um die Anzahl der aufgezeichneten Neuronen zu erhöhen, verwenden Sie einen Piezoaktor, um Bilder in mehreren Tiefen (sechs Bildebenen im Abstand von 15 μm) aufzunehmen. Dadurch erhöht sich die Datenausbeute auf Kosten der Bildrate. Ermöglichen Sie eine schnelle Z-Achsen-Abtastung zur Steuerung des Piezoaktors (einheitlicher Modus, Anzahl der Schichten = 6, Schrittweite = 15 μm, Wellenform = Sägezahn, Flyback-Zeit = 4 ms, Aktuatorverzögerung = 8 ms).
- Um das Verhalten aufzuzeichnen, schalten Sie die 810-nm-Infrarotleuchten (IR) auf beiden Seiten des Tanks ein. Passen Sie den Winkel an, um den gesamten Körper zu beleuchten, der in der Kamera gut sichtbar sein sollte.
- Schalten Sie die Projektoren ein.
- Beginnen Sie mit dem Aufzeichnen von Daten.
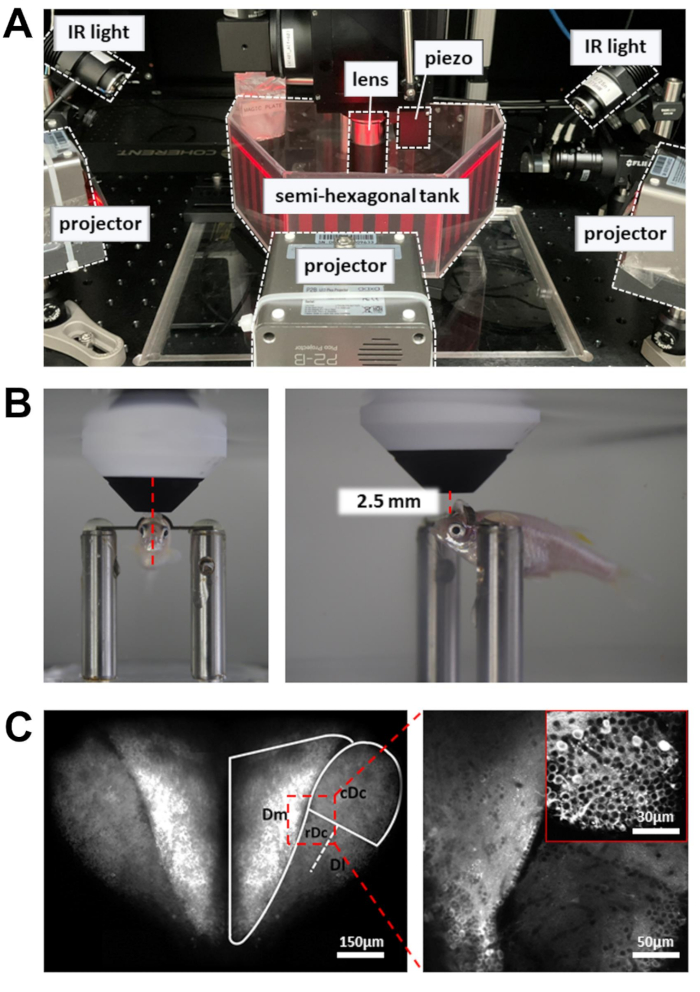
Abbildung 3: Aufbau zur Durchführung von Kalzium-Bildgebung, Verhaltensaufzeichnung und visueller Stimulusanzeige . (A) Drei Projektoren projizieren einen visuellen Reiz auf die Wände des halbsechseckigen Tanks. Seitliche IR-Leuchten dienen dazu, den Körper des Zebrafisches zu beleuchten. (B) Positionierung der Objektivlinse. Links: Vorderansicht. Rechts: Seitenansicht. Der Abstand zwischen der 16-fach-Objektivlinse und der anvisierten Hirnregion beträgt etwa 2,5 mm. (C) Beispiel Zwei-Photonen-Bild. Links: maximale Projektion des gesamten dorsalen Vorderhirns in Tg[neuroD:GCaMP6f]. Rechts: vergrößertes Bild, um Neuronen in mehreren Gehirnregionen sichtbar zu machen. Einschub: eine höhere Vergrößerung aus einer anderen Hirnregion. Bei den Bildern handelt es sich um Durchschnittswerte von 10 s Daten, die mit 5 Hz aufgezeichnet wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Das Protokoll besteht aus zwei Teilen: der Kopfstützenchirurgie und der Zwei-Photonen-Kalzium-Bildgebung neuronaler Aktivitäten im Vorderhirn. Der Erfolg einer Operation wird durch das Überleben des Tieres und die Stabilität der Kopfstütze bestimmt. Die Überlebensrate kann durch häufige Perfusion von 0,01%iger TMS-Lösung durch den Mund während der Operation stark verbessert werden. Die Fische sollten sich von der Narkose erholen und innerhalb von 1-2 Minuten aktiv atmen, nachdem sie in das Wasser des Aquariums e...
Diskussion
Hier beschreiben wir ein detailliertes Protokoll zur Fixierung des Kopfes von erwachsenen Zebrafischen für die Zwei-Photonen-Kalzium-Bildgebung. Es gibt zwei entscheidende Schritte, um eine Kopfstütze zu erreichen, die stabil genug für die Laserscanning-Bildgebung ist. Zuerst muss der Kopfbügel auf die spezifischen Befestigungsstellen der Schädel geklebt werden. Andere Teile des Schädels sind oft zu dünn, um mechanische Stabilität zu gewährleisten, und können bei starken Körperbewegungen sogar gebrochen werden...
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Diese Arbeit wurde vom Institut für Molekularbiologie, Academia Sinica, und dem National Science and Technology Council, Taiwan, unterstützt. Die Maschinenwerkstatt des Instituts für Physik der Academia Sinica half bei der Herstellung von kundenspezifischen Teilen. Wir danken auch P. Argast (Friedrich Miescher Institute for Biomedical Research, Basel, Schweiz) für die Konstruktion des Schnellverschlussmechanismus der Kopfstufe.
Materialien
| Name | Company | Catalog Number | Comments |
| Acquisition card | MBF Bioscience | Vidrio vDAQ | Microscope |
| Back-projection film | Kimoto | Diland screen - GSK | present visual stimulus |
| Band-pass filter (510/80 nm) | Chroma | ET510/80m | Microscope |
| Base plate for the semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Camera filter (<875 nm) | Edmund optics | #86-106 | Behavior recording |
| Camera filter (>700 nm) | Edmund optics | #43-949 | Behavior recording |
| Camera lens | Thorlabs | MVL50M23 | Behavior recording |
| Chameleon Vision-S | Coherent | Vision-S | Laser |
| Circular plate for the head stage | custom made | see supplemental files | recording chamber |
| Controller for piezo actuator | Physik Instrumente | E-665. CR | Microscope |
| Current amplifier | Thorlabs | TIA60 | Microscope |
| Elitedent Q-6 | Rolence Enterprise | Q-6 | Surgery: UV lamp |
| Emission Filter 510/80 nm | Chroma | ET510/80m | Microscope |
| Head bar | custom made | see supplemental files | recording chamber |
| Infrared light | Thorlabs | M810L3 | Behavior recording |
| LED projector | AAXA | P2B LED Pico Projector | present visual stimulus |
| Moist paper tissue (Kimwipe) | Kimtech Science | 34155 | Surgery: moist paper tissue |
| Motorized XY sample stage | Zaber | X-LRM050 | Microscope |
| Neutral Density Filters (50% Transmission) | Thorlabs | NE203B | present visual stimulus |
| Ø1/2" Post Holder | ThorLabs | PH1.5V | Surgery: hollow tube for cannon |
| Ø1/2" Stainless Steel Optical Post | ThorLabs | TR150/M | Surgery: fish loading module |
| Objective lens 16x, 0.8NA | Nikon | CF175 | Microscope |
| Oil-based modeling clay | Ly Hsin Clay | C4086 | Surgery: head bar holder |
| Optical adhesive | Norland Products | NOA68 | Surgery: UV curable glue |
| Photomultiplier tube | Hamamatsu | H11706P-40 | Microscope |
| Piezo actuator | Physik Instrumente | P-725.4CA PIFOC | Microscope |
| Pockels Cell | Conoptics | M350-80-LA-BK-02 | Microscope |
| Red Wratten filter (> 600 nm) | Edmund optics | #53-699 | present visual stimulus |
| Resonant-Galvo Scan System | INSS | RGE-02 | Microscope |
| Right-Angle Clamp for Ø1/2" Post | ThorLabs | RA90/M | Surgery: fish loading module |
| Rotating Clamp for Ø1/2" Post | ThorLabs | SWC/M | Surgery: fish loading module |
| ScanImage | MBF Bioscience | Basic version | Microscope |
| Semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Super-Bond C&B Kit | Sun Medical Co. | Super-Bond C&B | Surgery: dental cement |
| Tricaine methanesulfonate | Sigma Aldrich | E10521 | Surgery: anesthetic |
| USB Camera | FLIR | BFS-U3-13Y3M-C | Behavior recording |
| Vetbond | 3M | 1469SB | Surgery: tissue glue |
Referenzen
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit neuroscience in zebrafish. Current Biology. 20 (8), R371-R381 (2010).
- Kappel, J. M., et al. Visual recognition of social signals by a tectothalamic neural circuit. Nature. 608 (7921), 146-152 (2022).
- Bartoszek, E. M., et al. Ongoing habenular activity is driven by forebrain networks and modulated by olfactory stimuli. Current Biology. 31 (17), 3861-3874 (2021).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning & Memory. 19 (4), 170-177 (2012).
- Buske, C., Gerlai, R. Maturation of shoaling behavior is accompanied by changes in the dopaminergic and serotoninergic systems in zebrafish. Developmental Psychobiology. 54 (1), 28-35 (2012).
- Huang, K. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Rupprecht, P., Prendergast, A., Wyart, C., Friedrich, R. W. Remote z-scanning with a macroscopic voice coil motor for fast 3D multiphoton laser scanning microscopy. Biomedical Optics Express. 7 (5), 1656-1671 (2016).
- Papadopoulos, I. N., Jouhanneau, J. -. S., Poulet, J. F. A., Judkewitz, B. Scattering compensation by focus scanning holographic aberration probing (F-SHARP). Nature Photonics. 11 (2), 116-123 (2017).
- Torigoe, M., et al. Zebrafish capable of generating future state prediction error show improved active avoidance behavior in virtual reality. Nature Communications. 12 (1), 5712 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten