Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie calcique à deux photons de l’activité du cerveau antérieur chez le poisson-zèbre adulte
Dans cet article
Résumé
Nous présentons ici un protocole permettant d’effectuer une imagerie calcique à deux photons dans le cerveau antérieur dorsal du poisson-zèbre adulte.
Résumé
Le poisson-zèbre adulte (Danio rerio) présente un riche répertoire de comportements pour l’étude des fonctions cognitives. Ils ont également un cerveau miniature qui peut être utilisé pour mesurer les activités dans les régions du cerveau grâce à des méthodes d’imagerie optique. Cependant, les rapports sur l’enregistrement de l’activité cérébrale chez les poissons-zèbres adultes ont été rares. La présente étude décrit les procédures permettant d’effectuer une imagerie calcique à deux photons dans le cerveau antérieur dorsal du poisson-zèbre adulte. Nous nous concentrons sur les mesures à prendre pour empêcher les poissons-zèbres adultes de bouger la tête, ce qui offre une stabilité qui permet l’imagerie par balayage laser de l’activité cérébrale. Les animaux dont la tête est attachée peuvent bouger librement les parties de leur corps et respirer sans aide. La procédure vise à raccourcir la durée de la chirurgie d’appuie-tête, à minimiser les mouvements du cerveau et à maximiser le nombre de neurones enregistrés. Une configuration permettant de présenter un environnement visuel immersif pendant l’imagerie calcique est également décrite ici, ce qui peut être utilisé pour étudier les corrélats neuronaux sous-jacents aux comportements déclenchés visuellement.
Introduction
L’imagerie par fluorescence de calcium avec des indicateurs génétiquement codés ou des colorants synthétiques a été une méthode puissante pour mesurer l’activité neuronale chez les animaux qui se comportent, y compris les primates non humains, les rongeurs, les oiseaux et les insectes1. L’activité de centaines de cellules, jusqu’à environ 800 μm sous la surface du cerveau, peut être mesurée simultanément à l’aide de l’imagerie multiphotonique 2,3. L’activité de types cellulaires spécifiques peut également être mesurée en exprimant des indicateurs calciques dans des populations neuronales génétiquement définies. L’application de la méthode d’imagerie à des modèles de petits vertébrés ouvre de nouvelles possibilités dans le domaine du calcul neuronal à travers les régions du cerveau.
Le poisson-zèbre est un système modèle largement utilisé dans la recherche en neurosciences. Les larves de poisson-zèbre environ 6 jours après la fécondation ont été utilisées pour l’imagerie calcique en raison de leur cerveau miniature et de leur corps transparent4. Les poissons-zèbres juvéniles (âgés de 3 à 4 semaines) sont également utilisés pour étudier les mécanismes neuronaux sous-jacents aux voies sensorimotrices 5,6. Cependant, le niveau de performance maximal pour les comportements complexes, y compris l’apprentissage associatif et les comportements sociaux, est atteint à un âge plus avancé de 7,8 ans. Ainsi, un protocole fiable est nécessaire pour étudier de multiples fonctions cognitives dans le cerveau des poissons-zèbres adultes à l’aide de méthodes d’imagerie. Alors que les larves de poisson-zèbre et les poissons-zèbres juvéniles peuvent être intégrés dans l’agarose pour l’imagerie in vivo, les poissons-zèbres adultes âgés de 2 mois ou plus souffrent d’hypoxie dans de telles conditions et sont physiquement trop forts pour être retenus par l’agarose. Par conséquent, une intervention chirurgicale est nécessaire pour stabiliser le cerveau et permettre à l’animal de respirer librement par les branchies.
Ici, nous décrivons un protocole d’appuie-tête qui implique une nouvelle conception d’une seule barre de tête. Le temps de chirurgie réduit de 25 min est deux fois plus rapide que la méthode précédente9. Nous décrivons également la conception de la chambre d’enregistrement (cuve semi-hexagonale), de la scène principale et d’un mécanisme de verrouillage rapide pour combiner les deux parties9. Enfin, la configuration permettant de présenter un stimulus visuel immersif pour étudier l’activité cérébrale et les comportements déclenchés visuellement est également décrite. Dans l’ensemble, les procédures décrites ici peuvent être utilisées pour effectuer une imagerie calcique à deux photons dans des populations cellulaires génétiquement définies chez un poisson-zèbre adulte à tête retenue, ce qui permet d’étudier les activités cérébrales au cours de divers paradigmes comportementaux.
Protocole
Toutes les procédures relatives aux animaux ont été approuvées et effectuées conformément aux directives du Comité institutionnel de protection et d’utilisation des animaux de l’Academia Sinica. Les détails des outils de recherche se trouvent dans le tableau des matériaux.
1. Préparation de la chambre d’enregistrement
- Préparez un réservoir semi-hexagonal, une plaque de base et une platine de tête (Figure 1A ; Fichiers supplémentaires 1 à 3). La scène principale est constituée de deux poteaux métalliques fixés à une plaque circulaire. La plaque circulaire contient des rainures qui peuvent être verrouillées sur la plaque de base. Après avoir été verrouillés ensemble, la platine de tête et la plaque de base sont posées au fond de la cuve semi-hexagonale.
- Placez le réservoir semi-hexagonal sur la plate-forme expérimentale du microscope. La plate-forme doit être capable de se déplacer dans les directions X et Y sans atteindre la limite de l’étape de traduction.
- Dirigez la lumière infrarouge (IR) de 810 nm et la caméra vers la tête de la scène pour l’enregistrement comportemental. Assurez-vous que le champ de vision de la caméra est suffisamment grand pour accueillir un poisson-zèbre adulte.
- Pour éviter que le laser à deux photons et le stimulus visuel n’interfèrent avec l’enregistrement comportemental, installez un filtre passe-court de 875 nm et un filtre passe-long de 700 nm devant la caméra, respectivement.
- Pour présenter le stimulus visuel, fixez des films de rétroprojection sur le côté intérieur des trois parois du réservoir semi-hexagonal (Figure 1A).
- Dirigez les trois projecteurs vers les trois surfaces du réservoir. Les trois images doivent être alignées pour former une scène visuelle continue. Pour éviter que les lumières du projecteur ne contaminent le signal de fluorescence calcique, placez un filtre à densité neutre et un filtre de couleur rouge (600 nm, passe-long) devant chaque projecteur, et placez un filtre passe-bande (510/80 nm) devant le tube photomultiplicateur (PMT).
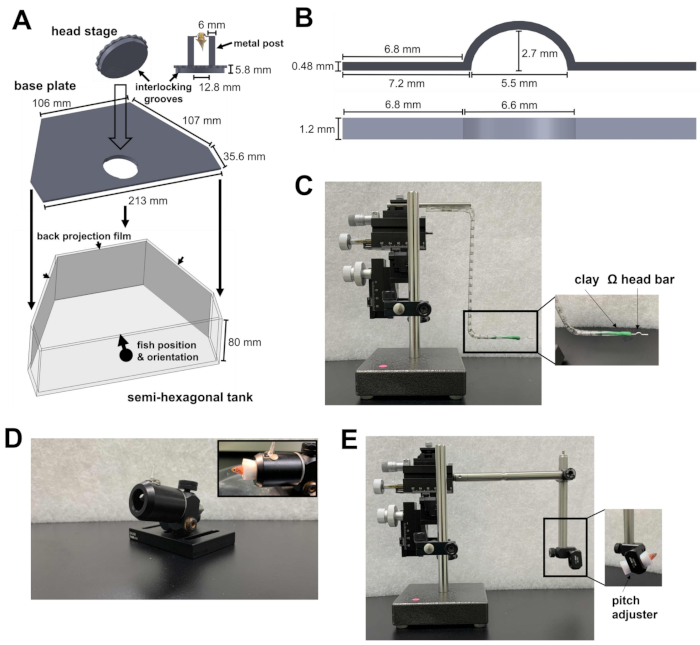
Figure 1 : Instruments requis pour la chirurgie de l’appuie-tête. (A) Le mécanisme de verrouillage rapide entre la plaque circulaire de la platine de tête et la plaque de base à l’intérieur du réservoir semi-hexagonal. Les fichiers de conception assistée par ordinateur (CAO) des pièces sur mesure se trouvent dans les fichiers supplémentaires 1 à 4. (B) Barre de tête en forme de Ω pour l’appuie-tête. (C) Le micromanipulateur à trois axes utilisé pour positionner la barre de tête sur le site de fixation. Médaillon : orientation de la barre de tête dans l’argile. (D) Canon pour tenir le poisson pendant l’opération. En médaillon : orientation du poisson à l’intérieur du canon. (E) Le module de chargement du poisson et le micromanipulateur utilisé pour charger le poisson sur la scène de tête. Encart : orientation des poissons à l’intérieur du module. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Chirurgie de l’appuie-tête
- Préparez une barre de tête en forme de Ω (Figure 1B ; Dossier supplémentaire 4) pour l’appuie-tête du poisson-zèbre. Pour ce faire, fixez un morceau de pâte à modeler à base d’huile à un micromanipulateur à trois axes. Assurez-vous que l’argile est suffisamment solide pour tenir la barre de tête, mais suffisamment molle pour se détacher de la barre de tête après l’appuie-tête.
- Insérez un bras de la barre de tête dans l’argile et orientez la barre de tête horizontalement (Figure 1C). Cela garantira que la fixation ultérieure de la barre de tête sur le poisson-zèbre sera de niveau.
REMARQUE : La barre de tête peut être en titane (24 mg) ou en acier inoxydable (43 mg) et peut être réutilisée pour plusieurs expériences. Le matériau de la barre de tête n’affecte pas le comportement du poisson-zèbre adulte (le poids varie de 300 à 1 000 mg) sous un appuie-tête. - Préparez le canon, un tube creux qui maintient le corps du poisson en place pendant l’intervention chirurgicale (figure 1D).
- Préparer 0,03 % et 0,01 % de méthanesulfonate de tricaïne (TMS ; voir le tableau des matériaux) dans l’eau de l’aquarium. Cela sera utilisé pour anesthésier et maintenir le poisson dans un état sédatif pendant la chirurgie.
- Préparez quatre écouvillons tissulaires pour enlever l’excès de peau et d’eau des sites de fixation sur le crâne. Pour préparer chaque écouvillon, découpez un essuie-tout en un carré de 3 cm et pliez-le le long de sa diagonale pour produire une structure en forme de tube. Torsadez les extrémités du tube en une pointe fine. Le site de fixation est très petit, de sorte qu’une pointe fine permet un contrôle plus fin de l’écouvillon.
- Préparez un module de chargement des poissons pour le micromanipulateur (Figure 1E).
REMARQUE : Le module se compose de deux poteaux en acier maintenus ensemble par une pince de poteau à angle droit. Un poteau se fixe au micromanipulateur, tandis que l’autre poteau contient une pince rotative qui transporte le poisson. Le module est utilisé pour positionner le poisson sur la tête de la scène avec un contrôle fin. La pince de poteau rotative sert de réglage du pas pour modifier l’angle de tangage du poisson. - Anesthésier le poisson avec 0,03% de TMS dans l’eau de l’aquarium. Tout au long des étapes suivantes, utilisez une seringue pour délivrer 0,01 % de TMS dans l’eau de l’aquarium à la bouche par impulsions courtes toutes les 90 s. L’écoulement de l’eau de la perfusion devrait induire un mouvement branchial. Cela permettra au poisson de survivre plus de 40 minutes pendant la chirurgie.
REMARQUE : Tg[neuroD :GCaMP6f] est utilisé en raison de sa large expression de l’indicateur calcique dans le cerveau antérieur aux stades larvaire et adulte10.
REMARQUE : Si vous le souhaitez, utilisez la perfusion par gravité pour fournir un débit d’eau constant à la bouche pendant les périodes de chirurgie où les deux mains sont occupées. - Enveloppez le poisson dans une capsule (figure 2A) qui le maintient à l’intérieur du canon.
- Enveloppez le poisson anesthésié dans un morceau de papier de soie humide en partant de l’extrémité de la queue jusqu’à environ 1 mm caudal jusqu’à la branchie. Assurez-vous que l’emballage est bien serré pour éviter que le poisson ne glisse hors du tissu.
- Enroulez un tube en plastique souple avec une fente longitudinale (par exemple, un tube thermorétractable de taille moyenne ouvert) autour du tissu en papier pour couvrir le poisson de l’extrémité de la queue jusqu’à environ 2 mm caudal jusqu’à la branchie. La tubulure garantit que le corps du poisson reste droit tout au long de la chirurgie.
- Enroulez une serviette en papier autour du tube à un diamètre à peu près similaire au diamètre du canon.
- Enroulez un tube en plastique souple découpé dans l’ampoule d’une pipette de transfert en plastique autour de l’essuie-tout. Cela garantit que la capsule peut être chargée en douceur dans le canon.
- Chargez le poisson dans le canon.
- À l’aide d’un scalpel, retirez la peau qui recouvre les sites d’attache, deux zones triangulaires du crâne rostrolatérales au cervelet et au-dessus des branchies (figure 2B), puis retirez la peau qui recouvre la région située entre les sites d’attache. Utilisez des écouvillons tissulaires pour sécher les sites de fixation et éliminer toute peau restante.
- Utilisez une plate-forme réglable pour soutenir la tête pendant l’extraction de la peau, mais la plate-forme ne doit pas entrer en contact avec les yeux pour éviter les blessures oculaires pendant l’opération.
REMARQUE : L’ablation complète de la peau au niveau des sites de fixation est cruciale pour réduire les artefacts de mouvement pendant l’imagerie.
- Utilisez une plate-forme réglable pour soutenir la tête pendant l’extraction de la peau, mais la plate-forme ne doit pas entrer en contact avec les yeux pour éviter les blessures oculaires pendant l’opération.
- Appliquez une goutte de colle à tissu (voir le tableau des matériaux) au centre de chaque site de fixation à l’aide d’une pointe de pipette de 10 μL.
REMARQUE : La colle à tissu recouvre les sites de fixation et sèche rapidement. La colle tissulaire fournit une interface de liaison entre le crâne et le ciment dentaire utilisé pour coller la barre de tête et empêche l’eau des branchies d’atteindre le site de fixation. - Placez le corps du poisson en position verticale et positionnez la barre de tête légèrement au-dessus et caudale des sites de fixation en préparation du collage de la barre de tête.
- Préparez du ciment dentaire (voir le tableau des matériaux) et utilisez-le immédiatement pour coller la barre de tête au crâne (figure 2C). La procédure est urgente et doit être effectuée dans les 45 s.
- Mélangez une petite cuillère de polymère avec quatre gouttes de monomère rapide et une goutte de catalyseur V. Remuez uniformément le mélange pendant 15 s.
- À l’aide d’une micropipette et d’une pointe de pipette de 10 μL, appliquer le mélange sur les sites de fixation et la région située entre les sites. Évitez de couvrir les branchies et les yeux.
- Appuyez doucement la barre de tête sur le ciment à l’aide du micromanipulateur. Recouvrez la barre de tête avec le reste de ciment.
- Attendez 12 min pour permettre le durcissement du ciment dentaire. Évitez le contact de l’eau avec le ciment.
- Pour améliorer l’accès optique au cerveau antérieur pour l’imagerie calcique, retirez la peau au-dessus du télencéphale. L’enlèvement de la peau peut se faire en 3 min avec cinq incisions à l’aide d’un scalpel (Figure 2D). Assurez-vous que les gouttelettes lipidiques adhérant à la surface des crânes sont éliminées.
- Après durcissement, retirez l’argile de la barre de tête.
- Transférez l’ensemble de la capsule du canon vers l’ajusteur de pas dans le module de chargement des poissons du micromanipulateur.
- Utilisez le micromanipulateur pour positionner le poisson. La barre de tête doit être positionnée au-dessus des poteaux métalliques de la scène principale. Augmentez légèrement l’angle de tangage du poisson afin que la surface du cerveau antérieur puisse être mieux alignée sur le plan optique lors de l’imagerie à deux photons.
- Collez la barre de tête sur les poteaux métalliques avec de la colle durcissable aux ultraviolets (UV). Une exposition UV de 15 s est suffisante pour le durcissement.
- Retirez le poisson de la capsule et verrouillez la platine de tête sur la plaque de base à l’intérieur du réservoir semi-hexagonal.
- Plongez l’animal dans l’eau de l’aquarium. Le poisson devrait commencer à respirer et se remettre de l’anesthésie en 1 à 2 minutes.
REMARQUE : Si vous le souhaitez, utilisez la perfusion à la seringue pour administrer de l’eau fraîche à la bouche.
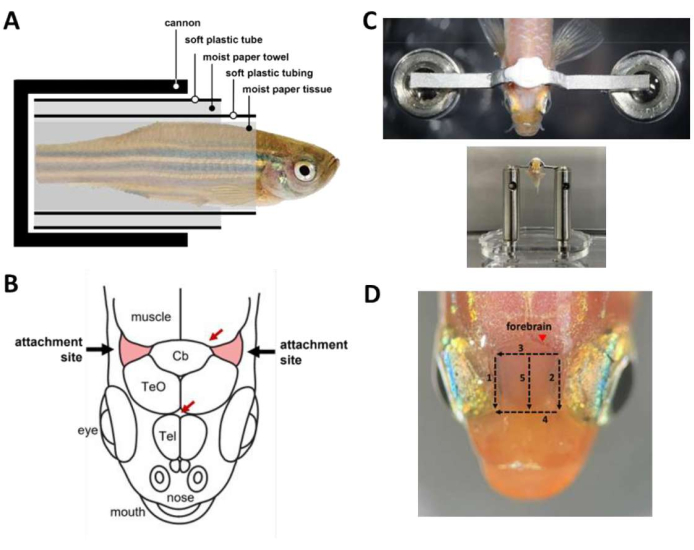
Figure 2 : Étapes clés de la chirurgie de l’appuie-tête. (A) Composition de la capsule à l’intérieur du canon. (B) Sites d’attache sur le crâne (rouge). Les flèches rouges précisent l’emplacement des vaisseaux sanguins. (C) En haut : barre de tête attachée au crâne du poisson. En bas : poissons chargés sur la tête de la scène. (D) Coupures nécessaires pour enlever la peau au-dessus du cerveau antérieur. Les chiffres indiquent la séquence de coupe. Éviter l’enlèvement de la peau à l’endroit marqué (pointe de flèche) pour éviter le saignement de l’animal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Imagerie à deux photons
- Allumez le laser et attendez 30 minutes pour que l’alimentation se stabilise. Réglez la longueur d’onde sur 920 nm et la puissance sur environ 50 mW au niveau de l’échantillon.
REMARQUE : Le faisceau laser contrôlé par le scanner résonant se déplace lentement aux points d’inflexion de la trajectoire de balayage. Pour éviter d’endommager les tissus, une cellule de Pockels est utilisée pour réduire la puissance du laser aux points d’arrêt. - Placer la chambre d’enregistrement contenant le poisson-zèbre à tête retenue sur la plate-forme expérimentale (figure 3A). La plate-forme doit être capable de se déplacer dans les directions X et Y sans atteindre la limite de l’étape de traduction.
- Placez la lentille de l’objectif aussi près que possible de la surface du cerveau antérieur. La lentille de l’objectif doit être dirigée vers le bord avant de la pupille (Figure 3B).
- Ouvrez l’obturateur laser et activez le PMT. Élevez progressivement la lentille de l’objectif (~1 mm) jusqu’à ce que le cerveau antérieur dorsal soit révélé dans l’image de fluorescence (Figure 3C).
- Pour augmenter le nombre de neurones enregistrés, utilisez un actionneur piézoélectrique pour acquérir des images à plusieurs profondeurs (six plans d’image, distants de 15 μm). Cela augmentera le rendement des données au détriment de la fréquence d’images. Permet un balayage rapide de l’axe Z pour contrôler l’actionneur piézoélectrique (mode uniforme, nombre de tranches = 6, taille du pas = 15 μm, forme d’onde = dents de scie, temps de retour en vol = 4 ms, décalage de l’actionneur = 8 ms).
- Pour l’enregistrement du comportement, allumez les lumières infrarouges (IR) de 810 nm des deux côtés du réservoir. Ajustez l’angle pour éclairer l’ensemble du corps, qui doit être clairement visible dans l’appareil photo.
- Allumez les projecteurs.
- Commencez à enregistrer des données.
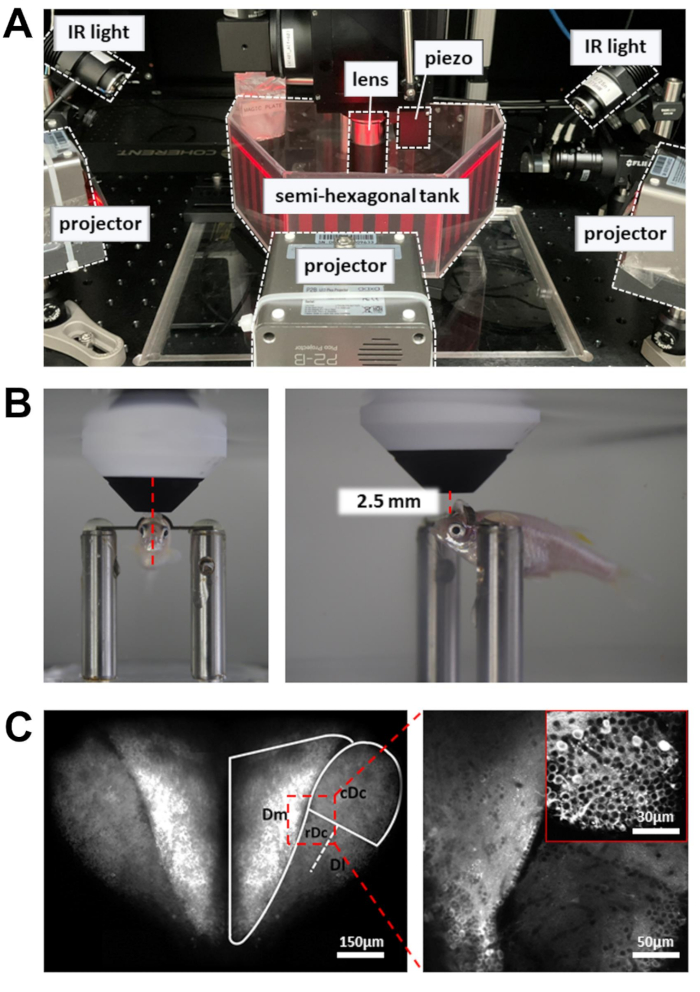
Figure 3 : Configuration permettant d’effectuer l’imagerie calcique, l’enregistrement du comportement et l’affichage des stimuli visuels. (A) Trois projecteurs présentent un stimulus visuel sur les parois du réservoir semi-hexagonal. Des lumières infrarouges sur le côté sont utilisées pour éclairer le corps du poisson-zèbre. (B) Positionnement de la lentille de l’objectif. À gauche : vue de face. À droite : vue de côté. La distance entre l’objectif 16x et la région cérébrale ciblée est d’environ 2,5 mm. (C) Exemple d’image à deux photons. À gauche : projection maximale de l’ensemble du cerveau antérieur dorsal en Tg[neuroD :GCaMP6f]. À droite : image agrandie pour révéler les neurones de plusieurs régions du cerveau. Médaillon : un grossissement plus élevé provenant d’une région cérébrale différente. Les images sont des moyennes de 10 s de données enregistrées à 5 Hz. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Le protocole se compose de deux parties : la chirurgie d’appuie-tête et l’imagerie calcique à deux photons des activités neuronales dans le cerveau antérieur. Le succès d’une intervention chirurgicale est défini par la survie de l’animal et la stabilité de l’appuie-tête. Le taux de survie peut être grandement amélioré par une perfusion fréquente de solution de SMT à 0,01 % par voie buccale pendant la chirurgie. Les poissons doivent se remettre de l’anesthésie et respirer activement dans les 1 à...
Discussion
Ici, nous décrivons un protocole détaillé pour retenir la tête du poisson-zèbre adulte pour l’imagerie calcique à deux photons. Il y a deux étapes essentielles pour obtenir un appuie-tête suffisamment stable pour l’imagerie par balayage laser. Tout d’abord, la barre de tête doit être collée aux sites de fixation spécifiques des crânes. D’autres parties du crâne sont souvent trop minces pour assurer une stabilité mécanique et peuvent même être fracturées lors de mouvements corporels importants. ...
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
Ce travail a été soutenu par l’Institut de biologie moléculaire, l’Academia Sinica et le Conseil national de la science et de la technologie de Taïwan. L’atelier d’usinage de l’Institut de physique de l’Academia Sinica a contribué à la fabrication de pièces conçues sur mesure. Nous tenons également à remercier P. Argast (Institut Friedrich Miescher pour la recherche biomédicale, Bâle, Suisse) pour la conception du mécanisme de verrouillage rapide de la scène de tête.
matériels
| Name | Company | Catalog Number | Comments |
| Acquisition card | MBF Bioscience | Vidrio vDAQ | Microscope |
| Back-projection film | Kimoto | Diland screen - GSK | present visual stimulus |
| Band-pass filter (510/80 nm) | Chroma | ET510/80m | Microscope |
| Base plate for the semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Camera filter (<875 nm) | Edmund optics | #86-106 | Behavior recording |
| Camera filter (>700 nm) | Edmund optics | #43-949 | Behavior recording |
| Camera lens | Thorlabs | MVL50M23 | Behavior recording |
| Chameleon Vision-S | Coherent | Vision-S | Laser |
| Circular plate for the head stage | custom made | see supplemental files | recording chamber |
| Controller for piezo actuator | Physik Instrumente | E-665. CR | Microscope |
| Current amplifier | Thorlabs | TIA60 | Microscope |
| Elitedent Q-6 | Rolence Enterprise | Q-6 | Surgery: UV lamp |
| Emission Filter 510/80 nm | Chroma | ET510/80m | Microscope |
| Head bar | custom made | see supplemental files | recording chamber |
| Infrared light | Thorlabs | M810L3 | Behavior recording |
| LED projector | AAXA | P2B LED Pico Projector | present visual stimulus |
| Moist paper tissue (Kimwipe) | Kimtech Science | 34155 | Surgery: moist paper tissue |
| Motorized XY sample stage | Zaber | X-LRM050 | Microscope |
| Neutral Density Filters (50% Transmission) | Thorlabs | NE203B | present visual stimulus |
| Ø1/2" Post Holder | ThorLabs | PH1.5V | Surgery: hollow tube for cannon |
| Ø1/2" Stainless Steel Optical Post | ThorLabs | TR150/M | Surgery: fish loading module |
| Objective lens 16x, 0.8NA | Nikon | CF175 | Microscope |
| Oil-based modeling clay | Ly Hsin Clay | C4086 | Surgery: head bar holder |
| Optical adhesive | Norland Products | NOA68 | Surgery: UV curable glue |
| Photomultiplier tube | Hamamatsu | H11706P-40 | Microscope |
| Piezo actuator | Physik Instrumente | P-725.4CA PIFOC | Microscope |
| Pockels Cell | Conoptics | M350-80-LA-BK-02 | Microscope |
| Red Wratten filter (> 600 nm) | Edmund optics | #53-699 | present visual stimulus |
| Resonant-Galvo Scan System | INSS | RGE-02 | Microscope |
| Right-Angle Clamp for Ø1/2" Post | ThorLabs | RA90/M | Surgery: fish loading module |
| Rotating Clamp for Ø1/2" Post | ThorLabs | SWC/M | Surgery: fish loading module |
| ScanImage | MBF Bioscience | Basic version | Microscope |
| Semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Super-Bond C&B Kit | Sun Medical Co. | Super-Bond C&B | Surgery: dental cement |
| Tricaine methanesulfonate | Sigma Aldrich | E10521 | Surgery: anesthetic |
| USB Camera | FLIR | BFS-U3-13Y3M-C | Behavior recording |
| Vetbond | 3M | 1469SB | Surgery: tissue glue |
Références
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit neuroscience in zebrafish. Current Biology. 20 (8), R371-R381 (2010).
- Kappel, J. M., et al. Visual recognition of social signals by a tectothalamic neural circuit. Nature. 608 (7921), 146-152 (2022).
- Bartoszek, E. M., et al. Ongoing habenular activity is driven by forebrain networks and modulated by olfactory stimuli. Current Biology. 31 (17), 3861-3874 (2021).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning & Memory. 19 (4), 170-177 (2012).
- Buske, C., Gerlai, R. Maturation of shoaling behavior is accompanied by changes in the dopaminergic and serotoninergic systems in zebrafish. Developmental Psychobiology. 54 (1), 28-35 (2012).
- Huang, K. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Rupprecht, P., Prendergast, A., Wyart, C., Friedrich, R. W. Remote z-scanning with a macroscopic voice coil motor for fast 3D multiphoton laser scanning microscopy. Biomedical Optics Express. 7 (5), 1656-1671 (2016).
- Papadopoulos, I. N., Jouhanneau, J. -. S., Poulet, J. F. A., Judkewitz, B. Scattering compensation by focus scanning holographic aberration probing (F-SHARP). Nature Photonics. 11 (2), 116-123 (2017).
- Torigoe, M., et al. Zebrafish capable of generating future state prediction error show improved active avoidance behavior in virtual reality. Nature Communications. 12 (1), 5712 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon