Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Двухфотонная кальциевая визуализация активности переднего мозга у взрослых рыбок данио-рерио
В этой статье
Резюме
Здесь мы представляем протокол для выполнения двухфотонной визуализации кальция в дорсальном переднем мозге взрослых рыбок данио.
Аннотация
Взрослые рыбки данио (Danio rerio) демонстрируют богатый репертуар поведения для изучения когнитивных функций. У них также есть миниатюрный мозг, который может быть использован для измерения активности в различных областях мозга с помощью методов оптической визуализации. Тем не менее, сообщения о регистрации активности мозга у взрослых рыбок данио-рерио были скудными. В настоящем исследовании описаны процедуры выполнения двухфотонной визуализации кальция в дорсальном переднем мозге взрослых рыбок данио. Мы фокусируемся на шагах, направленных на то, чтобы удержать взрослых рыбок данио от движения головой, что обеспечивает стабильность, позволяющую проводить лазерное сканирование активности мозга. Животные с ограниченной головой могут свободно двигать частями тела и дышать без вспомогательных средств. Процедура направлена на сокращение времени операции по удержанию головы, минимизацию движений мозга и максимальное количество регистрируемых нейронов. Здесь также описана установка для представления иммерсивной визуальной среды во время визуализации кальция, которая может быть использована для изучения нейронных коррелятов, лежащих в основе визуально запускаемого поведения.
Введение
Флуоресцентная визуализация кальция с генетически кодируемыми индикаторами или синтетическими красителями является мощным методом измерения активности нейронов у животных, включая нечеловекообразных приматов, грызунов, птиц инасекомых. Активность сотен клеток, расположенных на глубине примерно до 800 мкм под поверхностью мозга, может быть измерена одновременно с помощью многофотонной визуализации 2,3. Активность определенных типов клеток также может быть измерена путем экспрессии показателей кальция в генетически определенных популяциях нейронов. Применение метода визуализации для моделей мелких позвоночных открывает новые возможности в области нейронных вычислений в разных областях мозга.
Рыбки данио-рерио являются широко используемой модельной системой в исследованиях в области нейробиологии. Личинки рыбок данио-рерио примерно через 6 дней после оплодотворения были использованы для визуализации кальция из-за их миниатюрного мозга и прозрачноготела. Молодь рыбок данио-рерио (3-4 недели) также используется для изучения нейронных механизмов, лежащих в основе сенсомоторных путей 5,6. Тем не менее, максимальный уровень производительности для сложного поведения, включая ассоциативное обучение и социальное поведение, достигается в старшем возрасте 7,8 лет. Таким образом, требуется надежный протокол для изучения множественных когнитивных функций в мозге взрослых рыбок данио с помощью методов визуализации. В то время как личинки данио-рерио и молодые рыбки данио-рерио могут быть помещены в агарозу для визуализации in vivo, взрослые рыбки данио-рерио в возрасте 2 месяцев и старше страдают от гипоксии в таких условиях и физически слишком сильны, чтобы их можно было сдержать агарозой. Поэтому требуется хирургическое вмешательство, чтобы стабилизировать мозг и дать возможность животному свободно дышать через жабры.
Здесь мы опишем протокол подголовника, который включает в себя новую конструкцию одной дуги. Сокращение времени операции на 25 минут в два раза быстрее, чем при предыдущем методе9. Описана также конструкция записывающей камеры (полушестигранного бака), головного столика и быстросъемного механизма для совмещения двух частей9. Наконец, описывается установка для представления иммерсивного визуального стимула для изучения визуально запускаемой активности мозга и поведения. В целом, процедуры, описанные здесь, могут быть использованы для выполнения двухфотонной визуализации кальция в генетически определенных клеточных популяциях у взрослой рыбки данио с ограниченной головой, что позволяет исследовать активность мозга во время различных поведенческих парадигм.
протокол
Все процедуры для животных были одобрены и проведены в соответствии с руководящими принципами Институционального комитета по уходу за животными и их использованию Academia Sinica. Подробную информацию об инструментах исследования можно найти в Таблице материалов.
1. Подготовка записывающей камеры
- Подготовьте полушестигранный резервуар, опорную плиту и головную ступень (Рисунок 1А; Дополнительные файлы 1-3). Головная ступень состоит из двух металлических стоек, прикрепленных к круглой пластине. Круглая пластина содержит канавки, которые можно зафиксировать на опорной плите. После склеивания головная ступень и опорная плита укладываются на дно полушестигранного резервуара.
- Поместите полушестигранный резервуар на экспериментальную площадку микроскопа. Платформа должна иметь возможность двигаться в направлениях X и Y, не упираясь в предел этапа трансляции.
- Направьте инфракрасный (ИК) свет с длиной волны 810 нм и камеру на головной столик для записи поведения. Убедитесь, что поле зрения камеры достаточно велико, чтобы вместить взрослую рыбку данио.
- Чтобы двухфотонный лазер и визуальный стимул не мешали поведенческой записи, установите перед камерой короткочастотный фильтр с длиной волны 875 нм и длинночастотный фильтр с длиной волны 700 нм соответственно.
- Чтобы представить визуальный стимул, прикрепите пленки обратной проекции к внутренней стороне трех стенок полушестиугольного резервуара (рис. 1А).
- Направьте три прожектора на три поверхности резервуара. Три изображения должны быть выровнены, чтобы сформировать непрерывную визуальную сцену. Чтобы предотвратить загрязнение сигнала флуоресценции кальция светом проектора, поместите фильтр нейтральной плотности и фильтр красного цвета (600 нм, длиннопроходный) перед каждым проектором, а полосовой фильтр (510/80 нм) перед фотоумножителем (ФЭУ).
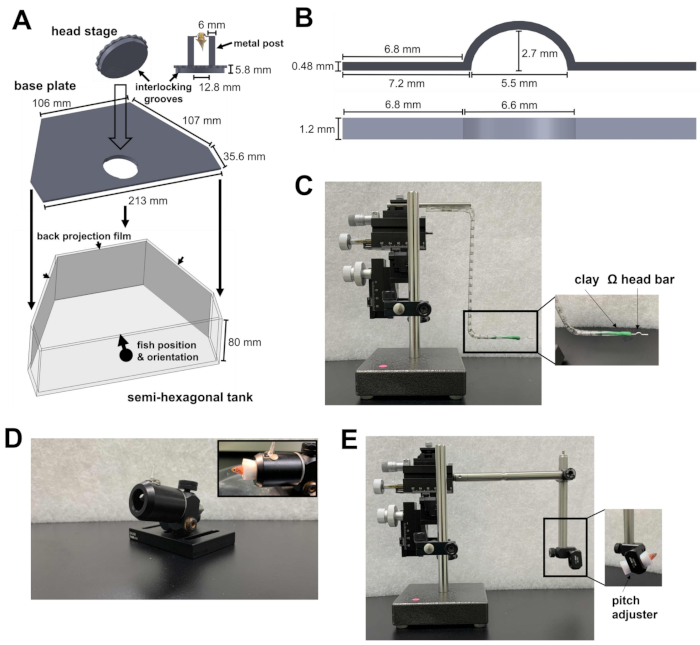
Рисунок 1: Инструменты, необходимые для операции с подголовником. (A) Быстросъемный механизм между круглой пластиной головной ступени и опорной плитой внутри полушестигранного резервуара. Файлы систем автоматизированного проектирования (САПР) деталей, изготовленных по индивидуальному заказу, можно найти в Дополнительных файлах 1-4. (B) Ω-образная перекладина для подголовника. (C) Трехосевой микроманипулятор, используемый для позиционирования головки шины к месту крепления. Врезка: ориентация головного стержня в глине. (D) Пушка для удержания рыбы во время операции. Врезка: ориентация рыбы внутри пушки. (E) Модуль загрузки рыбы и микроманипулятор, используемый для загрузки рыбы на головную ступень. Врезка: ориентация рыбы в модуле. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
2. Операция с подголовником
- Подготовьте Ω-образную планку головы (Рисунок 1Б; Дополнительный файл 4) для подголовника данио-рерио. Для этого приложите кусочек пластилина на масляной основе к трехосевому микроманипулятору. Убедитесь, что глина достаточно твердая, чтобы удерживать перекладину головы, но достаточно мягкая, чтобы отсоединиться от перекладины после подголовника.
- Вставьте кронштейн головного бруска в глину и сориентируйте головной брусок горизонтально (Рисунок 1C). Это гарантирует, что последующее крепление перекладины головы к рыбке данио-рерио будет ровным.
ПРИМЕЧАНИЕ: Головной стержень может быть изготовлен из титана (24 мг) или нержавеющей стали (43 мг) и может быть повторно использован для нескольких экспериментов. Материал перекладины для головы не влияет на поведение взрослых рыбок данио (вес колеблется в пределах 300-1000 мг) под подголовником. - Подготовьте пушку, полую трубку для удержания тела рыбы на месте во время операции (рис. 1D).
- Приготовьте 0,03% и 0,01% трикаина метансульфоната (ТМС; см. таблицу материалов) в воде аквариума. Он будет использоваться для анестезии и поддержания рыбы в седативном состоянии во время операции.
- Подготовьте четыре тканевых тампона, чтобы удалить лишнюю кожу и воду из мест прикрепления на черепе. Чтобы подготовить каждый тампон, разрежьте бумажное полотенце на квадрат диаметром 3 см и сложите по диагонали, чтобы получилась трубообразная структура. Скрутите концы трубки в тонкую точку. Место прикрепления очень маленькое, поэтому тонкая точка позволяет более точно контролировать тампон.
- Подготовьте модуль загрузки рыбы для микроманипулятора (рис. 1E).
ПРИМЕЧАНИЕ: Модуль состоит из двух стальных стоек, скрепленных между собой угловым зажимом. Одна стойка крепится к микроманипулятору, а другая стойка удерживает вращающийся зажим стойки, который несет рыбу. Модуль используется для позиционирования рыбы на головной столик с точным контролем. Вращающийся зажим стойки служит регулятором шага для изменения угла наклона рыбы. - Обезболивайте рыб 0,03% ТМС в воде аквариума. На следующих этапах используйте шприц для введения 0,01% ТМС в воде аквариума в рот короткими импульсами каждые 90 с. Поток воды из перфузии должен вызывать движение жабр. Это позволит рыбе выжить более 40 минут во время операции.
ПРИМЕЧАНИЕ: Tg[neuroD:GCaMP6f] используется из-за его широкой экспрессии индикатора кальция в переднем мозге как на личиночной, так и на взрослой стадиях10.
ПРИМЕЧАНИЕ: По желанию используйте гравитационную перфузию, чтобы обеспечить постоянный приток воды в рот во время операции, когда заняты обе руки. - Заверните рыбу в капсулу (Рисунок 2А), которая удерживает рыбу внутри пушки.
- Заверните рыбу, находящуюся под наркозом, в кусок влажной бумажной ткани, начиная от кончика хвоста примерно на 1 мм от хвоста до жабр. Убедитесь, что упаковка плотно затянута, чтобы предотвратить выскальзывание рыбы из ткани.
- Оберните мягкую пластиковую трубку с продольной прорезью (например, термоусадочную трубку среднего размера, разрезанную) вокруг бумажной ткани, чтобы покрыть рыбу от конца хвоста примерно до 2 мм хвоста до жабры. Трубка гарантирует, что тело рыбы остается прямым на протяжении всей операции.
- Оберните бумажное полотенце вокруг трубки до диаметра, который примерно равен диаметру пушки.
- Оберните вокруг бумажного полотенца мягкую пластиковую трубку, вырезанную из колбы пластиковой пипетки. Это обеспечивает плавную загрузку капсулы в пушку.
- Загрузите рыбу в пушку.
- С помощью скальпеля удалите кожу, покрывающую места прикрепления, два треугольных участка черепа ростролатерально по отношению к мозжечку и над жабрами (Рисунок 2B), затем удалите кожу, покрывающую область между местами прикрепления. Используйте тканевые тампоны, чтобы высушить места прикрепления и очистить оставшуюся кожу.
- Используйте регулируемую платформу для поддержки головы во время удаления кожи, но платформа не должна соприкасаться с глазами, чтобы избежать травмы глаз во время операции.
ПРИМЕЧАНИЕ: Тщательное удаление кожи в местах прикрепления имеет решающее значение для уменьшения артефактов движения во время визуализации.
- Используйте регулируемую платформу для поддержки головы во время удаления кожи, но платформа не должна соприкасаться с глазами, чтобы избежать травмы глаз во время операции.
- Нанесите каплю тканевого клея (см. Таблицу материалов) в центр каждого места крепления с помощью наконечника для пипетки объемом 10 мкл.
ПРИМЕЧАНИЕ: Тканевый клей покрывает места крепления и быстро высыхает. Тканевый клей обеспечивает связующее звено между черепом и стоматологическим цементом, используемым для приклеивания стержня головы, и предотвращает попадание воды из жабр в место крепления. - Поставьте туловище рыбы в вертикальное положение и расположите планку головы немного выше и каудально к местам крепления, готовясь к приклеиванию головного стержня.
- Приготовьте стоматологический цемент (см. Таблицу материалов) и сразу же используйте его, чтобы приклеить головной стержень к черепу (Рисунок 2C). Процедура зависит от времени и должна быть проведена в течение 45 секунд.
- Смешайте одну маленькую ложку полимера с четырьмя каплями быстрого мономера и одной каплей катализатора V. Равномерно перемешивайте смесь в течение 15 с.
- С помощью микропипетки и наконечника для пипетки объемом 10 мкл нанесите смесь на места прикрепления и область между ними. Не закрывайте жабры и глаза.
- Аккуратно прижмите головной стержень к цементу с помощью микроманипулятора. Покройте верхний брусок оставшимся цементом.
- Подождите 12 минут, чтобы стоматологический цемент затвердел. Избегайте попадания воды на цемент.
- Чтобы улучшить оптический доступ к переднему мозгу для визуализации кальция, удалите кожу над предмозговым мозгом. Удаление кожи может быть выполнено за 3 минуты с помощью пяти надрезов с помощью скальпеля (рис. 2D). Убедитесь, что липидные капли, прилипшие к поверхности черепа, удалены.
- После застывания удалите глину с головного бруска.
- Перенесите всю капсулу из пушки в регулятор тангажа в рыбопогрузочном модуле микроманипулятора.
- Используйте микроманипулятор для позиционирования рыбы. Головной стержень должен располагаться поверх металлических стоек головного столика. Немного увеличьте угол тангажа рыбы, чтобы поверхность переднего мозга могла быть лучше выровнена по оптической плоскости во время двухфотонной визуализации.
- Приклейте планку головы к металлическим стойкам с помощью клея, отверждаемого ультрафиолетом (УФ). Для отверждения достаточно 15-секундного воздействия ультрафиолета.
- Вытащите рыбу из капсулы и зафиксируйте головную ступень на опорной пластине в полушестиугольном резервуаре.
- Погрузите животное в воду аквариума. Рыба должна начать дышать и прийти в себя после наркоза в течение 1-2 минут.
ПРИМЕЧАНИЕ: По желанию используйте шприцевую перфузию для подачи пресной воды в рот.
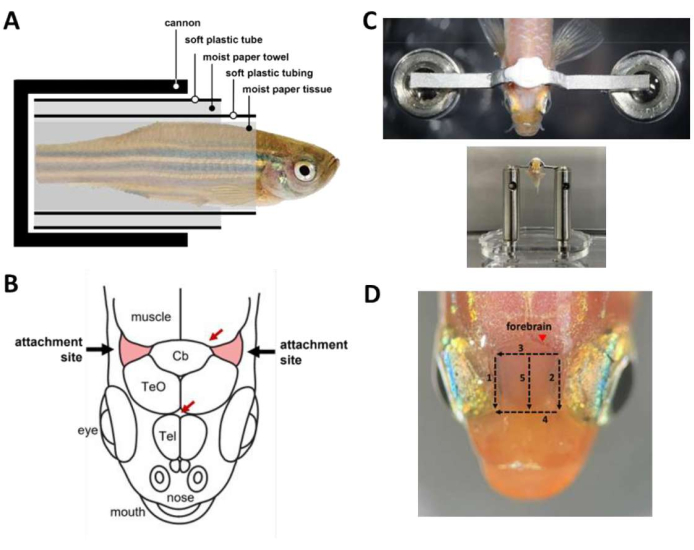
Рисунок 2: Основные этапы операции по установке подголовника . (А) Состав капсюля внутри пушки. (Б) Места прикрепления на черепе (красные). Красными стрелками обозначены места расположения кровеносных сосудов. (C) Вверху: перекладина головы, прикрепленная к черепу рыбы. Дно: рыба, загруженная на головную ступень. (D) Разрезы, необходимые для удаления кожи над передним мозгом. Цифры обозначают последовательность резки. Избегайте удаления шкуры в отмеченном месте (наконечник стрелы), чтобы предотвратить кровотечение животного. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Двухфотонная визуализация
- Включите лазер и подождите 30 минут, пока мощность стабилизируется. Установите длину волны 920 нм и мощность около 50 мВт на образце.
ПРИМЕЧАНИЕ: Лазерный луч, управляемый резонансным сканером, медленно движется в точках поворота траектории сканирования. Чтобы предотвратить повреждение тканей, используется ячейка Поккельса, которая снижает мощность лазера в точках оборота. - Поместите записывающую камеру, содержащую рыбку данио-рерио со скованной головой, на экспериментальную платформу (Рисунок 3A). Платформа должна иметь возможность двигаться в направлениях X и Y, не упираясь в предел этапа трансляции.
- Расположите линзу объектива как можно ближе к поверхности переднего мозга. Объектив должен быть направлен на передний край зрачка (рис. 3Б).
- Откройте лазерный затвор и включите ФЭУ. Постепенно поднимайте линзу объектива (~1 мм) до тех пор, пока на флуоресцентном изображении не будет видна тыльная часть переднего мозга (рис. 3C).
- Чтобы увеличить количество регистрируемых нейронов, используйте пьезопривод для получения изображений на разной глубине (шесть плоскостей изображения, расположенных на расстоянии 15 мкм друг от друга). Это увеличит выход данных за счет частоты кадров. Включите быстрое сканирование по оси Z для управления пьезоприводом (равномерный режим, количество срезов = 6, размер шага = 15 мкм, форма сигнала = пилообразный, время обратного хода = 4 мс, задержка привода = 8 мс).
- Для регистрации поведения включите инфракрасные (ИК) индикаторы с длиной волны 810 нм с обеих сторон резервуара. Отрегулируйте угол, чтобы осветить все тело, которое должно быть хорошо видно в камере.
- Включите проекторы.
- Начните запись данных.
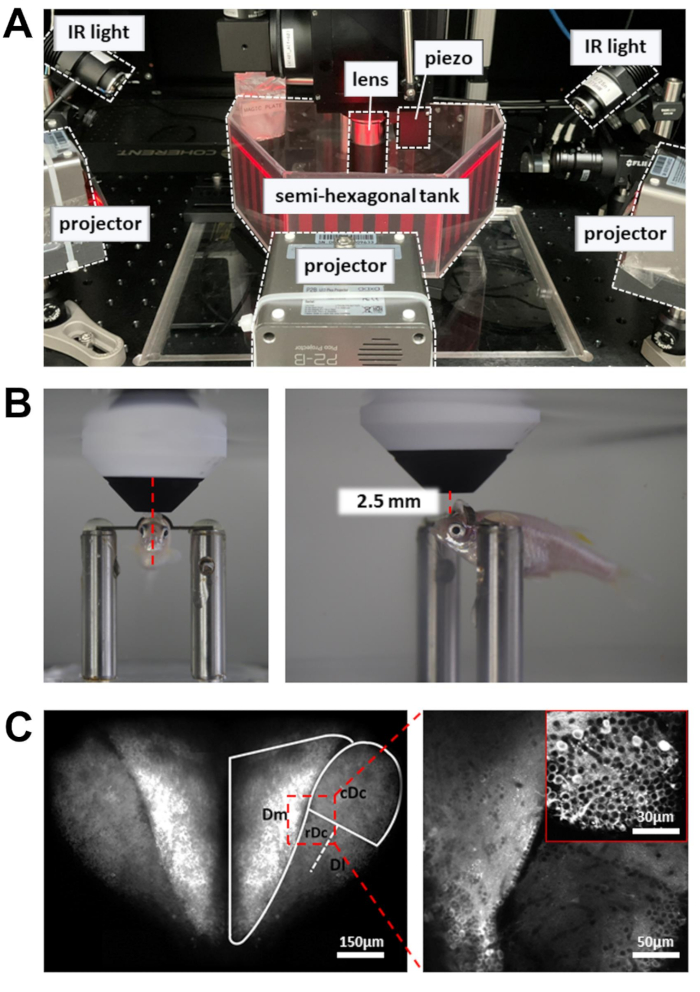
Рисунок 3: Установка для визуализации кальция, записи поведения и отображения визуальных стимулов . (A) Три проектора подают визуальный стимул на стенки полушестиугольного резервуара. ИК-лампы сбоку используются для подсветки тела рыбки данио. (B) Позиционирование объектива. Слева: вид спереди. Справа: вид сбоку. Расстояние между 16-кратным объективом и целевой областью мозга составляет около 2,5 мм. (C) Пример двухфотонного изображения. Слева: максимальная проекция всего дорсального переднего мозга в Tg[neuroD:GCaMP6f]. Справа: увеличенное изображение для выявления нейронов в нескольких областях мозга. Врезка: большее увеличение из другой области мозга. Изображения представляют собой среднее значение 10 с данных, записанных с частотой 5 Гц. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Протокол состоит из двух частей: операция на подголовнике и двухфотонная кальциевая визуализация активности нейронов в переднем мозге. Успех операции определяется выживаемостью животного и устойчивостью подголовника. Выживаемость может быть значительно улучшена за счет частой перф...
Обсуждение
Здесь мы опишем подробный протокол для фиксации головы взрослой рыбки данио для двухфотонной кальциевой визуализации. Есть два важных шага для достижения того, чтобы подголовник был достаточно устойчивым для лазерной сканирующей визуализации. Во-первых, планка головы должна быть при?...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана Институтом молекулярной биологии Academia Sinica и Национальным советом по науке и технологиям Тайваня. Механический цех Института физики Академии Синика помогал изготавливать детали по индивидуальному заказу. Мы также хотим поблагодарить. Аргаста (Институт биомедицинских исследований им. Фридриха Мишера, Базель, Швейцария) за разработку быстросъемного механизма головной ступени.
Материалы
| Name | Company | Catalog Number | Comments |
| Acquisition card | MBF Bioscience | Vidrio vDAQ | Microscope |
| Back-projection film | Kimoto | Diland screen - GSK | present visual stimulus |
| Band-pass filter (510/80 nm) | Chroma | ET510/80m | Microscope |
| Base plate for the semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Camera filter (<875 nm) | Edmund optics | #86-106 | Behavior recording |
| Camera filter (>700 nm) | Edmund optics | #43-949 | Behavior recording |
| Camera lens | Thorlabs | MVL50M23 | Behavior recording |
| Chameleon Vision-S | Coherent | Vision-S | Laser |
| Circular plate for the head stage | custom made | see supplemental files | recording chamber |
| Controller for piezo actuator | Physik Instrumente | E-665. CR | Microscope |
| Current amplifier | Thorlabs | TIA60 | Microscope |
| Elitedent Q-6 | Rolence Enterprise | Q-6 | Surgery: UV lamp |
| Emission Filter 510/80 nm | Chroma | ET510/80m | Microscope |
| Head bar | custom made | see supplemental files | recording chamber |
| Infrared light | Thorlabs | M810L3 | Behavior recording |
| LED projector | AAXA | P2B LED Pico Projector | present visual stimulus |
| Moist paper tissue (Kimwipe) | Kimtech Science | 34155 | Surgery: moist paper tissue |
| Motorized XY sample stage | Zaber | X-LRM050 | Microscope |
| Neutral Density Filters (50% Transmission) | Thorlabs | NE203B | present visual stimulus |
| Ø1/2" Post Holder | ThorLabs | PH1.5V | Surgery: hollow tube for cannon |
| Ø1/2" Stainless Steel Optical Post | ThorLabs | TR150/M | Surgery: fish loading module |
| Objective lens 16x, 0.8NA | Nikon | CF175 | Microscope |
| Oil-based modeling clay | Ly Hsin Clay | C4086 | Surgery: head bar holder |
| Optical adhesive | Norland Products | NOA68 | Surgery: UV curable glue |
| Photomultiplier tube | Hamamatsu | H11706P-40 | Microscope |
| Piezo actuator | Physik Instrumente | P-725.4CA PIFOC | Microscope |
| Pockels Cell | Conoptics | M350-80-LA-BK-02 | Microscope |
| Red Wratten filter (> 600 nm) | Edmund optics | #53-699 | present visual stimulus |
| Resonant-Galvo Scan System | INSS | RGE-02 | Microscope |
| Right-Angle Clamp for Ø1/2" Post | ThorLabs | RA90/M | Surgery: fish loading module |
| Rotating Clamp for Ø1/2" Post | ThorLabs | SWC/M | Surgery: fish loading module |
| ScanImage | MBF Bioscience | Basic version | Microscope |
| Semi-hexagonal tank | custom made | see supplemental files | recording chamber |
| Super-Bond C&B Kit | Sun Medical Co. | Super-Bond C&B | Surgery: dental cement |
| Tricaine methanesulfonate | Sigma Aldrich | E10521 | Surgery: anesthetic |
| USB Camera | FLIR | BFS-U3-13Y3M-C | Behavior recording |
| Vetbond | 3M | 1469SB | Surgery: tissue glue |
Ссылки
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Chow, D. M., et al. Deep three-photon imaging of the brain in intact adult zebrafish. Nature Methods. 17 (6), 605-608 (2020).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Friedrich, R. W., Jacobson, G. A., Zhu, P. Circuit neuroscience in zebrafish. Current Biology. 20 (8), R371-R381 (2010).
- Kappel, J. M., et al. Visual recognition of social signals by a tectothalamic neural circuit. Nature. 608 (7921), 146-152 (2022).
- Bartoszek, E. M., et al. Ongoing habenular activity is driven by forebrain networks and modulated by olfactory stimuli. Current Biology. 31 (17), 3861-3874 (2021).
- Valente, A., Huang, K. H., Portugues, R., Engert, F. Ontogeny of classical and operant learning behaviors in zebrafish. Learning & Memory. 19 (4), 170-177 (2012).
- Buske, C., Gerlai, R. Maturation of shoaling behavior is accompanied by changes in the dopaminergic and serotoninergic systems in zebrafish. Developmental Psychobiology. 54 (1), 28-35 (2012).
- Huang, K. H., et al. A virtual reality system to analyze neural activity and behavior in adult zebrafish. Nature Methods. 17 (3), 343-351 (2020).
- Rupprecht, P., Prendergast, A., Wyart, C., Friedrich, R. W. Remote z-scanning with a macroscopic voice coil motor for fast 3D multiphoton laser scanning microscopy. Biomedical Optics Express. 7 (5), 1656-1671 (2016).
- Papadopoulos, I. N., Jouhanneau, J. -. S., Poulet, J. F. A., Judkewitz, B. Scattering compensation by focus scanning holographic aberration probing (F-SHARP). Nature Photonics. 11 (2), 116-123 (2017).
- Torigoe, M., et al. Zebrafish capable of generating future state prediction error show improved active avoidance behavior in virtual reality. Nature Communications. 12 (1), 5712 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены